La fibrilación auricular es la arritmia cardiaca más frecuente en la práctica clínica diaria. Además de las alteraciones hemodinámicas que ocasiona —consecuencia de la pérdida de la contracción auricular y la frecuencia cardiaca habitualmente elevada, que pueden causar la aparición de insuficiencia cardiaca—, el principal riesgo de la fibrilación auricular es que la estasis circulatoria en la aurícula cause una embolia arterial. Se sabe que la fibrilación auricular se asocia a un marcado aumento del riesgo de accidentes tromboembólicos arteriales, asociados a elevadas mortalidad y morbilidad y alto riesgo de recurrencia. Está demostrado que el tratamiento antitrombótico con anticoagulantes orales se asocia a un drástico descenso del riesgo de accidentes tromboembólicos. Sin embargo, los anticoagulantes orales incrementan significativamente el riesgo de hemorragias mayores, de las que es especialmente devastadora la hemorragia intracraneal. Por lo tanto, al iniciar el tratamiento anticoagulante de un paciente con fibrilación auricular, resulta imprescindible valorar adecuadamente el beneficio/riesgo del tratamiento según sus características clínicas. Múltiples estudios han mostrado una serie de variables que determinan los riesgos embolígeno y de sangrado asociados al tratamiento anticoagulante, y con base en ellas se han desarrollado diversos sistemas de estratificación para calcular el riesgo de embolia secundaria a la fibrilación auricular y el riesgo de hemorragia relacionado con el tratamiento antitrombótico. En la práctica clínica diaria, la aplicación de estas escalas de riesgo es de gran ayuda para elegir la mejor alternativa terapéutica para un paciente concreto.
Palabras clave
La fibrilación auricular (FA) es la arritmia cardiaca más frecuente en la práctica clínica diaria y afecta a 2,3 millones de personas en Estados Unidos y 4,5 millones en Europa1. Su incidencia aumenta con la edad, de forma que por encima de los 80 años la prevalencia de FA es superior al 10%2. Casi la cuarta parte de la población sufrirá una FA en algún momento de su vida3.
Contrariamente a lo que se podría imaginar, la FA no es una arritmia benigna. Además de las alteraciones hemodinámicas que ocasiona —consecuencia de la pérdida de la contracción auricular y la frecuencia cardiaca habitualmente elevada, que pueden causar la aparición de insuficiencia cardiaca—, el principal riesgo de la FA es que la estasis circulatoria en la aurícula ocasione una embolia arterial. Es sobradamente conocido que la FA se asocia a un marcado aumento del riesgo de accidentes tromboembólicos arteriales, fundamentalmente cerebrales (ictus isquémico), pero también en el sistema periférico. En total, un 20–25% de los ictus isquémicos son de origen cardioembólico. La FA no valvular es la causa cardiaca más frecuente asociada a ictus, cerca del 50%. El riesgo de ictus en los pacientes con FA es de 5 a 7 veces superior que el de la población similar sin esta arritmia.
Aunque el ictus isquémico es el principal riesgo de la FA, esta arritmia también puede ser causa de embolias arteriales periféricas. Desde un punto de vista clínico, las embolias periféricas son sólo el 7% de los accidentes embólicos de los pacientes con FA. Sin embargo, estudios autópsicos han puesto de manifiesto que las embolias sistémicas son relativamente frecuentes, pero a diferencia de lo que sucede con los accidentes cerebrovasculares (ACV), la mayoría pasa clínicamente inadvertida3,4. Es importante destacar que el riesgo embolígeno de los pacientes con FA permanente o paroxística es similar, así como en los pacientes con aleteo (flutter) auricular, aunque hay menos datos a este respecto5–7.
Los ACV tienen elevadas mortalidad y morbilidad y alto riesgo de recurrencia. En el estudio de Framingham8, se demostró que los pacientes que han sufrido un ictus por FA tienen mayor riesgo de recurrencia y mortalidad que los pacientes con ictus sin FA (tabla 1).
Riesgo de muerte y recurrencia de ictus en función de la presencia o ausencia de fibrilación auricular en el Framingham Heart Study
| Con FA | Sin FA | ||
| Recurrencia de ictus a 1 año | 23% | 8% | p <0,001 |
| Mortalidad 30 días tras el ictus | 25% | 14% | OR=1,84 (IC95%, 1,04–3,27) |
| Mortalidad 1 año tras el ictus | 63% | 34% | p <0,001 |
FA: fibrilación auricular; IC95%: intervalo de confianza del 95%; OR: odds ratio. Reproducido de Lin et al8.
Está ampliamente demostrado que el tratamiento antitrombótico con anticoagulantes orales se asocia a un drástico descenso del riesgo de accidentes tromboembólicos. En el clásico metaanálisis de Hart et al9, que incluyó 29 estudios con más de 28.000 pacientes, se demostró que el tratamiento con anticoagulantes orales reduce el riesgo de ictus en un 64% y la mortalidad en un 26%. Sin embargo, los anticoagulantes orales se asocian a un incremento del riesgo de complicaciones hemorrágicas mayores, de las que es especialmente devastadora la hemorragia intracraneal. Debido a este hecho, a la hora de indicar el tratamiento anticoagulante de un paciente individual con FA, resulta imprescindible hacer una adecuada valoración del beneficio/riesgo del tratamiento anticoagulante en función de sus características clínicas. Múltiples estudios han podido demostrar una serie de variables que determinan tanto el riesgo embolígeno como el riesgo de sangrado asociado al tratamiento anticoagulante. Según estas variables, se han desarrollado diversos métodos de estratificación que permiten calcular el riesgo de embolia secundaria a la FA y el riesgo de hemorragia asociada al tratamiento antitrombótico. En la práctica clínica diaria, la aplicación de estas escalas de riesgo resulta de gran ayuda a la hora de elegir la mejor alternativa terapéutica para un paciente concreto.
Evaluación del riesgo de tromboemboliaExisten situaciones clínicas de muy alto riesgo, como la valvulopa-tía mitral reumática o ser portador de una prótesis valvular mecánica, que por sí solas son ya indicación absoluta de anticoagulación, independientemente de que el paciente se encuentre en ritmo sinusal o FA (el riesgo de embolia de los pacientes con estenosis mitral y FA es del 4–6%/año). En el presente artículo, nos referiremos exclusivamente a los pacientes con FA no valvular, en quienes la indicación de anticoagular dependerá de la concomitancia de la arritmia con otros factores clínicos que confieran un riesgo adicional que pudiera justificar la necesidad de establecer el tratamiento anticoagulante.
Los principales factores individuales de riesgo que se han asociado a mayor propensión de sufrir un accidente tromboembólico se enumeran en la tabla 2.
Factores de riesgo de accidente tromboembólico en los pacientes con fibrilación auricular no valvular
| • Edad |
| • Antecedentes de ictus o accidente isquémico transitorio |
| • Sexo femenino |
| • Diabetes mellitus |
| • Hipertensión arterial |
| • Disfunción ventricular izquierda |
| • Insuficiencia cardiaca |
| • Dilatación auricular izquierda |
| • Infarto de miocardio previo |
| • Vasculopatía arterial periférica (claudicación intermitente) |
| • Ateromatosis aórtica o de troncos supraaórticos |
| • Enfermedad tiroidea |
A partir de los datos obtenidos en diversos registros, estudios poblacionales y estudios multicéntricos aleatorizados, se han publicado diversos esquemas para la estratificación del riesgo de ACV en pacientes con FA no valvular10–18. La mayoría de estos esquemas han intentado simplificar la estratificación del riesgo clasificando a los pacientes en subgrupos de riesgo de ACV «elevado, moderado y bajo». Sin lugar a dudas, de todos estos esquemas de evaluación del riesgo, el más simple y el que ha tenido mayor aceptación es la clasificación CHADS2 (insuficiencia cardiaca, hipertensión, edad, diabetes mellitus, ACV [doble]) (tabla 3). El índice de riesgo CHADS2 se ha desarrollado a partir de los criterios de los investigadores del AF Investigators and Stroke Prevention in Atrial Fibrillation (SPAF) y se basa en un sistema de puntuación en el que se asigna 2 puntos a una historia de ACV o accidente isquémico transitorio y 1 punto a cada una de las siguientes condiciones: edad > 75 años, historia de hipertensión, diabetes mellitus o insuficiencia cardiaca reciente19. Así, el esquema de estratificación de riesgo de CHADS2 puede usarse como una forma de valoración inicial del riesgo de ACV rápida y fácil de memorizar. Para los pacientes con una clasificación CHADS2 >2 se recomienda, a menos que esté contraindicado, el tratamiento crónico con anticoagulantes orales, ajustando la dosis para alcanzar una razón normalizada internacional (INR) de 2,5 (intervalo, 2-3)20.
Puntuación CHADS2
| C: insuficiencia cardiaca congestiva (Congestive heart failure) | |
| H: Hipertensión | |
| A: edad (Age) | |
| D: Diabetes mellitus | |
| S: episodio previo de accidente cerebrovascular (ictus o accidente isquémico transitorio) (Stroke) | |
| Escala de puntuación | |
| Insuficiencia cardiaca congestiva | 1 |
| Hipertensión | 1 |
| Edad > 75 años | 1 |
| Diabetes mellitus | 1 |
| Episodio previo de ACV | 2 |
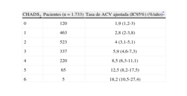
Tal como se muestra en la tabla 4, hay una clara relación entre la clasificación CHADS2 y la tasa de ACV19. La validación original de este esquema ha clasificado la puntuación CHADS2=0 como riesgo bajo, 1-2 como riesgo moderado y >2 como riesgo elevado. El Stroke in AF Working Group (Grupo de Trabajo sobre Accidente Cerebrovascular en la FA) ha comparado doce métodos de estratificación de riesgo publicados para predecir un ACV en pacientes con FA no valvular, y ha concluido que hay diferencias sustanciales y clínicamente relevantes entre los esquemas publicados diseñados para estratificar el riesgo de ACV en pacientes con FA20. La mayoría de ellos tienen un valor predic-tivo moderado para los ACV (estadístico C —como medida del valor predictivo— de -0,6); además, la proporción de pacientes asignados a categorías de riesgo individuales variaba mucho entre los distintos esquemas. La clasificación CHADS2 categorizó a la mayoría de los sujetos como en «riesgo moderado» y mostró un estadístico C=0,58 para predecir 1 ACV en la cohorte entera. Por eso, en las actuales Guías de Práctica Clínica20 de la Sociedad Europea de Cardiología (ESC) se ha intentado restar protagonismo al uso simplista de las categorías de riesgo «bajo, moderado y elevado», teniendo en cuenta el pobre valor predictivo de este tipo de categorías artificiales y reconociendo que el riesgo es un continuo. La clasificación CHADS2 no incluye muchos factores de riesgo de ACV, y es necesario considerar otros «modificadores del riesgo de ACV» para una evaluación integral del riesgo de ACV.
Puntuación CHADS2 y tasa de accidente cerebrovascular
| CHADS2 | Pacientes (n=1.733) | Tasa de ACV ajustada (IC95%) (%/año)* |
| 0 | 120 | 1,9 (1,2-3) |
| 1 | 463 | 2,8 (2-3,8) |
| 2 | 523 | 4 (3,1-5,1) |
| 3 | 337 | 5,9 (4,6-7,3) |
| 4 | 220 | 8,5 (6,3-11,1) |
| 5 | 65 | 12,5 (8,2-17,5) |
| 6 | 5 | 18,2 (10,5-27,4) |
ACV: accidente cerebrovascular; CHADS2: insuficiencia cardiaca, hipertensión, edad, diabetes mellitus, accidente cerebrovascular (doble); FA: fibrilación auricular; IC95%: intervalo de confianza del 95%.
La tasa ajustada de ACV se deriva del análisis multivariable en el supuesto de que no haya consumo de ácido acetilsalicílico; las tasas de ACV se basan en datos de una cohorte de pacientes hospitalizados con FA, publicada en 2001, con números bajos en aquellos que tienen una puntuación CHADS2 de 5 y 6, para poder obtener una valoración precisa del riesgo en estos pacientes. Teniendo en cuenta que se está produciendo un descenso general de las tasas de ACV, las tasas actuales de ACV en las cohortes contemporáneas no hospitalizadas también pueden variar respecto a estos cálculos. Reproducido de Cam et al20.
Para ello, la ESC recomienda incorporar el concepto de «factores de riesgo mayores» y «factores de riesgo no mayores clínicamente relevantes». Los factores de riesgo «mayores» (previamente denominados factores de riesgo «elevado») son el ACV o accidente isquémico transitorio previos, la tromboembolia y la edad avanzada (>75 años). La presencia de algunos tipos de valvulopatías (estenosis mitral o prótesis valvular) también puede categorizar a los pacientes con FA «valvular» como pacientes en «riesgo elevado». Los factores de riesgo «no mayores clínicamente relevantes » (previamente denominados factores de riesgo «moderado») son la insuficiencia cardiaca (especialmente la disfunción sistólica ventricular izquierda de moderada a grave, definida arbitrariamente como fracción de eyección del ventrículo izquierdo <40%), hipertensión arterial o diabetes mellitus (tabla 5). Otros factores de riesgo «no mayores clínicamente relevantes» (previamente considerados «factores de riesgo menos validados») incluyen el sexo femenino, la edad de 65-74 años y la enfermedad vascular (específicamente, infarto de miocardio, placa aórtica compleja y enfermedad arterial periférica).
Puntuación CHA2DS2-VASc y tasa de accidente cerebrovascular
| Factores de riesgo de ACV y tromboembolias en la FA no valvular | |
| Factores de riesgo «mayores» | Factores de riesgo «no mayores clínicamente relevantes» |
| ACV previo, AIT o embolia sistémica; edad > 75 años | Insuficiencia cardiaca o disfunción sistólica ventricular izquierda moderada-grave (FEVI <40%); hipertensión, diabetes mellitus, sexo femenino, edad 65-74 años, enfermedad vasculara |
| Enfoque basado en factores de riesgo expresado como un sistema de puntuación con el acrónimo CHA2DS2-VASc | |
| Factor de riesgo | Puntuación |
| Insuficiencia cardiaca o disfunción sistólica ventricular izquierda | 1 |
| Hipertensión | 1 |
| Edad > 75 años | 2 |
| Diabetes mellitus | 1 |
| ACV, AIT o tromboembolia | 2 |
| Enfermedad vasculara | 1 |
| Edad 65-74 años | 1 |
| Categoría de sexo (femenino) | 1 |
| Puntuación máxima | 9b |
| Tasa de ACV ajustada según la puntuación CHA2DS2-VASc | ||
| Puntuación CHA2DS2-VASc | Pacientes (n=7.329) | Tasa de ACV ajustada (%/año) |
| 0 | 1 | 0 |
| 1 | 422 | 1,3 |
| 2 | 1.230 | 2,2 |
| 3 | 1.730 | 3,2 |
| 4 | 1.718 | 4 |
| 5 | 1.159 | 6,7 |
| 6 | 679 | 9,8 |
| 7 | 294 | 9,6 |
| 8 | 82 | 6,7 |
| 9 | 14 | 15,2 |
ACV: accidente cerebrovascular; AIT: accidente isquémico transitorio; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo (documentada por eco-cardiografía, ventriculografía isotópica, cateterización cardiaca, imagen cardiaca por resonancia magnética, etc.).
Infarto de miocardio previo, enfermedad arterial periférica, placa aórtica. Las tasas actuales de ACV en las cohortes contemporáneas pueden variar respecto a estos cálculos.
La máxima puntuación es 9 porque la edad puede contribuir con 0, 1 o 2 puntos. Reproducido de Camm et al20.
Siguiendo estos nuevos criterios, la ESC recomienda cambiar de la estratificación CHADS2 a la nueva clasificación CHA2DS2-VASc (insuficiencia cardiaca congestiva, hipertensión, edad >75 [doble], diabetes mellitus, ACV [doble], enfermedad vascular, edad 65-74 años y sexo femenino)21,22. En este nuevo esquema de puntuación se asigna 2 puntos a una historia clínica de ACV o accidente isquémico transitorio y a los pacientes de edad >75 años, y se asigna 1 punto a cada una de las siguientes condiciones: edad 65-74 años, historia de hipertensión arterial, diabetes mellitus, insuficiencia cardiaca reciente, enfermedad vascular (infarto de miocardio, placa aórtica compleja y enfermedad arterial periférica, incluida revascularización previa, amputación debida a enfermedad arterial periférica o evidencia angiográfica de enfermedad arterial periférica, etc.) y sexo femenino (tabla 5). Como puede verse al comparar las tasas ajustadas de ACV (%/año) de la estratificación CHADS2 (tabla 4) con las de la nueva clasificación CHA2DS2-VASc (tabla 5), con esta conseguimos diferenciar mejor a los pacientes con riesgo de ACV bajo-moderado, aunque sea a expensas de una mayor complejidad de la clasificación, que incorpora nuevos criterios, lo que va a resultar controvertido y puede limitar su aplicabilidad en la práctica diaria.
Riesgo de sangradoEstá absolutamente demostrado que los anticoagulantes orales y, en menor medida, los antiagregantes plaquetarios reducen significativamente el riesgo de ictus isquémico. Como ya se ha comentado, en el metaanálisis de Hart et al9 se demostró que el tratamiento con anticoagulantes orales reduce el riesgo de ictus en un 64% y la mortalidad en un 26%, aunque su empleo se asocia a un incremento del riesgo de complicaciones hemorrágicas, como el sangrado intracraneal o las hemorragias extracraneales mayores. En realidad, el riesgo de ictus está estrechamente ligado al riesgo de sangrado, lo cual explica que las clasificaciones que estratifican los riesgos de ictus y de hemorragia compartan algunos de sus criterios. La edad avanzada y los antecedentes de ACV o de hipertensión arterial se asocian a mayor riesgo de ictus, pero también de hemorragias por anticoagulantes orales. Este hecho es uno de los motivos por los que resulta difícil la implementa-ción del tratamiento anticoagulante en un importante número de pacientes con FA.
Ante un paciente individual con FA, a la hora de indicar el inicio del tratamiento anticoagulante resulta imprescindible hacer una adecuada valoración del beneficio/riesgo del tratamiento en función desus características clínicas. A pesar de que actualmente, con el mejor control del tratamiento con dicumarínicos y el empleo de los nuevos anticoagulantes orales, se ha reducido el riesgo de complicaciones hemorrágicas, la estratificación del riesgo de sangrado debe formar parte de la evaluación del paciente antes de comenzar la anticoagulación.
Se han publicado diversas clasificaciones para estratificar el riesgo de hemorragia de los pacientes tratados con anticoagulantes orales23–25; la clasificación HAS-BLED26 se ha incorporado en las guías de práctica clínica de la ESC20. A partir de una cohorte del «mundo real» formada por 3.978 sujetos europeos con FA del EuroHeart Survey, se estableció una clasificación nueva y simple del riesgo de sangrado, el HAS-BLED23 (hipertensión, función renal/hepática anormal, ACV, historia o predisposición de sangrado, INR lábil, edad avanzada [>65 años], fármacos/alcohol simultáneamente) (tabla 6).
Características clínicas del sistema de puntuación de sangrado HAS-BLED
| Letra | Característica clínica* | Puntos |
| H | Hipertensión | 1 |
| A | Funciones renal y hepática alteradas (1 punto cada una) | 1 o 2 |
| S | ACV | 1 |
| B | Sangrado | 1 |
| L | INR lábil | 1 |
| E | Edad avanzada (> 65 años) | 1 |
| D | Fármacos o alcohol (1 punto cada uno) | 1 o 2 |
| Máximo, 9 puntos |
ACV: accidente cerebrovascular; INR: razón internacional normalizada.
«Hipertensión» se define como presión arterial sistólica > 160mmHg. «Función renal alterada» se define como la presencia de diálisis crónica o trasplante renal o creatinina sérica > 200 umol/l. «Función hepática alterada» se define como enfermedad hepática crónica (p. ej., cirrosis) o evidencia bioquímica de trastorno hepático significativo (p. ej., bilirrubina > 2 veces el límite superior normal, en asociación con aspartato ami-notransferasa/alaninaminotransferasa/fosfatasa alcalina > 3 veces el límite superior normal, etc.). «Sangrado» se refiere a historia previa de sangrado y/o predisposición al sangrado (p. ej., diátesis, anemia, etc.). «INR lábil» se refiere a valor de INR inestable/ elevado o poco tiempo en el intervalo terapéutico (p. ej., <60%). «Fármacos o alcohol» se refiere al uso concomitante de fármacos, como antiplaquetarios, antiinflamatorios no esteroideos, abuso de alcohol, etc.
Adaptado de Pisters et al23.
En los pacientes con FA no valvular, una vez se ha establecido la indicación del tratamiento con anticoagulantes orales según el riesgo embolígeno moderado-alto con CHA2DS2-VASc (tabla 5), se debe calcular el riesgo hemorrágico con HAS-BLED (tabla 6). Una puntuación HAS-BLED >3 indica «riesgo elevado» de sangrado con dicumarínicos, por lo que se debe emplearlos con extrema precaución o valorar la posibilidad de otras alternativas terapéuticas, como los nuevos anticoagulantes o la oclusión de la orejuela con dispositivos implantables.
En resumen, la FA es la arritmia cardiaca más frecuente en la práctica clínica diaria y se asocia a un marcado aumento del riesgo de accidentes tromboembólicos. Está ampliamente demostrado que el tratamiento antitrombótico con anticoagulantes orales se asocia a un importante descenso del riesgo de accidentes tromboembólicos, pero puede ocasionar un incremento significativo del riesgo de complicaciones hemorrágicas mayores. Por eso, antes de indicar el tratamiento anticoagulante en un paciente con FA, resulta imprescindible hacer una adecuada valoración del beneficio/riesgo del tratamiento, utilizando los métodos de estratificación de riesgo de embolia (CHA2DS2-VASc) y de sangrado (HAS-BLED) según las recomendaciones de la ESC.
Conflicto de interesesNinguno.