En los últimos años se ha estabilizado el número de trasplantes cardiacos, por lo que se ha extendido el uso de asistencias ventriculares como terapia de destino1.
Se presenta el caso de una mujer de 72 años que acudió a nuestro centro con dolor torácico de 6 h de duración y cambios electrocardiográficos compatibles con infarto agudo de miocardio de localización anterior. La coronariografía emergente mostró oclusión trombótica de la arteria descendente anterior proximal, con daño de tronco distal y circunfleja proximal, por lo que se realizó revascularización percutánea completa con 3 stents farmacoactivos. La paciente presentó shock cardiogénico, por lo que necesitó soporte con aminas vasoactivas y balón de contrapulsación intraaórtico durante la fase aguda; se estabilizó a la paciente y se le dio el alta hospitalaria tras 3 semanas. En los siguientes 3 meses la evolución clínica fue desfavorable, por lo que ingresó en varias ocasiones por insuficiencia cardiaca y precisó agentes inotrópicos intravenosos. La ecocardiografía y la cardiorresonancia magnética mostraron remodelado adverso, disfunción ventricular grave e insuficiencia mitral grave funcional. El estudio cardiorrespiratorio mostró consumo pico de oxígeno de 11,4ml/kg/min (clase C de Weber) y el estudio hemodinámico, un índice cardiaco de 1,8 l/min/m2 y presión capilar pulmonar de 27 mmHg. En situación INTERMACS III, se decidió implantar un dispositivo de asistencia ventricular izquierda como terapia de destino, para los cual se escogió el dispositivo HVAD (HeartWare Inc.; Miami Lakes, Estados Unidos) debido a la pequeña superficie corporal de la paciente. La cirugía fue mínimamente invasiva mediante abordaje por hemiesternotomía superior combinada con minitoracotomía anterior izquierda. Tras el implante, se observó mejoría progresiva y persistente.
El seguimiento del dispositivo HVAD se realizó mediante ecocardiografía transesofágica en fases iniciales y transtorácica después, limitada por la ausencia de ventana acústica apical por la posición del dispositivo. Por ello se optó por una evaluación integral (vascular, cardiaca y del dispositivo de asistencia) mediante tomografía computarizada cardiaca (TCc) en 4 dimensiones.
Se llevó a cabo mediante equipo Brilliance iCT-256 (Philips Healthcare; Países Bajos), cobertura torácica helicoidal retrospectiva (100 keV, 550 mA, modulado al 40 y el 78% de ciclo; dosis efectiva estimada, 5,4 mSv), bolus-track en aorta descendente media (umbral, 150 UH; retraso tras umbral, 7 s), inyección trifásica utilizando iodixanol 320 mg/ml en secuencia: a) 60 ml de contraste a 5 ml/s; b) 30 ml de contraste a 3 ml/s, y c) 40 ml de suero salino a 3 ml/s. Las imágenes se reconstruyeron cada 5% del ciclo cardiaco (reconstrucción iterativa iDose4, kernel duro; FOV, 512 × 512 mm; resolución final, 0,4 × 0,5 × 0,5 mm; 20 Hz). El posprocesado se llevó a cabo con software específico (Comp Cardiac; Philips Healthcare, Países Bajos). Tras reconstruir los ejes cardiacos longitudinales y el eje corto, se trazaron los bordes endocárdicos telediastólico y telesistólico de ambos ventrículos para el cálculo mediante el método de Simpson (figura 1). Se comprobó la correcta posición del dispositivo y la integridad de las anastomosis y se descartó succión indebida de septo o papilares, trombosis en cono de succión o cánula eyectiva (figura 2 y ). Ambos ventrículos mostraban tamaño normal, con acinesia extensa en el territorio anterior. La fracción de eyección izquierda era del 34% (volumen latido, 36 ml) y la derecha, del 54% (volumen latido, 88 ml). Dada la imposibilidad de medir flujos con TCc, en ausencia de shunt intracardiaco, con mínima apertura valvular aórtica y descartada una regurgitación valvular significativa en ecocardiografías previas, se estimó indirectamente un soporte del dispositivo de 3,1 l/min.
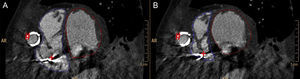
Posprocesado del análisis de la función sistólica biventricular. Contornos endocárdicos telediastólico (A) y telesistólico (B) trazados manualmente en eje corto que cubre ambos ventrículos. Cánula de eyección (#) realizando impronta en la pared lateral del ventrículo derecho. Electrodo de desfibrilador automático implantable (+).
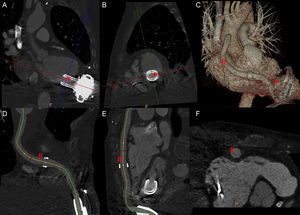
Reconstrucción multiplanar del cono de succión de HVAD (*) en eje longitudinal (A) y transversal (B). Reconstrucción volumétrica tridimensional del dispositivo de asistencia ventricular (C). Reconstrucción multiplanar curvada de cánula de eyección (#) en planos longitudinales (D y E) y transversal (F).
El dispositivo HVAD consiste en una bomba centrífuga de flujo continuo de tercera generación que, debido a su pequeño tamaño (aproximadamente 50 ml), permite el implante directo apical en el espacio pericárdico y una cánula de eyección anastomosada directamente en la aorta ascendente. La disfunción ventricular derecha es el principal determinante pronóstico, y se ha identificado hasta en un 30% de los pacientes tras el implante. El cambio de geometría del septo interventricular tras la descarga del ventrículo izquierdo o por succión directa del dispositivo, así como un aumento del retorno venoso sistémico en situación de soporte, puede desenmascarar una disfunción sistólica derecha silente2.
Se recomienda el seguimiento mediante técnicas de imagen con ecocardiografía y considerar el uso de TCc para casos seleccionados con información incompleta3. La sensibilidad y la especificidad de la TCc para la detección de trombo o mala posición son del 85 y el 100% respectivamente4. Series previas han demostrado la reproducibilidad del cálculo de la función sistólica derecha en el seguimiento de la asistencia ventricular mediante TCc, si bien la mayoría de los dispositivos eran de segunda generación5.
El interés de nuestro caso está determinado por ser, en nuestro mejor conocimiento, el primero que se ha descrito de HVAD con estudio integral mediante TCc en 4 dimensiones de más de 64 detectores.