Estudios recientes en animales han demostrado que la metformina (MF) perjudica la endotelización de los stents farmacoactivos (SFA). Se evaluó el efecto de la MF en el recubrimiento neointimal de los SFA en pacientes diabéticos por tomografía de coherencia óptica (OCT).
MétodosEl ensayo RESERVOIR aleatorizó 116 lesiones en 112 pacientes con diabetes mellitus a stents liberadores de amphilimus o everolimus, a los que se realizó una OCT a los 9 meses. Los pacientes se dividieron en 3 grupos según el tratamiento hipoglucemiante recibido: a) no MF; b) MF sin insulina, y c) MF con insulina. El objetivo primario fue el porcentaje de struts no recubiertos.
ResultadosDiecisiete pacientes (19 lesiones) al grupo sin MF; 53 pacientes (54 lesiones) al grupo MF sin insulina y 28 pacientes (28 lesiones) al grupo MF con insulina. Las características basales fueron comparables, aunque los pacientes del grupo MF sin insulina tuvieron un mejor control glucémico (p < 0,01). Por OCT la frecuencia relativa de struts no recubiertos fue comparable entre grupos (3,07±4,80% frente a 2,23±4,73% frente a 3,43±6,69% respectivamente, p = 0,48). El análisis multivariante confirmó que la MF no altera el recubrimiento de los SFA (OR = 1,49; IC95%, 0,71-3,08, p = 0,29). La angiografía cuantitativa tampoco mostró efecto de la MF sobre la pérdida luminal tardía, mientras que el tratamiento con insulina si se asoció a una mayor pérdida luminal tardía (p = 0,02).
ConclusionesEl uso de MF no perjudica el recubrimiento neointimal de los SFA en diabéticos independientemente de que reciban o no tratamiento con insulina. De acuerdo a nuestros resultados, el uso de MF parece no estar desaconsejado en estos pacientes.
Palabras clave
Los pacientes con diabetes mellitus (DM) presentan un aumento del riesgo de eventos coronarios tras una intervención coronaria percutánea1,2. El uso de stents farmacoactivos (SFA) en estos pacientes se asocia con una significativa reducción de eventos, en comparación con los stents metálicos sin recubrimiento3. Sin embargo, la DM es un factor predictivo de trombosis del SFA claramente identificado, lo cual puede tener entre otras causas la falta de endotelización del strut4.
La metformina (MF), una biguanida sensibilizante a la insulina, inhibe el complejo I de la cadena respiratoria mitocondrial y produce la activación de la proteincinasa activada por el 5’-monofosfato de adenosina, lo cual da lugar a la inhibición del complejo 1 de diana de rapamicina de mamífero (mTOR) y su substrato, la S6-cinasa5. Así pues, la MF y los inhibidores de mTOR procedentes de la elución de la mayoría de los SFA (como sirolimus o everolimus) tienen unas vías de señalización convergentes comunes. En consecuencia, la asociación de sirolimus y MF podría actuar de manera sinérgica y deteriorar la endotelización tras la colocación del stent. En cambio, los pacientes con DM, en especial los tratados con insulina, presentan un crecimiento exagerado de la neoíntima (NI) y no una falta de endotelización, de modo que la combinación de MF e inhibidores de mTOR puede aumentar su eficacia.
En estudios clínicos previos se ha demostrado una reducción significativa de la endotelización del stent en los animales no diabéticos tratados con MF5,6. Sin embargo, el efecto de la MF en la endotelización del strut en el ser humano no se ha evaluado hasta ahora mediante técnicas de imagen intracoronarias. El objetivo de este estudio es comparar el efecto de la MF en la endotelización de los SFA mediante tomografía de coherencia óptica (OCT) en pacientes con diabetes mellitus tratada con insulina (DMTI) y no tratada con insulina (DMNTI).
MÉTODOSPoblación del estudioSe incluyó en el presente estudio a todos los pacientes del ensayo RESERVOIR7 evaluados mediante OCT a los 9 meses de seguimiento. Anteriormente se ha publicado una descripción completa del ensayo7. De forma resumida, el RESERVOIR es un ensayo clínico aleatorizado, multicéntrico y prospectivo cuyo objetivo fue comparar la endotelización de 2 SFA diferentes mediante OCT en 112 pacientes con DM8. Formaban la población diana los pacientes diabéticos con un cuadro documentado de isquemia silente, angina estable, angina inestable o infarto agudo de miocardio sin elevación del segmento ST. Los criterios de exclusión principales fueron los pacientes con DM tratados únicamente con dieta y cambios del estilo de vida, infarto agudo de miocardio con elevación del segmento ST, estenosis de arteria principal izquierda o descendente izquierda en el ostium, bifurcaciones grandes, lesiones muy calcificadas, reestenosis del stent, insuficiencia renal crónica o fracción de eyección del ventrículo izquierdo < 30%. De un total de 112 pacientes aleatorizados, a los 9 meses se dio seguimiento con exploraciones angiográficas y por OCT a 98 pacientes (101 lesiones). Los resultados de la OCT mostraron que la formulación del fármaco con un portador anfifílico (stents liberadores de anfilimus, CID Saluggia; Italia)9 proporcionaba una eficacia no inferior a la de la liberación clásica a partir de polímeros duraderos (stents liberadores de everolimus, Abbott Vascular; Illinois, Estados Unidos).
Todos los pacientes fueron objeto de seguimiento por un endocrinólogo durante todo el estudio. Se determinó un perfil metabólico completo, que incluía los valores de índice de masa corporal, creatinina, glucohemoglobina, colesterol unido a lipoproteínas de alta densidad y colesterol unido a lipoproteínas de baja densidad, en la situación inicial y en el momento del seguimiento angiográfico. El tratamiento de la DM se realizó según las recomendaciones de tratamiento estándar de la guía de práctica clínica europea sobre la DM10.
Se dividió a los pacientes en 3 grupos según los fármacos hipoglucemiantes recibidos durante el seguimiento del estudio: a) pacientes no tratados con MF; pacientes tratados con MF, luego divididos en función del uso de insulina exógena; b) pacientes tratados con MF pero que no recibían insulina exógena, y c) pacientes tratados con insulina y también con MF.
Variables de valoración y definiciones del estudioLa sinergia entre la MF y los inhibidores de mTOR para inhibir la cicatrización de la neoíntima se evaluó en este estudio mediante la frecuencia relativa de struts no cubiertos según la evaluación realizada mediante OCT en el seguimiento a los 9 meses (objetivo principal). Los struts se clasificaron como no cubiertos si alguna parte del strut mostraba una exposición visible a la luz del vaso, o como cubiertos si había una capa de tejido visible sobre la totalidad de las superficies de reflexión11. La obstrucción de volumen de NI se utilizó como objetivo de eficacia para valorar la inhibición de la hiperplasia de la NI. La obstrucción de volumen de neoíntima se definió como el volumen de NI (mm3) dividido por el volumen del stent (mm3) multiplicado por 10011. Otros objetivos fueron la frecuencia relativa de los struts con mala aposición, la frecuencia relativa de los struts no cubiertos y con mala aposición, el grosor de la NI, la obstrucción de área máxima de la NI evaluada mediante OCT y la pérdida tardía en el stent angiográfica8.
Análisis angiográfico y por tomografía de coherencia ópticaAnalistas con experiencia, a los que se ocultó el tratamiento médico recibido por los pacientes para la DM, realizaron el análisis coronario cuantitativo en un laboratorio central (BARCICORE Lab, Barcelona, España)12, mediante un programa informático dedicado para análisis de las coronariografías (CAAS versión 5.9, Pie Medical BV; Maastricht, Países Bajos).
Analistas también experimentados, a los que se ocultó los datos clínicos, analizaron los datos de OCT en el mismo laboratorio central (BARCICORE Lab, Barcelona, España) por con un programa comercial (LightLab Imaging, St. Jude Medical Inc.) aplicado offline. Se analizaron, con métodos ya descritos, cortes transversales a intervalos de 1mm en el interior del segmento del stent y en los 5mm proximales y distales a los límites del stent. No se tuvieron en cuenta para el análisis los fotogramas con stents solapados u orígenes de ramas laterales. En los vasos con una oclusión total que no se asociaba con una trombosis del stent, se consideró que toda la longitud del stent estaba ocupada por hiperplasia de la NI13.
Análisis estadísticoEl análisis estadístico se realizó con el programa SPSS versión 23.0 (Chicago, Illinois, Estados Unidos). Las variables continuas se presentan en forma de media ± desviación estándar, a menos que se indique otra cosa. Las variables discretas se expresan mediante frecuencia y porcentaje del grupo. Las características iniciales se compararon mediante la prueba de la χ2 o la prueba exacta de Fischer para las variables discretas y con un ANOVA (análisis de la varianza) para las variables continuas. Se utilizó un ajuste de Bonferroni para las comparaciones múltiples entre los grupos. Para evaluar el efecto sinérgico de los inhibidores de mTOR y la MF teniendo en cuenta la falta de independencia de los struts en las lesiones, se usaron modelos de ecuaciones de estimación generalizada y un análisis no paramétrico de los datos agregados14. Los modelos de ecuaciones de estimación generalizada se elaboraron con un anidado de los struts con lesiones y utilizando los grupos de tratamiento y el tipo de stent utilizado según la aleatorización como covariables. La significación estadística se estableció en p < 0,05 para todas las comparaciones.
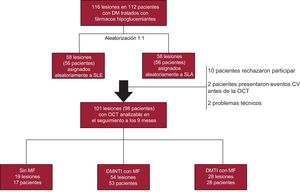
RESULTADOSEntre octubre de 2012 y octubre de 2013, se incluyó a 98 pacientes (101 lesiones) para el estudio y se llevó a cabo una evaluación por OCT en el seguimiento a los 9 meses; 17 pacientes (19 lesiones) no recibieron MF, mientras que se prescribió MF a 53 con DMNTI (54 lesiones) y 28 con DMTI (28 lesiones) (figura 1).
Diagrama de flujo del estudio. CV: cardiovascular; DM: diabetes mellitus; DMNTI: diabetes mellitus no tratada con insulina; DMTI: diabetes mellitus tratada con insulina; MF: metformina; OCT: tomografía de coherencia óptica; SLA: stent liberador de anfilimus; SLE: stent liberador de everolimus.
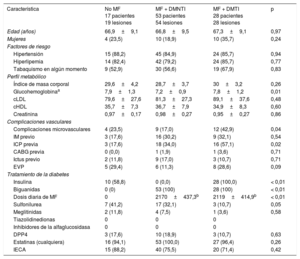
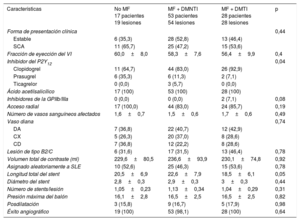
Las características clínicas iniciales y de la intervención se muestran en la tabla 1 y la tabla 2. Es de destacar que un 60% de los pacientes del grupo sin MF recibían tratamiento con insulina. En consecuencia, el control de la glucemia tendió a ser mejor en el grupo tratado tan solo con MF (p = 0,06). La frecuencia de las complicaciones microvasculares y macrovasculares fue mayor entre los pacientes con DMTI. En cambio, el colesterol unido a lipoproteínas de baja densidad y el colesterol unido a lipoproteínas de alta densidad fueron similares en ambos grupos (p > 0,50 en todos los casos).
Características basales y perfil metabólico
| Característica | No MF 17 pacientes 19 lesiones | MF + DMNTI 53 pacientes 54 lesiones | MF + DMTI 28 pacientes 28 lesiones | p |
|---|---|---|---|---|
| Edad (años) | 66,9±9,1 | 66,8±9,5 | 67,3±9,1 | 0,97 |
| Mujeres | 4 (23,5) | 10 (18,9) | 10 (35,7) | 0,24 |
| Factores de riesgo | ||||
| Hipertensión | 15 (88,2) | 45 (84,9) | 24 (85,7) | 0,94 |
| Hiperlipemia | 14 (82,4) | 42 (79,2) | 24 (85,7) | 0,77 |
| Tabaquismo en algún momento | 9 (52,9) | 30 (56,6) | 19 (67,9) | 0,83 |
| Perfil metabólico | ||||
| Índice de masa corporal | 29,6±4,2 | 28,7±3,7 | 30±3,2 | 0,26 |
| Glucohemoglobinaa | 7,9±1,3 | 7,2±0,9 | 7,8±1,2 | 0,01 |
| cLDL | 79,6±27,6 | 81,3±27,3 | 89,1±37,6 | 0,48 |
| cHDL | 35,7±7,3 | 36,7±7,9 | 34,9±8,3 | 0,60 |
| Creatinina | 0,97±0,17 | 0,98±0,27 | 0,95±0,27 | 0,86 |
| Complicaciones vasculares | ||||
| Complicaciones microvasculares | 4 (23,5) | 9 (17,0) | 12 (42,9) | 0,04 |
| IM previo | 3 (17,6) | 16 (30,2) | 9 (32,1) | 0,54 |
| ICP previa | 3 (17,6) | 18 (34,0) | 16 (57,1) | 0,02 |
| CABG previa | 0 (0,0) | 1 (1,9) | 1 (3,6) | 0,71 |
| Ictus previo | 2 (11,8) | 9 (17,0) | 3 (10,7) | 0,71 |
| EVP | 5 (29,4) | 6 (11,3) | 8 (28,6) | 0,09 |
| Tratamiento de la diabetes | ||||
| Insulina | 10 (58,8) | 0 (0,0) | 28 (100,0) | < 0,01 |
| Biguanidas | 0 (0) | 53 (100) | 28 (100) | < 0,01 |
| Dosis diaria de MF | 0 | 2170±437,3b | 2119±414,9b | < 0,01 |
| Sulfonilurea | 7 (41,2) | 17 (32,1) | 3 (10,7) | 0,05 |
| Meglitinidas | 2 (11,8) | 4 (7,5) | 1 (3,6) | 0,58 |
| Tiazolidinedionas | 0 | 0 | 0 | |
| Inhibidores de la alfaglucosidasa | 0 | 0 | 0 | |
| DPP4 | 3 (17,6) | 10 (18,9) | 3 (10,7) | 0,63 |
| Estatinas (cualquiera) | 16 (94,1) | 53 (100,0) | 27 (96,4) | 0,26 |
| IECA | 15 (88,2) | 40 (75,5) | 20 (71,4) | 0,42 |
CABG: cirugía de bypass arterial coronario; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; DMNTI: diabetes mellitus no tratada con insulina; DMTI: diabetes mellitus tratada con insulina; DPP4: inhibidores de la dipeptidil peptidasa-4; EVP: enfermedad vascular periférica; ICP: intervención coronaria percutánea; IECA: inhibidores de la enzima de conversión de la angiotensina; IM: infarto de miocardio; MF: metformina.
Los valores expresan n (%) o media ±desviación estándar.
Características clínicas y de la intervención
| Características | No MF 17 pacientes 19 lesiones | MF + DMNTI 53 pacientes 54 lesiones | MF + DMTI 28 pacientes 28 lesiones | p |
|---|---|---|---|---|
| Forma de presentación clínica | 0,44 | |||
| Estable | 6 (35,3) | 28 (52,8) | 13 (46,4) | |
| SCA | 11 (65,7) | 25 (47,2) | 15 (53,6) | |
| Fracción de eyección del VI | 60,0±8,0 | 58,3±7,6 | 56,4±9,9 | 0,4 |
| Inhibidor del P2Y12 | 0,04 | |||
| Clopidogrel | 11 (64,7) | 44 (83,0) | 26 (92,9) | |
| Prasugrel | 6 (35,3) | 6 (11,3) | 2 (7,1) | |
| Ticagrelor | 0 (0,0) | 3 (5,7) | 0 (0,0) | |
| Ácido acetilsalicílico | 17 (100) | 53 (100) | 28 (100) | |
| Inhibidores de la GPIIb/IIIa | 0 (0,0) | 0 (0,0) | 2 (7,1) | 0,08 |
| Acceso radial | 17 (100,0) | 44 (83,0) | 24 (85,7) | 0,19 |
| Número de vasos sanguíneos afectados | 1,6±0,7 | 1,5±0,6 | 1,7±0,6 | 0,49 |
| Vaso diana | 0,74 | |||
| DA | 7 (36,8) | 22 (40,7) | 12 (42,9) | |
| CX | 5 (26,3) | 20 (37,0) | 8 (28,6) | |
| CD | 7 (36,8) | 12 (22,2) | 8 (28,6) | |
| Lesión de tipo B2/C | 6 (31,6) | 17 (31,5) | 13 (46,4) | 0,78 |
| Volumen total de contraste (ml) | 229,6±80,5 | 236,6±93,9 | 230,1±74,8 | 0,92 |
| Asignado aleatoriamente a SLE | 10 (52,6) | 25 (46,3) | 15 (53,6) | 0,78 |
| Longitud total del stent | 20,5±6,9 | 22,6±7,9 | 18,5±6,1 | 0,05 |
| Diámetro del stent | 2,8±0,3 | 2,9±0,3 | 3±0,3 | 0,44 |
| Número de stents/lesión | 1,05±0,23 | 1,13±0,34 | 1,04±0,29 | 0,31 |
| Presión máxima del balón | 16,1±2,8 | 16,5±2,5 | 16,5±2,5 | 0,82 |
| Posdilatación | 3 (15,8) | 9 (16,7) | 5 (17,9) | 0,98 |
| Éxito angiográfico | 19 (100) | 53 (98,1) | 28 (100) | 0,64 |
CD: arteria coronaria derecha; CX: arteria circunfleja; DA: arteria coronaria descendente anterior; DMNTI: diabetes mellitus no tratada con insulina; DMTI: diabetes mellitus tratada con insulina; MF: metformina; SCA: síndrome coronario agudo; SLE: stent liberador de everolimus; VI: ventrículo izquierdo.
Los valores expresan n (%) o media ± desviación estándar.
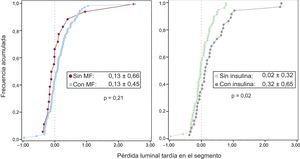
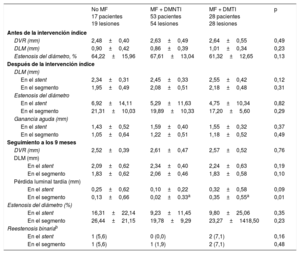
Las características angiográficas se presentan en la tabla 3. Tras el implante del stent, el diámetro del vaso de referencia, el diámetro luminal mínimo y la ganancia aguda fueron similares en todos los grupos. En el seguimiento a los 9 meses, la pérdida luminal tardía en el segmento fue significativamente menor en los pacientes con DMNTI tratados con MF que en los pacientes con DMTI tratados con MF (p < 0,01), mientras que no hubo diferencias entre los pacientes con DMNTI tratados y no tratados con MF (p = 1,0). Los pacientes tratados con insulina presentaron una pérdida tardía significativamente mayor que la de los nunca tratados con insulina (p = 0,02) (figura 2).
Resultados emparejados de la angiografía coronaria cuantitativa
| No MF 17 pacientes 19 lesiones | MF + DMNTI 53 pacientes 54 lesiones | MF + DMTI 28 pacientes 28 lesiones | p | |
|---|---|---|---|---|
| Antes de la intervención índice | ||||
| DVR (mm) | 2,48±0,40 | 2,63±0,49 | 2,64±0,55 | 0,49 |
| DLM (mm) | 0,90±0,42 | 0,86±0,39 | 1,01±0,34 | 0,23 |
| Estenosis del diámetro, % | 64,22±15,96 | 67,61±13,04 | 61,32±12,65 | 0,13 |
| Después de la intervención índice | ||||
| DLM (mm) | ||||
| En el stent | 2,34±0,31 | 2,45±0,33 | 2,55±0,42 | 0,12 |
| En el segmento | 1,95±0,49 | 2,08±0,51 | 2,18±0,48 | 0,31 |
| Estenosis del diámetro | ||||
| En el stent | 6,92±14,11 | 5,29±11,63 | 4,75±10,34 | 0,82 |
| En el segmento | 21,31±10,03 | 19,89±10,33 | 17,20±5,60 | 0,29 |
| Ganancia aguda (mm) | ||||
| En el stent | 1,43±0,52 | 1,59±0,40 | 1,55±0,32 | 0,37 |
| En el segmento | 1,05±0,64 | 1,22±0,51 | 1,18±0,52 | 0,49 |
| Seguimiento a los 9 meses | ||||
| DVR (mm) | 2,52±0,39 | 2,61±0,47 | 2,57±0,52 | 0,76 |
| DLM (mm) | ||||
| En el stent | 2,09±0,62 | 2,34±0,40 | 2,24±0,63 | 0,19 |
| En el segmento | 1,83±0,62 | 2,06±0,46 | 1,83±0,58 | 0,10 |
| Pérdida luminal tardía (mm) | ||||
| En el stent | 0,25±0,62 | 0,10±0,22 | 0,32±0,58 | 0,09 |
| En el segmento | 0,13±0,66 | 0,02±0.33a | 0,35±0,55a | 0,01 |
| Estenosis del diámetro (%) | ||||
| En el stent | 16,31±22,14 | 9,23±11,45 | 9,80±25,06 | 0,35 |
| En el segmento | 26,44±21,15 | 19,78±9,29 | 23,27±1418,50 | 0,23 |
| Reestenosis binariab | ||||
| En el stent | 1 (5,6) | 0 (0,0) | 2 (7,1) | 0,16 |
| En el segmento | 1 (5,6) | 1 (1,9) | 2 (7,1) | 0,48 |
DLM: diámetro luminal mínimo del vaso; DMNTI: diabetes mellitus no tratada con insulina; DMTI: diabetes mellitus tratada con insulina; DVR: diámetro del vaso de referencia; MF: metformina.
Salvo otra indicación, los valores expresan n (%) o media ± desviación estándar.
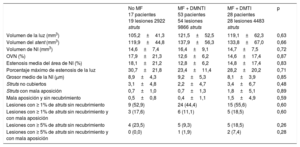
Los resultados de la OCT se presentan en la tabla 4, la figura 3 y la figura del material suplementario. Se dispuso de datos de volumen de neoíntima analizables de todos los pacientes; sin embargo, no fue posible evaluar la cobertura del strut en 1 paciente del grupo sin tratamiento de MF debido a problemas técnicos. Los resultados en cuanto al objetivo principal, es decir, la frecuencia relativa de struts no cubiertos, fue similar en los 3 grupos (el 3,07 ± 4,80% de los pacientes sin tratamiento de MF frente al 2,23 ± 4,73% del grupo de DMNTI + MF frente al 3,43 ± 6,69% del grupo de DMTI + MF; p = 0,48). Los modelos de ecuaciones de estimación generalizada confirmaron la ausencia de asociación entre la MF y la frecuencia relativa de struts no cubiertos, con independencia del uso de tratamiento con insulina o del tipo de stent asignado durante la aleatorización del estudio (odds ratio [OR] = 1,49; intervalo de confianza del 95% [IC95%], 0,71-3,08; p = 0,29). De igual modo, la obstrucción del volumen de NI (objetivo de eficacia respecto a la combinación de fármacos) fue también similar en todos los grupos (p = 0,87).
Resultados de la tomografía de coherencia óptica
| No MF 17 pacientes 19 lesiones 2922 struts | MF + DMNTI 53 pacientes 54 lesiones 9866 struts | MF + DMTI 28 pacientes 28 lesiones 4483 struts | p | |
|---|---|---|---|---|
| Volumen de la luz (mm3) | 105,2±41,3 | 121,5±52,5 | 119,1±62,3 | 0,63 |
| Volumen del stent (mm3) | 119,9±44,8 | 137,9±56,3 | 133,8±67,0 | 0,66 |
| Volumen de NI (mm3) | 14,6±7,4 | 16,4±9,1 | 14,7±7,5 | 0,72 |
| OVN (%) | 17,9±21,3 | 12,6±6,2 | 14,6±17,4 | 0,87 |
| Estenosis media del área de NI (%) | 18,1±21,2 | 12,8±6,2 | 14,8±17,4 | 0,83 |
| Porcentaje máximo de estenosis de la luz | 30,7±21,8 | 23,4±11,4 | 28,2±20,2 | 0,71 |
| Grosor medio de la NI (μm) | 8,9±4,3 | 9,2±5,3 | 8,1±3,9 | 0,85 |
| Struts no cubiertos | 3,1±4,8 | 2,2±4,7 | 3,4±6,7 | 0,48 |
| Struts con mala aposición | 0,7±1,0 | 0,7±1,3 | 1,8±5,1 | 0,89 |
| Mala aposición y sin recubrimiento | 0,5±0,8 | 0,4±1,1 | 1,5±4,9 | 0,59 |
| Lesiones con ≥ 1% de struts sin recubrimiento | 9 (52,9) | 24 (44,4) | 15 (55,6) | 0,60 |
| Lesiones con ≥ 1% de struts sin recubrimiento y con mala aposición | 3 (17,6) | 6 (11,1) | 5 (18,5) | 0,60 |
| Lesiones con ≥ 5% de struts sin recubrimiento | 4 (23,5) | 5 (9,3) | 5 (18,5) | 0,26 |
| Lesiones con ≥ 5% de struts sin recubrimiento y con mala aposición | 0 (0,0) | 1 (1,9) | 2 (7,4) | 0,28 |
DMNTI: diabetes mellitus no tratada con insulina; DMTI: diabetes mellitus tratada con insulina; MF: metformina; NI: neoíntima; OVN: obstrucción de volumen de neoíntima.
Salvo otra indicación, los valores expresan n (%) o media ± desviación estándar.
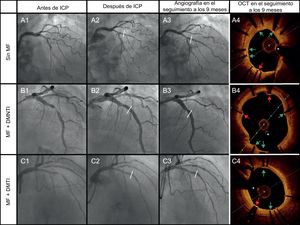
Los casos de los 3 grupos de tratamiento recibieron lo siguiente: A: No MF; B: MF + DMNTI; C: MF + DMTI. La columna 1 corresponde a las imágenes de angiografía previas a la ICP; la columna 2, a las posteriores a la ICP; la columna 3, a la angiografía realizada a los 9 meses, y la última columna, a las imágenes de OCT a los 9 meses. Las flechas verdes indican los struts cubiertos y las rojas, los no cubiertos. El asterisco indica un artefacto de la guía. DMNTI: diabetes mellitus no tratada con insulina; DMTI: diabetes mellitus tratada con insulina; ICP: intervención coronaria percutánea; MF: metformina; OCT: tomografía de coherencia óptica. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Se dispuso de un seguimiento clínico de todos los pacientes a los 12 meses (tabla 5). No se observaron diferencias significativas entre los grupos en ninguno de los objetivos preespecificados, si bien numéricamente hubo más revascularizaciones del vaso diana en el grupo sin MF y en el de DMTI + MF (el 15,8 y el 14,3% respectivamente, en comparación con el 5,6% del grupo de DMNTI + MF; p = 0,28).
Eventos clínicos a los 12 meses
| Evento | No MF 17 pacientes 19 lesiones | MF + DMNTI 53 pacientes 54 lesiones | MF + DMTI 28 pacientes 28 lesiones | p |
|---|---|---|---|---|
| Muerte cardiaca, n | 0 | 0 | 0 | |
| Infarto de miocardio, n | 0 | 0 | 0 | |
| Trombosis de stent clara*, n | 0 | 0 | 0 | |
| Trombosis del stent clara o probable* | 1 (5,3) | 0 (0,0) | 0 (0,0) | 0,11 |
| Revascularización de la lesión diana a causa de isquemia* | 2 (10,5) | 2 (3,7) | 3 (10,7) | 0,39 |
| Revascularización del vaso diana* | 3 (15,8) | 3 (5,6) | 4 (14,3) | 0,28 |
DMNTI: diabetes mellitus no tratada con insulina; DMTI: diabetes mellitus tratada con insulina; MF: metformina.
Salvo otra indicación, los valores expresan n (%).
El presente estudio es el primero en el que se evalúa el papel de la MF en la endotelización de los SFA mediante técnicas de imagen intravasculares en el ser humano. Los principales resultados de este estudio son: a) el uso de MF no se asocia con un deterioro de la cicatrización de la NI en los SFA en el ser humano con DM, y b) los pacientes tratados con insulina presentaron en el seguimiento unos resultados angiográficos significativamente peores que los de pacientes no tratados con insulina exógena.
Los estudios previos realizados en animales indicaban que la MF puede inhibir la endotelización después de un implante de stents liberadores de fármacos limus, y por consiguiente, esta combinación puede aumentar el riesgo de trombosis del stent5,6. Es de destacar que estos estudios se realizaron en modelos de animales no diabéticos. En cambio, nuestros resultados se obtuvieron en arterias coronarias humanas de pacientes diabéticos. Es importante señalar que el engrosamiento de la íntima se regula por la p27Kip1 (un inhibidor de la cinasa dependiente de ciclina), que está aumentada en las células de músculo liso vascular quiescentes e inhibe la proliferación celular vascular y la migración celular. En el ser humano sin DM, una lesión vascular como la causada por el despliegue de un stent produce una degradación de la proteína p27Kip1 de un modo dependiente de mTOR, lo cual induce una proliferación y migración que permite la endotelización del stent15. Así pues, la sinergia entre la MF y los inhibidores de mTOR puede aumentar la concentración de p27Kip1, lo cual inhibe de manera potente la endotelización del strut. En cambio, en los pacientes con DM, la cantidad de ARN mensajero de la p27Kip1 suele mostrar una reducción debido a un aumento de la actividad de la cinasa de respuesta de señal extracelular15, que fomenta el crecimiento de la NI con independencia de la inhibición de mTOR (un proceso denominado «resistencia a la inhibición de mTOR»)16. En consecuencia, aunque la combinación de MF + stents liberadores de fármacos limus puede reducir la endotelización del strut en los mamíferos no diabéticos, este efecto no parece tener trascendencia clínica en el ser humano con DM, probablemente porque la concentración de p27Kip1 está reducida a pesar de la inhibición de mTOR.
Nuestros resultados coinciden con los de un estudio de Lipinski et al.17, que observaron unas tasas de trombosis del stent similares en los pacientes tratados y no tratados con MF en una cohorte retrospectiva de pacientes con DM no insulinodependiente. Sin embargo, estos autores señalaban que la falta de asociación entre la MF y la trombosis del stent se debía a los efectos antiinflamatorios de la MF, y también a que el tratamiento antiagregante plaquetario combinado doble puede superar la mala endotelización en casos con tratamiento de MF. No obstante, nuestro estudio muestra que se produce una cobertura endotelial en las arterias coronarias humanas de pacientes con DM independientemente del uso de MF.
A los pacientes tratados con insulina se los ha excluido sistemáticamente de los análisis previos. Así pues, nuestro estudio es también el primero en el que se evalúa el efecto de la MF en los pacientes con DMTI (grupo 3). Los pacientes tratados con insulina suelen ser pacientes con una DM de más tiempo de evolución y a menudo con un mayor grado de resistencia a la insulina18,19. De hecho, cabe prever un aumento del crecimiento de la NI en estos pacientes y, por consiguiente, no solo el riesgo de trombosis del stent, sino también el de reestenosis, puede ser más alto20. Así pues, en nuestro estudio se separó a los pacientes tratados on insulina a los que se administró MF de los nunca tratados con insulina. Nuestros resultados no mostraron efecto alguno de la MF en la cobertura del strut, con independencia del uso de insulina, y confirmaron también un peor resultado angiográfico en los pacientes tratados con insulina. Es de destacar que la mayor pérdida tardía angiográfica en el interior del segmento en los pacientes tratados con insulina no mostró relación alguna con ninguno de los parámetros determinados mediante OCT en el interior del stent. Esto puede indicar que la progresión de la enfermedad en los márgenes del stent explica la mayor parte de la diferencia de pérdida tardía entre los pacientes tratados y no tratados con insulina, lo cual puede deberse a un efecto sobre el borde del stent inducido por el SFA o a la progresión difusa general de la enfermedad que se incrementa en la diabetes.
Limitaciones y puntos fuertesEl diseño de este estudio tiene algunas limitaciones. Es un análisis post-hoc de un ensayo clínico aleatorizado diseñado para comparar 2 SFA diferentes. El tamaño muestral se calculó basándose en una hipótesis diferente, y la MF no se asignó aleatoriamente. En consecuencia, los resultados deben interpretarse con precaución.
Sin embargo, este estudio tiene también algunos puntos fuertes. En primer lugar, la población se incluyó prospectivamente y se realizó un seguimiento. Además, los datos se obtuvieron de manera exhaustiva y los verificó una organización de investigación bajo contrato externo. En segundo lugar, los fármacos hipoglucemiantes en este estudio los prescribió un endocrinólogo local según las recomendaciones actuales, en vez de hacerse con una asignación aleatoria, por lo que las conclusiones del estudio pueden ser más representativas de una población real de pacientes diabéticos.
CONCLUSIONESEl uso de MF no deteriora la cicatrización endotelial de los SFA en los pacientes con DM tratados o no tratados con insulina. Según lo indicado por estos resultados, el uso de MF no debe desaconsejarse en esos pacientes.
FINANCIACIÓNEste estudio fue financiado por la Fundación Española del Corazón y la Sociedad Española de Cardiología.
CONFLICTO DE INTERESESLa Fundación Española del Corazón ha recibido una subvención no condicionada de Biomenco, una compañía que distribuye productos de Alvimedica en España.
- –
La MF y los inhibidores de mTOR liberados por la mayor parte de los SFA (como sirolimus o everolimus) tienen en común vías de señalización convergentes.
- –
En estudios clínicos previos se ha demostrado una reducción significativa de la endotelización del stent en los animales no diabéticos tratados con MF.
- –
El efecto de la MF en la endotelización del strut en el ser humano no se ha evaluado hasta ahora mediante técnicas de imagen intracoronarias.
- –
El presente estudio es el primero en el que se evalúa el papel de la MF en la endotelización de los SFA mediante técnicas de imagen intravasculares en el ser humano.
- –
El uso de MF no se asocia con un deterioro de la cicatrización de la neoíntima de los SFA en humanos con diabetes mellitus tratada o no con insulina.