El tratamiento óptimo de pacientes con insuficiencia cardiaca aguda (ICA) y síndrome cardiorrenal tipo 1 (SCR-1) no está bien definido. La hipoperfusión arterial y la congestión venosa tienen un papel fundamental en la fisiopatología del SCR-1. El antígeno carbohidrato 125 (CA125) ha emergido como marcador indirecto de sobrecarga de volumen en la ICA. El objetivo de este estudio es evaluar la utilidad del CA125 para el ajuste del tratamiento diurético de pacientes con SCR-1.
MétodosEnsayo clínico multicéntrico, abierto y paralelo, que incluye a pacientes con ICA y creatinina ≥ 1,4 mg/dl al ingreso, aleatorizados a: a) estrategia convencional: titulación basada en la evaluación clínica y bioquímica habitual, o b) estrategia basada en CA125: dosis altas de diuréticos si CA125 > 35 U/ml y bajas en caso contrario. El objetivo principal es el cambio en la función renal a las 24 y las 72 h tras el comienzo del tratamiento. Como objetivos secundarios: a) cambios clínicos y bioquímicos a las 24 y las 72 h, y b) cambios en la función renal y eventos clínicos mayores a 30 días.
ResultadosLos resultados de este estudio aportarán datos relevantes sobre la utilidad del CA125 para guiar el tratamiento diurético en el SCR-1. Además, permitirá ampliar el conocimiento de la fisiopatología de esta compleja entidad clínica.
ConclusionesLa hipótesis del presente estudio es que las concentraciones de CA125 aumentadas pueden identificar a una población de pacientes con SCR-1 para quienes una estrategia diurética más intensa puede ser beneficiosa. Por el contrario, las concentraciones bajas de esta glucoproteína seleccionarían a los pacientes para los que serían perjudiciales las dosis altas de diuréticos.
Palabras clave
La insuficiencia renal se produce con frecuencia en la insuficiencia cardiaca (IC); esta asociación conlleva un impacto pronóstico negativo1-3. Un alto porcentaje de los pacientes ingresados por IC aguda (ICA) presentan insuficiencia renal al ingreso o muestran un empeoramiento de la función renal (EFR) durante la hospitalización3. La concomitancia de estos 2 trastornos se ha traducido en una mayor duración de la hospitalización y un peor pronóstico a corto y a largo plazo4,5. En el contexto de la ICA, la fisiopatología de la disfunción renal es compleja y no se conoce por completo3. Aunque tradicionalmente se ha atribuido a la reducción del gasto cardiaco y la consiguiente hipoperfusión renal, hay datos recientes que resaltan el papel de la congestión renal como otro posible mecanismo central6-9. Según estas observaciones, creemos que es crucial identificar a los pacientes para los que podría ser útil un control estricto de la sobrecarga de volumen. Dado que la intensidad del tratamiento diurético empleado suele basarse en una evaluación subjetiva y no en una guía basada en la evidencia, resulta necesario buscar un instrumento que no solo refleje la gravedad de la sobrecarga de líquidos, sino que también sea útil para individualizar la intensidad del tratamiento diurético. Teniendo en cuenta los datos que indican que las concentraciones plasmáticas del antígeno carbohidrato 125 (CA125) están estrechamente correlacionadas con los parámetros clínicos, hemodinámicos y electrocardiográficos que son indicadores indirectos de la sobrecarga de líquidos10-15, así como los resultados recientes de un ensayo clínico que corroboró el papel del CA125 para guiar el tratamiento de los pacientes con un episodio reciente de ICA16, se plantea la hipótesis de que este biomarcador pueda ser un posible candidato para guiar el tratamiento diurético de los pacientes con síndrome cardiorrenal tipo 1 (SCR-1). Según la hipótesis propuesta, las dosis altas de diuréticos serían especialmente beneficiosas respecto a la función renal y el estado clínico de los pacientes con un aumento del CA125. En cambio, un valor bajo del CA125 identificaría a los pacientes a los que se debe aplicar una estrategia diurética más conservadora.
MÉTODOSDiseño del estudioEste es un ensayo clínico multicéntrico, abierto, de grupos paralelos, iniciado por los investigadores, en el que participarán pacientes con ICA asignados aleatoriamente a 1 de las 2 estrategias siguientes: a) estrategia diurética estándar con un esquema de ajuste del tratamiento basado en una evaluación clínica habitual, o b) estrategia diurética basada en las concentraciones plasmáticas de CA125. Dadas las características inherentes a este diseño, no es factible el enmascaramiento completo al médico; sin embargo, se oculta a los pacientes el grupo de tratamiento al que se los asigna. La duración mínima de la participación de los pacientes es de 30 días. El estudio se lleva a cabo en 9 centros de España y se atiene a los principios de buenas prácticas clínicas según lo establecido en la Declaración de Helsinki. Todos los pacientes firmaron un documento de consentimiento informado y el protocolo fue aprobado por el comité de ética de investigación de los centros participantes y la Agencia Española de Medicamentos y Productos Sanitarios. Este estudio está registrado en clinicaltrials.gov (NCT02643147).
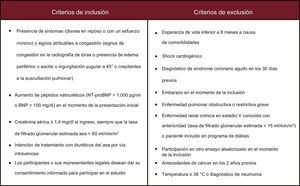
Población del estudioFormaron la población del estudio los pacientes con ICA y disfunción renal que requirieron un ingreso hospitalario o la administración intravenosa de diuréticos en un contexto ambulatorio. Estos pacientes se distribuyen aleatoriamente durante las primeras 24 h siguientes a la presentación clínica. Los criterios de inclusión y exclusión se presentan en la figura.
Asignación aleatoriaTras dar su consentimiento informado, se aleatorizó a los pacientes a la estrategia basada en el CA125 o la diurética estándar usando un método de aleatorización a distancia por bloques generado por ordenador, a través de Internet, en relación 1:1.
Métodos del estudioExamen de selección y evaluación de la elegibilidad (visita 0)El cribado de los pacientes incluye análisis de laboratorio y otros procedimientos en el momento de la presentación clínica, junto con la verificación de los criterios de inclusión y exclusión.
Se llevan a cabo los siguientes procedimientos u obtención de datos tras haber establecido que se cumplen los criterios de inclusión: a) documento de consentimiento informado firmado y fechado; b) datos demográficos; c) historia clínica completa, incluido el tratamiento actual y las medicaciones recibidas en los últimos 30 días; d) evaluación de la clase funcional de la New York Heart Association (NYHA) más reciente previa a la descompensación; e) evaluación de la disnea mediante escala visual analógica; f) constantes vitales y exploración física completa; g) electrocardiograma; h) análisis de orina, e i) análisis de sangre con hemograma, péptidos natriuréticos, troponina, CA125 y los parámetros de función renal (creatinina sérica [Cr], nitrógeno de urea, tasa de filtrado glomerular estimada (TFGe) y cistatina C). Se determina la TFGe mediante la fórmula Modification of Diet in Renal Disease.
Visitas de SeguimientoSe llevan a cabo visitas de seguimiento programadas a las 24 y las 72 h y a los 30 días de la aleatorización (visita final). En estas visitas se registran los datos de las constantes vitales, la exploración física completa, la clase funcional de la NYHA y la evaluación de la escala visual analógica. Los análisis de laboratorio incluyen un análisis de orina y las concentraciones séricas de Cr, urea, nitrógeno de urea en sangre, TFGe, cistatina C y péptido natriurético cerebral/fracción aminoterminal del propéptido natriurético cerebral. Durante el seguimiento, se censura para el análisis a los pacientes que fallezcan. Si los pacientes retiran su consentimiento informado, se produce el abandono del estudio.
Visitas adicionalesSe autorizan visitas fuera de la programación prevista (visitas opcionales) a criterio del médico encargado del paciente. Debe registrarse en la historia clínica el motivo principal de cada una de las visitas opcionales y todo análisis de laboratorio o procedimiento aplicado, y debe informarse de ello al monitor del ensayo clínico.
En la tabla 1 se presenta un resumen de todos los procedimientos del estudio.
Diseño del seguimiento
| Visita 0 | 24 h | 72 h | 30 días | Adicional | |
|---|---|---|---|---|---|
| Documento de consentimiento informado | X | ||||
| Características demográficas | X | ||||
| Historia clínica completa | X | ||||
| NYHA | X | X | X | X | X |
| EVA | X | X | X | X | |
| Constantes vitales | X | X | X | X | X |
| Exploración física completa | X | X | X | X | X |
| ECG | X | X | |||
| Análisis de sangre y orina | X | X | X | X | X |
| Eventos adversos | X | X | X | X | |
| Cambios en el tratamiento | X | X | X | X |
ECG: electrocardiograma; EVA: escala visual analógica de la disnea; NYHA: clase funcional de la New York Heart Association.
Durante el periodo de estudio, se recoge información sobre las medicaciones concomitantes y los eventos clínicos adversos (muerte por cualquier causa o agravamiento de la ICA de nueva aparición).
Intervención del ensayoA los pacientes elegibles para el ensayo se los aleatoriza a una estrategia diurética convencional (basada en la evaluación clínica) o una guiada por la concentración de CA125 en plasma. Todos los diuréticos y las medicaciones concomitantes utilizadas en este ensayo están autorizadas para el tratamiento de la IC y forman parte de la asistencia estándar utilizada para este trastorno17,18. En la tabla 2 se presentan algoritmos de tratamiento detallados.
Estrategias de tratamiento diurético
| Estrategia convencional | Estrategia guiada por CA125 |
|---|---|
| – Posología de diuréticos según la presencia de signos y síntomas de congestión sistémica – La dosis inicial de furosemida intravenosa debe ser como mínimo igual a la dosis oral preexistente utilizada en el domicilio, a menos que se sospeche un llenado arterial insuficiente e hipoperfusión – Se recomiendan dosis altas de furosemida intravenosa > 120 mg/día si hay signos inequívocos de congestión – Los ajustes de dosis durante la hospitalización se realizarán según los cambios clínicos y bioquímicos | Pacientes con CA125 ≤ 35 U/ml – Dosis inicial de furosemida intravenosa ≤ 80 mg/día – Retirada de las tiacidas – Al cabo de 24 h: ajuste de la dosis según los cambios clínicos y bioquímicos Pacientes con CA125 > 35 U/ml – Dosis inicial de furosemida intravenosa > 120 mg/día o 2,5 veces la dosis oral previa – Si el CA125 es > 100 U/ml y/o hay signos clínicos concomitantes inequívocos de congestión sistémica, dosis > 160 mg/día – Al cabo de 24 h: se recomienda aumento de la dosis de furosemida intravenosa y/o la adición de clortalidona (25-50 mg/día v.o.) si la diuresis es < 3 l durante las primeras 24 h y/o acetazolamida (250 mg/día v.o.) |
CA125: antígeno carbohidrato 125; v.o.: vía oral.
La posología de la medicación diurética se elige en función de la presencia de signos y síntomas de congestión sistémica y ateniéndose a las recomendaciones actuales17,18. La dosis inicial de furosemida intravenosa debe ser como mínimo igual a la dosis oral preexistente utilizada en el domicilio, a menos que se sospeche un llenado arterial insuficiente e hipoperfusión. Se considera aconsejable mantener la dosis inicial programada durante al menos las primeras 24 h de ingreso. La pauta posológica diurética se modifica en función de la respuesta del paciente y de criterios analíticos. La administración de diuréticos adicionales y otros fármacos (nitratos, antiarrítmicos, fármacos inotrópicos, inhibidores de la enzima de conversión de la angiotensina, antagonistas del receptor de la angiotensina II, inhibidores de la neprilisina y el receptor de la angiotensina II, bloqueadores beta y digoxina) se deja al criterio del médico encargado del paciente. Se debe considerar la instauración de una terapia sustitutiva renal para los pacientes con IC congestiva resistente al tratamiento a criterio del médico encargado, hiperpotasemia grave (> 6,5 mmol/l) o acidemia grave (pH < 7,2).
Estrategia guiada por el antígeno carbohidrato 125En este grupo, la pauta posológica diurética se ajusta según la concentración de CA125 en suero:
- –
Pacientes con un CA125 ≤ 35 U/ml. Se recomienda una dosis inicial de furosemida intravenosa ≤ 80mg/día; esto es independiente de cualquier dosis previa que se estuviera administrando al paciente. Se aconseja mantener esta dosis durante las primeras 24 h. Se recomienda también interrumpir la administración de antagonistas de aldosterona, tiacida u otros diuréticos. Después de las primeras 24 h, toda ulterior decisión respecto a la modificación de la dosis inicial o la vía de administración de los diuréticos del asa queda al criterio del médico que atienda al paciente, en función de su respuesta clínica y analítica.
- –
Pacientes con un CA125 > 35 U/ml. Para este grupo, se establece como tratamiento estándar una dosis inicial de furosemida intravenosa > 120mg/día (o 2,5 veces la dosis oral que estuviera recibiendo el paciente). Se recomiendan dosis > 160 mg/día para los pacientes con CA125 > 100 U/ml y signos clínicos de congestión sistémica grave. Después de 24 h, el médico encargado de la asistencia del paciente puede realizar cambios en la posología o la vía de administración o, en caso necesario, suspender el tratamiento diurético. Como regla general, si la diuresis obtenida durante las primeras 24 h es ≤ 3 l, se recomienda un aumento de la dosis de furosemida intravenosa o la adición de clortalidona a dosis de 25-50mg/día, a menos que haya un deterioro importante de la función renal (aumento de Cr > 0,5mg/dl respecto al valor al ingreso). El método preferido de administración de la furosemida intravenosa para dosis > 250mg/día es la infusión continua; en los demás casos se usa una inyección en bolos.
Para todos los pacientes, debe evitarse la administración oral de diuréticos del asa junto con la administración intravenosa de estos fármacos. Las recomendaciones respecto al uso de otros fármacos (nitratos, antiarrítmicos, inotrópicos, inhibidores de la enzima de conversión de la angiotensina, antagonistas del receptor de la angiotensina II, inhibidores de la neprilisina y del receptor de la angiotensina II, bloqueadores beta y digoxina) y terapia sustitutiva renal son las mismas que se indican para el grupo de tratamiento convencional.
ObjetivosObjetivo principalEl objetivo principal es evaluar los cambios de la función renal a las 24 y las 72 h de la inclusión en el estudio. Para ello, se determinan los siguientes marcadores de la función renal: Cr sérica, urea, cociente urea:Cr, TFGe y cistatina C. Los cambios de los parámetros de la función renal se evalúan como variables continuas (cambio absoluto y relativo) y discretas. La mejora de la función renal y el EFR se definen, respectivamente, como un aumento o una disminución de la Cr ≥ 0,3 mg/dl.
Objetivos secundariosSe evaluan también los siguientes objetivos secundarios, mediante la comparación de las 2 estrategias:
- –
Resolución de la disnea (cambios en la clase funcional de la NYHA), signos de congestión sistémica y evaluación general del paciente (mediante escala visual analógica) a las 24 y las 72 h de la inclusión.
- –
Cambios en las concentraciones plasmáticas de los péptidos natriuréticos (péptido natriurético cerebral o fracción aminoterminal del propéptido natriurético cerebral) a las 72 h de la inclusión en el estudio.
- –
Cambios en las concentraciones plasmáticas de troponina a las 72 h de la inclusión en el estudio.
- –
Cambios en el análisis de orina a las 24 y las 72 h (Cr, sodio y potasio).
- –
Tiempo necesario para el cambio de los diuréticos intravenosos a la administración oral.
- –
Parámetros de la función renal (Cr, urea, cociente urea:Cr, TFGe y cistatina C) a los 30 días.
- –
Eventos clínicos adversos: combinación de los eventos adversos muerte o rehospitalización por ICA a los 30 días.
Se aplica un criterio estricto respecto a la estrecha vigilancia de eventos adversos, con objeto de garantizar una detección temprana y un tratamiento adecuado de la disfunción renal o las alteraciones graves de los electrolitos y el pH. En consecuencia, se debe supervisar, tratar y registrar los siguientes trastornos tras la inclusión en el estudio: a) aumento de Cr en suero ≥ 300% o un valor de Cr en suero ≥ 4mg/dl (≥ 354 mmol/l) con un aumento agudo ≥ 0,5mg/l (44 mmol/l) en comparación con los valores previos a la aleatorización; b) hiperpotasemia (potasio sérico > 6,0 mEq/l): en los casos en que pueda estar involucrado un tipo de tratamiento diurético, se debe realizar un examen especial del tratamiento diurético utilizado, en cuyo caso debe retirarse el antagonista de aldosterona, y c) hipopotasemia (potasio en suero < 3,0 mEq/l): se debe notificar todos los casos y considerar la posible conveniencia de un suplemento de potasio, en especial para los pacientes tratados con antagonistas de aldosterona.
Cálculo del tamaño muestralPara el cálculo del tamaño muestral, se utilizó una prueba exacta de Fisher bilateral. El tamaño muestral estimado por lo que respecta a la mejora de la función renal resultó en 77 pacientes en cada grupo (total, 154 pacientes) y para la EFR, 39 por grupo (total, 78 pacientes). Partiendo del supuesto de una pérdida de un 5-10% de los pacientes (retirada del consentimiento, pérdida del seguimiento a los 30 días y muertes tempranas), se aumentó el tamaño de la muestra en un 10%, con lo que quedó una muestra final de 170 pacientes. La magnitud del efecto de interés (el tamaño mínimo significativo) y la probabilidad de los resultados (mejoría de la función renal y EFR) en el grupo 1 se determinaron a partir de un estudio piloto llevado a cabo en nuestro departamento19. En el material suplementario se presenta información más detallada acerca de la estimación del tamaño muestral.
Análisis estadísticoTodas las comparaciones estadísticas se realizan según el principio de intención de tratar. Los datos se presentan como media ± desviación estándar para las variables con distribución normal y como mediana [intervalo intercuartílico] en los demás casos. Los datos de variables discretas se expresan mediante frecuencia y porcentajes. Las variables continuas y de distribución normal se comparan en las 2 estrategias con una prueba de la t de Student o la suma de rangos de Wilcoxon. Se utiliza la prueba exacta de Fisher para comparar las variables discretas de 2 niveles; las variables discretas de múltiples clases se comparan con pruebas de la χ2.
Objetivo primarioLas hipótesis nulas establecen que no hay diferencias entre las estrategias en cuanto al cambio de la Cr, con cambios absolutos de la Cr entre el ingreso y las 72 h que van de –0,29 a 0,29 mg/dl. Se compara el cambio absoluto entre las 2 estrategias a las 24 y las 72 h de la inclusión mediante un ANCOVA (análisis de covarianza), utilizando el valor basal de Cr como covariable. En caso de que haya un desequilibrio motivado por el azar en algunas de las características basales, esta variable o variables se utilizan también como covariables en el modelo de ANCOVA. Se aplica una corrección de Bonferroni estableciendo el valor de alfa en 0,025 para tener en cuenta la realización de múltiples comparaciones entre los 3 subgrupos: control, CA125 ≤ 35 U/ml, CA125 > 35 U/ml.
Objetivos secundariosLa diferencia entre las estrategias por lo que respecta a la combinación de muerte o rehospitalización por ICA a los 30 días se presenta gráficamente con el método de Kaplan-Meier y se analiza mediante test de log rank. Se calculan los valores de hazard ratio (HR) univariables mediante regresión de riesgos proporcionales de Cox; el criterio principal de censura para el análisis es la finalización del ensayo (censura administrativa a los 30 días). Se utiliza un análisis de regresión de Cox multivariable solo en caso de que haya importantes factores pronósticos o características basales de los pacientes que tengan un desequilibrio significativo entre los 2 grupos de aleatorización. En todos los análisis se tiene en cuenta el posible efecto de agrupación dentro de los centros. Los valores no disponibles se imputan empleando técnicas de imputación múltiple, bajo el supuesto de MCAR (valores completamente perdidos al azar) o MAR (perdidos al azar).
En todos los análisis se considerará estadísticamente significativo un valor de p bilateral < 0,05. Todos los análisis se llevan a cabo con el programa Stata 14.2 (StataCorp.; College Station, Texas, Estados Unidos).
Estado actual del ensayoLa inclusión de pacientes se inició en abril de 2015. El 2 de noviembre de 2016, se había incluido en el estudio a 142 pacientes (el 83,5% del objetivo).
DISCUSIÓNLa disfunción renal es un acompañante habitual de la IC, y durante las descompensaciones de ICA su frecuencia es mayor1-3. En consecuencia, estos pacientes tienen hospitalizaciones más largas y en general peor pronóstico a corto y largo plazo4,5.
Otro factor de complicaciones es que, para un mayor grado de insuficiencia renal, faltan tratamientos con buena base de evidencia y la asistencia actual a los pacientes continúa siendo mayoritariamente empírica3,17,18.
La fisiopatología de la disfunción renal en los pacientes con ICA es compleja y multifactorial y no se ha esclarecido por completo3. Históricamente, el EFR se ha atribuido a una reducción del gasto cardiaco y la consiguiente hipoperfusión renal3. Sin embargo, algunos datos recientes no han mostrado una correlación de parámetros indirectos que indiquen bajo gasto cardiaco con el EFR en los pacientes con IC3,9. De hecho, en un reciente y elegante estudio, Hanberg et al.20 no observaron asociación alguna entre la reducción del índice cardiaco (determinada mediante cateterismo de la arteria pulmonar) y el grado de disfunción renal en 575 pacientes con IC avanzada (NYHA III o IV y media de fracción de eyección del ventrículo izquierdo del 23 ± 12%). Asimismo hay datos recientes que resaltan el papel de la congestión renal (presión venosa, intraabdominal e hidrostática de la vena renal) como factor importante en la patogenia del EFR como complicación de una ICA6-9. Por ejemplo, Mullens et al.8 observaron que el aumento de la presión venosa central al ingreso y su persistencia después del tratamiento son los factores más importantes relacionados con el EFR. En un contexto similar, Damman et al.21 señalaron que, en 30 pacientes con IC congestiva crónica, hubo un aumento de los marcadores de la lesión tubular renal tras la retirada de los diuréticos. Se han confirmado observaciones similares en otros estudios que han resaltado el papel de la congestión venosa como posible factor contribuyente a la fisiopatología de la disfunción renal, en especial en los pacientes con ICA6-9.
Actualmente los diuréticos son el tratamiento farmacológico de elección para el control de la congestión de los pacientes con ICA17,18. Sin embargo, su uso es en gran parte empírico y se ha asociado tradicionalmente con efectos nocivos importantes, como el EFR3,17,18,22,23. Paradójicamente, en algunos subgrupos de pacientes, se ha observado también que los diuréticos se asocian de manera independiente con una mejora de la función renal3,19,21,23, observación que, al menos indirectamente, refuerza el papel de la congestión venosa como factor principal en el deterioro del filtrado glomerular en la ICA. Parece que los efectos de los diuréticos en la función renal vienen dados por un delicado equilibrio entre la presión de perfusión renal y la congestión venosa renal3. Lamentablemente, no hay consenso respecto a la mejor forma de guiar el tratamiento diurético de estos pacientes17,18. Tal vez la falta de evidencia clara basada en ensayos clínicos aleatorizados, además de que no hay un método viable para cuantificar la congestión sistémica, explique que no se disponga de un instrumento clínico para guiar el tratamiento con diuréticos24,25. De hecho, los parámetros clínicos corrientes que se utilizan para el diagnóstico y la estratificación pronóstica han resultado poco útiles para cuantificar el grado y la distribución de la sobrecarga de líquidos24. Además, conviene mencionar que la concentración de péptidos natriuréticos no ha mostrado correlación alguna con el grado de congestión24,26. Así pues, en el contexto de la ICA, existe una necesidad insatisfecha de un instrumento clínico/biológico que refleje la gravedad de la sobrecarga de líquidos y que, a la vez, sea lo bastante sensible para detectar las variaciones inducidas por el tratamiento diurético.
En esta línea de pensamiento, han surgido las determinaciones de CA125 en plasma como posible candidato para guiar el tratamiento reductor15. El CA125 es una glucoproteína sintetizada por las células serosas epiteliales que se ha utilizado ampliamente para el seguimiento del tratamiento del cáncer de ovario. Sin embargo, se han descrito también altas concentraciones en plasma en otras enfermedades como la IC, el síndrome nefrótico, la cirrosis hepática o la enfermedad inflamatoria pelviana, entre otras15. En el contexto de la IC, varios estudios han indicado que el CA125 muestra una estrecha correlación con los parámetros clínicos, ecocardiográficos y hemodinámicos que indican la gravedad de la congestión sistémica o la redistribución hídrica en los órganos10-15. Además, hay un aumento de esta glucoproteína en la mayoría de los pacientes hospitalizados por ICA, y se asocia con aumento del riesgo de muerte y reingresos por ICA10-15. Por otra parte, se ha demostrado que este biomarcador es lo suficientemente sensible para realizar el seguimiento del curso clínico del paciente; en consecuencia, se ha evaluado su uso como posible instrumento de supervisión y guía del tratamiento reductor en la IC27-31. De hecho, en un reciente ensayo clínico aleatorizado en 380 pacientes con un evento de ICA reciente, un tratamiento guiado por el CA125, basado principalmente en los cambios de la frecuencia del seguimiento y la intensidad del tratamiento diurético, se asoció con una reducción significativa del riesgo a 1 año de reingresos por ICA, en comparación con la asistencia estándar16. En este ensayo, los autores proponen una intensificación de la frecuencia de la supervisión y un aumento de los diuréticos cuando el CA125 está aumentado (CA125 > 35 U/ml), mientras que se sigue una pauta más relajada de visitas ambulatorias y se reduce el tratamiento diurético si el CA es ≤ 35 U/ml16. En la misma línea, pero en contexto de la ICA, se observa que, en 526 pacientes hospitalizados por ICA, los cambios tempranos de la función renal tras la administración intravenosa de furosemida dependían en gran parte de la función renal y la concentración plasmática de CA125 determinados al ingreso. De hecho, el aumento de las dosis de furosemida se asoció con un incremento de la Cr sérica a las 48 a 72 horas en los pacientes con Cr ≥ 1,4mg/dl al ingreso y CA125 < 35 U/ml19. En cambio, el aumento de las dosis de furosemida se asoció con una disminución significativa de la Cr en los pacientes con Cr ≥ 1,4mg/dl y CA125 > 35 U/ml al ingreso. Se observaron resultados similares en los valores de nitrógeno de urea en sangre y la TFGe19. Además, en 1.389 pacientes ingresados por ICA, nuestro grupo observó que el riesgo de mortalidad asociado con la dosis de diuréticos del asa en el momento del alta era intensa y que había una asociación diferenciada con la concentración plasmática de nitrógeno de urea y CA12532. Así, las dosis altas de diurético del asa se asociaron a un aumento del riesgo de muerte durante el seguimiento, en especial en los pacientes con valores de CA125 normales y altas concentraciones de nitrógeno de urea en sangre, mientras que en los pacientes con cifras altas de urea en sangre y CA125, las dosis altas de diuréticos del asa se asociaron con una disminución del riesgo de muerte del 27%32.
Otras características, como la amplia disponibilidad, el bajo coste, la forma de determinación estandarizada, la larga semivida y que las determinaciones de CA125 no se afecten de manera sustancial por la edad y la disfunción renal, son ventajas importantes que conviene resaltar15.
En resumen, existe un considerable conjunto de evidencia que indica la utilidad de este biomarcador para el seguimiento y la guía del tratamiento diurético de los pacientes con SCR-1. Un ensayo clínico aleatorizado es un paso necesario para evaluar esta hipótesis.
CONCLUSIONESNo existe evidencia suficiente que respalde el concepto de que, en los pacientes hospitalizados por una ICA, el grado de congestión venosa influya en los cambios tempranos de la función renal inducidos por la administración de diuréticos. Partiendo de estas premisas, se propone que el uso de dosis altas de diuréticos podría ser especialmente beneficioso (por lo que respecta a la mejora de la función renal) para los pacientes con un EFR y un aumento de las concentraciones plasmáticas de CA125 al ingreso. En cambio, las dosis altas de diuréticos podrían asociarse con un mayor deterioro de la función renal en los pacientes con un EFR y CA125 al ingreso dentro de los límites de la normalidad.
FINANCIACIÓNProyecto PI13/01519 en colaboración con la «Plataforma de Unidades de Investigación Clínica y Ensayos Clínicos» (SCReN [red española de investigación clínica]) (PT13/0002/0031). Cofinanciado por el ERDF (Fondo Europeo de Desarrollo Regional). Subvención no condicionada: «Proyectos de Investigación de Insuficiencia Cardiaca de la Sección de Insuficiencia Cardiaca 2015» de la Sección de Insuficiencia Cardíaca de la Sociedad Española de Cardiología. Subvención no condicionada: «Beca Mutual Médica 2014», Instituto de Salud Carlos III, y cofinanciado por el ERDF (número de subvención PIE15/00013). Red de Investigación Cardiovascular; Programa 7 (RD12/0042/0010).
CONFLICTO DE INTERESESNinguno.
- –
La insuficiencia renal se produce con frecuencia en la ICA, en la que tiene un efecto adverso en los principales resultados clínicos.
- –
Algunos datos recientes han resaltado el papel de la congestión renal en la fisiopatología de la disfunción renal de los pacientes con ICA.
- –
Faltan tratamientos con buena base de evidencia en este contexto, y la intensidad del tratamiento diurético suele basarse en una evaluación subjetiva, en vez de en una guía basada en la evidencia.
- –
Los valores plasmáticos de CA125 están intensamente correlacionados con los indicadores clínicos, hemodinámicos y ecocardiográficos indirectos de la sobrecarga de líquidos.
- –
Se plantea la hipótesis de que el CA125 es un posible candidato para guiar el tratamiento diurético en los pacientes con un SCR-1.
- –
Las dosis altas de diuréticos podrían ser especialmente beneficiosas (por lo que respecta a la mejora de la función renal) para los pacientes con un EFR y un aumento de las concentraciones plasmáticas de CA125 al ingreso.
- –
En cambio, las dosis altas de diuréticos podrían asociarse con un mayor deterioro de la función renal en los pacientes con un EFR y CA125 sérico al ingreso dentro de los límites de la normalidad.
Amparo Villaescusa, Anna Mollar, Antonio Gabarrón y Paula Lizandra.