La fibrilación auricular es la arritmia cardiaca más prevalente en la población general y su presencia aumenta 5 veces el riesgo de que se produzcan fenómenos tromboembólicos. El tratamiento antitrombótico disminuye ese riesgo, pero aumenta la posibilidad de fenómenos hemorrágicos, y la hemorragia intracraneal es la complicación más temida. El riesgo no es homogéneo en todos los pacientes; por ello, en los últimos años se han desarrollado diferentes escalas de riesgo tromboembólico (las escalas CHADS2, CHA2DS2-VASc y ATRIA); la escala CHA2DS2-VASc es la recomendada por las guías de práctica clínica para optimizar la terapia antitrombótica de los pacientes con fibrilación auricular. Las mismas guías recomiendan valorar no solo el riesgo trombótico, sino también el hemorrágico. Se han propuesto distintos esquemas de riesgo que valoran el riesgo hemorrágico del paciente (HEMORR2HAGES, HAS-BLED, ATRIA y ORBIT), pero la escala HAS-BLED es la que recomiendan actualmente la mayoría de las guías. Con todo ello, es fundamental evaluar el beneficio clínico neto de la terapia anticoagulante, que el beneficio esperado con la terapia anticoagulante exceda el daño esperado por un posible sangrado. Sin embargo, tanto los esquemas de riesgo trombótico como de riesgo hemorrágico tienen un poder predictivo de eventos solo moderado. Por ello, diferentes estrategias, como el uso de los biomarcadores (dímero D, factor de von Willebrand o GDF-15), pueden ayudar en la evaluación del riesgo tromboembólico individual de los pacientes con fibrilación auricular.
Palabras clave
La fibrilación auricular (FA) es la arritmia cardiaca más frecuente en nuestro medio, y su prevalencia en España se sitúa, según los últimos datos del estudio OFRECE1, en el 4,4% de la población mayor de 40 años. La presencia de FA se asocia con un aumento de hasta 5 veces del riesgo de ictus y eventos tromboembólicos2, con el incremento de la mortalidad y morbilidad que conlleva.
El tratamiento antitrombótico disminuye la tasa de eventos trombóticos, con una reducción del 64% en la tasa de ictus y un 26% en la de mortalidad en comparación con placebo3. Sin embargo, el tratamiento anticoagulante está asociado a un aumento del riesgo de complicaciones hemorrágicas; como complicación mortal, destaca el incremento de la tasa de hemorragia intracraneal. Dado que el riesgo embólico y hemorrágico no es homogéneo en todos los pacientes, es fundamental evaluar individualmente el beneficio de la reducción del riesgo tromboembólico frente al aumento del riesgo hemorrágico de los pacientes con FA y seleccionar así el inicio del tratamiento antitrombótico más adecuado.
Evaluación del riesgo tromboembólicoHay un gran número de factores que se asocian con el riesgo tromboembólico de los pacientes con FA. La combinación de estos factores de riesgo se ha utilizado para generar escalas de estratificación de riesgo tromboembólico con el objetivo inicial de identificar a los pacientes candidatos a iniciar terapia anticoagulante4,5.
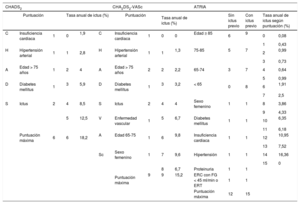
La escala de riesgo CHADS2 (insuficiencia cardiaca, hipertensión, edad > 75 años, diabetes mellitus e ictus [doble]) es una de las más simples y se ha usado habitualmente para guiar la terapia antitrombótica desde que fue propuesta y validada en 2001 en los estudios AFI6 y SPAF7. Esta escala CHADS2 asigna 1 punto si el paciente tiene insuficiencia cardiaca, hipertensión arterial, edad ≥ 75 años o diabetes mellitus, y 2 puntos si hay antecedente de ictus. Así, permite clasificar artificialmente el riesgo trombótico en bajo (CHADS2 = 0), moderado (CHADS2 = 1) y alto (CHADS2 ≥ 2)8 (tabla 1). Sin embargo, mientras la escala CHADS2 clasifica bien a los pacientes de alto riesgo, genera un gran grupo de riesgo intermedio (> 60%) y la puntuación CHADS2 = 0 no identifica realmente a los pacientes que tienen bajo riesgo trombótico, ya que presentan una tasa anual de riesgo trombótico > 3,2%9. Además, no incluye otros muchos factores de riesgo que favorecen la aparición de eventos trombóticos. Por todo ello, en 2009 el grupo de Birmingham propuso la nueva escala de riesgo CHA2DS2-VASc (insuficiencia cardiaca, hipertensión, edad ≥ 75 años [doble], diabetes mellitus, ictus [doble], enfermedad vascular, edad 65-74 y sexo femenino), derivada de la población del Euro Heart Survey on Atrial Fibrillation10. La escala CHA2DS2-VASc añade 3 factores de riesgo a la anterior escala: la importancia de la edad, asignando 2 puntos a los pacientes con FA y edad > 75 años y 1 punto si tiene 65-74 años; 1 punto a la presencia de enfermedad vascular (infarto de miocardio, enfermedad arterial periférica o placa aórtica complicada), y otro punto si el sexo es femenino (no puntúa si es el único factor de riesgo presente). La escala CHA2DS2-VASc se demostró mejor que la escala CHADS2 en la identificación de pacientes con verdadero bajo riesgo, ya que identifica a aquellos que no se benefician de iniciar terapia anticoagulante11–14. Así, en un estudio de validación del esquema CHA2DS2-VASc en 4.670 pacientes15, la escala CHA2DS2-VASc reclasificó a los pacientes con CHADS2 = 1. Un 26% de los pacientes presentaban una puntuación CHA2DS2-VASc = 1, con un riesgo anual de ictus del 0,9%, y se reclasificó a un 74% de los pacientes con CHADS2 = 1 en una puntuación CHA2DS2-VASc ≥ 2, con un riesgo anual de ictus o embolia sistémica del 2,1%.
Principales esquemas de riesgo tromboembólico y tasa anual de ictus según puntuación.
| CHADS2 | CHA2DS2-VASc | ATRIA | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Puntuación | Tasa anual de ictus (%) | Puntuación | Tasa anual de ictus (%) | Sin ictus previo | Con ictus previo | Tasa anual de ictus según puntuación (%) | ||||||||
| C | Insuficiencia cardiaca | 1 | 0 | 1,9 | C | Insuficiencia cardiaca | 1 | 0 | 0 | Edad ≥ 85 | 6 | 9 | 0 | 0,08 |
| 1 | 0,43 | |||||||||||||
| H | Hipertensión arterial | 1 | 1 | 2,8 | H | Hipertensión arterial | 1 | 1 | 1,3 | 75-85 | 5 | 7 | 2 | 0,99 |
| 3 | 0,73 | |||||||||||||
| A | Edad > 75 años | 1 | 2 | 4 | A | Edad > 75 años | 2 | 2 | 2,2 | 65-74 | 3 | 7 | 4 | 0,64 |
| 5 | 0,99 | |||||||||||||
| D | Diabetes mellitus | 1 | 3 | 5,9 | D | Diabetes mellitus | 1 | 3 | 3,2 | < 65 | 0 | 8 | 6 | 1,91 |
| 7 | 2,5 | |||||||||||||
| S | Ictus | 2 | 4 | 8,5 | S | Ictus | 2 | 4 | 4 | Sexo femenino | 1 | 1 | 8 | 3,86 |
| 9 | 4,33 | |||||||||||||
| 5 | 12,5 | V | Enfermedad vascular | 1 | 5 | 6,7 | Diabetes mellitus | 1 | 1 | 10 | 6,35 | |||
| 11 | 6,18 | |||||||||||||
| Puntuación máxima | 6 | 6 | 18,2 | A | Edad 65-75 | 1 | 6 | 9,8 | Insuficiencia cardiaca | 1 | 1 | 12 | 10,95 | |
| 13 | 7,52 | |||||||||||||
| Sc | Sexo femenino | 1 | 7 | 9,6 | Hipertensión | 1 | 1 | 14 | 16,36 | |||||
| 15 | 0 | |||||||||||||
| 8 | 6,7 | Proteinuria | 1 | 1 | ||||||||||
| Puntuación máxima | 9 | 9 | 15,2 | ERC con FG < 45 ml/min o ERT | 1 | 1 | ||||||||
| Puntuación máxima | 12 | 15 | ||||||||||||
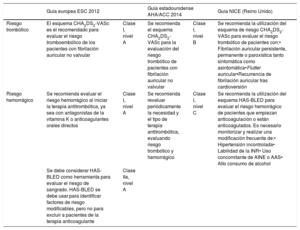
La guía europea de 201216, la estadounidense de la AHA/ACC de 201417 y las del NICE18 recomiendan el uso del esquema CHA2DS2-VASc para evaluar el riesgo embólico de los pacientes con FA no valvular (clase I B) (tabla 3). Se recomienda la terapia anticoagulante oral para los pacientes con FA no valvular y CHA2DS2-VASc ≥ 2 (clase I). En el caso de los pacientes con CHA2DS2-VASc = 1, se recomienda anticoagulación oral, con un balance riesgo-beneficio (clase Ila), y para los pacientes con CHA2DS2-VASc = 0, que son los pacientes con «verdadero bajo riesgo», la terapia anticoagulante no está recomendada19–21.
Recomendaciones de las guías de práctica clínica.
| Guía europea ESC 2012 | Guía estadounidense AHA/ACC 2014 | Guía NICE (Reino Unido) | |||
|---|---|---|---|---|---|
| Riesgo trombótico | El esquema CHA2DS2-VASc es el recomendado para evaluar el riesgo tromboembólico de los pacientes con fibrilación auricular no valvular | Clase I, nivel A | Se recomienda el esquema CHA2DS2-VASc para la evaluación del riesgo trombótico de pacientes con fibrilación auricular no valvular | Clase I, nivel B | Se recomienda la utilización del esquema de riesgo CHA2DS2-VASc para evaluar el riesgo trombótico de pacientes con:• Fibrilación auricular persistente, permanente o paroxística tanto sintomática como asintomática•Flutter auricular•Recurrencia de fibrilación auricular tras cardioversión |
| Riesgo hemorrágico | Se recomienda evaluar el riesgo hemorrágico al iniciar la terapia antitrombótica, ya sea con antagonistas de la vitamina K o anticoagulantes orales directos | Clase I, nivel A | Se recomienda revaluar periódicamente la necesidad y el tipo de terapia antitrombótica, evaluando riesgo trombótico y hemorrágico | Clase I, nivel C | Se recomienda la utilización del esquema HAS-BLED para evaluar el riesgo hemorrágico de pacientes que empiezan anticoagulación o están anticoagulados. Es necesario monitorizar y realizar una modificación frecuente de:• Hipertensión incontrolada• Labilidad de la INR• Uso concomitante de AINE o AAS• Alto consumo de alcohol |
| Se debe considerar HAS-BLED como herramienta para evaluar el riesgo de sangrado. HAS-BLED se debe usar para identificar factores de riesgo modificables, pero no para excluir a pacientes de la terapia anticoagulante | Clase IIa, nivel A | ||||
AAS: acido acetilsalicilico; ACC: American College of Cardiology; AHA: American Heart Association; AINE: antiinflamatorios no esteroideos; ESC: Sociedad Europea de Cardiologia; NICE: National Institute for Health and Care Excellence.
Recientemente se ha desarrollado una nueva escala de riesgo, la escala ATRIA, derivada de la cohorte ATRIA22,23 y validada por Singer et al24. Este esquema divide a los pacientes según ya hayan tenido un ictus isquémico o no, y procede a sumar puntos según los factores de riesgo que tenga. Así, asigna 1 punto a la presencia de insuficiencia cardiaca, hipertensión arterial, diabetes mellitus, proteinuria, filtrado glomerular < 45 ml/min o enfermedad renal terminal o sexo femenino, y los puntos asignados en función de la edad varían si el paciente ya ha tenido un ictus o no. De 0 a 5 puntos corresponde a bajo riesgo (tasa de eventos tromboembólicos < 1% anual); 6 puntos, a riesgo moderado (1-2% anual), y 7-15 puntos, alto riesgo (≥ 2% anual) (tabla 1). Los autores concluyeron que la escala ATRIA clasifica mejor a los pacientes con FA y tiene mayor poder predictivo de ictus isquémico que las escalas existentes, con un estadístico C de 0,76 (intervalo de confianza del 95% [IC95%], 0,74-0,79) en comparación con 0,72 (IC95%, 0,70-0,75) para el esquema CHADS2 y 0,73 (IC95%, 0,71-0,75) para el esquema CHA2DS2-VASc. Además, Van den Ham et al25 analizaron a 60.594 pacientes y demostraron que la escala ATRIA identificaba de manera más precisa a los pacientes de bajo riesgo que la escala CHA2DS2-VASc. Esta reclasificación del riesgo de ictus disminuiría el uso de anticoagulación en pacientes con muy bajo riesgo trombótico. El esquema ATRIA clasificó a un 49% de los pacientes dentro de la categoría de alto riesgo y a un 40% como bajo riesgo, mientras que el esquema CHA2DS2-VASc clasificó a un 82,6% como alto riesgo y a un 6,6% como bajo riesgo. Sin embargo, las tasas de eventos para las categorías de riesgo moderado y alto de la escala CHA2DS2-VASc fueron más bajas que con el esquema ATRIA.
Recientemente, 3 estudios con cohortes de validación de Dinamarca26, Taiwán27 y España28 han demostrado que el esquema CHA2DS2-VASc es superior a la escala ATRIA para clasificar correctamente a los pacientes de bajo riesgo, con mayor poder predictivo y asociación con los eventos trombóticos, tanto en los pacientes anticoagulados como en los no anticoagulados28. Por ello, el esquema ATRIA, dada su complejidad y que no clasifica mejor a los pacientes según su riesgo trombótico, no está recomendado para la evaluación del riesgo tromboembólico en los pacientes con FA no valvular.
Evaluación de la función renal como predictor de eventos trombóticosHay datos que indican que el empeoramiento de la función renal se asocia a un incremento de eventos cardiovasculares y trombóticos en los pacientes con FA29. Un 10-15% de los pacientes con FA sufren enfermedad renal crónica (ERC) y el riesgo aumenta significativamente con la presencia de ERC en estadio > III (filtrado glomerular < 60 ml/min). Sin embargo, la presencia de la función renal como factor de riesgo puntuable en los esquemas de riesgo existentes ha mostrado resultados controvertidos. Una de las primeras en aparecer fue la escala R2CHADS2, que agrega a los componentes conocidos de la escala CHADS2 la asignación de 2 puntos para un aclaramiento de creatinina (AclCr) < 60 ml/min30. Este esquema se validó en la cohorte del estudio ROCKET-AF31. La escala R2CHADS2 presentó un estadístico C = 0,59, sin diferencias estadísticamente significativas con la escala CHA2DS2-VASc (0,58) y CHADS2 (0,58).
En una cohorte de 978 pacientes con FA tratados con acenocumarol, Roldán et al32 demostraron que añadir la presencia de ERC a los esquemas CHADS2 y CHA2DS2-VASc no mejoraba el poder predictivo de ictus o embolia sistémica ni la mortalidad por cualquier causa, como mostraba el estadístico C = 0,67 (IC95%, 0,64-0,70) para CHADS2 frente a 0,69 (IC95%, 0,66-0,71) para CHADS2+ERC (p = 0,224) o el estadístico C = 0,66 (IC95%, 0,63-0,69) para CHA2DS2-VASc frente a 0,67 (IC95%, 0,64-0,70) para CHA2DS2-VASc+ERC (p = 0,224). Asimismo, en la cohorte de 4.576 pacientes del estudio AMADEUS33 se evaluó la repercusión de añadir a los esquemas CHADS2 y CHA2DS2-VASc el empeoramiento de la función renal. A pesar de que los pacientes con AclCr < 60 ml/min presentaban un aumento de más del doble del riesgo de ictus o eventos trombóticos en comparación con los pacientes con AclCr > 60 ml/min, no se apreció diferencia estadísticamente significativa en el poder predictivo de eventos medido por el estadístico C(CHADS2, C = 0,71; IC95%, 0,63-0,78; p = 0,054; CHA2DS2-VASc, C = 0,73; IC95%, 0,66-0,79; p = 0,63).
Así, a pesar de que el deterioro de la función renal implica un aumento del riesgo de embolia, añadir la función renal a los esquemas de riesgo CHADS2 y CHA2DS2-VASC no mejora su poder predictivo.
Evaluación del riesgo hemorrágicoEl incremento del riesgo de hemorragia, especialmente la temida hemorragia intracraneal, acompaña al tratamiento con anticoagulantes orales. La incidencia anual de sangrado intracraneal asociado a anticoagulación aumenta de 0,8 a 44,4/100.000 habitantes34. Por ello es necesario conocer el riesgo hemorrágico individual de los pacientes antes de iniciar el tratamiento antitrombótico. Hay numerosos factores de riesgo que predisponen al sangrado, por lo que se han desarrollado varias escalas para evaluar el riesgo hemorrágico. Una de las primeras escalas fue HEMORR2HAGES (disfunción hepática o renal, abuso de alcohol, enfermedad maligna, edad ≥ 75 años, reducción de recuento o función plaquetaria, resangrado [doble], hipertensión, anemia, factores genéticos, riesgo excesivo de caídas e ictus), derivada de los factores de riesgo hemorrágico del National Registry of Atrial Fibrillation35 (tabla 2). No obstante, esta escala se usa poco en la práctica clínica debido a que implica numerosos factores y requiere utilizar estudios genéticos.
Escalas de riesgo hemorrágico.
| hemorr2hages | ATRIA | HAS-BLED | ORBIT | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| H | Disfunción hepática o renal | 1 | Anemia | 3 | H | Hipertensión | 1 | O | Edad ≥ 74 años | 1 |
| E | Alcohol | 1 | Disfunción renal grave (ClCr < 30 ml/min) | 3 | A | Función renal o hepática anormal | 1 o 2 | R | Reducción Hb/anemia | 2 |
| M | Enfermedad maligna | 1 | Edad ≥ 75 años | 2 | S | Ictus | 1 | B | Sangrado previo | 2 |
| O | Edad > 75 años | 1 | Sangrado previo | 1 | B | Sangrado previo | 1 | I | Insuficiencia renal | 1 |
| R | Reducción recuento plaquetas | 1 | Hipertensión | 1 | L | Labilidad INR | 1 | T | Tratamiento con antiplaquetarios | 1 |
| R | Resangrado | 2 | E | Edad > 65 años | 1 | |||||
| H | Hipertensión | 1 | D | Fármacos/alcohol | 1 o 2 | |||||
| A | Anemia | 1 | ||||||||
| G | Genética | 1 | ||||||||
| E | Excesivo riesgo de caídas | 1 | ||||||||
| S | Ictus | 1 | ||||||||
| Puntuación máxima | 12 | Puntuación máxima | 10 | Puntuación máxima | 9 | Puntuación máxima | 7 | |||
| CATEGORÍAS DE RIESGO | ||||||||||
| Bajo riesgo: 0-1 puntos | Bajo: 0-3 puntos | Bajo: 0-1 | Bajo: 0-2 | |||||||
| Intermedio: 2-3 puntos | Moderado: 4 puntos | Moderado: 2 | Moderado: 3 | |||||||
| Alto ≥ 4 puntos | Alto: ≥ 5 puntos | Alto: ≥ 3 | Alto: ≥ 4 | |||||||
AclCr: aclaramiento de creatinina; Hb: hemoglobina.
La siguiente escala propuesta y la que más se emplea en la práctica clínica diaria es la escala HAS-BLED (hipertensión, alteración de la función renal, ictus, sangrado previo, labilidad de la International Normalized Ratio [INR], edad > 65 años o uso de fármacos/alcohol), validada en la Euro Heart Survey in Atrial Fibrillation Cohort36. El acrónimo HAS-BLED representa cada uno de los factores de riesgo de sangrado (tabla 2) y asigna 1 punto a la presencia de hipertensión arterial (presión arterial sistólica > 160 mmHg), función renal y hepática alterada (creatinina > 200 pmol/l, diálisis o trasplante renal, cifras de bilirrubina > 2 veces el límite de la normalidad o enzimas hepáticas > 3 veces el límite superior de la normalidad), ictus previo, historia de sangrado previo, INR lábil (tiempo en rango terapéutico [TTR] < 60%, solo aplicable a tratamiento con antagonistas de la vitamina K), edad > 65 años y consumo concomitante de fármacos y alcohol en exceso (incluye los fármacos que puedan interferir con la warfarina/acenocumarol en el riesgo de sangrado, como antiinflamatorios no esteroideos y antiplaquetarios). Una puntuación de 0-1 se clasificó como bajo riesgo; 2, como riesgo moderado, y ≥ 3, como de alto riesgo. El esquema HAS-BLED es el que presenta mayor poder predictivo de hemorragia intracraneal en comparación con otros esquemas de riesgo hemorrágico37,38 y además se ha validado para predecir riesgo de sangrado con anticoagulantes directos39. También está validado para predecir el riesgo hemorrágico durante la terapia puente40 a intervencionismo coronario percutáneo en pacientes con41 y sin FA42,43. La escala HAS-BLED es fácil de recordar y, sobre todo, identifica los factores modificables (p. ej., control de la presión arterial, suspensión del tratamiento concomitante con un antiagregante plaquetario) que pueden reducir el riesgo hemorrágico de los pacientes.
Otro de los esquemas de riesgo de sangrado desarrollados es la escala ATRIA, derivada del estudio ATRIA-AF23. Este esquema utiliza los siguientes factores de riesgo: anemia (hemoglobina < 13 g/dl los varones y < 12 g/dl las mujeres, 3 puntos), enfermedad renal grave (filtrado glomerular estimado < 30 ml/min/1,73 m2, 3 puntos), edad > 75 años (2 puntos), sangrado previo (1 punto) e hipertensión (1 punto) (tabla 2). Una puntuación de 0-3 se define como bajo riesgo; 4, como riesgo intermedio, y ≥ 5, como alto riesgo. En su cohorte de validación, presentó un buen poder predictivo de sangrado mayor (C = 0,74)44. No obstante, se ha puesto de manifiesto en varios estudios23,45 su pobre poder predictivo y su incapacidad para predecir el sangrado intracraneal en comparación con la escala HAS-BLED. En una población de 937 pacientes anticoagulados con acenocumarol, el esquema HAS-BLED presentó mayor poder predictivo (C = 0,68 frente a C = 0,59; p = 0,035) en comparación con el esquema ATRIA, lo que refuerza el valor del sencillo esquema HAS-BLED46.
Recientemente se ha desarrollado y validado un nuevo esquema de riesgo de sangrado, el ORBIT. Este esquema se desarrolló del registro ORBIT-AF y se ha validado en la población del ROCKET-AF47. Evalúa el poder predictivo de sangrado de los siguientes factores: se asigna 1 punto para edad > 74 años, insuficiencia renal (filtrado glomerular < 60 ml/min/1,73 m2) y tratamiento con antiplaquetarios, y se asignan 2 puntos a la presencia de anemia o hemoglobina anormal (hemoglobina < 13 g/dl los varones y < 12 g/dl las mujeres) y a los antecedentes de sangrado. Una puntuación de 0 a 2 se considera de bajo riesgo; 3, riesgo intermedio, y ≥ 4, de alto riesgo. Sin embargo, esta escala de riesgo presenta factores escasamente modificables en la práctica diaria48.
Ante tantas escalas de riesgo de sangrado, surge la necesidad de saber cuál predice de manera más fidedigna el riesgo de sangrado real. Varios grupos han comparado estos esquemas. Apostolakis et al37 demostraron la superioridad de la escala HAS-BLED con respecto a las escalas HEMORR2HAGE y ATRIA, ya que el esquema HAS-BLED demostró mayor poder predictivo de hemorragia intracraneal (C = 0,75). Por otro lado, también se ha comparado el poder predictivo de las escalas HAS-BLED, ATRIA y ORBIT48 en la predicción de cualquier sangrado clínicamente relevante. Las 3 escalas mostraron un moderado poder predictivo de sangrado mayor, aunque el esquema HAS-BLED fue mejor que los otros 2. Por último, se debe comentar que también se ha evaluado el papel de las escalas CHADS2 y CHA2DS2-VASc en la evaluación de los eventos, aunque presentan menor poder predictivo que el esquema HAS-BLED49.
Por todo lo expuesto, la escala HAS-BLED es la recomendada en la mayoría de las guías de práctica clínica16–18 para la evaluación del riesgo hemorrágico, y hay que destacar que una puntuación elevada en la escala HAS-BLED no debe ser razón de no iniciar o suspender la terapia con anticoagulación, sino que debe ser una alerta para evaluar y corregir los factores que generan esa elevada puntuación37.
Beneficio clínico neto de la terapia anticoagulanteEl beneficio clínico neto es un índice que evalúa los beneficios y riesgos obtenidos con la hipotética aplicación de un tratamiento. Es de suma importancia determinar el beneficio clínico neto en el tratamiento de pacientes con FA en términos de riesgo de fenómenos embólicos y sangrado mayor, sobre todo de sangrado intracraneal. Los estudios recientes han demostrado que el riesgo de sufrir una hemorragia intracraneal es similar en los pacientes tratados con anticoagulantes orales y los tratados con ácido acetilsalicílico (AAS)50. El estudio de Olesen et al51 mostró que el riesgo de sangrado aumentó tanto en los pacientes tratados con antagonistas de la vitamina K como en los tratados con AAS, pero el beneficio clínico neto fue claramente positivo a favor del tratamiento con anticoagulantes orales, puesto que reduce el riesgo de tromboembolia en comparación con el tratamiento con AAS. Hubo resultados similares en un estudio en una cohorte de 182.678 pacientes con FA. Friberg et al52 concluyeron que, en casi todos los pacientes con FA, el riesgo de ictus isquémico sin tratamiento anticoagulante es mayor que el riesgo de sangrado intracraneal con tratamiento anticoagulante. Por lo tanto, la mayoría de los pacientes se beneficiarían del tratamiento anticoagulante. La excepción eran los pacientes con muy bajo riesgo de ictus isquémico con CHA2DS2-VASc 0 y riesgo moderado de sangrado53.
En los pacientes con ERC aumenta el riesgo de ictus o eventos tromboembólicos, pero también seriamente el riesgo de sangrado. Se ha demostrado que en los pacientes renales con alto riesgo embólico (CHA2DS2-VASc ≥ 2), el tratamiento con anticoagulantes orales reduce el riesgo de mortalidad por cualquier causa (odds ratio = 0,85; IC95%, 0,72-0,99) y el tratamiento con anticoagulantes se asoció con un beneficio neto significativo, con disminución de los eventos trombóticos y mortalidad sin aumento de los eventos hemorrágicos54.
El riesgo de los pacientes con FA no solo está determinado por su riesgo individual de ictus o sangrado. Por ello, Lip et al55 plantearon la hipótesis de que el cálculo con un esquema predictivo de riesgo combinado ofrece mayor poder predictivo que el cálculo independiente de los esquemas de riesgo trombótico y hemorrágico existentes. Se analizaron en la población del estudio AMADEUS 2 esquemas combinados: el esquema 1, compuesto de ictus o embolia sistémica + sangrado mayor, y el esquema 2, la combinación de ictus, embolia sistémica con trombosis venosa profunda, infarto de miocardio, muerte cardiovascular o sangrado mayor. Sin embargo, en comparación con los esquemas de riesgo HAS-BLED y CHA2DS2-VASC, el esquema 1 (área bajo la curva, 0,69 frente a 0,63; p = 0,488) y el esquema 2 (área bajo la curva, 0,64 frente a 0,63; p = 0,863) no mostraron diferencias estadísticamente significativas con los esquemas de riesgo individuales. Así, el uso de la evaluación independiente con los esquemas de riesgo trombótico y hemorrágico permite realizar un balance del beneficio clínico de manera individualizada.
Generalmente, cuando el riesgo isquémico medido por el esquema CHA2DS2-VASc es alto, el riesgo de sangrado medido por la escala HAS-BLED también lo es. Sin embargo, el riesgo de sangrado con la terapia anticoagulante no es estático. El esquema HAS-BLED es de gran utilidad para corregir factores de riesgo hemorrágico (p. ej., la labilidad de la INR, el empleo de fármacos que favorecen el sangrado o la hipertensión arterial descontrolada), y ello puede mejorar el beneficio neto de la anticoagulación oral.
El papel de los biomarcadores en la evaluación del riesgo de los pacientes con fibrilación auricularTodos los esquemas de riesgo trombótico y hemorrágico citados anteriormente presentan potencia solo moderada para la predicción de eventos55,56. Varios estudios destacan que la incorporación de estos biomarcadores puede mejorar el poder predictivo de los esquemas de riesgo trombótico y hemorrágico57. Las elevaciones de troponina T o I y NT-proBNP (prohormona aminoterminal del péptido natriurético cerebral), biomarcadores de daño y estrés de la pared miocárdica, son comunes en pacientes con FA y se relacionan, de forma independiente, con el incremento de riesgo de ictus y mortalidad, como han demostrado los subestudios de los ensayos clínicos RE-LY58 o ARISTOTLE59.
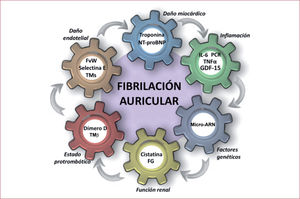
Por otro lado, se debate si la inflamación es inicio, causa o consecuencia de la FA, pero distintos biomarcadores, como la proteína C reactiva60, la interleucina (IL) 6 o el factor de necrosis tumoral alfa (TNFa) se han relacionado con la perpetuación y el pronóstico de la FA61,62. Además, se ha demostrado que la IL-6 o la proteína ST2 (que pertenece al grupo de los receptores de IL-1) son factores independientes de riesgo de muerte para los pacientes con FA63. También se han analizado componentes de fibrosis y matriz extracelular (factor de crecimiento tumoral beta, mieloperoxidasas y metaloproteinasas), o factores genéticos (micro-ARN y polimorfismos de nucleótidos57) (figura). Importante mención merecen los biomarcadores que se relacionan con el estado de hipercoagulabilidad o protrombótico y el daño o disfunción endotelial en la FA64.
Principales biomarcadores en fibrilación auricular. Modificada con permiso de Vílchez et al 57. FG: filtrado glomerular; FvW: factor de von Willebrand; GDF-15: factor de diferenciación de crecimiento; IL-6: interleucina 6; PCR: proteína C reactiva; TMβ: trombomodulina beta; TMs: trombomodulina sérica; TNFα: factor de necrosis tumoral alfa.
La clásica tríada de Virchow muestra cómo la trombogénesis es un estado resultante de la combinación entre anormalidad del flujo, anormalidad en la pared del vaso y alteración en los componentes sanguíneos que conllevan un estado protrombótico. Así, los biomarcadores relacionados con el estado protrombótico (dímero D o beta-trombomodulina) o con el daño o disfunción endotelial (trombomodulina soluble, selectina-E y factor de von Willebrand) pueden ayudar en la predicción de eventos embólicos64,65. Diferentes grupos66–68 han demostrado que las altas concentraciones plasmáticas de factor de von Willebrand son un factor independiente de riesgo de eventos adversos, isquémicos y de sangrado mayor en los pacientes con FA permanente anticoagulados. Recientemente se ha estudiado el papel de un nuevo biomarcador en la FA, el factor de crecimiento diferenciado 15 (GDF-15), de la familia de los factores de crecimiento tumoral beta (TGFβ). Se sabía que podría estar relacionado con el estrés oxidativo durante la isquemia-reperfusión y que puede contribuir al remodelado auricular y el desarrollo de FA69. Wallentin et al70 han demostrado que el GDF-15 es un marcador pronóstico que se asocia de manera independiente (de otros factores como troponina I o NT-proBNP) con el sangrado mayor y la mortalidad en los pacientes con FA.
Hijazi et al71 han demostrado la potencial aplicabilidad de estos biomarcadores, y recientemente han desarrollado un nuevo esquema de riesgo tromboembólico, el esquema ABC. Este incluye como factores de riesgo independientes asociados con el riesgo de ictus la edad (age), los biomarcadores (B: troponina T ultrasensible y NT-proBNP) y una variable clínica (C: presencia o ausencia de ictus o accidente isquémico transitorio). El esquema ABC se ha desarrollado y validado internamente en 14.701 pacientes del ensayo clínico ARISTOTLE y externamente en 1.400 pacientes con FA del ensayo STABILITY72 sobre enfermedad coronaria estable, y presentó un poder predictivo de eventos moderado. En comparación con el esquema CHA2DS2-VASc, el esquema ABC presentó mejor poder predictivo de eventos tanto en la cohorte de derivación (C = 0,68; 1C95%, 0,65-0,71; frente a C = 0,62; 1C95%, 0,60-0,65; p < 0,001) como en la cohorte de validación externa (C = 0,66; 1C95%, 0,58-0,74; frente a C = 0,58; 1C95%, 0,49-0,67; p < 0,001). Este esquema de riesgo presenta la dificultad de su cálculo, ya que la puntuación se obtiene a partir de nomogramas, y se asigna de 0 a 10 puntos a cada factor según su puntuación individual y calculando así el riesgo de ictus al año y a los 3 años. El esquema ABC clasifica como riesgo bajo (< 1%), moderado (1-2%) y alto (> 2%) de ictus/ eventos trombóticos al año.
El mismo grupo73 ha analizado también su papel como predictor de eventos hemorrágicos. Analiza la edad (A); como biomarcadores (B) de sangrado, el GDF-15, la troponina T ultrasensible y el hematocrito, y como variable clínica (C), el antecedente de sangrado. 1gual que para los eventos trombóticos, el esquema ABC presenta mayor poder predictivo que el HAS-BLED recomendado por las guías clínicas (0,68 frente a 0,59). Este esquema de riesgo incluye pocas variables y destaca el papel de los biomarcadores presentes en la práctica clínica diaria (troponina T, NT-proBNP y GDF-15) con la finalidad de individualizar cada vez más el tratamiento de la FA. Sin embargo, el esquema ABC no está ampliamente validado, por lo que no se lo puede considerar herramienta de referencia en la práctica clínica diaria.
Por todo ello, parece que los biomarcadores podrán tener un papel para mejorar significativamente la estratificación de riesgo añadidos a los esquemas trombóticos y hemorrágicos actuales como nuevas herramientas que mejoren la clasificación de los pacientes con FA para proporcionarles el mejor tratamiento anticoagulante individualizado.
ConclusionesLa prevención de los eventos trombóticos es esencial en el manejo de los pacientes con FA para evitar la morbimortalidad asociada. La terapia antitrombótica disminuye el riesgo de fenómenos tromboembólicos de los pacientes que padecen FA a expensas de elevar el riesgo hemorrágico, por lo que resulta crucial valorar el riesgo individual a la hora de tomar decisiones de inicio de tratamiento anticoagulante. Para ello se dispone de varias escalas de riesgo trombótico y hemorrágico que pueden ayudar en la práctica clínica. Por el momento no se ha demostrado que el deterioro de la función renal aporte mayor poder predictivo a los esquemas de riesgo existentes. Sin embargo, los biomarcadores reflejan diferentes mecanismos fisiopatológicos de la FA y su relación con eventos tanto trombóticos como hemorrágicos, por lo que pueden tener un papel prometedor al identificar individualmente los factores de riesgo de cada paciente con FA. Por ello, antes de iniciar el tratamiento antitrombótico, es fundamental la evaluación individual del riesgo de los pacientes analizando el beneficio clínico neto de la terapia antitrombótica.
FinanciaciónLos autores han recibido financiación de RD12/0042/0049 (RETICS) del ISCIII y PI13/00513/FEDER del ISCIII.
Conflicto de interesesNinguno.