La enfermedad hepática relacionada con la cirugía de Fontan hace referencia a los cambios hepáticos secundarios a las alteraciones hemodinámicas y la congestión venosa sistémica que se producen tras ese procedimiento. Aunque su historia natural aún no está establecida, los pacientes con daño hepático más avanzado pueden presentar complicaciones de la hipertensión portal, como la ascitis, la hemorragia por rotura de varices o encefalopatía. En los últimos años se ha demostrado que el riesgo de hepatocarcinoma está incrementado. El seguimiento hepático periódico es fundamental para prevenir y tratar precozmente las complicaciones hepáticas.
Palabras clave
La enfermedad hepática relacionada con cirugía de Fontan (EHCF) hace referencia a un amplio abanico de alteraciones estructurales y funcionales en el hígado, causadas por los cambios hemodinámicos surgidos tras la cirugía de Fontan (CF). Como en toda enfermedad hepática crónica, el individuo atraviesa diferentes estadios hasta alcanzar la fase final, momento en el que aparecen la mayoría de las complicaciones, como el carcinoma hepatocelular, la hemorragia variceal, la ascitis o la encefalopatía hepática. Aunque la alteración hepática a la larga aparece en todos los pacientes con CF, es esencial caracterizarla adecuadamente, lo que permite conocer el grado de daño hepático y así establecer programas de cribado y seguimiento que permitan evitar y/o tratar precozmente las complicaciones hepáticas que puedan surgir. En esta revisión se resume la evidencia disponible hasta la fecha sobre la fisiopatología de la EHCF, así como los métodos disponibles para su diagnóstico y tratamiento. Finalmente se propone una estrategia de seguimiento adaptada a las peculiaridades de estos pacientes.
CIRUGÍA DE FONTAN: DEFINICIÓN, TIPOS Y CONSECUENCIASLa CF es un procedimiento utilizado en el tratamiento de varias cardiopatías congénitas complejas con una característica común: la presencia de un único ventrículo funcionante. El objetivo de la cirugía es garantizar que el retorno venoso sistémico alcance la arteria pulmonar evitando el ventrículo derecho. De manera simplificada, la técnica de Fontan crea quirúrgicamente una anastomosis entre el retorno venoso sistémico procedente de ambas venas cavas y la arteria pulmonar que transmitirá la sangre a la única cámara ventricular pasivamente. Se trata, por lo tanto, de una cirugía no curativa cuyo objetivo principal es paliar la hipoxemia y prolongar la supervivencia1.
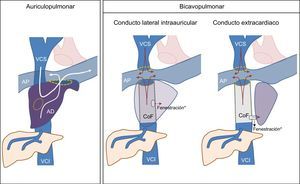
Existen 2 grandes variantes de la técnica: la auriculopulmonar y la bicavopulmonar (figura 1). La CF clásica consiste en transformar la aurícula en un canal que conecta la sangre desde ambas venas cavas hasta la arteria pulmonar. Para ello se crea una anastomosis entre la aurícula y la arteria pulmonar y se cierra la válvula tricúspide y la comunicación interauricular. Aunque inicialmente se pensó que, al mantener la participación de la aurícula en el circuito, esta facilitaría la propulsión de la sangre hacia los pulmones, más tarde se comprobó que incrementaba el riesgo de taquiarritmias y trombosis auriculares2,3. La variante bicavopulmonar, técnica de elección en los últimos años, se lleva a cabo en 2 pasos: en el primero se conecta el retorno venoso de la vena cava superior a la circulación arterial pulmonar (cirugía de Glenn) y, finalmente, se completa en el mismo tiempo o en diferido con una anastomosis desde la vena cava inferior a la arteria pulmonar interponiendo un conducto artificial (conducto de Fontan).
Variantes de la cirugía de Fontan. AD: aurícula derecha; AP: arteria pulmonar; CoF: conducto de Fontan; VCI: vena cava inferior; VCS: vena cava superior.
* La realización de una fenestración que comunique el conducto de Fontan y la aurícula derecha es una variante empleada solo en algunos pacientes. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Aunque la técnica se describió por primera vez en 1968, su expansión no llegó hasta la década de los ochenta4. Por ello hasta ahora no se ha podido conocer sus resultados a largo plazo. En general, se puede afirmar que la CF ha supuesto uno de los grandes avances en la cardiología infantil, ya que garantiza tasas de supervivencia en torno al 80% a los 20 años, lo que se debe catalogar de gran éxito teniendo en cuenta la gravedad de los defectos anatómicos cardiacos tratados5,6. Sin embargo, ahora se sabe que las modificaciones hemodinámicas surgidas tras la cirugía a largo plazo originan un gran número de complicaciones que pueden afectar prácticamente a todos los órganos7,8.
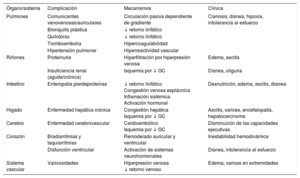
El concepto «fracaso del Fontan» designa de forma sindrómica el conjunto de manifestaciones sistémicas que acontecen a largo plazo en la mayoría de los pacientes a los que se les practicó. Sea cual fuere su causa, la consecuencia es siempre la misma: el aumento de la presión venosa sistémica. El fracaso del Fontan puede precipitarse por diferentes eventos, como las arritmias cardiacas, la estenosis u obstrucción del conducto de Fontan o, en su forma más avanzada, disfunción ventricular. Dicho incremento determina 2 fenómenos clave: a) la congestión en la circulación venosa esplácnica (carente de capacidad autorreguladora del flujo), y b) la disminución del retorno linfático por el conducto torácico. Finalmente, cuando el fracaso del Fontan se acompaña de un deterioro de la función sistólica del ventrículo único, el gasto cardiaco disminuye, lo que facilita la isquemia de órganos diana. Estos mecanismos y otros que se comentan más adelante condicionan el daño de los diferentes órganos y sistemas, tal y como se representa en la tabla 19-12.
Consecuencias sistémicas del «fracaso» de la circulación de Fontan
| Órgano/sistema | Complicación | Mecanismos | Clínica |
|---|---|---|---|
| Pulmones | Comunicantes venovenosas/auriculares | Circulación pasiva dependiente de gradiente | Cianosis, disnea, hipoxia, intolerancia al esfuerzo |
| Bronquitis plástica | ↓ retorno linfático | ||
| Quilotórax | ↓ retorno linfático | ||
| Tromboembolia | Hipercoagulabilidad | ||
| Hipertensión pulmonar | Hiperreactividad vascular | ||
| Riñones | Proteinuria | Hiperfiltración por hiperpresión venosa | Edema, ascitis |
| Insuficiencia renal (aguda/crónica) | Isquemia por ↓ GC | Disnea, oliguria | |
| Intestino | Enteropatía pierdeproteínas | ↓ retorno linfático Congestión venosa esplácnica Inflamación sistémica Activación hormonal | Desnutrición, edema, ascitis, diarrea |
| Hígado | Enfermedad hepática crónica | Congestión hepática Isquemia por ↓ GC | Ascitis, varices, encefalopatía, hepatocarcinoma |
| Cerebro | Enfermedad cerebrovascular | Cardioembólico Isquemia por ↓ GC | Disminución de las capacidades ejecutivas |
| Corazón | Bradiarritmias y taquiarritmias | Remodelado auricular y ventricular | Inestabilidad hemodinámica |
| Disfunción ventricular | Activación de sistemas neurohormonales | Disnea, intolerancia al esfuerzo | |
| Sistema vascular | Varicosidades | Hiperpresión venosa ↓ retorno venoso | Edema, varices en extremidades |
GC: gasto cardiaco.
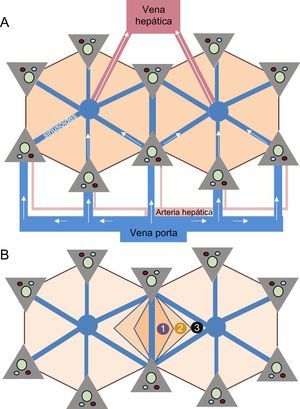
El hígado es un órgano con una arquitectura vascular compleja con doble vascularización, ya que recibe dos tercios de la sangre a través del sistema venoso portal y aproximadamente un tercio mediante la arteria hepática. Sin embargo, el drenaje venoso se lleva a cabo únicamente a través de las venas hepáticas, que drenan la sangre a la vena cava inferior y de ahí al corazón. Esta peculiar vascularización explica la arquitectura microscópica del hígado en forma de lobulillos poliédricos. Conocerla es fundamental para entender la fisiopatología de la EHCF13 (figura 2).
Arquitectura microscópica del hígado. A: los principales vasos aferentes hepáticos (vena porta y arteria hepática) se dividen en vénulas y arteriolas, que a su vez originan pequeños vasos que confluyen en los sinusoides hepáticos; los sinusoides son pequeños espacios vasculares formados por células endoteliales y rodeados de hepatocitos, que permiten la distribución del flujo y devuelven la sangre a través de las venas centrolobulillares a la circulación sistémica. B: el lobulillo hepático presenta una arquitectura poliédrica en cuyos extremos se localizan los «espacios porta», constituidos por pequeños vasos portales, arteriales y conductos biliares; en el centro del lobulillo se sitúa la vena centrolobulillar, conectada con los espacios porta a través de los sinusoides. Puesto que los espacios porta y la vena centrolobulillar están anatómicamente separados, existe un gradiente en la concentración de oxígeno y nutrientes en la sangre, que es mayor en las zonas próximas a los espacios porta y menor en las cercanas a la vena centrolobulillar. Este gradiente ha permitido dividir al lobulillo en 3 zonas: la zona 1 es la periportal y la 3, la pericentrolobulillar. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
En la mayoría de las enfermedades hepáticas, el daño se ocasiona por la llegada al hígado de productos tóxicos, como alcohol o fármacos, infecciones virales y otros, a través de mecanismos inflamatorios. La inflamación requiere gran cantidad de oxígeno, por lo que el daño inicialmente aparece en las zonas más oxigenadas, esto es, las periportales14. Sin embargo, en los pacientes con CF la fisiopatología es muy diferente, ya que no se dan fenómenos inflamatorios, y el modelo de daño está condicionado sobre todo por la congestión hepática persistente15.
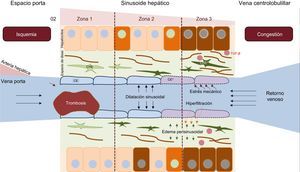
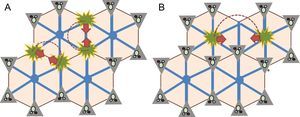
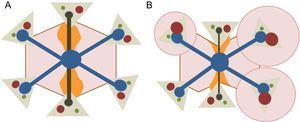
La localización del hígado hace que un incremento en la presión venosa central se transmita fácilmente al hígado que, si se mantiene, causa congestión y aumento de la presión intrahepática. La traducción microscópica de estos fenómenos es la dilatación sinusoidal, más evidente en el área centrolobulillar. La hiperpresión sinusoidal trasmitida desde la circulación sistémica facilita la hiperfiltración de la sangre, por lo que aparece edema en el espacio situado entre las células endoteliales sinusoidales y los hepatocitos (espacio de Disse). Este edema, unido al bajo gasto cardiaco, dificulta la llegada de oxígeno y facilita fenómenos de necrosis hepatocitaria y la aparición de mediadores profibrogénicos como el factor de crecimiento tumoral beta16. Además, la tensión vascular y el estrés al que se encuentran sometidas las células endoteliales sinusoidales inducen un cambio fenotípico que las convierte en células fenestradas que liberan mediadores, que a su vez permiten la activación de las células hepáticas estrelladas situadas en el espacio de Disse, con gran capacidad fibrogénica (figura 3). Aunque inicialmente los cambios son perisinusoidales y en la zona 3, conforme pasa el tiempo se puede afectar todo el lobulillo hepático con formación de puentes fibrosos y áreas regenerativas, esto es, aparece la cirrosis (figura 4).
Fisiopatología de la enfermedad hepática relacionada con la cirugía de Fontan. La hipertensión venosa sistémica secundaria a la cirugía de Fontan se traduce en una disminución del retorno venoso, que aumenta la presión y dilata de manera retrógrada el sinusoide. Se producen fenómenos de hiperfiltración hacia el espacio de Disse, y el estrés mecánico induce un cambio fenotípico de la célula endotelial sinusoidal. La liberación de ciertas moléculas por esta activa de manera autocrina la célula hepática estrellada, que facilita los fenómenos de fibrogénesis. La hipoxia y la fibrosis perisinusoidal a la larga producen necrosis parenquimatosa hepatocitaria, más evidente en la zona 3 (cercana a la vena centrolobulillar). CE: célula endotelial sinusoidal; CHE: célula hepática estrellada. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Fibrogénesis en la enfermedad hepática relacionada con la cirugía de Fontan. Mientras que en los modelos convencionales de cirrosis (A) los puentes fibrosos aparecen entre los espacios porta, en el modelo de daño hepático relacionado con la cirugía de Fontan, los puentes fibrosos se forman entre las zonas centrolobulillares (B); lo que da lugar al concepto de «cirrosis invertida», característica de estos pacientes. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Es importante destacar que los pacientes con CF presentan importantes alteraciones hemostáticas, que afectan a todas las fases y son superponibles a las encontradas en pacientes con enfermedad hepática avanzada, lo que les confiere un estado latente de hipercoagulabilidad17. Si a esto se une el daño endotelial intrahepático y la gran estasis venosa, se cumple a la perfección la tríada de Virchow, por lo que es muy probable que puedan darse fenómenos de microtrombosis intrahepática que agraven y perpetúen el daño hepático18. Esta hipótesis, que requiere futuros estudios, abre la puerta a plantear alternativas terapéuticas, como la anticoagulación, que permitan aminorar el daño hepático.
Finalmente, no se debe olvidar que los pacientes con CF pueden presentar enfermedad hepática por motivos diferentes de la propia cirugía cardiaca, como la hepatotoxicidad por amiodarona19, un antiarrítmico muy utilizado en esta población, o la hepatitis C20.
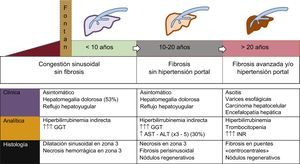
HISTORIA NATURAL Y FORMAS CLÍNICAS DE LA ENFERMEDAD HEPÁTICA TRAS CIRUGÍA DE FONTANLa EHCF es una de las principales y, frecuentemente, la primera de las manifestaciones del fracaso del Fontan. Aunque su historia natural aún no está establecida, en general se puede dividir en 3 grandes fases (figura 5):
- 1.
Congestión hepática y dilatación sinusoidal. Esta fase comienza incluso antes de la CF y se prolonga durante los primeros años tras ella21,22. El 53% de los pacientes presentan hepatomegalia dolorosa y/o reflujo hepatoyugular, aunque muchos de ellos se encuentran asintomáticos. Al análisis, se caracteriza por hiperbilirrubinemia indirecta leve e incremento de gamma-glutamil transpeptidasa, en relación con la congestión canalicular secundaria al edema perisinusoidal. En la biopsia se aprecia dilatación sinusoidal y necrosis hepatocelular en la zona 3 del lobulillo23.
- 2.
Fibrosis sin hipertensión portal. Una vez transcurridos entre 5 y 10 años, aparecen datos de fibrosis perisinusoidal, nódulos regenerativos y necrosis hepatocelular. En esta fase, los fenómenos de necrosis pueden acentuarse si hay bajo gasto cardiaco, por lo que es frecuente un leve aumento de aspartato aminotransferasa, alanina transaminasa y lactato deshidrogenasa. En esta fase, la fibrosis es potencialmente reversible si el paciente recibe un trasplante cardiaco24.
- 3.
Fibrosis avanzada con hipertensión portal. Es la fase final de cualquier enfermedad hepática. Se detecta hipoalbuminemia, prolongación en los tiempos de la coagulación y disminución del recuento de plaquetas. En esta fase, está incrementado el riesgo de hepatocarcinoma y complicaciones de la hipertensión portal, como la ascitis o la hemorragia por rotura de varices esofagogástricas25.
Historia natural de la enfermedad hepática relacionada con la cirugía de Fontan. La secuencia temporal es orientativa, ya que la cronología depende de la evolución de la cardiopatía. Las arritmias o la disfunción ventricular pueden acelerar la evolución. ALT: alanina transaminasa; AST: aspartato aminotransferasa; GGT: gamma-glutamil transpeptidasa. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
En cualquiera de las fases descritas, puede acontecer un cuadro clínico con entidad propia: la hepatitis isquémica, que se caracteriza por una elevación marcada de aspartato aminotransferasa, alanina transaminasa y lactato deshidrogenasa y acontece en el contexto agudo de bajo gasto cardiaco. Suele ser reversible una vez cesa el evento que condiciona la precaria situación hemodinámica.
La cronología de la EHCF es difícil de establecer, ya que, al no tratarse de una enfermedad primaria del hígado, su evolución depende de la situación cardiaca. En la tabla 2 se enumeran las variables relacionadas con mayor riesgo de daño hepático26–28. Sin embargo, el principal factor determinante de las complicaciones hepáticas es el tiempo, de modo que, cuando se compara el riesgo de descompensación a los 5 años frente a los 15 y 20 años tras la CF, se comprueba que es 4 y 9 veces superior respectivamente29.
Factores de riesgo de daño hepático en pacientes con cirugía de Fontan
| Relacionados con la situación hemodinámica |
| Reducción del gasto cardiaco |
| Elevación de la presión capilar pulmonar |
| Elevación de la presión venosa central |
| Relacionados con la cirugía |
| Atresia pulmonar como causa de la cirugía |
| Técnica clásica (variante auriculopulmonar) |
| Estenosis/trombosis del conducto de Fontan |
| Tiempo desde la cirugía |
| Relacionados con eventos cardiológicos |
| Arritmias cardiacas |
| Disfunción ventricular sistólica |
| Otros |
| Infección por virus hepatotropos |
| Exposición a fármacos hepatotóxicos (amiodarona) |
El daño hepático en los pacientes con CF es universal. Sin embargo, no todos presentan sus complicaciones, por lo que se debe disponer de métodos que permitan identificar a aquellos con riesgo de experimentarlas que se beneficiarían de un seguimiento estrecho y dirigido30. Para los pacientes compensados, el único método diagnóstico que actualmente permite una adecuada estadificación de la enfermedad hepática es la biopsia. Sin embargo, los últimos avances en hepatología se han encaminado al desarrollo de métodos de diagnóstico no invasivo, que también se han evaluado en pacientes con CF.
Métodos serológicosUn hemograma básico puede ser suficiente para llevar a cabo una aproximación diagnóstica a la hepatopatía del paciente con CF. Un recuento de plaquetas < 150.000/μl es el principal indicador de hiperesplenismo, uno de los hallazgos analíticos de hipertensión portal más evidentes. En los últimos años se han desarrollado múltiples métodos sencillos que relacionan diferentes parámetros analíticos entre sí y estos con algunos hallazgos radiológicos. Pese a que se han creado para establecer el diagnóstico de cirrosis con otras indicaciones diferentes de la CF, muchos de ellos se han utilizado con esta indicación (tabla 3). El principal inconveniente es que aún no se han validado estos métodos frente al patrón de referencia, que es la biopsia hepática, lo que hace que no se disponga de puntos de corte validados. En una cohorte de 204 pacientes, de los que el 26% presentaba datos de descompensación hepática, se evaluaron comparativamente varios métodos, de los que el índice de Forns es el que mejor predice la existencia de daño hepático avanzado, con un área bajo la curva de 0,78629. En pacientes con daño hepático avanzado de cualquier etiología, se ha demostrado que la escala MELD (Model for End-stage Liver Disease) es una herramienta pronóstica muy útil, tanto que en la mayoría de los centros se utiliza para establecer la indicación y la prioridad del trasplante hepático. Su principal inconveniente es que precisa del INR, que se encuentra artificialmente aumentado por algunos anticoagulantes de uso común en los pacientes con CF. La MELD-XI es una escala que no incluye el INR y se ha creado para pacientes anticoagulados31. Aunque se ha demostrado correlación de la MELD-XI con el grado de fibrosis, no se ha conseguido definir un punto de corte adecuado para graduar la EHCF32.
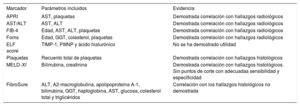
Métodos de diagnóstico serológico para pacientes con cirugía de Fontan
| Marcador | Parámetros incluidos | Evidencia |
|---|---|---|
| APRI | AST, plaquetas | Demostrada correlación con hallazgos radiológicos |
| AST/ALT | AST, ALT | Demostrada correlación con hallazgos radiológicos |
| FIB-4 | Edad, AST, ALT, plaquetas | Demostrada correlación con hallazgos radiológicos |
| Forns | Edad, GGT, colesterol, plaquetas | Demostrada correlación con hallazgos radiológicos |
| ELF score | TIMP-1, PIIINP y ácido hialurónico | No se ha demostrado utilidad |
| Plaquetas | Recuento total de plaquetas | Demostrada correlación con hallazgos histológicos |
| MELD-XI | Bilirrubina, creatinina | Demostrada correlación con hallazgos histológicos. Sin puntos de corte con adecuadas sensibilidad y especificidad |
| FibroSure | ALT, A2-macroglobulina, apolipoproteína A-1, bilirrubina, GGT, haptoglobina, AST, glucosa, colesterol total y triglicéridos | Correlación con los hallazgos histológicos no demostrada |
ALT: alanina transaminasa; AST: aspartato aminotransferasa; APRI: AST to Platelet Ratio Index; ELF: Enhanced Liver Fibrosis; FIB-4: fibrosis 4; GGT: gamma glutamil transpeptidasa; MELD-XI: Model for End-stage Liver Disease-XI; PIIINP: polipéptido N-terminal del colágeno tipo III; TIMP-1: inhibidores tisulares de las metaloproteinasas-1.
Es el método de imagen de elección en la valoración inicial de todos los pacientes con sospecha de enfermedad hepática crónica, y en la mayoría de los casos permite su diagnóstico gracias a los signos recogidos en la tabla 4. El contorno irregular del parénquima valorado con transductor de alta frecuencia es el hallazgo ecográfico más específico para el diagnóstico de enfermedad hepática avanzada33–35. Por su parte, la inversión del flujo portal presenta una especificidad del 100% para el diagnóstico de hipertensión portal36. La combinación de métodos radiológicos y analíticos, como el cociente plaquetas/bazo, puede facilitar el diagnóstico de hipertensión portal y seleccionar a los pacientes en riesgo de que se les desarrollen varices esofagogástricas37. En los pacientes con EHCF, los hallazgos ecográficos más frecuentes son ecogenicidad heterogénea, superficie nodular y nódulos hiperecoicos de pequeño tamaño35,38. Kutty el al.39 realizaron un estudio controlado con Doppler a 106 individuos, y demostraron un mayor índice de resistencia y pulsatilidad en el tronco celiaco y la arteria mesentérica, con reducción significativa de la velocidad portal en los pacientes con CF. La pérdida del patrón trifásico Doppler de las venas hepáticas es universal en la variante bicavopulmonar (por ausencia de trasmisión del latido auricular), pero la presencia de un patrón monofásico traduce daño hepático avanzado26.
Hallazgos ecográficos que indican daño hepático avanzado e hipertensión portal en la enfermedad hepática relacionada con la cirugía de Fontan
| Modo B |
| Bordes hepáticos romos o nodulares |
| Heterogeneidad del parénquima hepático |
| Comunicantes venovenosas intrahepáticas |
| Diámetro de la vena porta> 12 mm |
| Esplenomegalia (área> 50cm2) |
| Doppler |
| Disminución de la velocidad portal (< 16 cm/s) |
| Inversión del flujo portal |
| Índice de resistencia> 0,71 e índice de pulsatilidad> 1,3 en arteria hepática |
| Flujo monofásico o bifásico en las venas suprahepáticas |
Es un sencillo método de diagnóstico no invasivo que permite obtener una medida de la rigidez hepática. Un transductor emite una vibración mecánica en forma de señal luminosa de baja frecuencia y alta amplitud que alcanza el tejido hepático y genera una onda longitudinal que es captada nuevamente por el transductor. Cuanto más rígido sea el tejido, es decir, cuanta más fibrosis haya, mayor es la velocidad de transmisión de la onda. El valor de la velocidad se transforma mediante algoritmos matemáticos en rigidez medida en kilopascales40. Existen 2 grandes métodos elastográficos: la elastografía de transición (Fibroscan), más simple y de uso extendido en Europa, y la sonoelastografía, que requiere un operador experto y se usa más en Norteamérica. La elastografía permite clasificar a los pacientes en los 4 estadios clásicos de fibrosis y se ha validado en prácticamente todas las etiologías, lo que evita muchas de las biopsias que se realizaban en el pasado30. Uno de sus principales inconvenientes es los falsos positivos que se pueden dar en varias situaciones, como la congestión hepática41. Este hecho hace que en los pacientes con CF los valores de elastografía puedan estar sobrestimados. De hecho, la cirugía induce una elevación casi inmediata de los valores de elastografía que únicamente se debe a la congestión hepática42. No obstante, también se ha demostrado que, conforme transcurren los años y aparecen datos de fracaso del Fontan y daño hepático, los valores de elastografía de transición aumentan hasta sobrepasar los 15 kPa, probablemente debido a la fibrosis43,44. En una prueba de concepto llevada a cabo mediante sonoelastografía con la técnica de shear-wave, se ha demostrado una correlación positiva entre el daño hepático histológico y la rigidez39. Por lo tanto, aunque aún se desconocen los puntos de corte adecuados para el diagnóstico de enfermedad hepática avanzada, la elastografía puede resultar una herramienta útil.
Resonancia magnéticaLa resonancia magnética es una técnica que puede resultar muy útil en la EHCF45. Su mayor atractivo en este escenario es la capacidad para el diagnóstico y la caracterización de los nódulos hepáticos. Además, ya que la resonancia cardiaca es hoy una de las principales herramientas utilizadas en el seguimiento de esta población, se puede combinar la realización de una resonancia dinámica hepática en el mismo momento, con lo cual se minimizan las molestias para el paciente y se optimizan los recursos. Aunque su uso aún no está extendido por el alto coste, la elastografía mediante resonancia magnética también permite una aproximación a la fibrosis; de hecho, se ha comprobado una correlación positiva entre los valores de rigidez obtenidos con este método y el índice de APRI, MELD, las presiones de canal de Fontan e incluso con el daño histológico46.
Hemodinámica hepáticaSe ha propuesto que la medición del gradiente de presión venosa hepático (GPVH) puede ayudar a una mejor graduación de la EHCF e incluso puede ser una herramienta de ayuda en el diagnóstico diferencial de la ascitis. Es un procedimiento rápido, sencillo y mínimamente invasivo que no requiere sedación47. El GPVH se define como la diferencia entre las presiones de enclavamiento y libre en una de las venas hepáticas, preferiblemente la derecha. La medición del GPVH permite el diagnóstico diferencial de los cuadros de hipertensión portal, de modo que unas presiones elevadas con GPVH normal indican un origen poshepático, que es el hallazgo más frecuente tras la CF27. Si hubiera daño parenquimatoso avanzado, el GPVH podría superar los 6 mmHg, incluso los 10 mmHg, umbral que se considera de riesgo de descompensación en la mayoría de las hepatopatías48. Sin embargo, diversas circunstancias pueden hacer que se subestime el GPVH, como la presencia de fístulas vasculares entre las propias venas hepáticas o de estas con las ramas portales que, en nuestra experiencia, son muy frecuentes en los pacientes con CF, lo que dificulta la interpretación del resultado del GPVH y hace necesario que personal experto realice la medición.
Biopsia hepáticaEs el procedimiento diagnóstico de referencia y, puesto que actualmente los métodos de diagnóstico no invasivo no están adecuadamente validados, continúa siendo necesaria para conocer de manera fehaciente el daño hepático. Se puede llevar a cabo por vía transyugular, junto con la medición del GPVH, o percutánea. Los hallazgos histológicos característicos se recogen en la tabla 5. La dilatación sinusoidal está presente en un 90-97% de los pacientes con CF y es el hallazgo más precoz. Característicamente, la dilatación sinusoidal es más marcada que en otras causas de cirrosis cardiogénica. La distribución de la fibrosis en fases iniciales es típicamente perisinusoidal (en el espacio de Disse), dato que no está presente en otras hepatopatías de origen cardiaco. Por su parte, el hallazgo de mayor gravedad y más tardío es la fibrosis centrolobulillar extensa en puentes con nódulos regenerativos, que habitualmente traduce irreversibilidad. La inflamación periportal suele estar ausente, lo que permite el diagnóstico diferencial con otras etiologías de enfermedad hepática49. Algunos autores proponen llevar a cabo una biopsia en todos los pacientes una vez transcurridos 10 años desde la CF25. Siguiendo esta estrategia en una cohorte de 67 pacientes, se ha comprobado que el 100% de ellos contraen fibrosis hepática y que esta aumenta con el tiempo. Sin embargo, no se ha podido correlacionar el grado de fibrosis con eventos clínicamente relevantes ni parámetros hemodinámicos o analíticos50, por lo que se desconoce su utilidad como marcador pronóstico que facilite la toma de decisiones. Actualmente se recomienda realizar una biopsia hepática a los pacientes con enfermedad hepática de etiología dudosa y los candidatos a trasplante cardiaco y/o hepático39,40.
COMPLICACIONES HEPÁTICAS DE LA CIRUGÍA DE FONTANEn estadios avanzados de la EHCF, como ocurre en otras formas de cirrosis hepática, pueden aparecer varices esofagogástricas, ascitis, encefalopatía hepática, hepatocarcinoma y esplenomegalia con trombocitopenia. No existe ningún estudio que evalúe de forma pormenorizada las características o historia natural de estas complicaciones en la EHCF.
Nódulos hepáticos y carcinoma hepatocelularLa aparición de grandes nódulos de regeneración en el parénquima hepático es frecuente en la EHCF, como en otras hepatopatías congestivas15,51. Estos nódulos suelen ser múltiples, hipervasculares en fase arterial, hiperecoicos en la ecografía y <3 cm, localizarse en la periferia del hígado y mostrar una prevalencia directamente proporcional al tiempo desde la cirugía. En el estudio histológico, estos nódulos suelen ser de regeneración, una hiperplasia nodular focal o adenomas28,38,52,53. Aunque se desconoce la fisiopatología de los nódulos hepáticos benignos en los pacientes con EHCF, su localización periférica y el comportamiento radiológico indican que su origen sería vascular (figura 6)54.
Hiperplasia nodular regenerativa en la enfermedad hepática relacionada con la cirugía de Fontan. A: la congestión hepática y la disminución del gasto cardiaco producen una disminución del flujo sanguíneo portal en las zonas más periféricas del hígado e isquemia focal. B: la extinción del parénquima secundaria a la isquemia desencadena una respuesta vasodilatadora arterial que estimula la proliferación de hepatocitos sanos en forma de hiperplasia nodular regenerativa. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
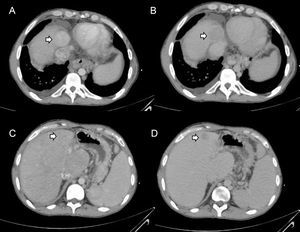
En los últimos años se han publicado casos aislados y pequeñas series de casos de hepatocarcinoma en pacientes con EHCF54–67. Suelen tener una hepatopatía avanzada y con un tiempo desde la cirugía superior a 5-10 años. Los nódulos malignos suelen ser hipervasculares en la fase arterial, con aclaramiento en la fase portal, y cursar con alfafetoproteína aumentada (figura 7). Sin embargo, estas características no son patognomónicas, pueden estar ausentes en algunos casos y su precisión diagnóstica en la EHCF no se ha evaluado, por lo que el diagnóstico diferencial de los nódulos en la EHCF está aún por definir. A ello hay que añadir que los criterios de hepatocarcinoma empleados en la cirrosis no se han validado en otras enfermedades hepáticas como la EHCF. Por estos motivos, el diagnóstico de hepatocarcinoma en pacientes con EHCF requiere siempre la confirmación histológica46.
Diagnóstico radiológico de carcinoma hepatocelular. Las 4 imágenes corresponden a un mismo paciente con cirugía de Fontan que presentaba 2 lesiones focales; se tomaron biopsias. A: hepatocarcinoma que presenta hiperdensidad en la fase arterial. B: hepatocarcinoma que presenta hipodensidad en la fase tardía. C: nódulo benigno periférico sin hiperdensidad arterial. D: nódulo benigno periférico con aclaramiento en la fase venosa.
El cribado cada 4-12 meses mediante pruebas de imagen se ha demostrado coste-efectivo y aumenta la supervivencia de los pacientes con cirrosis, ya que permite detectar el hepatocarcinoma en estadios precoces y ofrecer tratamientos curativos68. Nandwana et al.69. analizaron retrospectivamente una cohorte de 145 pacientes con CF a los que se realizó periódicamente una prueba de imagen hepática; encontraron 1 caso de hepatocarcinoma en la primera prueba de imagen y 4 casos incidentes tras una mediana de seguimiento de 3,05 años. La mayoría de los expertos aconsejan el cribado periódico, aunque no se conoce cuáles son la prueba de imagen y el intervalo óptimos25,52. El tratamiento del hepatocarcinoma debe seguir las guías de práctica clínicas utilizadas para otras formas de cirrosis68.
Varices esofagogástricasSe estima que la prevalencia de varices esofagogástricas oscila entre el 2 y el 43% tras una CF25,30,70. En un estudio retrospectivo de 73 pacientes, su concomitancia con otras manifestaciones de la hipertensión portal se asoció con un mayor riesgo de muerte, trasplante cardiaco o hepatocarcinoma70. Se han publicado casos de hemorragia digestiva variceal, algunos con desenlace fatal, por lo que el cribado y la correcta prevención deben ser sistemáticos25. La piedra angular de la profilaxis de la hemorragia variceal en otras formas de cirrosis es el uso de bloqueadores beta no cardioselectivos; sin embargo, no se ha analizado su efecto en este grupo de pacientes71. Puesto que el modelo de hipertensión portal en los pacientes con EHCF es característicamente hipodinámico, al contrario que en las demás formas de cirrosis, la eficacia de estos fármacos es cuestionable. Si a esto se une que los bloqueadores beta pueden tener efectos deletéreos en la propia circulación de Fontan, se plantea la ligadura con bandas elásticas como método de profilaxis primaria y secundaria. El episodio agudo de hemorragia digestiva por rotura de varices se debe tratar con fármacos vasoactivos (somatostatina, terlipresina u octreotida) y terapia endoscópica (ligadura con bandas). En casos de hemorragia refractaria al tratamiento estándar, se ha demostrado que la creación de un shunt portosistémico intrahepático (TIPS) mejora la supervivencia en otros tipos de hepatopatía71; sin embargo, el hiperaflujo de sangre a la circulación de Fontan procedente del territorio esplácnico puede precipitar un cuadro de hipertensión pulmonar e insuficiencia cardiaca. En la bibliografía se recoge solo 1 caso en el que se logró controlar la hemorragia variceal colocando un TIPS; no obstante, su utilización debe restringirse a casos muy seleccionados no respondedores al tratamiento convencional y que preserven una buena función cardiaca72.
AscitisLa ascitis en una manifestación tardía de la cirrosis hepática y se asocia con menor supervivencia y deterioro de la calidad de vida73. Es la descompensación clínica hepática más frecuente y su prevalencia oscila entre el 2 y el 17% de los pacientes con CF52. En las hepatopatías crónicas con hipertensión portal intrahepática, la ascitis aparece cuando el GPVH es ≥ 10 mmHg, lo cual también tiene valor pronóstico48. Sin embargo, en la EHCF el GPVH suele ser normal y la ascitis puede aparecer en ausencia de cirrosis hepática, por lo que su valor como marcador pronóstico y sus mecanismos fisiopatológicos no son superponibles a los de las demás hepatopatías28,74. Son varias las causas de ascitis en los pacientes con CF (tabla 6), por lo que cuando aparece es imprescindible realizar un adecuado diagnóstico diferencial74. En cualquier caso, en mayor o menor medida, siempre se acompaña de daño hepático y es su marcador clínico más evidente.
Causas de ascitis en pacientes con cirugía de Fontan
| Hipertensión venosa sistémica por fracaso de la circulación de Fontan (arritmias, trombosis/estenosis del conducto, disfunción ventricular, hipertensión pulmonar) |
| Hipertensión portal de origen poshepático |
| Hipertensión portal sinusoidal (fibrosis hepática avanzada) |
| Hipoalbuminemia/hipoproteinemia secundaria a enteropatía pierdeproteínas |
La ascitis suele ser tratable optimizando la función cardiaca y la nutrición y empleando diuréticos del asa y antialdosterónicos, ya que el sistema renina-angiotensina-aldosterona se encuentra aumentado en la hipertensión portal y la insuficiencia cardiaca48,75. Las paracentesis evacuadoras de repetición son una opción de rescate, aunque no se han publicado series de EHCF en las que haya sido necesaria.
Encefalopatía hepáticaLa encefalopatía hepática se define como una disfunción cerebral secundaria a la insuficiencia hepática y/o los shunts portosistémicos. Se manifiesta como un amplio espectro de alteraciones neurológicas y psiquiátricas que van desde los cambios subclínicos al coma. Se estima que un 30-40% de los pacientes con cirrosis presentarán este cuadro en algún momento de su evolución76, aunque en la EHCF es un evento muy poco documentado. Únicamente se recogen 3 casos publicados25,30,77; no obstante, es probable que su incidencia y su prevalencia estén subestimadas por la naturaleza retrospectiva de los trabajos y la posibilidad de que se considerara la encefalopatía hepática en el diagnóstico diferencial.
Trasplante hepáticoEl trasplante hepático es el tratamiento de elección de la cirrosis descompensada con una puntuación MELD> 15 y en determinados casos de hepatocarcinoma. En el siglo xx, la cirrosis se concebía como una enfermedad irreversible; sin embargo, números trabajos en cirrosis de origen viral y alcohólico señalan que la fibrosis puede revertirse parcialmente e incluso por completo si se elimina la noxa del daño hepático78,79. Sobre la cirrosis de origen cardiaco, existen modelos experimentales y pequeñas series de casos que indican que la hepatopatía también puede mejorar e incluso normalizarse si se restaura la función cardiaca74,80,81. Teniendo en cuenta que la gravedad de la cardiopatía tiene relación directa con un mayor daño hepático y que este es universal en mayor o menor grado, la principal incógnita es determinar qué subgrupos de pacientes requieren un trasplante solo cardiaco o un doble trasplante cardiohepático.
Los 2 estudios más significativos que analizan esta cuestión son retrospectivos, tienen un pequeño tamaño muestral y adolecen de limitaciones metodológicas82,83. En ellos se destaca el buen pronóstico del trasplante cardiaco en la cirrosis compensada y del doble trasplante, si bien no se incluyó a pacientes con enfermedad hepática descompensada. En cualquier caso, los resultados de ambos estudios abren el interesante debate sobre si el doble trasplante se debe plantear para todo paciente con sospecha de enfermedad hepática avanzada antes de la descompensación o se debe reservar para los que presenten complicaciones. Desde nuestra perspectiva, el doble trasplante en pacientes con enfermedad hepática compensada es demasiado agresivo, ya que la gravedad del daño hepático en estos pacientes probablemente sea insuficiente para justificar el trasplante hepático, máxime teniendo en cuenta la escasez actual de órganos, la morbilidad quirúrgica que implica y la potencial mejoría de la función hepática tras el trasplante solo cardiaco. Además, ningún estudio ha demostrado que la hepatopatía compensada sea un factor de riesgo perioperatorio o de mal pronóstico a largo plazo tras el trasplante cardiaco. Actualmente no hay consenso sobre cuándo llevar a cabo un doble trasplante. Las instituciones con mayor experiencia en este campo recomiendan un análisis individualizado de cada caso en un comité multidisciplinario.
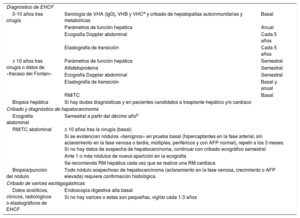
CONCLUSIONESTodos los pacientes con CF desarrollan enfermedad hepática crónica. Aunque su historia natural no es bien conocida y depende de la evolución de su cardiopatía, una vez transcurridos 10 años tras la cirugía se debe investigar sistemáticamente su presencia. En los últimos años, a raíz de los casos de hepatocarcinoma comunicados, ha crecido el interés por la EHCF. Sus peculiares fisiopatología y comportamiento clínico hacen de la EHCF un tipo de hepatopatía única que requiere un abordaje específico en el que, sin duda, debe participar el hepatólogo. En nuestra experiencia, se debe dar a estos pacientes un seguimiento hepático periódico (tabla 7). Puesto que son muchos los interrogantes que aún quedan por contestar sobre la fisiopatología y el tratamiento de la EHCF, es fundamental la creación de grupos de investigación multicéntricos que permitan reunir en el futuro la suficiente evidencia científica para establecer el seguimiento óptimo de estos pacientes.
Recomendaciones de seguimiento hepático tras cirugía de Fontan del Hospital Universitario Ramón y Cajal
| Diagnóstico de EHCF | ||
| 0-10 años tras cirugía | Serología de VHA (IgG), VHB y VHCa y cribado de hepatopatías autoinmunitarias y metabólicas | Basal |
| Parámetros de función hepática | Anual | |
| Ecografía Doppler abdominal | Cada 5 años | |
| Elastografía de transición | Cada 5 años | |
| ≥ 10 años tras cirugía o datos de «fracaso del Fontan» | Parámetros de función hepática | Semestral |
| Alfafetoproteína | Semestral | |
| Ecografía Doppler abdominal | Semestral | |
| Elastografía de transición | Basal y anual | |
| RM/TC | Basal | |
| Biopsia hepática | Si hay dudas diagnósticas y en pacientes candidatos a trasplante hepático y/o cardiaco | |
| Cribado y diagnóstico de hepatocarcinoma | ||
| Ecografía abdominal | Semestral a partir del décimo añob | |
| RM/TC abdominal | ≥ 10 años tras la cirugía (basal) | |
| Si se evidencian nódulos «benignos» en prueba basal (hipercaptantes en la fase arterial, sin aclaramiento en la fase venosa o tardía, múltiples, periféricos y con AFP normal), repetir a los 3 meses. Si no hay datos de sospecha de hepatocarcinoma, continuar con cribado ecográfico semestral | ||
| Ante 1 o más nódulos de nueva aparición en la ecografía | ||
| Se recomienda RM hepática cada vez que se realice una RM cardiaca | ||
| Biopsia/punción del nódulo | Todo nódulo sospechoso de hepatocarcinoma (aclaramiento en la fase venosa, crecimiento o AFP elevada) requiere confirmación histológica | |
| Cribado de varices esofagogástricas | ||
| Datos analíticos, clínicos, radiológicos o elastográficos de EHCF | Endoscopia digestiva alta basal | |
| Si no hay varices o estas son pequeñas, vigilar cada 1-3 años | ||
AcHBc: anticuerpo del core del virus de la hepatitis B; AcHBs: anticuerpo de superficie del virus de la hepatitis B; AFP: alfafetoproteína; AgHBs: antígeno de superficie del virus de la hepatitis B; EHCF: enfermedad hepática relacionada con cirugía de Fontan; RM: resonancia magnética; TC: tomografía computarizada; VHA: virus de la hepatitis A; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C.
Realizar serología (IgG) del VHA y ELISA del VHC y el VHB (AgHBs, AcHBc y AcHBs) a todo paciente con cirugía de Fontan. En caso de que no esté inmunizado, se debe indicar vacunación contra el VHA y VHB y comprobar su eficacia con nuevas serologías. Tras 10 años de la vacunación eficaz contra el VHB, se debe determinar los AcHBs e indicar nueva dosis si fueran <100 UI/l.
No se declara ninguno.
Al Servicio de Cardiología Infantil del Hospital Universitario Ramón y Cajal por su dedicación entusiasta y constante a la EHCF.