La fibrosis intersticial en miocardiopatía hipertrófica (MCH) se ha propuesto como substrato de arritmias malignas. La fibrosis se asocia a expansión del volumen extracelular (VEC) que se puede cuantificar por tomografía computarizada (TC). El objetivo es analizar la asociación entre VEC determinado por TC y la presencia de arritmias malignas.
MétodosEstudio observacional de casos y controles en pacientes con MCH y desfibrilador automático implantable sometidos a TC con infusión continua de contraste yodado para cuantificar el VEC en equilibrio. Se comparó el VEC determinado por TC en las paredes septal y lateral de ventrículo izquierdo entre casos (presencia de arritmia maligna previa) y controles (sin arritmias malignas).
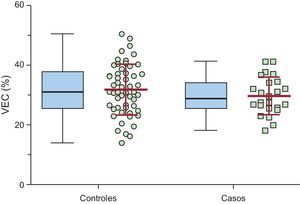
ResultadosSe incluyó a 78 pacientes con MCH-desfibrilador automático implantable, 24 eran mujeres con una edad media de 52,1 ± 15,6 años. El VEC medio ± desviación estándar en pared septal fue 29,8 ± 6,3% en casos (n = 24) frente a 31,9 ± 8,5% en controles (n = 54); p = 0,282. El VEC medio en pared lateral fue 24,5 ± 6,8% en casos frente a 28,2 ± 7,4% en controles; p = 0,043. No se encontraron diferencias en el número de pacientes con choques apropiados entre los diferentes terciles de VEC. Por el contrario, se encontró una tendencia (p = 0,056) de un mayor número de pacientes dentro del menor tercil de VEC en pared lateral con descargas apropiadas.
ConclusionesEl VEC en pacientes con MCH-desfibrilador automático implantable con arritmias malignas no se mostró incrementado comparado con pacientes con MCH-desfibrilador automático implantable sin arritmias. Estos hallazgos no apoyan en uso de VEC (subrogado de fibrosis difusa) como predictor de arritmias malignas en pacientes con MCH de alto riesgo.
Palabras clave
La miocardiopatía hipertrófica (MCH) es una forma de miocardiopatía de transmisión genética que tiene una prevalencia estimada de 1/500 en población general1–6. La enfermedad puede tener una evolución clínica favorable7, en especial con las estrategias de tratamiento contemporáneas5; sin embargo, sigue implicando un riesgo de muerte súbita cardiaca (MSC), y el modo de estimar dicho riesgo es un campo de investigación en rápida evolución.
La principal estrategia utilizada para la prevención de la MSC en los pacientes con MCH de alto riesgo es el implante de un desfibrilador automático implantable (DAI)8–10. Sin embargo, en la mayoría de los pacientes con MCH, nunca se llega a utilizar el DAI. Además, el implante de un DAI conlleva riesgo de descargas inapropiadas y otras complicaciones. En consecuencia, son necesarias mejores herramientas para estratificar el riesgo de arritmias en la MCH.
Se cree que las arritmias ventriculares que conducen a la MSC en la MCH se producen como consecuencia de una fibrosis miocárdica11. Algunos estudios han relacionado las arritmias ventriculares con la fibrosis focal, evaluada mediante la presencia y el grado de realce tardío de gadolinio en la cardiorresonancia magnética (CRM)12–14. Sin embargo, esta relación no se considera lo bastante potente para respaldar el implante de un DAI como medida de prevención primaria en las guías de Estados Unidos y Europa15,16. La CRM con realce tardío de gadolinio no detecta la fibrosis difusa; sin embargo, la histología evaluada post mortem muestra que la fibrosis difusa es más prevalente tras la MSC en los pacientes con MCH en comparación con lo que se observa en las muertes no relacionadas con una causa cardiovascular o en las de pacientes con hipertrofia del ventrículo izquierdo de origen hipertensivo, lo cual indica que es un sustrato proarrítmico11,17–20. Hasta la fecha, son pocos los estudios diseñados para evaluar la asociación entre las arritmias ventriculares malignas y la fibrosis difusa detectada por medios no invasivos21,22.
La fibrosis miocárdica se asocia con un aumento del volumen extracelular (VEC), que puede cuantificarse mediante CRM o tomografía computarizada (TC)23,24. El objetivo del presente estudio es determinar si la cuantificación del VEC mediante TC, como medida indirecta de la fibrosis difusa, permite diferenciar entre presencia y ausencia de arritmias ventriculares malignas en los pacientes con MCH a los que se había implantado un DAI (pacientes con MCH-DAI).
MÉTODOSSe llevó a cabo en pacientes con MCH-DAI un estudio retrospectivo observacional de casos y controles. Entre noviembre de 2013 y febrero de 2015, se incluyó a 78 pacientes con MCH-DAI (edad > 18 años y sin contraindicaciones para el uso de una TC con contraste) en 5 unidades de miocardiopatía de España (Puerta de Hierro, Majadahonda, Madrid: n = 24; La Fe, Valencia: n = 15; Son Llàtzer, Palma de Mallorca: n = 17; Clínico San Carlos, Madrid: n = 10; 12 de Octubre, Madrid: n = 12). El estudio fue aprobado por el comité de ética local. A todos los pacientes se les había implantado anteriormente un DAI siguiendo lo establecido en las guías actuales de estratificación del riesgo16,25,26. Todos los pacientes dieron su consentimiento informado por escrito.
Grupos de casos y controles preespecificadosLos casos fueron los pacientes con MCH a los que se había implantado un DAI para prevención secundaria o prevención primaria y en los que se había documentado algún tratamiento apropiado del DAI (marcapasos antitaquicardia o descarga). Se definió como paciente de control a aquellos con MCH a los que se había implantado un DAI para prevención primaria pero que no tenían antecedentes de tratamiento del DAI en el momento de la inclusión.
Protocolo de tomografía computarizadaSe cuantificó el VEC mediante los datos de TC adquiridos con 2 escáneres: un ICT 256 (Philips; Best, Países Bajos) en el Centro Nacional de Investigaciones Cardiovasculares (CNIC), Madrid (n = 61) y un Lightspeed VCT 64 Slice CT scanner (General Electric; Estados Unidos) en el Hospital Son Llàtzer, Mallorca (n = 17). Antes del examen de TC, se llevó a cabo una exploración de los pacientes para verificar la frecuencia cardiaca, la presión arterial y el ritmo cardiaco (ritmo sinusal, fibrilación auricular o marcapasos) y se les extrajo una muestra de sangre para la determinación del hematocrito. El protocolo de adquisición de imágenes de TC consistió en secuencias exploratorias (scout) y 2 adquisiciones (previa y posterior al contraste) con cobertura de la dirección z de 160 mm (con objeto de aportar la máxima cobertura del ventrículo izquierdo). Se realizó una adquisición prospectiva de los datos de TC a un 70% del intervalo RR. Las adquisiciones posteriores al contraste se llevaron a cabo 25 min después del inicio de la infusión del medio de contraste yodado (Omnipaque 300mg l/ml, GE Healthcare). La infusión del contraste se realizó rápidamente con un inyector de TC (Medrad Stellant para las exploraciones realizadas en el CNIC; Ulrich Medical Missouri para las del Hospital Son Llàtzer) a 3 ml/s hasta alcanzar un volumen total de 1 ml/kg. Una vez completada la infusión rápida, se inició una perfusión continua con una bomba de infusión a 1,88 ml/h/kg, que se continuó durante 25 min (Hospira PlumA+ en el CNIC; Braun Space Infusomat en el Hospital Son Llàtzer)24. Por motivos de seguridad, el volumen máximo de medio de contraste inyectado se estableció en 200 ml. La dosis de radiación absorbida se expresó como producto dosis-longitud (mGy·cm), y se calculó la dosis de radiación efectiva mediante el producto dosis-longitud × 0,014, expresado en mSv27.
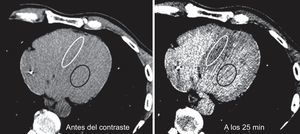
Análisis de las imágenesEl análisis de las imágenes se llevó a cabo en el laboratorio central de diagnóstico por la imagen del CNIC y lo realizaron evaluadores que desconocían los datos clínicos. Se utilizó una estación de trabajo (Philips; Best, Países Bajos) para reconstruir cortes de 5 mm. Se seleccionó para los análisis posteriores el corte con la mejor calidad, definida por la ausencia de artefactos de endurecimiento del haz derivados del electrodo del DAI, y con suficiente miocardio y sangre. Se delimitó una región de interés (RdI) en el tabique interventricular en el área de grosor máximo del miocardio. Si había una fibrosis focal evidente28, se incluía en la RdI junto con el resto del tejido del tabique. De modo análogo, se delimitó una RdI en el interior del conjunto de sangre del ventrículo izquierdo (figura 1). Por último, se definió una RdI lateral en la pared lateral. Las RdI se ubicaron de manera idéntica en las adquisiciones previa y posterior al contraste.
Dos imágenes de tomografía computarizada con características de ventana optimizadas para resaltar el contraste entre la atenuación del miocardio y la de la sangre. En todas las imágenes, la región de interés se ubica en el tabique (círculo blanco) y el conjunto de sangre (círculo negro). Imágenes captadas antes del contraste y 25 min después de iniciarse la infusión con bomba.
Se estimó el VEC después de 25 min de infusión con bomba, utilizando la siguiente fórmula24:
Desfibriladores automáticos implantables y seguimiento clínicoSe documentaron los eventos registrados en el seguimiento del DAI (concretamente, el número y las fechas de los tratamientos de descarga apropiados, los tratamientos de descarga inapropiados y el marcapasos antitaquicardia; se documentó también la presencia de fibrilación auricular paroxística o permanente). Se utilizaron los datos del DAI del seguimiento más reciente para determinar la presencia o ausencia de tratamientos del DAI apropiados. Se registraron los siguientes parámetros de ecocardiografía: grosor máximo del tabique interventricular, diámetro auricular izquierdo paraesternal y gradiente máximo en el tracto de salida del ventrículo izquierdo. Se registró la clase funcional de la New York Heart Association (NYHA) en el momento de realizar la TC. Se estimó el riesgo de MSC por MCH a los 5 años (%) cuando fue posible, aplicando el método de O’Mahony et al., que evalúa los datos de ecocardiografía, los antecedentes familiares y los datos clínicos en la fecha de implante del DAI (excepto por la edad actual)29. No se calculó el riesgo para la prevención secundaria.
Análisis estadísticoLas comparaciones estadísticas se realizaron con el programa IBM SPSS Statistics V.22. Las variables cualitativas se expresan como n (%). Las variables cuantitativas se expresan como media ± desviación estándar para los datos con distribución normal o mediana [intervalo intercuartílico] cuando la muestra tenía una distribución no normal. Las variables cualitativas se compararon con la prueba de la χ2 y las variables cuantitativas, con la prueba de la t de Student. Se utilizó la prueba de la U de Mann-Whitney no paramétrica en caso necesario. Para las comparaciones de terciles se aplicó un ANOVA (análisis de la varianza) y la prueba de la χ2 (prueba de Mantel-Haenszel para la tendencia lineal) según procediera. Se calculó el coeficiente de correlación intraclase para evaluar la variación intraobservador e interobservadores. Las diferencias estadísticas se consideraron significativas con p < 0,05.
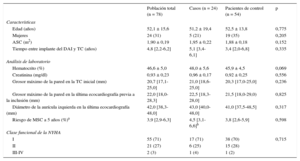
RESULTADOSSe incluyó a un total de 78 pacientes (24 [30,8%] mujeres; media de edad, 52 ± 16 años), 24 casos y 54 controles. Las características demográficas se presentan en la tabla 1 y la tabla 1 del material suplementario. La mayoría de los pacientes se encontraban en buena clase funcional en el momento de la inclusión: un 71% estaban en NYHA I y solo un 3% estaba en NYHA III-IV. Del total de la población del estudio, un 5% de los pacientes estaban en terapia de resincronización cardiaca y un 12% recibía diuréticos. La mediana del grosor máximo de la pared fue 20,7 [17,1-25,0] mm en la TC, en comparación con 22,0 [18,0-28,3] mm en la última ecocardiografía antes de la inclusión. El 67% de todos los pacientes estaban en tratamiento con bloqueadores beta y un 13% recibía amiodarona. Excluyendo a los pacientes de prevención secundaria, la mediana de riesgo de MSC a 5 años según los criterios de la guía de la Sociedad Europea de Cardiología (ESC)29 fue del 3,9% [2,9-6,3], sin que se observaran diferencias significativas en cuanto a la aparición de arritmias ventriculares malignas después del implante del DAI.
Características de los pacientes
| Población total (n = 78) | Casos (n = 24) | Pacientes de control (n = 54) | p | |
|---|---|---|---|---|
| Características | ||||
| Edad (años) | 52,1 ± 15,6 | 51,2 ± 19,4 | 52,5 ± 13,8 | 0,775 |
| Mujeres | 24 (31) | 5 (21) | 19 (35) | 0,205 |
| ASC (m2) | 1,90 ± 0,19 | 1,95 ± 0,22 | 1,88 ± 0,18 | 0,152 |
| Tiempo entre implante del DAI y TC (años) | 4,8 [2,2-6,2] | 5,1 [3,4-6,1] | 3,4 [2,0-6,8] | 0,335 |
| Análisis de laboratorio | ||||
| Hematocrito (%) | 46,6 ± 5,0 | 48,0 ± 5,6 | 45,9 ± 4,5 | 0,069 |
| Creatinina (mg/dl) | 0,93 ± 0,23 | 0,96 ± 0,17 | 0,92 ± 0,25 | 0,556 |
| Grosor máximo de la pared en la TC inicial (mm) | 20,7 [17,1-25,0] | 21,0 [18,6-25,0] | 20,3 [17,0-25,0] | 0,236 |
| Grosor máximo de la pared en la última ecocardiografía previa a la inclusión (mm) | 22,0 [18,0-28,3] | 22,5 [18,3-28,0] | 21,5 [18,0-29,0) | 0,825 |
| Diámetro de la aurícula izquierda en la última ecocardiografía (mm) | 42,0 [38,3-48,0] | 43,0 [40,0-48,0] | 41,0 [37,5-48,5] | 0,317 |
| Riesgo de MSC a 5 años (%)a | 3,9 [2,9-6,3] | 4,5 [3,1-6,6]b | 3,8 [2,6-5,9] | 0,598 |
| Clase funcional de la NYHA | ||||
| I | 55 (71) | 17 (71) | 38 (70) | 0,715 |
| II | 21 (27) | 6 (25) | 15 (28) | |
| III-IV | 2 (3) | 1 (4) | 1 (2) | |
ASC: área de superficie corporal; DAI: desfibrilador automático implantable; MSC: muerte súbita cardiaca; NYHA: New York Heart Association; TC: tomografía computarizada.
Salvo otra indicación, los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
En 17 pacientes (21,8%) de la población en estudio, la puntuación de riesgo no se calculó debido a la falta de los datos necesarios para ello. Se presentan otras características clínicas adicionales en la tabla 1 del material suplementario.
En la población de casos (n = 24), a 14 pacientes se les había implantado un DAI con fines de prevención secundaria. En los 10 pacientes restantes fue para la prevención primaria y las arritmias ventriculares malignas documentadas conllevaron un tratamiento apropiado del DAI durante el seguimiento. En los casos en que el DAI se había aplicado con fines de prevención secundaria, se produjo tratamiento apropiado del DAI (marcapasos antitaquicardia o descarga) antes que en los pacientes con DAI destinado a prevención primaria. Los datos de los tratamientos de los DAI en el conjunto de la población del estudio se resumen en la tabla 2 del material suplementario.
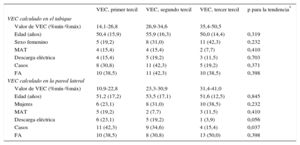
La media de volumen de contraste yodado administrado a los pacientes fue similar en los casos y los controles (146,7 frente a 138,4 ml; p = 0,147). La mediana de dosis efectiva de radiación fue la misma en los 2 grupos de estudio (4,5 frente a 4,5 mSv en los casos y los controles respectivamente; p = 0,295). Los valores de la atenuación para cada uno de los compartimentos se resumen en la tabla 2, en la que se indica el nivel de ruido mediante la desviación estándar. En la tabla 3 del material suplementario se presentan otros datos adicionales relativos a la exploración de TC. Las diferencias existentes en el VEC del tabique entre los pacientes con y sin fibrilación auricular y el tipo de fibrilación auricular se presentan, respectivamente, en la tabla 4 y la tabla 5 del material suplementario.
Resultados de la tomografía computarizada
| Población total (n = 78) | Pacientes casos (n = 24) | Pacientes controles (n = 54) | p (casos frente a controles) | |
|---|---|---|---|---|
| VEC y atenuación, pared del tabique | ||||
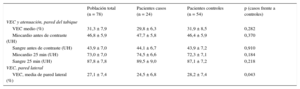
| VEC medio (%) | 31,3 ± 7,9 | 29,8 ± 6,3 | 31,9 ± 8,5 | 0,282 |
| Miocardio antes de contraste (UH) | 46,8 ± 5,9 | 47,7 ± 5,8 | 46,4 ± 5,9 | 0,370 |
| Sangre antes de contraste (UH) | 43,9 ± 7,0 | 44,1 ± 6,7 | 43,9 ± 7,2 | 0,910 |
| Miocardio 25 min (UH) | 73,0 ± 7,0 | 74,5 ± 6,6 | 72,3 ± 7,1 | 0,184 |
| Sangre 25 min (UH) | 87,8 ± 7,8 | 89,5 ± 9,0 | 87,1 ± 7,2 | 0,218 |
| VEC, pared lateral | ||||
| VEC, media de pared lateral (%) | 27,1 ± 7,4 | 24,5 ± 6,8 | 28,2 ± 7,4 | 0,043 |
VEC: volumen extracelular.
Los datos expresan media ± desviación estándar.
Se presentan otros datos adicionales de tomografía computarizada en la tabla 2 del material suplementario.
La media de VEC en el tabique interventricular (variable de valoración principal) fue del 31,3 ± 7,9% en la cohorte completa, el 29,8 ± 6,3% en los casos y el 31,9 ± 8,5% en los controles (p = 0,282) (tabla 2 y figura 2). El VEC en la pared lateral fue del 27,1 ± 7,4%, el 24,5 ± 6,8% en los casos frente al 28,2 ± 7,4% en los controles (p = 0,043). El VEC en el tabique interventricular fue significativamente superior al calculado en la pared lateral del ventrículo izquierdo: el 31,3 ± 7,9% frente al 27,1 ± 7,4% (p < 0,001). El cociente VEC del tabique/VEC de la pared lateral (un indicador indirecto de la asimetría del VEC en el ventrículo izquierdo) fue superior, de manera no significativa, en los casos (1,32 ± 0,11) en comparación con los controles (1,17 ± 0,31; p = 0,133).
Se comparó también el VEC entre casos y controles con los 64 participantes con DAI en prevención primaria. El VEC fue de 31,9 ± 8,5 en los controles (n = 54) y 32,6 ± 6,8 (p = 0,81) en los casos (n = 10).
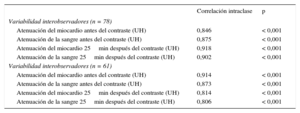
En todos los parámetros (atenuación del miocardio y de la sangre, tanto antes como después del contraste), los valores del coeficiente de correlación intraclase estuvieron entre 0,8 y 0,9, de tal manera que los valores de p fueron significativos en todos los casos, lo cual demuestra la buena reproducibilidad de los datos de TC (tabla 3).
Reproducibilidad del volumen extracelular determinado en la tomografía computarizada
| Correlación intraclase | p | |
|---|---|---|
| Variabilidad interobservadores (n = 78) | ||
| Atenuación del miocardio antes del contraste (UH) | 0,846 | < 0,001 |
| Atenuación de la sangre antes del contraste (UH) | 0,875 | < 0,001 |
| Atenuación del miocardio 25min después del contraste (UH) | 0,918 | < 0,001 |
| Atenuación de la sangre 25min después del contraste (UH) | 0,902 | < 0,001 |
| Variabilidad interobservadores (n = 61) | ||
| Atenuación del miocardio antes del contraste (UH) | 0,914 | < 0,001 |
| Atenuación de la sangre antes del contraste (UH) | 0,873 | < 0,001 |
| Atenuación del miocardio 25min después del contraste (UH) | 0,814 | < 0,001 |
| Atenuación de la sangre 25min después del contraste (UH) | 0,806 | < 0,001 |
Se dividió al conjunto de la población en los terciles de VEC septales y laterales y se compararon los tratamientos del DAI aplicados en ambos grupos. No se observó ninguna tendencia lineal en el número de pacientes que recibieron descargas apropiadas en los diversos terciles de VEC: 4 (15,1%), 5 (19,2%) y 3 (11,5%) en los terciles de VEC inferior, medio y superior del VEC del tabique respectivamente (p = 0,703). En cambio, se observó una tendencia no significativa en los terciles del VEC de la pared lateral, con una incidencia superior de descargas apropiadas del DAI en los pacientes del tercil inferior del VEC lateral, en comparación con los pacientes de los demás terciles (p = 0,056). En la comparación de los casos con los controles, se apreció una tendencia lineal estadísticamente significativa en los terciles del VEC en la pared lateral según lo definido anteriormente (p = 0,037) (tabla 4).
Terciles del volumen extracelular calculados en el tabique y la pared lateral
| VEC, primer tercil | VEC, segundo tercil | VEC, tercer tercil | p para la tendencia* | |
|---|---|---|---|---|
| VEC calculado en el tabique | ||||
| Valor de VEC (%mín-%máx) | 14,1-26,8 | 26,9-34,6 | 35,4-50,5 | |
| Edad (años) | 50,4 (15,9) | 55,9 (16,3) | 50,0 (14,4) | 0,319 |
| Sexo femenino | 5 (19,2) | 8 (31,0) | 11 (42,3) | 0,232 |
| MAT | 4 (15,4) | 4 (15,4) | 2 (7,7) | 0,410 |
| Descarga eléctrica | 4 (15,4) | 5 (19,2) | 3 (11,5) | 0,703 |
| Casos | 8 (30,8) | 11 (42,3) | 5 (19,2) | 0,371 |
| FA | 10 (38,5) | 11 (42,3) | 10 (38,5) | 0,398 |
| VEC calculado en la pared lateral | ||||
| Valor de VEC (%mín-%máx) | 10,9-22,8 | 23,3-30,9 | 31,4-41,0 | |
| Edad (años) | 51,2 (17,2) | 53,5 (17,1) | 51,6 (12,5) | 0,845 |
| Mujeres | 6 (23,1) | 8 (31,0) | 10 (38,5) | 0,232 |
| MAT | 5 (19,2) | 2 (7,7) | 3 (11,5) | 0,410 |
| Descarga eléctrica | 6 (23,1) | 5 (19,2) | 1 (3,9) | 0,056 |
| Casos | 11 (42,3) | 9 (34,6) | 4 (15,4) | 0,037 |
| FA | 10 (38,5) | 8 (30,8) | 13 (50,0) | 0,398 |
FA: fibrilación auricular; MAT: marcapasos antitaquicardia; VEC: volumen extracelular.
Salvo otra indicación, los valores expresan n (%).
Este es el primer estudio en que se evalúa la asociación entre la fibrosis miocárdica difusa y las arritmias ventriculares malignas en pacientes con MCH de alto riesgo portadores de un DAI. Se evaluó la hipótesis de que el VEC detectado mediante TC, que es un indicador indirecto de fibrosis miocárdica difusa, sería superior en los pacientes con MCH de alto riesgo que sufrieron episodios de arritmia ventricular maligna en comparación con los pacientes sin eventos de este tipo. Para ello, se examinó a los pacientes con MCH a los que se había implantado un DAI, y se dividió a la población según la presencia o ausencia de arritmias (previas al implante, es decir, prevención secundaria, o posteriores al implante, es decir, tratamiento de DAI apropiado para un individuo al que se ha implantado un DAI como estrategia de prevención primaria). El VEC de los pacientes con MCH-DAI que sufrieron arritmias ventriculares malignas no mostró aumento en comparación con el de los pacientes sin arritmias ventriculares malignas. Visto desde otra perspectiva, al dividir la cohorte completa en terciles, se observó una tendencia a mayor incidencia de descargas apropiadas en los pacientes que se encontraban en el tercil inferior del VEC. Así pues, estos resultados no confirman la hipótesis e indican que la cuantificación del VEC no mejoraría la predicción del riesgo de arritmias de los pacientes con MCH.
La fibrosis miocárdica, con un aumento del depósito de matriz miocárdica de colágeno, es un fenómeno reconocido que se da en la evolución natural de la MCH y se detecta en la autopsia de pacientes jóvenes que han fallecido por una muerte súbita relacionada con una MCH11. En los pacientes con MCH, el aumento de la síntesis de colágeno puede detectarse por el aumento de las concentraciones circulantes del propéptido carboxiterminal de procolágeno tipo I30. La introducción de la CRM con realce tardío de gadolinio ha permitido el estudio de la fibrosis macroscópica y ha conducido a proponer una asociación con los eventos arrítmicos mortales en los pacientes con MCH. En un estudio de 1.293 pacientes con MCH, se observó que el grado de realce tardío de gadolinio es un buen predictor de MSC, de tal manera que había un aumento del 40% en el riesgo relativo de MSC por cada 10% de incremento del realce tardío de gadolinio a lo largo de una mediana de seguimiento de 3,3 años12. Sin embargo, en un metanálisis en el que se incluyó a 1.063 pacientes de 4 estudios, se observó que la asociación entre el realce tardío de gadolinio y la muerte súbita no era significativa en un seguimiento medio de 3,1 años31; además, un análisis de 711 pacientes con MCH observó de manera similar la ausencia de asociación estadísticamente significativa entre la presencia y la cantidad de fibrosis (áreas con realce tardío de gadolinio positivo en la CRM) y la MSC en una mediana de seguimiento de 3,5 años13. Así pues, aunque hay una relación plausible entre la fibrosis y el riesgo de arritmias, no hay clara asociación entre la fibrosis macroscópica focal detectada mediante CRM con realce tardío de gadolinio y las arritmias ventriculares malignas o la MSC. Esta situación se refleja en el hecho de que, en las guías actuales para el implante de DAI, la estratificación del riesgo no tiene en cuenta la presencia de realce tardío de gadolinio, tan solo como criterio menor, y se considera de posible utilidad para la selección de los pacientes16, tal y como se incluía en las guías previas como criterio menor15. La reciente introducción de técnicas de imagen que permiten cuantificar la fibrosis microscópica difusa23 ha permitido revaluar la hipótesis de que la fibrosis es un marcador del riesgo de los pacientes con MCH.
En nuestra población, se había implantado un DAI en prevención primaria a 64 pacientes, y 10 (15,6%) de ellos tuvieron al menos 1 tratamiento apropiado en una mediana de 4,8 años (3,3%/año). Esta cifra es similar a la publicada del 3,6% al año32, y claramente superior a la mediana de riesgo calculada del 3,9% en 5 años (0,8%/año) según el algoritmo de la guía de la ESC29. Sin embargo, es importante mencionar que no todos los tratamientos apropiados habrían sido tratamientos que salvaran la vida de los pacientes, ya que es bien sabido que algunas arritmias ventriculares finalizan espontáneamente, sin ninguna intervención de DAI, por lo que el porcentaje de tratamientos apropiados del DAI no equivale directamente al riesgo de muerte súbita. Sin embargo, se observa una diferencia sorprendente entre el riesgo estimado de muerte súbita según el algoritmo de la ESC y el porcentaje muy superior de tratamientos apropiados del DAI. En relación con ello, debe tenerse en cuenta la información no disponible. No se calculó la puntuación de riesgo del 21,8% de esta población debido a la falta de los datos necesarios para ello. El porcentaje de tratamientos apropiados en la población en prevención primaria incluida en el grupo de casos (3,3%/año) fue ligeramente superior al riesgo establecido de muerte súbita (el 6% de riesgo en 5 años, 1,2%/año) para el implante de un DAI según la guía actual de la ESC16. De los 14 pacientes de este estudio a los que se había implantado un DAI con fines de prevención secundaria, 8 (57,1%) tuvieron al menos 1 evento de tratamiento apropiado documentado en una mediana de seguimiento de 5,0 años (11,4%/año), lo cual es similar al 10,6%/año registrado en otras cohortes32.
Validez de la tomografía computarizada para calcular el volumen extracelularEl estudio de referencia de Flett et al.23 introdujo la CRM con contraste de equilibrio no invasiva como método para el estudio de la fibrosis difusa, que anteriormente solo se podía evaluar mediante histología. La población del estudio original incluía a 8 pacientes con MCH; sin embargo, en estudios posteriores del mismo grupo se examinó a un mayor número de pacientes con MCH33. Una vez establecida la utilidad del VEC para medir la fibrosis miocárdica difusa, se centró la atención en otras técnicas de imagen alternativas. En una comparación del rendimiento de la TC y la CRM para medir el VEC, se observó una correlación excelente entre los 2 métodos en poblaciones con estenosis aórtica o amiloidosis cardiaca24,34. Los valores de VEC normales en individuos sanos que los estudios de CRM han descrito son de alrededor de un 25%33. No existen datos sobre los valores de VEC determinados mediante TC en individuos sanos.
En comparación con la CRM, la TC no se ha estudiado tan ampliamente como método de cuantificación del VEC, y el presente estudio es el primero que se publica sobre el empleo de la TC para medir el VEC de los pacientes con MCH. La TC tiene menos resolución que la CRM y expone al paciente a radiación; en cambio, a diferencia de la CRM, su empleo es seguro para los pacientes portadores de DAI y otros dispositivos cardiacos implantados. La experiencia previa con la TC utilizada para cuantificar el VEC incluye la evaluación de la fibrosis difusa en pacientes con insuficiencia cardiaca35, estenosis aórtica24 o amiloidosis34. En estos 2 últimos estudios, la validación de la TC frente a la CRM mostró unos resultados comparables con ambas técnicas. La precisión de la TC en la determinación del VEC y su seguridad para los pacientes portadores de un DAI llevaron a utilizar este método para evaluar la fibrosis difusa en una población de pacientes de alto riesgo a los que ya se había implantado un DAI. Esto permitió estudiar la asociación entre la fibrosis difusa y el riesgo de arritmias en la mejor situación posible.
Utilidad del volumen extracelular para detectar el riesgo de arritmias ventriculares malignas en pacientes portadores de un desfibrilador automático implantableLa ausencia de toda asociación entre el VEC y las arritmias en este estudio tiene varias explicaciones posibles. La primera es que el aumento de la fibrosis en la MCH no incremente el riesgo de aparición de arritmias malignas. En esta interpretación, los resultados serían coherentes con los de estudios previos que no han mostrado una asociación significativa entre el realce tardío de gadolinio y el riesgo de arritmias13,31. En este estudio no se incluyó un grupo de participantes sanos sin MCH y, por consiguiente, no se puede confirmar que el VEC estuviera aumentado en la población de MCH; sin embargo, la media de VEC (31%) en la cohorte completa es similar a los valores descritos para los pacientes con MCH con la CRM, y es superior al valor observado en los grupos de control18,21,33,36,37, lo cual indica que había una fibrosis difusa significativa en la población de este estudio. La segunda posibilidad es que el VEC no sea un marcador exacto de la fibrosis miocárdica. En estudios previos se ha observado una correlación razonable entre el VEC y el contenido de colágeno en biopsias de miocardio23; sin embargo, el colágeno es solo uno de los componentes extracelulares, y el compartimento extracelular se ve afectado también por el edema (infarto agudo de miocardio), la infiltración inflamatoria y otros trastornos del miocardio38,39. Así pues, el aumento del VEC en los pacientes con MCH-DAI podría estar motivado no solo por la fibrosis difusa, sino también por estos otros componentes. Una tercera posibilidad es la clasificación de los participantes según sus antecedentes de arritmias ventriculares malignas; algunos pacientes con un VEC alto pero sin antecedentes de arritmias podrían sufrir arritmias en el futuro. Esta posible explicación de los resultados neutros se abordará en futuros estudios de seguimiento de la población de este estudio. La principal razón por la que se diseñó así el estudio es la incidencia relativamente baja de MSC en poblaciones de pacientes con MCH no seleccionadas5. Al seleccionar una población de MCH de alto riesgo, se intentó maximizar las posibilidades de identificar diferencias del VEC entre los pacientes con arritmias y sin eventos de arritmia ventricular maligna. Sin embargo, no se puede descartar la posibilidad de que la fibrosis aumente el riesgo de arritmia solo en una población con MCH no seleccionada y no en una de muy alto riesgo.
Más difícil de interpretar es la tendencia lineal significativa observada en cuanto a un mayor número de casos en el tercil inferior del VEC de la pared lateral. Este resultado va en contra de la hipótesis preespecificada de que un mayor VEC se asociaría con más arritmias en los pacientes. Tiene interés señalar que se observó que los casos tenían un cociente VEC del tabique/VEC de la pared lateral mayor que los controles (aunque sin alcanzar significación estadística). Una posible interpretación es que, puesto que todos los pacientes con MCH tienen un VEC aumentado en la pared del tabique, los que tienen altos valores de VEC en la pared lateral (y, por consiguiente, una menor asimetría del VEC en el ventrículo izquierdo) podrían presentar una reducción de la incidencia de arritmias ventriculares. Estos datos deben interpretarse con precaución, puesto que son simplemente generadores de hipótesis y puramente especulativos en este momento.
LimitacionesEste estudio utilizó un diseño retrospectivo, de casos y controles, por lo cual no se puede descartar la posibilidad de que algunos de los pacientes clasificados como controles sufran un evento arrítmico en un futuro próximo. A este respecto, se ha previsto realizar un seguimiento de los participantes incluidos en este estudio para documentar si alguno de los controles sufre un evento y evaluar el grado de VEC en tales pacientes. Aunque el tamaño de la muestra es pequeño, los resultados ponen claramente de manifiesto que la hipótesis planteada no era correcta y, por consiguiente, la posible falta de potencia estadística no tuvo influencia en los resultados observados. Dado que no era viable realizar estudios de CRM en esta población, no se dispuso de cálculos de la masa miocárdica total ni de realce tardío de gadolinio (la adquisición limitada en la TC por razones de seguridad impide también calcular la masa del ventrículo izquierdo). Por la misma razón, no se sabe cuántos pacientes tenían fibrosis macroscópica. Así pues, no se puede descartar la posibilidad de que algunas de las RdI incluyeran áreas de fibrosis macroscópica. Sin embargo, si fuera así, se prevé que la fibrosis macroscópica sería más pronunciada en los pacientes afectados por arritmias. En consecuencia, todo sesgo posible habría decantado los resultados hacia valores de VEC superiores en los casos y no en los controles, y no habría contribuido, por lo tanto, a los resultados negativos que se presentan aquí.
CONCLUSIONESEn las mediciones realizadas mediante TC en equilibrio, el VEC de los pacientes con MCH y arritmias ventriculares malignas documentadas no está aumentado en comparación con el de los pacientes con MCH pero sin arritmias ventriculares malignas. Serán necesarios estudios de seguimiento más largos para investigar el potencial del VEC de mejorar la predicción del riesgo de arritmias ventriculares malignas en los pacientes con MCH.
FINANCIACIÓNEste trabajo fue financiado por la RIC (Red de Investigación Cardiovascular) del Ministerio de Salud de España, programa de miocardiopatía familiar (RD 12/0042/0054 concedida a B. Ibáñez; RD 12/0042/066 a P. García-Pavía; RD 12/0042/0069 a T. Ripoll-Vera; RD12/0042/0036, RD06/0003/0009 a REDINSCOR [Red Española de Insuficiencia Cardiaca]). Este trabajo contó con el apoyo del Plan Estatal de I+D+I 2013-2016 – FEDER (Fondo Europeo de Desarrollo Regional) «A way of making Europe». Este estudio forma parte de un MRA (Master Research Agreement) entre el CNIC y Philips Healthcare. El CNIC cuenta con el apoyo del Ministerio de Economía y Competitividad de España y la Fundación Pro-CNIC y es un Centro de Excelencia Severo Ochoa (designación del MINECO SEV-2015-0505).
CONFLICTO DE INTERESESJ. Sánchez-González es empleado de Philips.
- –
La MSC sigue siendo un riesgo para la población con MCH. Los instrumentos existentes para cuantificar dicho riesgo son incompletos.
- –
La fibrosis miocárdica se asocia con un aumento del VEC miocárdico, que puede cuantificarse mediante resonancia magnética o TC.
- –
La relación entre el VEC y la MSC en la MCH no está bien establecida.
- –
La fibrosis difusa en la MCH, medida con el VEC en la TC, no está aumentada en los pacientes con MCH de alto riesgo que sufren eventos arrítmicos, en comparación con los pacientes con MCH de alto riesgo sin eventos arrítmicos.
- –
La participación de la fibrosis difusa en la aparición de arritmias ventriculares malignas en los pacientes con MCH requiere más estudios.
Damos las gracias a Noemí Escalera por la coordinación del estudio, a Ángel Macías y Braulio Pérez-Asenjo por la adquisición de las imágenes, y a Maite D. Rodríguez por el cuidado del bienestar de los pacientes durante el estudio. R. Fernández-Jiménez ha recibido una beca FICNIC de la Fundació Jesús Serra, la FIC (Fundación Interhospitalaria de Investigación Cardiovascular) y el CNIC.