Analizar el coste-efectividad del edoxabán frente al acenocumarol en la prevención del ictus y la embolia sistémica en pacientes con fibrilación auricular no valvular (FANV) en España.
MétodosModelo de Markov, adaptado a España desde la perspectiva del Sistema Nacional de Salud, que simula la evolución de una cohorte hipotética de pacientes con FANV a lo largo de toda su vida a partir de diferentes estados de salud: ictus, hemorragias y otras complicaciones cardiovasculares. Los datos de eficacia y seguridad se obtuvieron a partir de la evidencia clínica disponible (principalmente del estudio en fase III ENGAGE AF-TIMI 48). Los costes del tratamiento de la FANV y sus complicaciones se obtuvieron de fuentes españolas.
ResultadosEl edoxabán resultó en 0,34 años de vida ajustados por calidad (AVAC) adicionales en comparación con el acenocumarol. El coste incremental con el edoxabán fue de 3.916 euros, derivado principalmente de un mayor coste farmacológico, que se compensa parcialmente por los menores costes de la monitorización del tratamiento y del tratamiento de eventos y complicaciones de la FANV. Se obtuvo un coste por AVAC de 11.518 euros, dentro de los umbrales comúnmente considerados coste-efectivos en España (25.000-30.000 euros/AVAC). Los diferentes análisis de sensibilidad realizados confirmaron la robustez de los resultados.
ConclusionesEl edoxabán es una alternativa coste-efectiva frente al acenocumarol en la prevención del ictus y la embolia sistémica en pacientes con FANV en España.
Palabras clave
La fibrilación auricular (FA) es la arritmia más frecuente en los países occidentales, con una prevalencia estimada del 3%1. Su prevalencia aumenta con la edad (en España, el 4,4% son mayores de 40 años), es similar entre sexos y se incrementa escalonadamente a partir de los 60 años (el 17,7% de los mayores de 80 años)2. En España se estima en más de 1 millón los pacientes con FA, unos 90.000 sin diagnosticar2.
La FA es la primera causa de eventos embólicos, de los que el ictus es el más frecuente y grave. Se estima que los pacientes con FA tienen 5 veces más riesgo de tener un ictus3, y además con mayores grados de discapacidad, recurrencia y mortalidad que los pacientes sin FA4. La incidencia de ictus en los pacientes con FA no anticoagulados es de 3,1 casos/100 pacientes-año (0,3 en anticoagulados)4.
El ictus es la primera causa mundial de discapacidad del adulto, la segunda de demencia y la tercera de muerte (la primera entre los mayores de 75 años). Es una de las enfermedades con mayor coste socioeconómico5,6, principalmente por hospitalizaciones y cuidados informales7. Sin embargo, muchos eventos asociados con la FA podrían evitarse con tratamiento anticoagulante8.
La FA no valvular (FANV) se refiere a la FA que ocurre en ausencia de válvulas cardiacas protésicas mecánicas y en ausencia de estenosis mitral moderada a grave (generalmente de origen reumático)9. El tratamiento estándar para prevenir el ictus en estos pacientes son los anticoagulantes orales, tales como los antagonistas de la vitamina K (AVK) y los anticoagulantes orales de acción directa (ACOD)10. El AVK de referencia es la warfarina, aunque en España es más frecuente el uso de acenocumarol4. El control del cociente internacional normalizado (INR) y los eventos hemorrágicos y/o tromboembólicos es similar con warfarina o acenocumarol11. A pesar de su eficacia, los AVK presentan algunas desventajas inherentes que dificultan su tratamiento. Se requiere un control periódico del INR de los pacientes, dada su elevada variabilidad en la relación dosis-respuesta, que implica ajustes del tratamiento en busca de una dosis efectiva sin consecuencias graves (ictus o hemorragias)12. Un control del INR inadecuado medido mediante el método directo implica un tiempo en rango terapéutico inferior al 60%10 (un 40-54% de los pacientes en España)13. La incomodidad de las frecuentes monitorizaciones, así como el potencial riesgo de interacciones y hemorragias graves, ha llevado tradicionalmente a la infrautilización de los AVK en pacientes con FA14, cuyas reacciones adversas se han incrementado15. En España, la adherencia a los AVK es solo del 50%4, lo que se asocia con un mayor riesgo de ictus y hemorragias12.
Los ACOD dan respuesta eficaz y segura a la mayoría de las necesidades no cubiertas por los AVK16,17: amplia ventana terapéutica, respuesta anticoagulante predecible en ausencia de interferencias con alimentos y escasas interacciones con otros fármacos, y ofreciendo una anticoagulación constante sin necesidad de monitorizaciones periódicas ni ajustes de dosis repetitivos12.
El último ACOD autorizado en España para el tratamiento de la FANV es el edoxabán en su régimen de dosis alta, una sola toma de 60mg al día, con la posibilidad de reducción a 30mg para pacientes con insuficiencia renal moderada/grave (aclaramiento de creatinina 15-50 ml/min), peso corporal bajo (≤ 60 kg) o uso concomitante de ciertos inhibidores de la glucoproteína P (ciclosporina, dronedarona, eritromicina o ketoconazol). El edoxabán es un inhibidor oral, directo y selectivo del factor Xa, que en el ensayo clínico ENGAGE AF-TIMI 48 demostró que su régimen de dosis alta es al menos tan eficaz como la warfarina en la prevención de ictus o embolia sistémica, y reduce significativamente las tasas de hemorragia mayor respecto a la warfarina bien controlada18,19.
El objetivo de este análisis es evaluar el coste-efectividad del edoxabán en la prevención del ictus y la embolia sistémica en pacientes adultos con FANV y 1 o más factores de riesgo en España.
MÉTODOSSujetos del estudio y comparadoresLa población del análisis base reflejó las características de los pacientes del estudio ENGAGE AF-TIMI 4819, es decir, pacientes con FANV, riesgo moderado-alto de ictus (CHADS2 ≥ 2), un 62,29% varones y 71 años de media.
Asimismo, se comparó el edoxabán a régimen de dosis alta frente al tratamiento con AVK19. Debido a que el acenocumarol es el AVK más utilizado en España4, el análisis asumió similares eficacia y seguridad que con la warfarina.
Tipo de análisisSe estima el coste y la efectividad media por paciente asociados con cada alternativa terapéutica, se calcula la razón de coste-efectividad incremental del edoxabán frente a AVK y se muestra el coste adicional del edoxabán para obtener 1 año de vida ajustado por calidad (AVAC).
Se analiza desde la perspectiva del Sistema Nacional de Salud y se incluyen los costes directos médicos (euros de 2017). El horizonte temporal se extendió a toda la vida del paciente. Se aplicó una tasa de descuento anual del 3% tanto para costes como para efectos futuros20.
La adaptación al contexto español se hizo posible tras consultar con un grupo de expertos seleccionados por su experiencia y su conocimiento de la práctica clínica. Tras completar cuestionarios individuales, se planteó un caso base para su validación.
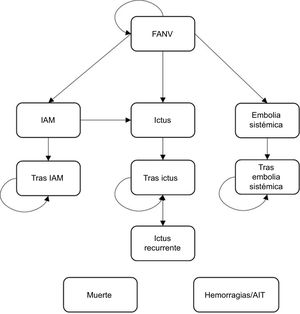
Modelo farmacoeconómicoSe usó el modelo de Markov que simula la evolución de los pacientes con FANV y riesgo moderado-alto de presentar un ictus a través de distintas situaciones clínicas (estados de salud) que conllevan una utilización de recursos y consecuencias clínicas específicas. La figura 1 muestra el esquema simplificado del modelo. La transición entre estados y sus consecuencias clínicas/económicas se evaluaron en ciclos mensuales. Los pacientes transitan entre estados (de más leves a más graves, según su evolución) con una probabilidad derivada de los resultados clínicos de los tratamientos.
Los pacientes inician el análisis en el estado de FANV estable y, cada ciclo, transitan entre estados de salud: ictus hemorrágico o isquémico (leve, moderado o grave), embolia sistémica e infarto agudo de miocardio. Estos eventos tienen asociados un impacto inicial (evento agudo) y a largo plazo (tras el evento).
Otros eventos (complicaciones) incluidos son: hemorragias (intracraneales, mayores no intracraneales y no mayores clínicamente relevantes) y accidentes isquémicos transitorios. Estos pueden ocurrir desde cualquier estado de salud.
Tras un primer ictus pueden ocurrir nuevos eventos (recurrencia), así como complicaciones, e interrumpir el tratamiento de modo permanente o temporal (cambiando el tratamiento).
El riesgo de morir depende de las características demográficas del paciente (edad/sexo) y el estado de salud en que se encuentre.
Datos clínicosLos datos clínicos del modelo se obtuvieron principalmente del estudio en fase III ENGAGE AF-TIMI 4819 o de evidencia científica disponible.
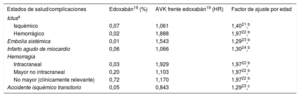
La tabla 1 muestra las probabilidades mensuales de transición. Se asumió que el riesgo de que ocurra un evento se incrementa con la edad.
Probabilidades mensuales de transición y factor de ajuste por edad
| Estados de salud/complicaciones | Edoxabán19 (%) | AVK frente edoxabán19 (HR) | Factor de ajuste por edad |
|---|---|---|---|
| Ictusa | |||
| Isquémico | 0,07 | 1,061 | 1,4021,b |
| Hemorrágico | 0,02 | 1,888 | 1,9722,b |
| Embolia sistémica | 0,01 | 1,543 | 1,2923,b |
| Infarto agudo de miocardio | 0,06 | 1,066 | 1,3024,b |
| Hemorragia | |||
| Intracraneal | 0,03 | 1,929 | 1,9722,b |
| Mayor no intracraneal | 0,20 | 1,103 | 1,9722,b |
| No mayor (clínicamente relevante) | 0,72 | 1,170 | 1,9722,b |
| Accidente isquémico transitorio | 0,05 | 0,843 | 1,2923,c |
AVK: antagonista de la vitamina K; HR: hazard ratio.
Tras tener un ictus, hay una probabilidad mensual de recurrencia del 0,25% para ictus isquémico y del 0,26% para ictus hemorrágico25. Tras infarto agudo de miocardio, la probabilidad mensual de presentar un ictus es del 0,44%25.
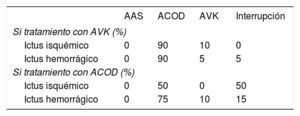
La interrupción de tratamiento tras un ictus y el cambio de tratamiento que conlleva se derivaron de la opinión de expertos (tabla 2).
Cambios de tratamiento por interrupción
| AAS | ACOD | AVK | Interrupción | |
|---|---|---|---|---|
| Si tratamiento con AVK (%) | ||||
| Ictus isquémico | 0 | 90 | 10 | 0 |
| Ictus hemorrágico | 0 | 90 | 5 | 5 |
| Si tratamiento con ACOD (%) | ||||
| Ictus isquémico | 0 | 50 | 0 | 50 |
| Ictus hemorrágico | 0 | 75 | 10 | 15 |
AAS: ácido acetilsalicílico; ACOD: anticoagulante oral de acción directa; AVK: antagonista de la vitamina K.
El análisis considera 3 tipos de mortalidad: mortalidad general26 (ajustada por el riesgo asociado con la FA; hazard ratio [HR] = 1,3427), mortalidad por evento agudo y riesgo adicional de fallecer por un evento previo (tabla 3)19,28-32.
Mortalidad asociada con la incidencia de un evento agudo y mortalidad asociada con los supervivientes a un evento agudo
| Mortalidad asociada con la incidencia de un evento agudo | ||
|---|---|---|
| Evento | Probabilidad (%) | Fuente |
| Ictus isquémico | ||
| Leve | 0,0 | Presunción |
| Moderado | 16,8 | Janes et al.28 |
| Grave | 16,8 | Janes et al.28 |
| Ictus hemorrágico | ||
| Leve | 0,0 | Presunción |
| Moderado | 31,6 | Janes et al.28 |
| Grave | 31,6 | Janes et al.28 |
| Embolia sistémica | 0,0 | Giugliano et al.19 |
| Infarto agudo de miocardio | 13,2 | Scarborough et al.29 |
| Hemorragia intracraneal | 31,6 | Janes et al.28 |
| Hemorragia mayor no intracraneal | 0,0 | Presunción |
| Hemorragia no mayor (clínicamente relevante) | 0,0 | Presunción |
| Accidente isquémico transitorio | 0,0 | Presunción |
| Mortalidad asociada con los supervivientes a un evento agudo | ||
|---|---|---|
| Evento previo | HR* | |
| Ictus isquémico/hemorrágico | ||
| Leve | 3,18 | Bronnum-Hansen et al.30 |
| Moderado | 5,84 | Henriksson et al.31 |
| Grave | 15,75 | Huybrechts et al.32 |
| Embolia sistémica | 5,45 | Giugliano et al.19 |
| Infarto agudo de miocardio | 3,36 | Bronnum-Hansen et al.30 |
HR: hazard ratio.
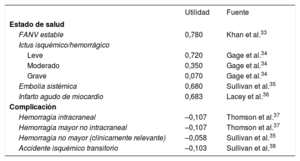
Los valores de utilidad se emplean para representar la calidad de vida asociada con un estado de salud concreto en una escala de 0 (muerte) a 1 (salud perfecta). Las utilidades de cada estado, así como la pérdida de utilidad asociada con complicaciones, se obtuvieron de la bibliografía (tabla 4)33-38.
Utilidades empleadas en el modelo
| Utilidad | Fuente | |
|---|---|---|
| Estado de salud | ||
| FANV estable | 0,780 | Khan et al.33 |
| Ictus isquémico/hemorrágico | ||
| Leve | 0,720 | Gage et al.34 |
| Moderado | 0,350 | Gage et al.34 |
| Grave | 0,070 | Gage et al.34 |
| Embolia sistémica | 0,680 | Sullivan et al.35 |
| Infarto agudo de miocardio | 0,683 | Lacey et al.36 |
| Complicación | ||
| Hemorragia intracraneal | –0,107 | Thomson et al.37 |
| Hemorragia mayor no intracraneal | –0,107 | Thomson et al.37 |
| Hemorragia no mayor (clínicamente relevante) | –0,058 | Sullivan et al.35 |
| Accidente isquémico transitorio | –0,103 | Sullivan et al.38 |
FANV: fibrilación auricular no valvular.
Los pacientes tratados con AVK, aunque estables, muestran cierto grado de ansiedad por estar en rango terapéutico de INR, además de interacciones con otros medicamentos o alimentos; de ahí que sea posible una ligera pérdida de calidad de vida39. Para el caso base, se consideró una pérdida de utilidad de 0,012 en estos pacientes40.
Uso de recursos y costesLos costes médicos directos considerados fueron: farmacológico, monitorización del tratamiento con AVK y tratamiento asociado con cada evento.
El coste farmacológico diario se estimó considerando la pauta terapéutica y el precio de venta al público41 y aplicándole la deducción correspondiente42. En estos términos, el coste diario del edoxabán (60 mg) y el acenocumarol (2,75 mg/día) es de 2,58 y 0,07 euros respectivamente.
El tratamiento con AVK requiere una monitorización regular del INR (14 monitorizaciones anuales43) y posibles ajustes de dosis. Según la opinión de expertos, se lleva a cabo un 50% en el hospital y un 50% de forma ambulatoria. El coste estimado de cada monitorización hospitalaria es 20,15 euros y el de la ambulatoria, 30,89 euros44. Así, el coste anual por monitorización estimado es de 357,28 euros.
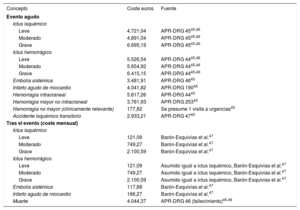
Los costes por tipo de evento se estimaron a partir de bibliografía relacionada y la opinión de expertos (tabla 5).
Costes asociados con los estados de salud del modelo
| Concepto | Coste euros | Fuente |
|---|---|---|
| Evento agudo | ||
| Ictus isquémico | ||
| Leve | 4.721,04 | APR-DRG 4545,46 |
| Moderado | 4.891,04 | APR-DRG 4545,46 |
| Grave | 6.695,19 | APR-DRG 4545,46 |
| Ictus hemorrágico | ||
| Leve | 5.526,54 | APR-DRG 4445,46 |
| Moderado | 5.654,92 | APR-DRG 4445,46 |
| Grave | 6.415,15 | APR-DRG 4445,46 |
| Embolia sistémica | 3.481,91 | APR-DRG 4645 |
| Infarto agudo de miocardio | 4.041,82 | APR-DRG 19045 |
| Hemorragia intracraneal | 5.817,26 | APR-DRG 4445 |
| Hemorragia mayor no intracraneal | 3.761,93 | APR-DRG 25345 |
| Hemorragia no mayor (clínicamente relevante) | 177,82 | Se presume 1 visita a urgencias45 |
| Accidente isquémico transitorio | 2.933,21 | APR-DRG 4745 |
| Tras el evento (coste mensual) | ||
| Ictus isquémico | ||
| Leve | 121,09 | Barón-Esquivias et al.47 |
| Moderado | 749,27 | Barón-Esquivias et al.47 |
| Grave | 2.100,59 | Barón-Esquivias et al.47 |
| Ictus hemorrágico | ||
| Leve | 121,09 | Asumido igual a ictus isquémico, Barón-Esquivias et al.47 |
| Moderado | 749,27 | Asumido igual a ictus isquémico, Barón-Esquivias et al.47 |
| Grave | 2.100,59 | Asumido igual a ictus isquémico, Barón-Esquivias et al.47 |
| Embolia sistémica | 117,88 | Barón-Esquivias et al.47 |
| Infarto agudo de miocardio | 166,27 | Barón-Esquivias et al.47 |
| Muerte | 4.044,37 | APR-DRG 46 (fallecimiento)45,46 |
APR-DRG: All Patient Refined-Diagnosis-Related Group.
Para valorar la influencia de la incertidumbre de los parámetros en los resultados, se llevó a cabo un análisis de sensibilidad probabilístico mediante la técnica de simulación de Monte-Carlo de segundo orden (cohorte hipotética de 1.000 pacientes)20. Los principales parámetros del análisis base son variados simultáneamente y se les asigna una distribución específica: distribución normal para la edad de inicio; distribución Dirichlet para la distribución de la gravedad del ictus; distribución beta para la mortalidad por evento agudo, las utilidades, la probabilidad de eventos y recurrencias; distribución log normal para las HR, la mortalidad tras el evento, el factor de ajuste sobre la mortalidad general y el ajuste de riesgo por década; y distribución gamma para los costes.
Los resultados del análisis se expresaron mediante un plano de coste-efectividad, donde cada punto corresponde a una simulación según los parámetros y distribuciones estipulados, así como mediante la curva de aceptabilidad.
Además se llevaron a cabo otros análisis de sensibilidad por escenarios:
- •
Dada la variabilidad regional en cuanto al lugar de monitorización, se consideró un escenario donde el 20% de las monitorizaciones son ambulatorias y el 80%, hospitalarias, y otro escenario a la inversa.
- •
El coste anual de la monitorización del INR puede estar sobrestimado, dada la antigüedad de las fuentes. Por ello, se consideró un tercio del coste anual base (119,09 euros).
- •
Subgrupo de pacientes con CHADS2 ≥ 348.
- •
Subgrupo de pacientes con un tiempo en rango terapéutico ≥ 60%48.
- •
No considerar una pérdida de utilidad en pacientes tratados con AVK.
El horizonte temporal del análisis y, por ende, la duración de tratamiento son un factor relevante para evaluar su eficiencia. Por ello se evaluaron diferentes horizontes temporales tanto sobre el caso base como en los subgrupos de CHADS2 ≥ 3 y tiempo en rango terapéutico ≥ 60%.
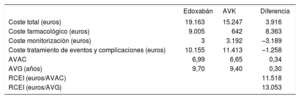
RESULTADOSResultados del caso baseLos resultados del análisis mostraron una mayor efectividad del edoxabán (0,34 AVAC y 0,30 AVG respecto a AVK), derivada de las menores incidencias de ictus y hemorragia (intracraneales y extracraneales), embolia sistémica e infarto agudo de miocardio (tabla 6).
Resultados del caso base
| Edoxabán | AVK | Diferencia | |
|---|---|---|---|
| Coste total (euros) | 19.163 | 15.247 | 3.916 |
| Coste farmacológico (euros) | 9.005 | 642 | 8.363 |
| Coste monitorización (euros) | 3 | 3.192 | –3.189 |
| Coste tratamiento de eventos y complicaciones (euros) | 10.155 | 11.413 | –1.258 |
| AVAC | 6,99 | 6,65 | 0,34 |
| AVG (años) | 9,70 | 9,40 | 0,30 |
| RCEI (euros/AVAC) | 11.518 | ||
| RCEI (euros/AVG) | 13.053 |
AVAC: años de vida ajustados por calidad; AVG: años de vida ganados; AVK: antagonista de la vitamina K; RCEI: razón de coste-efectividad incremental.
El edoxabán resultó en un coste adicional de 3.916 euros, derivado principalmente de su mayor coste farmacológico, parcialmente compensado por los menores costes de la monitorización y del tratamiento de eventos y complicaciones como consecuencia de su menor incidencia (tabla 6). El análisis de coste-efectividad incremental mostró un coste adicional por AVAC ganado con el edoxabán respecto al AVK de 11.518 euros, por debajo del umbral comúnmente aceptado como eficiente (25.000-30.000 euros/AVAC)49,50.
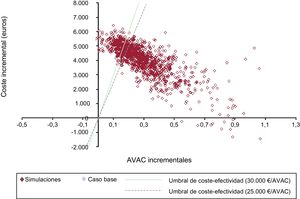
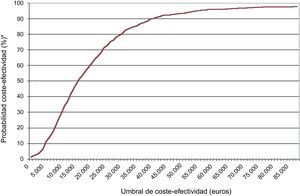
Resultados del análisis de sensibilidadLos resultados del análisis de sensibilidad probabilístico, representados mediante el plano de coste-efectividad (figura 2) y la curva de aceptabilidad (figura 3), mostraron que, en un 73-81% de las simulaciones, el edoxabán resultó coste-efectivo.
Para los demás escenarios analizados, los resultados mostraron el edoxabán como coste-efectivo (tabla 7).
Análisis de escenarios
| Escenario | Coste por AVAC (euros) |
|---|---|
| Lugar de monitorización (80% hospital, 20% ambulatorio) | 12.700 |
| Lugar de monitorización (20% hospital, 80% ambulatorio) | 10.332 |
| Menor coste anual de monitorización del tratamiento con AVK | 17.892 |
| Subgrupo de pacientes con CHADS2 ≥ 3 | 8.127 |
| Subgrupo de pacientes con TRT ≥ 60% | 16.170 |
| Sin pérdida de utilidad para pacientes tratados con AVK | 17.026 |
AVAC: años de vida ajustados por calidad; AVK: antagonistas de la vitamina K; CHADS2: insuficiencia cardiaca, hipertensión, edad, diabetes, ictus [doble]; TRT: tiempo en rango terapéutico.
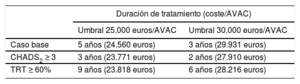
La tabla 8 muestra que el edoxabán es coste-efectivo tras 3-5 años de tratamiento (2-3 años para los pacientes con CHADS2 ≥ 3 y 6-9 años para los pacientes con tiempo en rango terapéutico ≥ 60%).
Duración mínima del tratamiento para que el edoxabán sea coste-efectivo frente a los antagonistas de la vitamina K
| Duración de tratamiento (coste/AVAC) | ||
|---|---|---|
| Umbral 25.000 euros/AVAC | Umbral 30.000 euros/AVAC | |
| Caso base | 5 años (24.560 euros) | 3 años (29.931 euros) |
| CHADS2 ≥ 3 | 3 años (23.771 euros) | 2 años (27.910 euros) |
| TRT ≥ 60% | 9 años (23.818 euros) | 6 años (28.216 euros) |
AVAC: años de vida ajustados por calidad; TRT: tiempo en rango terapéutico.
Pese a la eficacia de los AVK en la prevención de eventos tromboembólicos en pacientes con FANV, la frecuente monitorización del INR y los ajustes de dosis conllevan un riesgo sustancial ante un mal control de la anticoagulación, así como inconvenientes que pueden explicar su infrautilización y su baja adherencia17,51.
El presente análisis mostró que, comparado con los AVK, el edoxabán es coste-efectivo en España para la prevención del ictus en pacientes con FANV y características del estudio ENGAGE AF-TIMI 48.
Este es el primer análisis de coste-efectividad del edoxabán frente a AVK realizado en España, y los resultados obtenidos están en línea con los obtenidos en otros países52–58.
LimitacionesCabe mencionar que el presente análisis se basó en un modelo matemático que pretende ser una representación de la realidad. Para ello fue necesaria la extrapolación a largo plazo de datos obtenidos durante 2,8 años en el ensayo clínico ENGAGE AF-TIMI 4819, asumiéndose que la eficacia y la seguridad del edoxabán se mantienen constantes. Esta es una limitación inherente a este tipo de estudios, en los que se necesitan los efectos terapéuticos a largo plazo, mientras que la evidencia clínica disponible es a corto plazo y se basa principalmente en estudios de fase III. Disponer de información de estudios de fase IV respaldaría con mayor validez externa a este tipo de análisis. Un ejemplo de ello es el valor medio de la escala CHADS2, que en la práctica clínica es menor (2,3)59 que en el ensayo clínico ENGAGE AF-TIMI 48 (2,8).
La validez externa puede estar limitada también, ya que actualmente se emplea la escala CHAD2S2-VASc para medir el riesgo tromboembólico1. Sin embargo, el diseño del estudio ENGAGE AF-TIMI 48 se realizó considerando la escala CHADS2 porque era la habitual entonces.
La variabilidad de los datos, así como las presunciones realizadas en ausencia de estos, también representan una limitación. Sin embargo, la necesidad de modelizar los parámetros del análisis a partir de diversas fuentes es inherente a la naturaleza de las enfermedades crónicas60. En particular, el uso de utilidades de publicaciones internacionales es una limitación común ante la falta de datos nacionales, aunque estas se emplean por igual para ambos comparadores y su relevancia en el análisis es su relación incremental. Además, su variabilidad y su influencia se consideraron en el análisis de sensibilidad probabilístico.
La evidencia disponible no permitió realizar un análisis por subgrupos de edad pese a su potencial influencia. Sin embargo, el efecto del edoxabán frente a la warfarina parece mantenerse independientemente de la edad en cuanto a eficacia y seguridad61.
Una de las principales presunciones del modelo, la equivalencia terapéutica de la warfarina y el acenocumarol, es coherente con otros estudios económicos españoles, que los consideran equivalentes en términos de eficacia, seguridad y uso de recursos asociados47,62,63.
Pese a que en otros análisis de coste-efectividad en España se ha considerado o no la pérdida de utilidad asociada con el tratamiento con un AVK de manera dispar47,62,63, no considerarla en el análisis no afectó a las conclusiones.
Cabe mencionar que la eficiencia del edoxabán en el presente análisis puede estar subestimada, ya que en la práctica clínica la prevención del ictus en muchos pacientes con FANV se trata con ácido acetilsalicílico o no se trata64. Asimismo, considerar otro tipo de costes (sanitarios no directos o la pérdida de productividad) asociados a largo plazo con la discapacidad por ictus reforzaría la eficiencia del edoxabán.
La eficiencia del edoxabán respecto al tratamiento con un AVK disminuye a medida que aumenta la calidad de la anticoagulación57, por lo que su uso es especialmente eficiente en pacientes mal controlados con AVK (tiempo en rango terapéutico < 60%), en línea con las recomendaciones actuales10.
Ante la ausencia de ensayos comparativos directos entre ACOD en pacientes con FANV, es necesario confirmar en la práctica real las diferencias observadas de manera indirecta en metanálisis en red51. Consecuentemente, hoy no se dispone de datos fiables que permitan optimizar el uso de unos ACOD frente a otros65, aunque su eficacia y su seguridad en comparación con AVK parece demostrada17. Estudios de fase IV permitirían evaluar la sostenibilidad de la adopción extensiva de los ACOD en países industrializados.
CONCLUSIONESEn la última década, los ACOD se han incorporado a la prevención del ictus y la embolia sistémica en pacientes con FANV para superar las limitaciones de los AVK. En el tratamiento de la FANV, el edoxabán es una alternativa terapéutica tan eficaz como los AVK y más segura, y a pesar de su mayor coste farmacológico, resulta una alternativa coste-efectiva para el Sistema Nacional de Salud en España.
FINANCIACIÓNEstudio financiado por Daiichi Sankyo.
CONFLICTO DE INTERESESJ.M. Rodríguez y P. Barja de Soroa son empleados de Daiichi Sankyo. F. Pérez-Alcántara es miembro de Oblikue, consultora independiente que recibió fondos para llevar a cabo el análisis. I. Lekuona, M. Anguita y J.L. Zamorano recibieron honorarios de Daiichi Sankyo por su colaboración como asesores.
- –
Los ACOD son una alternativa a los AVK en el tratamiento para prevenir el ictus en pacientes con FANV.
- –
Los ACOD se han demostrado al menos tan eficaces y seguros como los AVK, pero con mayor comodidad de uso, fundamentalmente porque no es necesario monitorizar, y menos interacciones medicamentosas y alimentarias.
- –
Pese a dichas ventajas, los ACOD se usan menos que los AVK, y se argumenta en ocasiones la barrera de la diferencia de coste entre ambas alternativas.
- –
El edoxabán es el último ACOD autorizado en España para el tratamiento de la FANV.
- –
Este es el primer análisis de coste-efectividad del edoxabán frente a un AVK para el tratamiento de la FANV en el contexto español.
- –
El edoxabán se muestra como una opción coste-efectiva frente a los AVK para la FANV.