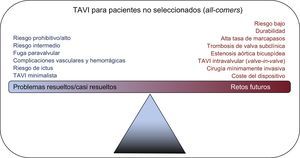
El implante percutáneo de válvula aórtica (TAVI) ha progresado rápidamente gracias al enfoque basado en el equipo multidisciplinario (heart team) para pacientes valvulares y el compromiso riguroso con la medicina basada en la evidencia. Los rápidos avances de la tecnología han impulsado el desarrollo del TAVI hasta situarlo en la vanguardia de las opciones de tratamiento. La progresión del TAVI ha hecho que pase de ser una intervención realizada en quirófanos híbridos y con anestesia general a otra que se lleva a cabo en el laboratorio de cateterismo y sin anestesia, con lo que se reduce la estancia hospitalaria y en algunos casos puede darse de alta al paciente el «mismo día». Las indicaciones para el TAVI se han ampliado con el respaldo de evidencia firme. Actualmente el TAVI está indicado para pacientes con riesgo quirúrgico prohibitivo, alto o intermedio. Sin embargo, en un futuro próximo, ¿llegará a ser el tratamiento de elección para todos los pacientes? Para responder a esta pregunta, hay que valorar algunos de los problemas ya resueltos y centrarse en los retos futuros (figura 1) que podrían hacer de esta tecnología una opción única en el tratamiento de la estenosis aórtica (EA).
TAVI para pacientes no seleccionados. La figura muestra los problemas actualmente resueltos/casi resueltos y los retos futuros que será preciso resolver en el TAVI para que pase a ser el tratamiento de elección para la estenosis aórtica grave. TAVI: implante percutáneo de válvula aórtica.
En el estudio publicado en 2010, se demostró que el TAVI era superior al tratamiento médico en los pacientes con EA grave inoperables a causa de un riesgo quirúrgico prohibitivo1. Posteriormente, múltiples ensayos controlados, aleatorizados y realizados de manera rigurosa demostraron que el TAVI no era inferior al reemplazo quirúrgico de válvula aórtica (SAVR) en pacientes de riesgo quirúrgico alto o intermedio2–5. Además, en un estudio observacional analizado con emparejamiento por puntuación de propensión, en el que se comparó la válvula para TAVI de tercera generación SAPIEN 3 (Edwards Lifesciences; Irvine, California, Estados Unidos) con el grupo de tratamiento quirúrgico del ensayo PARTNER 2A en pacientes de riesgo intermedio, se observó que el TAVI era superior al SAVR respecto a la reducción de la variable combinada de mortalidad, ictus y fuga perivalvular (FPV) moderada o grave6. Este estudio fue el fundamento para el uso de TAVI en pacientes con una EA grave y riesgo quirúrgico prohibitivo, alto o intermedio. Desde entonces, las guías han respaldado el TAVI como tratamiento de elección para los pacientes con riesgo prohibitivo y como alternativa a la cirugía para aquellos con riesgo alto o intermedio.
Fuga perivalvularSe ha observado que la FPV después del TAVI se asocia con una peor evolución en cuanto a eventos cardiovasculares a largo plazo2. La calcificación del anillo y el despliegue insuficiente son motivos de la aparición de FPV descritos con frecuencia. La tasa de FPV es inferior con el SAVR, puesto que el cirujano dispone de visualización directa y mejor control para prevenir la FPV. Sin embargo, la FPV después de la cirugía sigue estando infradetectada2,4. La tasa de FPV moderada o grave con las válvulas de TAVI de primera y de segunda generación (tanto SAPIEN como CoreValve) fue alta, de un 9-12%. La válvula de tercera generación SAPIEN 3, que tiene un «faldón» alrededor del segmento de entrada de la válvula, redujo la FPV a una tasa de solo el 1,5%1,2,4–6. La válvula de tercera generación CoreValve (Evolut PRO, Medtronic plc; Dublín, Irlanda), dotada también de un faldón alrededor del segmento de entrada, parece prometedora para reducir la FPV. Se ha demostrado que la nueva válvula Lotus con expansión mecánica (Boston Scientific; Malborough, Massachusetts, Estados Unidos) tiene una incidencia muy baja de FPV moderada o grave a 1 año (ensayo REPRISE III, presentado en EuroPCR 2017, París, Francia). La frecuencia de la FPV moderada o grave con las válvulas de nueva generación es significativamente inferior y seguirá mejorando.
Complicaciones vasculares y hemorrágicas gravesLos dispositivos de TAVI de generaciones anteriores tenían unos sistemas de aplicación mucho más grandes, con un tamaño de la vaina de hasta 26 Fr. Los sistemas de aplicación actuales se han reducido hasta un calibre de 14 Fr, y los nuevos dispositivos que van a aparecer lo han reducido aún más, hasta los 10 Fr. Indudablemente, esta mejora técnica explica la reducción significativa de las complicaciones vasculares (el 1,2% en la base de datos del registro de la Society of Thoracic Surgeons y el American College of Cardiology Transcatheter Valve Therapy de 2016) y la poca necesidad de utilizar una vía de acceso alternativa (< 10%)7. Además, el uso sistemático de un análisis cuidadoso mediante angiografía por tomografía computarizada, el acceso con guía ecográfica, la técnica de micropunción, combinada con el uso de dispositivos de cierre vascular y la eliminación de la disección quirúrgica de la vía de acceso han hecho que el acceso de un calibre grande y el cierre del TAVI sean extraordinariamente seguros. Las complicaciones hemorrágicas con peligro para la vida son muchas menos que con la cirugía y apenas son el 2,4%7. A medida que los sistemas de aplicación se vayan haciendo cada vez más finos y más flexibles, cabe predecir una mayor reducción de las complicaciones vasculares y hemorrágicas.
Riesgo de ictusEn los ensayos de TAVI iniciales, se evidenció un aumento al doble de los ictus en comparación con la cirugía convencional, pero con las válvulas de nueva generación, la tasa de ictus con el TAVI fue similar o inferior a la observada en la cirugía (el 2,7 frente al 6,1%)4,5. El menor perfil de las válvulas de nueva generación y evitar la predilatación pueden haber facilitado la reducción de la incidencia de ictus. Aunque se estudiaron dispositivos de protección cerebral (p. ej., el dispositivo SENTINEL, Claret Medical, Inc.), su uso sistemático no redujo de manera significativa las lesiones de nueva aparición en la resonancia magnética ni el ictus no invalidante a los 30 días8. Está por ver todavía si tendrán algún papel en los subgrupos de pacientes de alto riesgo.
TAVI minimalistaEl abordaje de la intervención de TAVI de una manera más simplificada desde el momento de la intervención hasta el alta con «FastTrack» aporta efectos beneficiosos adicionales9. Fundamentalmente, mejora la satisfacción del paciente, reduce la duración de la hospitalización y el uso de recursos y el coste. El TAVI minimalista, que se realiza sin anestesia general ni ecocardiografía transesofágica con la finalidad de movilizar y dar de alta al paciente poco después de la intervención, constituye un argumento económico potente a favor del TAVI frente a la cirugía. En un estudio unicéntrico, el coste del TAVI minimalista fue unos 10.000 dólares menor que el del TAVI estándar, con una eficacia equivalente10.
RETOS FUTUROSPacientes con bajo riesgoSe prevé que los resultados del TAVI sean igual de buenos que los de la cirugía en pacientes con bajo riesgo, como mínimo a corto plazo. En el ensayo NOTION, en el que se incluyó a 280 pacientes de 3 centros nórdicos en la aleatorización de pacientes con bajo riesgo (puntuación de la Society of Thoracic Surgeons Predicted Risk of Mortality, 3,0 ± 1,7) a TAVI o cirugía, el objetivo principal combinado de mortalidad por cualquier causa, infarto de miocardio o ictus a 1 año con TAVI fue similar que con cirugía (el 13,1 frente al 16,3%; p = 0,43)11. Barker et al.12 predicen que es muy probable que, en los ensayos en curso que están estudiando a pacientes con bajo riesgo, el TAVI alcance un margen de no inferioridad comparado con la cirugía. Estos autores basan su argumentación en el examen de las tendencias de mortalidad a corto y a largo plazo de los ensayos previos en pacientes con riesgo alto e intermedio. En el ensayo de pacientes con riesgo alto con CoreValve, tras tener similares riesgos basales de la intervención con cirugía y TAVI, la cirugía se asoció con mayor mortalidad que con TAVI al cabo de entre 1 y 4 meses, tras lo cual el TAVI tuvo unos resultados similares a los de la cirugía. No obstante, en el ensayo SURTAVI en pacientes con riesgo intermedio, tras el riesgo inicial de la intervención, el TAVI no fue inferior a la cirugía, lo cual indica que los pacientes con riesgo alto tienen un riesgo de mortalidad inherente mucho después de la intervención4. Al examinar la cronología de los eventos cardiovasculares, Barker et al. predijeron que, en los ensayos de pacientes con riesgo bajo, el riesgo de mortalidad disminuirá en paralelo y el TAVI será no inferior a la cirugía. En el ensayo actualmente en curso PARTNER 3 (NCT02675114) y en el ensayo con CoreValve en pacientes con riesgo bajo (NCT02701283), se obtendrá una perspectiva muy necesaria respecto a los pacientes en bajo riesgo.
Alta tasa de marcapasosLas tasas de implante de marcapasos permanentes (MPP) después de TAVI continúan siendo altas, con valores de un 10% con la SAPIEN 3, un 16% con la Evolut R y un 26% con las válvulas Lotus. Los trastornos de la conducción preexistentes, la calcificación, el tamaño excesivo de la válvula y ciertas características de la intervención, como la profundidad de implantación y el uso de predilatación, aumentan el riesgo de que sea necesario el implante de un MPP. Algunas de estas causas pueden prevenirse prestando atención a diversos aspectos de la intervención. Además, los avances técnicos continuarán reduciendo la tasa de MPP. Por ejemplo, la válvula Lotus de nueva generación tiene una protección de profundidad que impide que el dispositivo llegue al tracto de salida del ventrículo izquierdo, con lo que se reduce el riesgo de MPP. Es crucial evitar el implante de MPP, ya que se asocia a un aumento de la duración de la hospitalización, mayor coste, riesgo a largo plazo de infección de dispositivo, fallos del electrodo y posiblemente mortalidad. Para que el TAVI pueda competir con la cirugía, la tasa de implantes de MPP debe ser al menos no mayor que la registrada en los procedimientos quirúrgicos convencionales.
Trombosis de valvaLa trombosis subclínica de valva, que puede detectarse en la tomografía computarizada de alta resolución, se produce tanto en las válvulas quirúrgicas como en el TAVI13. En los registros, la incidencia de la trombosis subclínica de valva fue mayor en las válvulas de TAVI (13%) que en las quirúrgicas (4%)14. Aunque no hubo diferencias en la tasa de ictus entre los pacientes con y sin trombosis subclínica de valva, sí se observó un aumento de la incidencia de accidentes isquémicos transitorios (4,18/100 frente a 0,6/100 años-persona; p = 0,0005) en los pacientes con trombosis de valva14. Se ha demostrado que la anticoagulación mejora la hemodinámica valvular y los resultados clínicos, pero no está clara la ventaja del uso sistemático de anticoagulación tras el TAVI para prevenir la trombosis de valva. Aunque no hay evidencia clara que indique un aumento de la frecuencia de eventos tromboembólicos, la simple evidencia de formación de un trombo en las valvas puede ser un factor importante para la degeneración temprana de la prótesis valvular. Se están realizando nuevos estudios para establecer los patrones de referencia para el diagnóstico y el tratamiento de la trombosis de valva (ENVISAGE-TAVI-AF, NCT02943785).
Ampliación de las indicaciones de TAVI: EA con válvula bicúspide y EA asintomáticaLa EA con válvula bicúspide se observa con frecuencia en pacientes tratados con cirugía, y generalmente se manifiesta a una edad más temprana que la de la EA con válvula tricúspide. La EA en la válvula bicúspide plantea dificultades técnicas para el TAVI, en especial en los pacientes con una aortopatía concomitante, y causa problemas respecto al tamaño o la colocación de la válvula. Aunque no hay ensayos controlados y aleatorizados, en un estudio con emparejamiento por puntuación de propensión en el que se comparó la EA bicuspídea con la tricuspídea tratadas con TAVI, los dispositivos de TAVI de nueva generación no mostraron diferencias durante la intervención y se asociaron con similar pronóstico15. Actualmente el TAVI no está indicado para los pacientes con EA grave asintomática. El ensayo EARLY TAVR (NCT03042104), que compara el TAVI con la vigilancia clínica en la EA asintomática, ha iniciado el registro de pacientes. Es de destacar que el ensayo UNLOAD (NCT02661451), de comparación de TAVI frente al tratamiento óptimo de la insuficiencia cardiaca en pacientes con EA moderada y fracción de eyección del ventrículo izquierdo < 50%, constituye un nuevo avance en el conocimiento de la posibilidad de ampliar la aplicación del TAVI.
DurabilidadLa durabilidad de las válvulas para TAVI sigue siendo una cuestión clave en el tratamiento con TAVI. Sin duda alguna, a medida que mejore la tecnología, mejorará también la durabilidad. Sin embargo, con la extensión de las indicaciones de TAVI a pacientes más jóvenes, la durabilidad de las válvulas para TAVI pasará a ser una cuestión extraordinariamente relevante. En el ensayo PARTNER I16, el funcionamiento de la válvula y la hemodinámica cardiaca a los 5 años fueron comparables a las de la cirugía con las válvulas SAPIEN. De igual manera, la experiencia a 5 años con el sistema CoreValve mostró una incidencia de degeneración de la válvula protésica del 1,4%17. En general se acepta que las válvulas de TAVI debieran durar lo mismo que las bioprótesis quirúrgicas, pero solo el tiempo lo dirá18. Además, si se puede aplicar de manera segura y efectiva el TAVI intravalvular (valve-in-valve [ViV]), probablemente el problema de la durabilidad quede mitigado. Aunque hay evidencia a corto plazo de que el TAVI ViV tiene un rendimiento igual de bueno que la reintervención quirúrgica, no se dispone de datos de resultados a largo plazo19. Los retos actuales con el TAVI ViV son los gradientes elevados tras la intervención, la obstrucción coronaria, la mala colocación, la durabilidad del ViV y la mayor tasa de trombosis de valva.
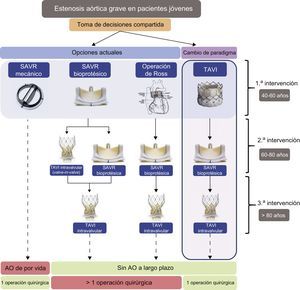
INTERVENCIÓN AÓRTICA EN PACIENTES CON EA JÓVENESAdemás de la falta de evidencia que respalde el uso de TAVI en pacientes con riesgo bajo, las principales inquietudes que suscita su uso en pacientes jóvenes son la «durabilidad» y la «sustituibilidad» de las válvulas aórticas. El tratamiento a largo plazo de la EA grave en pacientes más jóvenes requeriría un cambio de paradigma para pasar del modelo actual, basado en el riesgo quirúrgico, a un nuevo algoritmo basado en la edad o las opciones terapéuticas (figura 2). El objetivo es evitar la anticoagulación a largo plazo y más de una intervención a corazón abierto durante la vida del paciente. Para los pacientes con EA grave de entre 40 y 60 años, habría diversas opciones para la elección de la válvula, que en todo caso debe basarse en una toma de decisiones compartida. Por ejemplo, para un paciente de 50 años con EA grave, habría 2 o 3 opciones. Las opciones actuales incluyen las siguientes: a) una intervención quirúrgica con implante de una válvula aórtica mecánica que dure toda la vida del paciente, pero con el inconveniente de que se requiere anticoagulación de por vida; b) una intervención quirúrgica con una prótesis aórtica biológica, pero teniendo en cuenta que cuando la válvula sufra degeneración se necesitará un TAVI ViV o una reintervención quirúrgica como posibles opciones posteriores, y c) una operación de Ross (uso de la válvula pulmonar autóloga para reemplazar la válvula aórtica enferma) como opción conocida viable a largo plazo para adultos con EA grave, pero considerando que los fallos del homoinjerto y la disfunción del autoinjerto constituyen impedimentos importantes20. Aunque el inconveniente de la primera opción es la necesidad de anticoagulación oral de por vida, las otras 2 pueden requerir más de una intervención quirúrgica con circulación extracorpórea. Nosotros proponemos un cambio de paradigma dentro de una toma de decisiones compartida, introduciendo el TAVI como primera opción para los pacientes más jóvenes. En este caso, el TAVI puede durar aproximadamente 10 años hasta que el paciente tenga entre 60 y 80, y entonces se le podría practicar una intervención quirúrgica convencional con implante de una prótesis aórtica biológica. Si posteriormente se produce una disfunción de la bioprótesis cuando el paciente tiene más de 80 años, puede realizarse un TAVI ViV, con lo que se elimina la necesidad de la anticoagulación a largo plazo. La ventaja está en que, con una sola intervención quirúrgica con circulación extracorpórea, la EA de los pacientes jóvenes puede tratarse sin necesidad de anticoagulación a largo plazo.
Algoritmo propuesto para la elección de la intervención inicial y las posteriores de los pacientes con estenosis aórtica grave más jóvenes. Los pacientes que opten por una válvula aórtica mecánica necesitarían anticoagulación a largo plazo. Para quienes deseen evitar la anticoagulación a largo plazo, el empleo inicial de cirugía bioprotésica o una operación de Ross son opciones viables. Un cambio de paradigma que lleve a la elección del TAVI como opción inicial tiene la ventaja de que evita la anticoagulación a largo plazo con una sola intervención quirúrgica a corazón abierto en toda la vida del paciente. AO: anticoagulantes orales; SAVR: reemplazo quirúrgico de válvula aórtica; TAVI: implante percutáneo de la válvula aórtica.
Parece que el TAVI puede llegar a ser un tratamiento, si no para todos los pacientes, para la mayoría de los que tienen una EA grave. Los avances tecnológicos en los dispositivos de TAVI, la mejora significativa de los resultados y, lo que tal vez es aún más importante, la preferencia del paciente por tratamientos menos invasivos harán del TAVI el tratamiento preferido para los pacientes con EA grave. Sin embargo, continuará habiendo cierto subgrupo de pacientes para quienes la cirugía convencional sería la opción preferida, como los que requieren un agrandamiento de la raíz aórtica, los pacientes jóvenes que prefieran prótesis mecánicas y la concomitancia de una enfermedad coronaria significativa u otras valvulopatías cardiacas. Los avances de la cirugía mínimamente invasiva han reducido significativamente el tiempo de bypass cardiopulmonar y la estancia hospitalaria. Aún queda por ver si la cirugía mínimamente invasiva con una válvula aórtica sin puntos de sutura aporta ventajas respecto al TAVI.
El elevado coste actual del tratamiento con TAVI tiene enormes consecuencias para que esta opción se propague. Sin embargo, en pacientes adecuadamente seleccionados a los que se practica un TAVI minimalista con hospitalización breve, los costes médicos son menores y es posible que este tratamiento sea incluso coste-efectivo en comparación con la cirugía21. Serán necesarios más estudios para determinar las repercusiones económicas a largo plazo de esta técnica. Como ocurre con cualquier nueva técnica, es probable que el TAVI llegue a adoptarse de manera más amplia con la participación de la industria, lo que conducirá finalmente a una reducción de los costes.
En conclusión, el TAVI no está preparado todavía para uso en pacientes con EA grave no seleccionados (all-comers). No obstante, está en camino de convertirse en el elemento principal del tratamiento para la mayoría de los pacientes con EA grave. Es necesario un cambio de paradigma para pasar del modelo actual basado en el riesgo quirúrgico a nuevos modelos para pacientes de menos edad. Seguirá habiendo ciertas limitaciones anatómicas que harán necesaria la cirugía convencional. La preferencia de los pacientes por intervenciones menos invasivas y el rápido avance del desarrollo tecnológico probablemente resuelvan los futuros retos que plantee el TAVI. Además, el coste médico del tratamiento con TAVI deberá reducirse para hacer que esta técnica sea viable económicamente para los hospitales y para la asistencia sanitaria mundial.
CONFLICTO DE INTERESESC.E. Ruiz es investigador (no remunerado) del Portico Trial. Se dispuso de subvenciones de formación para el centro de Medtronic y Abbott-St. Jude Medical. T.K.R. Pasala no tiene ningún conflicto de intereses.