El objetivo es estudiar la angiogénesis coronaria inducida por el suero coronario y la implicación del factor inducible por hipoxia-1A (FIH-1A) en la reparación de la obstrucción microvascular (OMV) tras un infarto agudo de miocardio (IAM).
MétodosSe indujo un IAM en cerdos mediante oclusión coronaria durante 90 min. Se dividió a los animales entre 1 grupo de control y 4 grupos con IAM: sin reperfusión y 1 min, 1 semana y 1 mes tras la reperfusión. Se cuantificaron la OMV y la densidad microvascular. Se determinó la capacidad angiogénica del suero coronario mediante una prueba de tubulogénesis in vitro. Se determinaron las concentraciones circulantes del FIH-1A, su implicación en el miocardio infartado y el efecto del bloqueo del FIH-1A in vitro.
ResultadosEn la zona infartada, la microvascularización disminuye tras 90 min de isquemia, la OMV aparece tras 1 min de reperfusión, es máxima 1 semana tras la reperfusión y se resuelve en 1 mes. La capacidad angiogénica del suero aumenta durante la isquemia y 1 min tras la reperfusión (32 ± 4 y 41 ± 9 frente a 3 ± 3 tubos en el grupo de control; p < 0,01). Las concentraciones circulantes del FIH-1A se incrementan durante la isquemia (5 min de isquemia: 273 ± 52 frente a 148 ± 48 pg/ml de los controles; p < 0,01) y se hallan en la microvasculatura de todos los grupos con IAM (sin reperfusión frente a control, el 67 ± 5% frente al 15 ± 17%; p < 0,01). El bloqueo del FIH-1A in vitro reduce la capacidad angiogénica inducida por el suero.
ConclusionesEl suero coronario activa la neoangiogénesis desde antes de la reperfusión, y el FIH-1A podría tener un papel crucial. La capacidad angiogénica del suero coronario puede contribuir a la comprensión de la fisiopatología tras el IAM.
Palabras clave
En el infarto agudo de miocardio (IAM), la reperfusión temprana de la arteria coronaria ocluida es el paso imprescindible para conservar la viabilidad del tejido miocárdico en peligro1–3. Sin embargo, a pesar de que se restablezca satisfactoriamente el flujo de sangre por la arteria epicárdica, en un número considerable de pacientes la microcirculación puede seguir gravemente dañada. Este fenómeno, que se denomina obstrucción microvascular (OMV), consiste en una pérdida masiva de vasos pequeños y presagia un efecto negativo en la evolución clínica del paciente y el remodelado del ventrículo izquierdo2,4–6. Se puede considerar a la OMV como uno de los efectos negativos de la lesión por isquemia-reperfusión indeseada que se asocia paradójicamente con el restablecimiento del flujo sanguíneo en el área infartada. Con la reperfusión, el suero coronario conlleva al mismo tiempo consecuencias beneficiosas y deletéreas1,7,8.
La OMV es un proceso dinámico. En estudios experimentales y estudios de imagen cardiaca se ha observado no solo un inicio rápido tras la reperfusión, sino también una tendencia a una resolución espontánea tardía (en semanas o meses) después del IAM4,6,9. Indudablemente, la formación de nuevos vasos es de gran importancia en el restablecimiento de la circulación coronaria, puesto que aporta oxígeno y nutrientes, salva el miocardio isquémico, contribuye a la formación de una cicatriz sólida y evita el remodelado adverso del ventrículo izquierdo10–12. Hay diversos factores relacionado con el proceso neoangiogénico. De ellos, el factor inducible por hipoxia-1A (FIH-1A) es el que parece desempeñar un papel crucial en diferentes situaciones fisiológicas y patológicas relacionadas con la formación de neovasos13,14. La cronología y los mecanismos que regulan la neoangiogénesis y la reparación de la OMV después de un IAM todavía no están completamente esclarecidos.
Nuestra hipótesis es que el suero coronario fomenta la neoangiogénesis en las células endoteliales coronarias y, por consiguiente, contribuye a la reparación de la OMV desde las fases iniciales del IAM. En consecuencia, como parte de la multitud de efectos beneficiosos y perjudiciales causados por la reperfusión tras el IAM, el suero coronario podría participar al mismo tiempo en la aparición de la OMV y el inicio de su reparación.
Mediante un modelo porcino de IAM y OMV altamente controlado y una prueba in vitro de tubulogénesis de las células endoteliales coronarias, los objetivos específicos del presente estudio fueron: a) definir la evolución temporal de la pérdida de microvasos durante la aparición de la OMV y de la formación neovascular durante la reparación de la OMV; b) evaluar los efectos neoangiogénicos dinámicos del suero procedente de las venas coronarias en las células endoteliales coronarias desde el inicio de la isquemia hasta un tiempo después de la reperfusión, y c) explorar el posible mecanismo del efecto del FIH-1A en el proceso angiogénico tras el IAM.
MÉTODOSProtocolo experimentalEste estudio fue autorizado por el Comité para el Cuidado y Uso de Animales de la Universidad de Valencia y se atiene a lo indicado en la Guide for the Care and Use of Laboratory Animals publicada por los National Institutes of Health de Estados Unidos (NIH Publication No. 85-23, modificada en 1993), así como en la reglamentación europea (2010/63/EC) y nacional (RD53/2013). En el estudio experimental, se utilizaron hembras de cerdo doméstico jóvenes, de peso entre 25 y 30kg.
Tras el acceso a la arteria descendente anterior izquierda proximal mediante catéter Amplatz Left 0,75 de 6 Fr por vía transfemoral, se colocó un balón de angioplastia (2,5×16 mm) en la parte media de la arteria descendente anterior izquierda y se utilizó para inducir una isquemia coronaria aguda mediante el hinchado transitorio (90 min) del balón.
El protocolo experimental completo se validó con anterioridad y puede consultarse en otra fuente4.
Grupos experimentalesLos animales se distribuyeron en 1 grupo control y 4 grupos experimentales de IAM independientes. En los grupos de IAM, después de una oclusión de 90min de la parte media de la arteria descendente anterior izquierda mediante el balón de angioplastia, los experimentos se clasificaron de la siguiente forma: a) ausencia de reperfusión; b) 1 min; c) 1 semana, y d) 1 mes después de la reperfusión (n=5 cada uno). En el grupo de control (n=5) se aplicó el mismo protocolo experimental utilizado en los grupos de IAM, pero no se hinchó el balón de angioplastia y, por consiguiente, no se indujo isquemia ni infarto.
Puede consultarse información adicional respecto a los materiales y métodos específicos en el material suplementario.
RESULTADOSLos experimentos en los controles fueron exitosos (n=5). Se aplicó una oclusión de 90min en la parte media de la arteria coronaria descendente anterior izquierda de 25 cerdos; 3 de ellos murieron durante el periodo de hinchado del balón a causa de una fibrilación ventricular refractaria, y 2 murieron en el periodo de reperfusión. Los experimentos se completaron con éxito en los 20 animales restantes, aunque fue necesaria la desfibrilación ventricular eléctrica durante la oclusión coronaria o inmediatamente después de la reperfusión en 6 de ellos. Se confirmó la permeabilidad de la descendente anterior izquierda en todos los animales antes de sacrificarlos. Formaron el grupo final de estudio 5 controles y 20 experimentos de IAM (ausencia de reperfusión, 1min, 1 semana y 1 mes después de la reperfusión; n=5 cada uno).
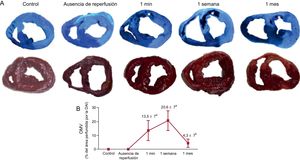
Dinámica de la obstrucción microvascularMacroscópicamente, los controles y el grupo de reperfusión mostraron una perfusión completamente intacta. Se produjo una OMV en el tejido miocárdico de todos los experimentos con reperfusión. La OMV se detectó por primera vez en el grupo de reperfusión de 1min, alcanzó su máximo en el grupo de 1 semana tras la reperfusión y se redujo significativamente en el de 1 mes tras la reperfusión (figura 1). Así pues, después de igual periodo de oclusión coronaria que en el grupo sin reperfusión (90 min), la OMV se produjo después de tan solo 1min tras la reperfusión, alcanzó el máximo al cabo de 1 semana y tendió a desaparecer espontáneamente al llegar a 1 mes.
Dinámica de la OMV en un modelo porcino de IAM reperfundido. A: en los paneles superiores se muestran imágenes macroscópicas representativas de cortes de corazón procedentes de los grupos de control y los 4 grupos de IAM (sin reperfusión, 1min, 1 semana y 1 mes después de la reperfusión) con tinción de tioflavina-S; los asteriscos indican el área de OMV en los grupos con reperfusión; en los paneles inferiores se muestran imágenes ilustrativas de cortes del corazón teñidos con solución de cloruro de 2,3,5-trifeniltetrazolio. B: el grado de OMV se cuantifica mediante el porcentaje de área perfundida por la arteria coronaria descendente anterior izquierda en los 5 grupos experimentales; la OMV apareció en las fases iniciales tras el IAM, alcanzó su máximo 1 semana después de la reperfusión y se había resuelto casi completamente 1 mes después de la reperfusión. Los datos (media ± desviación estándar; n ≥ 5) se analizaron con un ANOVA de una vía seguido de una prueba de Bonferroni. Un evaluador que no conocía el grupo experimental del que procedían las imágenes realizó el análisis. DAI: descendente anterior izquierda; IAM: infarto agudo de miocardio; OMV: obstrucción microvascular. ap < 0,01 frente al control. bp < 0,01 frente al grupo de 1 semana después de la reperfusión.
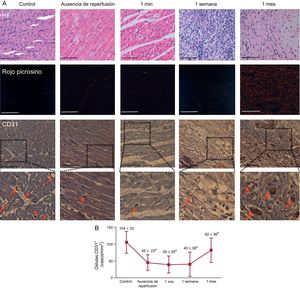
En comparación con los controles, se detectó una reducción significativa de la densidad de microvasos CD31+ en las muestras de miocardio infartado extraídas del grupo sin reperfusión tras 90min de isquemia. En los grupos de 1min y 1 semana tras la reperfusión, la densidad microvascular CD31+ se mantuvo baja y recuperó unos valores similares, sin una diferencia significativa respecto a los controles, en la cuantificación realizada al cabo de 1 mes (figura 2). En consecuencia, la pérdida de densidad microvascular precedió a la aparición de la OMV (antes de la reperfusión) y ambos procesos siguieron una recuperación paralela que, en el caso de la densidad microvascular, fue completa tras 1 mes de reperfusión. No se observaron diferencias en el número de microvasos CD31+ en las muestras de miocardio aisladas de áreas distantes en ninguno de los 4 grupos de IAM en comparación con los controles.
Dinámica de la densidad microvascular en un modelo porcino del infarto de miocardio reperfundido. A: imágenes representativas del tejido infartado aislado del grupo control y de los 4 grupos de infarto de miocardio (sin reperfusión, 1min, 1 semana y 1 mes tras la reperfusión) con tinción con hematoxilina-eosina (paneles superiores), rojo picrosirio (paneles centrales) y con el marcador vascular específico CD31 (paneles inferiores); las flechas rojas indican los vasos CD31+; la barra de escala indica 100 μm. B: cuantificación de los vasos con CD31+. Las imágenes del área infartada aislada de los 5 grupos independientes se analizaron con el programa informático de análisis Image-Pro Plus; el número de vasos CD31+ se redujo en el miocardio infartado de los grupos sin reperfusión y de 1min y de 1 semana de reperfusión, en comparación con los controles, y se recuperó 1 mes después de la reperfusión; los datos (media ± desviación estándar; n ≥ 5) se analizaron con un ANOVA de una vía seguido de una prueba de Bonferroni; un evaluador que no conocía el grupo experimental del que procedían realizó la evaluación. HE: hematoxilina-eosina. ap < 0,05 frente al control. bp < 0,05 frente al grupo de 1 semana de reperfusión. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Se utilizó un análisis de morfogénesis in vitro con células endoteliales coronarias para explorar la capacidad de inducción de tubulogénesis del suero coronario extraído de las venas coronarias en diferentes momentos del proceso de isquemia y reperfusión.
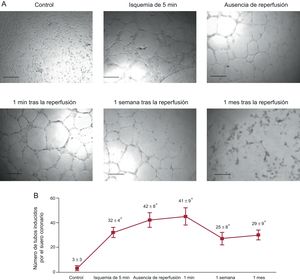
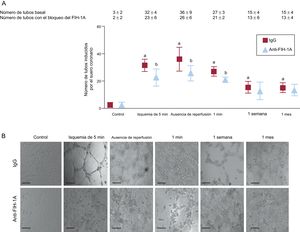
En comparación con los controles, el suero coronario extraído en los experimentos de IAM ejerció un estímulo potente para la generación de estructuras tubulares. Es de destacar que la capacidad angiogénica máxima del suero coronario en las células endoteliales coronarias se produjo en el momento en que la densidad microvascular en el área de miocardio infartada era menor, es decir, inmediatamente antes y 1min después de la reperfusión (figura 3).
Capacidad del suero coronario de inducir la angiogénesis en células endoteliales coronarias. A: imágenes representativas de las células endoteliales de arteria coronaria porcina en un análisis de diferenciación in vitro inducido por el suero coronario procedente de la situación de control (antes de hinchar el balón) y de diferentes momentos del proceso de isquemia y reperfusión: tras 5 y 90min de isquemia (inmediatamente antes de la reperfusión), así como 1min, 1 semana y 1 mes de reperfusión tras el infarto de miocardio; para la toma de las imágenes se usó un microscopio de contraste de fase; la barra de escala indica 500 μm. B: cuantificación del número de tubos inducidos por el suero coronario: el suero coronario obtenido en los experimentos de infarto de miocardio mostró una capacidad angiogénica superior a la de los controles, con un máximo en el suero obtenido durante la isquemia e inmediatamente después de la reperfusión. Los datos se expresan como la media ± desviación estándar del número de estructuras tubulares en 5 campos independientes (×100) (n ≥ 5 experimentos independientes realizados por triplicado) y se analizaron con un ANOVA de una vía seguido de la prueba de Bonferroni. Un evaluador que no conocía el grupo experimental del que procedían analizó los datos. *p < 0,01 frente al control.
Así pues, en las fases iniciales del IAM y simultáneamente con una pérdida masiva de la densidad microvascular, el suero coronario activa un potente mecanismo compensatorio destinado a restablecer la perfusión en el área del infarto.
Dinámica del factor inducible por hipoxia-1APara investigar el posible papel del FIH-1A en la mencionada capacidad angiogénica del suero coronario para reparar el daño microvascular en el IAM reperfundido, se evaluaron primero los cambios dinámicos de la concentración de FIH-1A en el suero coronario y después se cuantificó la expresión miocárdica en el área de infarto en periodos secuenciales del proceso de isquemia-reperfusión. Por último, se investigaron también ex vivo las consecuencias funcionales en la angiogénesis del bloqueo del FIH-1A sérico.
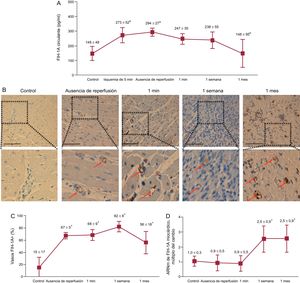
La concentración de FIH-1A circulante en el seno coronario fue paralela al efecto angiogénico del suero coronario en las células endoteliales coronarias: las concentraciones aumentaron intensamente tras 5 y 90min de isquemia, y se redujeron progresivamente en el primer mes siguiente a la reperfusión (figura 4A).
Dinámica del FIH-1A tras el infarto de miocardio. A: concentración de FIH-1A circulante en el suero coronario en diferentes momentos del proceso de isquemia y reperfusión; La concentración de FIH-1A en el seno coronario aumentó significativamente durante la isquemia y fue reduciéndose durante el primer mes tras la reperfusión; los datos (media ± desviación estándar; n ≥ 5) se analizaron con un ANOVA de una vía seguido de una prueba de Bonferroni. B: análisis inmunohistoquímico de la expresión del FIH-1A en el miocardio infartado en diferentes momentos del proceso de isquemia y reperfusión; se muestran imágenes representativas del área de infarto del grupo de control y de los 4 grupos de infarto de miocardio (sin reperfusión y 1min, 1 semana y 1 mes después de la reperfusión); las flechas indican vasos sanguíneos con FIH-1A; la barra de escala indica 100 μm. C: cuantificación del FIH-1A en el miocardio infartado; las imágenes del área infartada aislada de los 5 grupos independientes se analizaron con el programa informático de análisis Image-Pro Plus; el porcentaje de vasos sanguíneos FIH+ aumentó significativamente en el miocardio con infarto en todos los grupos de IAM; los datos (media±desviación estándar; n ≥ 5) se analizaron con un ANOVA de una vía seguido de una prueba de Bonferroni; un evaluador que no conocía el grupo experimental del que procedían analizó los datos. D: expresión de FIH-1A en el miocardio con infarto en diferentes momentos del proceso de isquemia y reperfusión; la expresión del ARNm de FIH-1A estaba regulada al alza en el miocardio infartado 1 semana y 1 mes después de la reperfusión, en comparación con los controles; los datos (media±desviación estándar; n ≥ 5 experimentos independientes realizados por triplicado) se analizaron con un ANOVA de una vía, seguido de una prueba de Bonferroni. FIH-1A: factor inducible por hipoxia-1A; IAM: infarto agudo de miocardio. ap < 0,01 frente al control. bp < 0,05 frente a la ausencia de reperfusión. cp < 0,01 frente al control. dp < 0,05 frente al control.
Se observó una expresión génica constitutiva débil del FIH-1A en los controles y en el área infartada de los grupos sin reperfusión y de 1min tras la reperfusión. Tiene interés señalar que se detectó una intensa regulación positiva del FIH-1A en las muestras miocárdicas obtenidas del área de infarto de los grupos de 1 semana y 1 mes tras la reperfusión (figura 4D). Sin embargo, al analizar la presencia de FIH-1A en el miocardio infartado, se observó que la tinción de FIH-1A aumentaba significativamente en las células endoteliales microvasculares del área de infarto en todos los grupos de IAM (figura 4B y figura 4C. Ni la expresión del ARNm ni los estudios de inmunohistoquímica mostraron aumento de la expresión de FIH-1A en las muestras de miocardio aisladas de las áreas distantes en ninguno de los 4 grupos de IAM en comparación con los controles.
En resumen, las concentraciones de FIH-1A circulante aumentan poco después de la isquemia y la reperfusión y son paralelos a los efectos proangiogénicos del suero coronario in vitro. No obstante, transcurre cierto tiempo hasta que se produce la regulación positiva en el miocardio.
Posible mecanismo de intervención del factor inducible por hipoxia-1A en la capacidad proangiogénica del suero coronario en las células endoteliales coronariasCon objeto de explorar el posible mecanismo de acción del FIH-1A en el efecto proangiogénico del suero coronario en las células endoteliales coronarias ya descrito, investigamos ex vivo las consecuencias del bloqueo funcional de FIH-1A sérico en la capacidad angiogénica mediante una prueba en Matrigel, según un método descrito con anterioridad15. Se observó que el bloqueo del FIH-1A producido por un anticuerpo monoclonal específico anulaba la capacidad del suero coronario de generar nuevas estructuras tubulares en los mismos plazos en que, en las condiciones basales, el suero coronario ejercía un efecto proangiogénico potente (figura 5).
Efecto funcional del FIH-1A en la capacidad proangiogénica del suero coronario en células endoteliales de las arterias coronarias. A: cuantificación del efecto de la neutralización del FIH-1A en el número de estructuras de tipo tubular inducido por el suero coronario; se incubaron células endoteliales coronarias de cerdo con el suero obtenido en la situación de control (antes de hinchar el balón) y tras 5 y 90min de isquemia (inmediatamente antes de la reperfusión); algunas células se incubaron en presencia de un anticuerpo monoclonal murino anti-FIH-1A porcino (10 μg/ml) o cualquier IgG de iguales isotipo y concentración; se observó mediante microscopio de contraste de fase y se contó el número de estructuras de tipo tubular; los datos se expresan como media±desviación estándar del número de estructuras tubulares en 5 campos independientes (×100) (n ≥ 5 experimentos independientes realizados por triplicado) y se analizaron con un ANOVA de una vía seguido de la prueba de Bonferroni; un evaluador que no conocía el grupo experimental del que procedían analizó los datos. B: imágenes representativas del análisis de diferenciación de las células endoteliales en Matrigel inducida por el suero coronario; la barra de escala indica 200 μm. FIH-1A: factor inducible por hipoxia-1A; IgG: inmunoglobulina G. ap < 0,01 frente al control. bp < 0,05 frente a una IgG del mismo isotipo irrelevante.
Este análisis in vitro indica que el FIH-1A tiene un papel relevante en la capacidad proangiogénica del suero coronario en situaciones de isquemia coronaria aguda y reperfusión.
DISCUSIÓNEl principal aporte del presente estudio es que, en el contexto del IAM, el suero coronario tiene la capacidad de fomentar in vitro la neoangiogénesis coronaria desde el inicio de la isquemia y que este proceso se produce en paralelo con el restablecimiento de la densidad microvascular y la reparación de la OMV en el área infartada. Parece que la regulación positiva del FIH-1A es crucial para que se produzcan los efectos favorables del suero coronario en la microcirculación coronaria.
Dinámica de la obstrucción microvascular y la densidad de microvasosA pesar de un restablecimiento rápido y completo de la permeabilidad del vaso responsable del infarto, se produce OMV en un número de pacientes considerable y ello tiene importantes repercusiones negativas tras el IAM por lo que respecta al pronóstico y el remodelado del ventrículo izquierdo5,6,9.
La cronología y los mecanismos que subyacen a la recuperación de la OMV están aún lejos de haberse aclarado por completo. Un mejor conocimiento de este proceso sería de gran importancia para progresar en nuestra comprensión de la fisiopatología del IAM y para la futura exploración de nuevas posibilidades terapéuticas que vayan más allá de la reperfusión de la arteria epicárdica.
Los experimentos se realizaron en un modelo porcino de IAM reperfundido y OMV que se había validado con anterioridad4. Macroscópicamente, este estudio confirmó la evolución dinámica de la OMV: se detectó inmediatamente después de la reperfusión, alcanzó su máximo al cabo de 1 semana y desapareció casi por completo al llegar a 1 mes4.
La falta de integridad microvascular en las muestras obtenidas de áreas de infarto se ha descrito ya anteriormente7, pero su asociación con la dinámica de la OMV en un modelo altamente controlado como el nuestro no se había analizado hasta ahora.
Según lo indicado por la cuantificación de las células CD31+, una intensa pérdida de densidad microvascular en el área infartada precedió a la aparición de la OMV macroscópica en las muestras de miocardio obtenidas durante la fase aguda de la isquemia (90 min) sin reperfusión. El daño microvascular persistió durante la primera semana y recuperó los valores de control 1 mes después de la reperfusión.
El flujo coronario cumple un papel en múltiples aspectos de la fisiopatología del IAM y la OMV durante la isquemia y la posterior reperfusión. Para empezar, la interrupción súbita de la perfusión coronaria tiene un efecto decisivo no solo para el inicio de la necrosis del miocardio, sino también, según los resultados, para el inicio del daño microvascular4. Por ello, el restablecimiento del flujo sanguíneo al área de infarto, aunque imprescindible para salvar miocardio, puede aumentar, según se ha demostrado ampliamente, el tamaño del infarto y la OMV a través de una multitud de mecanismos relacionados con la lesión por isquemia-reperfusión1,2,6. De hecho, en nuestros experimentos, con el mismo tiempo de isquemia, se produjo una OMV macroscópica significativa apenas 1min después de la reperfusión, pero no la hubo en el grupo sin reperfusión (figura 6A).
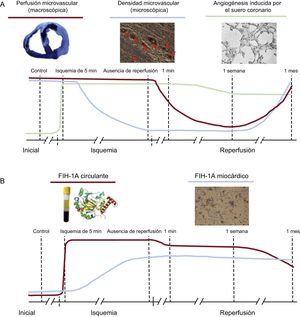
Dinámica del daño microvascular, la angiogénesis inducida por el suero coronario y la concentración de FIH-1A en el proceso de isquemia y reperfusión tras el infarto de miocardio. A: en el infarto de miocardio con reperfusión, la pérdida de la densidad microvascular precedió a la aparición de la obstrucción microvascular (antes de la reperfusión), tras lo cual ambos fenómenos se recuperaron en paralelo con un restablecimiento casi completo 1 mes después de la reperfusión; además, el suero coronario ejerce poco después de la isquemia una potente acción compensatoria destinada a restablecer la perfusión en el área del infarto. B: la dinámica del FIH-1A circulante aumenta drásticamente durante la isquemia y la reperfusión, y en paralelo al efecto proangiogénico del suero coronario en las células endoteliales coronarias; pasa un tiempo antes de que se produzca la regulación miocárdica positiva 1 semana después de la reperfusión. FIH-1A: factor inducible por hipoxia-1A.
Se observó que la recuperación de la microcirculación subyace a la resolución de la OMV 1 mes después de la reperfusión. El siguiente paso en el presente estudio fue investigar si el suero coronario era también decisivo para la estimulación del proceso de neoangiogénesis coronaria que interviene en la reparación de la OMV.
Suero coronario y angiogénesis tras el infarto de miocardioLa angiogénesis representa la formación de nuevos microvasos a partir de los capilares preexistentes, en respuesta a diferentes señales como la hipoxia, los factores de crecimiento o el estrés oxidativo10,11. El papel reparador crucial de este proceso tras el IAM está ampliamente demostrado10,12. No obstante, hasta donde se sabe, el potencial del suero coronario de inducir neoangiogénesis y, por consiguiente, la recuperación de la OMV y la cronología de este proceso no se habían descrito hasta ahora. Para alcanzar estos objetivos, se obtuvo suero coronario en momentos secuenciales del IAM. A continuación, en un análisis de morfogénesis funcional, se evaluó la capacidad del suero de estimular la formación de nuevas estructuras vasculares en las células endoteliales coronarias. Se observó que, en comparación con los controles, el suero coronario procedente de los experimentos de IAM tuvo un efecto neoangiogénico potente. Tiene interés señalar que la capacidad fue máxima con el suero extraído durante la isquemia e inmediatamente después de la reperfusión, y continuó siendo superior a la de los controles durante el primer mes siguiente al IAM. Esto indica que, incluso antes de la reperfusión, actúan mecanismos serológicos destinados a facilitar la recuperación del daño microvascular que acompaña al IAM. El aumento observado de los neovasos en el área de infarto y la resolución espontánea de la OMV 1 mes después de la reperfusión probablemente sean consecuencia, al menos en parte, del efecto neoangiogénico del suero coronario desde el inicio de la isquemia (figura 6A).
Indudablemente, el estímulo angiogénico del suero coronario es un fenómeno multifactorial desencadenado por un gran número de mediadores. Para avanzar en el conocimiento de este proceso, la atención se centró en la dinámica y la posible intervención del factor de transcripción FIH-1A.
Dinámica del factor inducible por hipoxia-1A tras el infarto de miocardio. Función en la angiogénesisEl FIH-1A aumenta en respuesta a la hipoxia fisiológica y patológica. Esta proteína interviene en la activación de la glucolisis anaerobia y los genes diana relacionados con la neoangiogénesis y la supervivencia del tejido viable alrededor de las áreas de isquemia10,16,17. En el IAM, se evaluó su intervención en las biopsias humanas de corazones con infarto18,19 y en modelos de IAM experimentales13,14. Además, se ha demostrado también que el FIH-1A desempeña un papel central en el precondicionamiento y el poscondicionamiento20–22. Estos procesos consisten en episodios breves de isquemia antes de la oclusión coronaria (en el primer caso) o inmediatamente después de la reperfusión (en el segundo) y se han relacionado con efectos favorables en cuanto a miocardio salvado. En ambas situaciones se produce una liberación de FIH-1A21,22.
En el presente estudio, la evolución temporal de las concentraciones de FIH-1A circulante mostró fluctuaciones muy notables, con un máximo durante la isquemia y poco después de la reperfusión. Esta dinámica refleja el efecto proangiogénico del suero coronario en las células endoteliales coronarias in vitro (figura 6).
Usando anticuerpos neutralizantes anti-FIH-1A para bloquear el efecto angiogénico del suero coronario in vitro, se confirmó el papel funcional de este factor en la neoangiogénesis coronaria tras el IAM y en la reparación de la OMV.
La expresión del FIH-1A se ha correlacionado con la formación de neovasos en diversas situaciones10,16,17. Este estudio ilustra de una forma altamente controlada la dinámica y la cronología de la reparación microvascular estimulada por el suero coronario y en particular por el FIH-1A en el contexto del IAM con OMV. La presencia de FIH-1A en las células endoteliales microvasculares de la región infartada en todos los grupos de IAM se detectó en paralelo con el aumento casi inmediato del FIH-1A en suero después del inicio de la isquemia y su mayor capacidad de generar estructuras vasculares in vitro. Sin embargo, la expresión del ARNm de FIH-1A solamente mostró regulación al alza 1 semana y 1 mes después de la reperfusión. Esto podría indicar que, si bien el FIH-1A está promoviendo ya la angiogénesis en el endotelio coronario incluso antes de la reperfusión, hay cierto retraso en la expresión miocárdica de este factor. En este estudio, la presencia miocárdica de FIH-1A alcanzó su máximo antes de la reperfusión y luego se siguió de una recuperación de la densidad microvascular y el restablecimiento de la OMV 1 mes después del IAM (figura 6B).
Contrariamente al concepto de irreversibilidad del tamaño del infarto, aplicando técnicas de imagen a pacientes y modelos animales experimentales altamente controlados, nuestro grupo, al igual que otros, ha demostrado una tendencia a la resolución espontánea de la OMV macroscópica durante las semanas y meses que siguen a un IAM reperfundido4,6,9. Se ha señalado que el retraso en la reparación de la OMV que se observa en la resonancia magnética cardiaca anuncia consecuencias estructurales graves en el ventrículo izquierdo de los pacientes que han experimentado un IAM23. Los resultados obtenidos ponen de manifiesto que el suero coronario y en particular la vía del FIH-1A desempeñan un papel clave en la regeneración microvascular tras el IAM. Se necesitan nuevos estudios para investigar si las maniobras terapéuticas destinadas a acelerar este proceso natural pueden constituir una opción realista más allá de la reperfusión coronaria.
LimitacionesLa evolución del daño y la reparación microvascular, así como el efecto proangiogénico del suero coronario y el FIH-1A en las células endoteliales coronarias, se ha demostrado en modelos in vitro y modelos experimentales en un contexto altamente controlado.
El modelo de IAM se basó en la oclusión aguda de una arteria coronaria normal, que no es lo mismo que una oclusión aguda en un contexto de clínica miocárdica aguda, en el que hay erosión o rotura de la placa. Estos resultados deberán confirmarse en pacientes con IAM espontáneos.
Las consecuencias terapéuticas de los resultados obtenidos exceden con mucho el alcance del presente estudio y no se han abordado.
CONCLUSIONESEn el contexto del IAM, el daño microvascular y el mecanismo de compensación para repararlo se inician simultáneamente incluso antes de la reperfusión coronaria. Tras desencadenarse por la isquemia miocárdica, el suero coronario y en particular el FIH-1A ejercen un efecto potente de estimulación neoangiogénica que se inicia poco después de la oclusión coronaria y termina con una reconstrucción macroscópica y microscópicamente casi completa de la microcirculación del área de infarto 1 mes más tarde. La neoangiogénesis inducida por el suero coronario en las células endoteliales coronarias es un concepto que podría contribuir a mejorar el conocimiento de la fisiopatología del IAM y puede usarse para desarrollar nuevas posibilidades terapéuticas más allá de la reperfusión coronaria.
FINANCIACIÓNEstudio financiado por el Instituto de Salud Carlos III y el Fondo de Desarrollo Regional Europeo (subvenciones PIE15/00013, PI14/00271, CPII13/00025, PI12/01271, PI15/00082 y CB16/11/00486) y la Generalitat Valenciana (subvención PROMETEO/2013/007).
CONFLICTO DE INTERESESNo se declara ninguno.
- –
En el contexto del IAM, la OMV consiste en una pérdida masiva de microvasos tras la reperfusión de la arteria epicárdica obstruida, lo cual causa efectos deletéreos en la evolución del paciente.
- –
Aunque los estudios experimentales y de imagen cardiaca han demostrado ampliamente la resolución espontánea de la OMV tardíamente tras el IAM, los mecanismos que intervienen en ello están lejos de haberse esclarecido por completo.
- –
La angiogénesis es esencial para restablecer la circulación coronaria y evitar un remodelado adverso del ventrículo izquierdo. Concretamente, el factor proangiogénico FIH-1A se ha descrito en múltiples situaciones fisiológicas y patológicas de hipoxia.
- –
El daño microvascular y el mecanismo de compensación para repararlo se inician simultáneamente incluso antes de la reperfusión coronaria.
- –
El suero coronario y en particular el FIH-1A tienen la capacidad de fomentar la angiogénesis in vitro desde el inicio de la isquemia, y probablemente participen en el aumento neovascular en el área infartada y en la resolución de la OMV 1 mes después de la reperfusión.