La dieta mediterránea rica en polifenoles se ha demostrado cardioprotectora, pero se desconocen los mecanismos implicados. Se ha investigado los efectos de un extracto de granada rico en polifenoles en la función coronaria de un modelo porcino.
MétodosLos animales ingirieron durante 10 días una dieta normocolesterolémica o hipercolesterolémica. La mitad de los cerdos recibieron un suplemento de 625mg/día de un extracto de granada (Pomanox®; 200mg punicalaginas/día). Se analizó (flujo-Doppler) la vasodilatación tras la administración coronaria de acetilcolina, ionóforo de calcio, nitroprusiato de sodio y L-NG-monometilarginina (inhibidor de la enzima óxido nítrico sintasa endotelial) y la activación del eje Akt/óxido nítrico sintasa endotelial, la expresión de proteína quimiotáctica de monocitos–1 y el daño oxidativo coronario del ácido desoxirribonucleico y la oxidación de las lipoproteínas.
ResultadosPomanox® redujo la disfunción endotelial inducida por la dieta hipercolesterolémica a valores de animales normocolesterolémicos tras la estimulación con acetilcolina y/o ionóforo de calcio. Este efecto se asoció con mayor actividad coronaria de Akt/óxido nítrico sintasa endotelial, menor expresión de proteína quimioatáctica de monocitos–1 y menor daño oxidativo. Las lipoproteínas de alta densidad mostraron mayor capacidad antioxidante y las lipoproteínas de baja densidad fueron más resistentes a la oxidación. Pomanox® no afectó a la vasorrelajación de los animales normocolesterolémicos. Todos los animales mostraron similar vasodilatación tras la administración de nitroprusiato de sodio y la L-NG-monometilarginina bloqueó la vasorrelajación de todos los agentes vasoactivos, a excepción del nitroprusiato de sodio.
ConclusionesLa toma de Pomanox® previene la disfunción endotelial coronaria inducida por la hiperlipemia, al preservar el eje Akt/óxido nítrico sintasa endotelial y contrarrestar la inflamación y el daño oxidativo vascular.
Palabras clave
La enfermedad cardiovascular (ECV) es la primera causa de mortalidad en todo el mundo y la aterosclerosis, una de sus principales causas subyacentes1. El endotelio tiene un papel fundamental en la prevención de la aterosclerosis, pues regula el tono vascular, la adhesión leucocitaria y la formación del trombo. De hecho, se considera que la disfunción endotelial, de la que se cree que es consecuencia de la exposición repetida a factores de riesgo cardiovascular (en especial, la hipercolesterolemia), es la característica distintiva de la fase inicial de la aterosclerosis y está presente incluso antes de la aparición de las lesiones vasculares2,3. Además, se ha demostrado que la disfunción endotelial es un factor predictivo de los resultados clínicos adversos en pacientes con enfermedad coronaria4. Así pues, las estrategias destinadas a la prevención o reducción del daño endotelial se han convertido en una cuestión de gran interés.
Varios estudios epidemiológicos han evidenciado que la adherencia a un patrón de dieta saludable, caracterizado por un consumo relativamente alto de frutas y verduras, se asocia a una reducción de la incidencia de ECV5,6. De hecho, los datos existentes indican que el papel de las frutas y los nutrientes asociados a ellas en la prevención cardiovascular podría ser más potente que el de las hortalizas. En cambio, se han obtenido resultados neutros o negativos en los ensayos clínicos controlados que no han demostrado una prevención significativa de la ECV con el empleo de suplementos de vitaminas y antioxidantes, lo cual subraya la importancia que tienen los alimentos completos7. La evidencia experimental y de mecanismos de acción indica que las frutas presentan un conjunto de sustancias fitoquímicas que previenen la enfermedad, como los polifenoles, que contribuyen a producir la modulación observada en los factores de riesgo ateroscleróticos y el desarrollo de la aterosclerosis8–10. A este respecto, durante la última década, la granada (Punica granatum L.) ha adquirido amplia popularidad como alimento rico en polifenoles con propiedades de fomento de la salud11. La mayor parte de los beneficios para la salud que aporta la granada se han atribuido a la presencia de elagitaninos (principalmente los compuestos polifenólicos grandes de isómeros α y β de punicalaginas), que se encuentran tan solo en la granada12. Aunque los elagitaninos no se absorben, en condiciones fisiológicas son hidrolizados a ácido elágico, el cual a su vez la microbiota intestinal metaboliza gradualmente para producir diferentes tipos de urolitinas (metabolitos). Se cree que las urolitinas son la causa de los efectos beneficiosos asociados al consumo de granadas13,14.
En el presente estudio se investigan los efectos in vivo de un extracto de granada rico en punicalaginas (Pomanox® [POX]) en la protección vascular y esclarecer los mecanismos subyacentes. De hecho, no se ha determinado todavía si la granada produce efectos beneficiosos vasculares. Este estudio se ha llevado a cabo en un modelo porcino de vasorreactividad coronaria utilizando una alimentación con pienso estándar o con una dieta rica en grasas/rica en colesterol. Es necesario un estudio que use modelos animales relevantes con una repercusión clínica traslacional para determinar mejor y explorar con mayor detalle los mecanismos biológicos por los que los alimentos ricos en polifenoles pueden ejercer sus efectos clínicos.
MÉTODOSEl protocolo del estudio fue aprobado por el comité de ética del centro (Consejo Superior de Investigaciones Científicas-Institut Català de Ciències Cardiovasculars) y todos los procedimientos se atuvieron a los criterios establecidos en la «Guide for the care and use of laboratory animals» (publicación del National Institute of Health número 85-23, revisión de 1996).
Diseño del estudioSe utilizaron cerdas híbridas comerciales (peso, 48±3kg) que fueron alimentadas durante 10 días con un pienso estándar para cerdos (dieta normocolesterolémica [NC], n=12) o con una dieta rica en grasas/rica en colesterol (dieta de tipo occidental hipercolesterolémica [HC], n=12, con un 20% de grasas saturadas, un 2% de colesterol y un 1% de ácido cólico). Anteriormente se ha descrito ya que el consumo de esta dieta rica en grasas durante 10 días eleva la concentración de colesterol a unos valores comparables a los que se observan en la dislipemia humana e induce disfunción endotelial15. A la mitad de los animales de los grupos de dieta NC y HC, se les proporcionó un suplemento de 625mg/día de POX. Se estudiaron los cuatro grupos experimentales siguientes (6 animales por grupo): NC, NC + POX, HC y HC + POX. Todos los animales fueron objeto de una vigilancia cuidadosa (es decir, supervisión continua) para asegurar el consumo diario de POX durante todo el estudio. POX es un extracto de granada estandarizado en función de su contenido de punicalaginas α + β. Los animales recibieron durante 10 días suplementos de un extracto de POX (contenido de punicalaginas, el 32,21%), que correspondía a 200mg de punicalaginas/día. Esta dosis se eligió basándose en estudios previos realizados en seres humanos, en los que se utilizaron dosis de entre 78mg/día de punicalaginas (evaluadas en pacientes con enfermedad coronaria que recibieron el suplemento durante 3 años y pacientes diabéticos durante 3 meses)16 y 380mg/día (pacientes sanos durante 4 semanas)17. Probelte Biotecnología S.L. (España) proporcionó el POX.
El día 10, 1h después de ingerirse la dieta, se evaluó la vasodilatación coronaria dependiente e independiente del endotelio in vivo mediante una infusión por catéter de sustancias vasoactivas en la arteria coronaria descendente anterior izquierda, según un método descrito con anterioridad15. Por lo que respecta a la pauta de tratamiento, Seeram et al18 describieron que las concentraciones plasmáticas máximas de un metabolito relacionado con la punicalagina, el ácido elágico, se alcanzaban 1h después de consumir zumo de granada. Al terminar el procedimiento experimental, los animales fueron sacrificados con una sobredosis de cloruro potásico.
Preparación y caracterización de Pomanox®El POX se preparó con frutas de granada recién recolectadas en el área mediterránea de España, según la Patente Europea EP196707919. Se cuantificaron las punicalaginas α + ß mediante cromatografía líquida de alto rendimiento/cromatografía de fase inversa con detección de ordenación de diodos. Las especificaciones de POX se presentan en la . El método analítico fue validado por Probelte Biotecnología S.L. por lo que respecta a linealidad, repetibilidad, reproducibilidad, recuperación y especificidad, según las directrices regulatorias: ICH Tema Q 2 R1 «Validación de procedimientos analíticos: texto y metodología» (6 de noviembre de 1996, incorporado en noviembre de 2005; ).
Estudios de reactividad vascularDiez días después de la dieta y 1h después de la última toma (con o sin suplemento de POX), se sedó a los animales con una inyección intramuscular de tiletamina + zolazepam (7mg/kg)+medetomidina (0,07mg/kg), se los intubó, y se mantuvo la anestesia con isoflurano (2%). En condiciones asépticas, se realizó una incisión en la parte ventral del cuello para exponer la arteria carótida y se llevó a cabo otra incisión en el tórax para proceder a la apertura torácica, extracción del pericardio y exposición del corazón. A continuación, se colocó cuidadosamente una sonda de flujo ultrasónico conectada a un flujómetro de sangre (Two-Channel Perivascular Flow System; ADInstruments) en la parte media de la arteria coronaria descendente anterior izquierda disecada. Se colocó una segunda sonda de flujo en la arteria carótida, con objeto de medir simultáneamente los cambios del flujo en los vasos grandes con fines de control (evaluación periférica). Tras haber realizado las mediciones del diámetro del vaso y los parámetros completos de hemodinámica en la situación basal, se evaluó la reactividad vascular mediante la administración intracoronaria de productos vasoactivos. Para ello, se realizó un cateterismo de la arteria coronaria principal izquierda. Todos los fármacos se diluyeron con una solución fisiológica de NaCl al 0,9% hasta un volumen de 1ml y se infundieron durante 30 s. Transcurrió un intervalo de al menos 15min entre el momento de completar la infusión de un fármaco y la administración del siguiente. La vasodilatación dependiente del endotelio se evaluó mediante la infusión intracoronaria de acetilcolina (vasodilatador operado por el receptor; de 10–9 a 10–6 mmol/l, Sigma) e ionóforo de calcio A23189 (vasodilatador no operado por el receptor; de 10–9 a 10–6 mmol/l, Sigma), mientras que la vasodilatación independiente del endotelio (relacionada con el músculo liso vascular) se evaluó con una curva de dosis-respuesta para SNP (nitroprusiato sódico, de 10–7 a 10–5 mmol/l). Las dosis de las sustancias vasoactivas, aunque causaron los efectos deseados tras la administración intracoronaria según lo descrito con anterioridad15,20, no indujeron cambio sistémico alguno. El papel de la vía de la óxido nítrico sintasa (NOS) en las respuestas de relajación se evaluó mediante la adición de L-NMMA (L-NG-monometilarginina) (10mg/kg; Sigma), un inhibidor de la NOS. Los datos se presentan en forma de cambio porcentual de las mediciones de la respuesta del flujo sanguíneo coronario entre la situación inicial y la del máximo tras la infusión del producto farmacológico (porcentaje de relajación). Se efectuó un registro continuo de la presión arterial media femoral y de la frecuencia cardiaca mediante un transductor de presión arterial y un electrocardiograma durante toda la intervención.
Análisis molecular de marcadores endotelialesAl sacrificar a los animales, se aisló cuidadosamente la arteria coronaria descendente anterior izquierda de todos ellos. Un fragmento se sometió a congelación rápida en nitrógeno líquido para el análisis molecular de los marcadores relacionados con el endotelio y otro fragmento se fijó en paraformaldehído al 4% y se incluyó en parafina para el análisis inmunohistoquímico del daño oxidativo del ADN.
Reacción en cadena de polimerasa en tiempo realSe determinó la concentración génica de NOS endotelial (eNOS) y proteína quimiotáctica monocitaria–1 (MCP–1) en la arteria coronaria de todos los animales. La expresión génica se evaluó con el sistema de detección de secuencia PCR-7000 en tiempo real ABIPRISM (Applied Biosystems). Se determinaron los valores de ciclo de umbral y se normalizaron para el gen constitutivo (housekeeping) 18SrRNA.
Análisis por Western blotEvaluamos la expresión proteica de Akt/PKB (Santa Cruz, #C-20) y Akt fosforilado en Ser473 (Cell Signaling, #9271), así como su efector distal eNOS (Cell Signaling, 9572#) y su forma activa, eNOS fosforilada en Ser1177 (Cell Signaling, #9571). Se evaluó también el contenido de MCP–1 (R&D System, #P0161) y se corrigió para la beta-actina. Los análisis densitométricos se realizaron con el programa ImageJ.
Daño oxidativo coronarioSe realizó una tinción de 8-hidroxiguanosina (Abcam ab48508) en muestras coronarias incluidas en parafina. Las imágenes se capturaron con un microscopio Nikon Eclipse 80i y se digitalizaron con la cámara Retiga 1300i Fast.
Marcadores oxidativos sistémicosOxidación de lipoproteínas de baja densidadSe determinó la resistencia de las lipoproteínas de baja densidad (LDL) a la oxidación inducida por cobre en muestras de sangre en EDTA (ácido etilendiaminotetraacético) obtenidas de todos los animales basalmente y al final del periodo de 10 días de consumo de la dieta21. Se determinó también el contenido de peróxido lipídico de las LDL oxidadas mediante la evaluación de las sustancias reactivas al ácido tiobarbitúrico.
Actividad antioxidante de las lipoproteínas de alta densidadSe evaluó la capacidad antioxidante de las lipoproteínas de alta densidad (HDL) en HDL aisladas del suero de todos los animales basalmente y el día 10 determinando el potencial antioxidante de atrapamiento de radicales total de las HDL, según un método descrito con anterioridad22,23. Dicho método se basa en la capacidad de las HDL de proteger las LDL de la oxidación (LDL de control).
Análisis estadísticoLos resultados se presentan en forma de media±error estándar de la media. Después de evaluar la distribución normal de los datos con la prueba de normalidad de Shapiro-Wilk, se determinó la significación estadística mediante un análisis de la varianza de una vía, seguido de un análisis post-hoc de la diferencia menos significativa con protección de Fisher o con la prueba de la t de Student para datos apareados, según fuera necesario. Se consideró estadísticamente significativos los valores de p<0,05. Todos los análisis estadísticos se llevaron a cabo con el programa informático Statview.
RESULTADOSDeterminaciones clínicas, bioquímicas y hematológicasEl aumento de peso a lo largo de todo el estudio fue comparable entre los cuatro grupos de animales (NC, 4,3±0,9kg; NC + POX, 3,8±0,4kg; HC, 3,9±0,5kg; HC + POX, 4,1±0,4kg). Tal como se indica en la tabla A, la administración a corto plazo (10 días) de esta dieta rica en colesterol/rica en grasas elevó de manera significativa la media de concentración plasmática de colesterol, colesterol unido a LDL y colesterol unido a HDL en comparación con los valores iniciales. Esta dieta hipercolesterolémica de tipo occidental condujo a unos valores del cociente de colesterol total/colesterol unido a HDL ≈ 4 y de colesterol no-HDL > 280mg/dl, que son similares a los observados en humanos con hipercolesterolemia. Los valores de glucosa y triglicéridos se mantuvieron inalterados en todos los grupos de animales durante todo el estudio. No se detectaron cambios en los parámetros renales y hepáticos (tabla B) ni en los valores del hemograma en todo el estudio (). Estudios previos de seguimiento a más largo plazo ya respaldaban la seguridad de la administración de punicalaginas24.
Seguimiento de concentraciones de glucosa y lípidos y parámetros hepáticos y renales
| A. Glucosa y lípidos | Glucosa (mg/dl) | Triglicéridos (mg/dl) | Colesterol (mg/dl) | HDL (mg/dl) | LDL (mg/dl) | LDL/HDL | Colesterol no-HDL (mg/dl) | Cociente colesterol total/HDL |
|---|---|---|---|---|---|---|---|---|
| HC | ||||||||
| Control | ||||||||
| Inicial | 112±19 | 24±4 | 101±3 | 66±7 | 52±10 | 0,8±0,1 | 34,7±5 | 1,6±0,2 |
| Día de experimento | 111±10 | 26±2 | 395±20a | 94±7a | 286±140a | 2,8±1,1a | 301,0±25* | 4,2±0,3a |
| POXb | ||||||||
| Inicial | 137±25 | 21±4 | 114±5 | 54±3 | 50±7 | 0,9±0,1 | 48,0±7 | 2,0±0,1 |
| Día de experimento | 135±11 | 19±4 | 475±41a | 113±9a | 353±114a | 3,2±1,1a | 361,0±54a | 4,2±0,2a |
| NC | ||||||||
| Control | ||||||||
| Inicial | 84±13 | 27±8 | 96±10 | 36±3 | 64±4 | 1,1±0,2 | 64,0±10 | 2,4±0,3 |
| Día de experimento | 76±11 | 24±15 | 95±8 | 32±3 | 32±5 | 1,1±0,2 | 63,0±4 | 2,6±0,3 |
| POXb | ||||||||
| Inicial | 111±10 | 39±5 | 109±7 | 47±5 | 47±4 | 1,0±0,2 | 54,0±3 | 2,4±0,4 |
| Día de experimento | 115±24 | 35±4 | 102±4 | 48±3 | 41±4 | 1,3±0,6 | 53,0±11 | 2,7±0,7 |
| HC (aumento frente a valor basal) | ||||||||
| Control | 27±7c | 341±97d | ||||||
| POXb | 59±9c | 303±133d | ||||||
| B. Parámetros hepáticos y renales | Urea (mg/dl) | Creatinina (mg/dl) | GGT (U/l) | GOT (U/l) | GPT (U/l) | |||
|---|---|---|---|---|---|---|---|---|
| HC | ||||||||
| Control | ||||||||
| Inicial | 14±1 | 1,7±0,1 | 38±7 | 19±3 | 38±2 | |||
| Día de experimento | 34±5 | 1,8±0,1 | 36±5 | 37±12 | 36±5 | |||
| POXb | ||||||||
| Inicial | 14±3 | 1,2±0,2 | 36±5 | 26±6 | 35±4 | |||
| Día de experimento | 27±3 | 1,3±0,1 | 32±3 | 28±6 | 36±2 | |||
| NC | ||||||||
| Control | ||||||||
| Inicial | 18±3 | 1,1±0,1 | 37±3 | 25±4 | 34±4 | |||
| Día de experimento | 20±4 | 1,3±0,1 | 40±5 | 24±3 | 29±4 | |||
| POXb | ||||||||
| Inicial | 17±1 | 1,3±0,1 | 30±1 | 24±5 | 24±2 | |||
| Día de experimento | 17±2 | 1,2±0,1 | 28±4 | 23±4 | 26±4 | |||
GGT: gamma-glutamiltransferasa; GOT: transaminasa glutámico oxalacética; GPT: transaminasa glutámico pirúvica; HC: hipercolesterolémico; HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad; NC: normocolesterolémico. POX: Pomanox®.
Los datos expresan media ± error estándar de la media.
Todos los animales presentaban similar tamaño de las arterias coronarias (mediana, 0,25±0,06cm) y carótidas (mediana, 0,32±0,01cm).
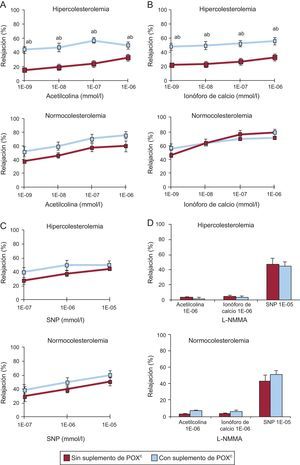
Los animales alimentados con la dieta HC durante 10 días presentaron una disfunción endotelial coronaria que se ponía de manifiesto en una reducción intensa (disminución del 50%) de la capacidad de relajación inducida por la acetilcolina (figura 1A) y por el calcio (figura 1B) en comparación con los animales NC (p<0,05). Este deterioro de la vasodilatación se evidenció con todas las dosis evaluadas de ambos productos vasoactivos y dependiente de la dosis (figuras 1A y B).
Gráficos que muestran la respuesta de relajación a (A) acetilcolina, (B) ionóforo de calcio, (C) nitroprusiato sódico y (D) L-NG-monometilarginina en la arteria coronaria de animales con normolipemia e hipercolesterolemia. L-NMMA: L-NG-monometilarginina; POX: Pomanox®; SNP: nitroprusiato sódico. Los datos se expresan en forma de porcentaje en relación con la determinación basal (media ± error estándar de la media). ap < 0,05 frente a animales con alimentación normocolesterolémica. bp < 0,05 frente a animales con alimentación hipercolesterolemica. cN = 6 animales por grupo.
Los suplementos de POX restablecieron significativamente la capacidad de vasodilatación dependiente del endotelio en los animales alimentados con una dieta HC, y se alcanzaron porcentajes de relajación coronaria similares a los observados en los animales NC (p<0,05 frente a HC; p=0,87 frente a NC). De hecho, los suplementos de POX mejoraron tanto la vasodilatación mediada por receptores (inducida por acetilcolina) como la no operada por receptores (inducida por ionóforo de calcio) en todos los animales dislipémicos.
En cambio, todos los animales NC sanos presentaron respuestas vasodilatadoras comparables, con independencia de los suplementos de POX, y no se observó un efecto vasodilatador adicional mediado por la acetilcolina o por el ionóforo de calcio en los animales alimentados con POX (figuras 1A y B).
Los cuatro grupos de animales presentaron similar relajación dependiente de la dosis en respuesta a SNP (figura 1C), lo cual respalda que no hay influencia en la función del musculo liso vascular y confirma los efectos asociados a POX centrados en la función de las células endoteliales.
El pretratamiento con L-NMMA produjo una abolición casi completa del efecto vasodilatador de las dosis altas de acetilcolina y ionóforo de calcio en todos los animales, mientras que la adición de NO (óxido nítrico) exógeno (es decir, SNP) restableció la respuesta de relajación coronaria (figura 1D), lo cual indica nuevamente un efecto impulsado por el NO endotelial.
El flujo carotídeo se mantuvo inalterado durante todo el periodo experimental (variación del 2±1% respecto a las determinaciones iniciales). De igual modo, la presión femoral y la frecuencia cardiaca de todos los animales no se vieron afectadas tras la administración intracoronaria de los fármacos vasoactivos ().
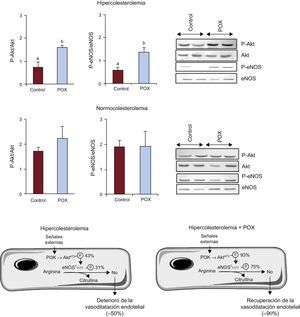
Mecanismos de acción de Pomanox® en la arteria coronariaEje Akt/óxido nítrico sintasa endotelialLa dislipemia condujo a una disminución significativa de la activación del eje Akt/eNOS en comparación con lo observado en los animales NC (figura 2; p<0,05); sin embargo, esta función se restableció casi por completo con el suplemento de POX. En los animales que recibieron NC + POX se observó un grado de activación de Akt/eNOS similar al detectado en los animales de control con NC (figura 2). No se observaron cambios en la concentración de ARNm de eNOS en ninguno de los grupos de animales (HC, 1,7±0,6; HC + POX, 1,7±0,5; NC, 1,6±0,4; NC + POX, 1,2±0,3 eNOS, ARNm/18SrRNA).
Activación del eje Akt/óxido nítrico sintasa endotelial en la arteria coronaria de animales con alimentación hipercolesterolémica y normocolesterolémica e imágenes representativas de Western blot. Diagrama que ilustra los mecanismos involucrados en la activación de óxido nítrico sintasa endotelial y la posterior liberación de óxido nítrico y el grado de expresión del eje Akt/óxido nítrico sintasa endotelial en animales con alimentación hipercolesterolémica (con y sin Pomanox®), tomando como 100% el valor de los animales sanos con alimentación ordinaria (controles normocolesterolémicos; n=6 animales por grupo). eNOS: óxido nítrico sintasa endotelial; POX: Pomanox®.
ap < 0,05 frente a animales con alimentación normocolesterolémica.
bp < 0,05 frente a animales con alimentación hipercolesterolémica.
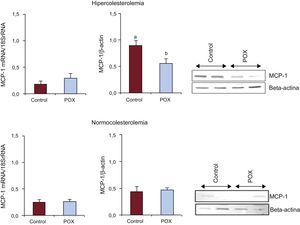
Los animales del grupo HC presentaron un aumento del contenido de MCP–1 coronaria en comparación con NC (p<0,05; figura 3). Sin embargo, los suplementos de POX redujeron significativamente, en alrededor de un 50%, la expresión de esta quimiocina inflamatoria en los animales con dislipemia hasta niveles comparables a los observados en condiciones no proaterogénicas (figura 3). No se observaron cambios de la expresión génica entre los diversos grupos de animales.
Efecto de los suplementos de Pomanox® en el contenido coronario de proteína quimiotáctica monocitaria–1 (expresión de ARNm y proteína) en animales hipercolesterolémicos y normocolesterolémicos (n=6 animales por grupo). MCP-1: proteína quimiotáctica monocitaria-1; POX: Pomanox®.
ap < 0,05 frente a animales con alimentación normocolesterolémica.
bp < 0,05 frente a animales con alimentación hipercolesterolémica.
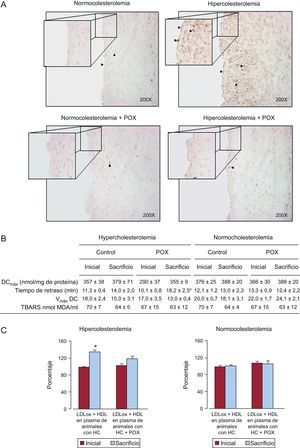
Tal como se muestra en la figura 4A, las células positivas para 8-OHdG aumentaron significativamente en las arterias coronarias de todos los animales HC, en comparación con los NC, y afectaron tanto a la capa endotelial como a la íntima. Los suplementos de POX de los animales con hiperlipemia protegieron del daño oxidativo inducido por la hipercolesterolemia, ya que el número de células positivas para 8-OHdG fue desdeñable, tal como se observó en los animales sanos alimentados con una dieta NC.
Potencial antioxidante de Pomanox®. A: daño oxidativo del ADN coronario evaluado mediante 8-OH-dG. La suplementación con Pomanox® previno el estrés oxidativo vascular inducido por la hiperlipemia tanto en las células endoteliales como en la íntima (puntas de flecha). Estas imágenes representativas reflejan perfectamente lo que se observó de manera constante en los diferentes grupos de animales. B: oxidación de partículas de lipoproteínas de baja densidad. C: potencial antioxidante de las lipoproteínas de alta densidad, expresado como porcentaje de la oxidación de lipoproteínas de baja densidad (lipoproteínas de baja densidad de control oxidadas ≈ 100%) (n=6 animales por grupo). DCmáx: concentración máxima de dienos conjugados; HC: hipercolesterolémica; HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad; LDLox; lipoproteínas de baja densidad oxidadas; POX: Pomanox®; TBARS: sustancias reactivas al ácido tiobarbitúrico; Vmáx DC: velocidad máxima de formación de dienos conjugados. *p < 0,05 frente al valor inicial.
Los suplementos de POX condujeron a un aumento significativo (p<0,05) de la resistencia de las LDL a la oxidación in vitro, determinada por la prolongación del tiempo de retardo (a casi el doble) desde la situación basal al final del periodo de 10 días de POX en los animales que recibieron una dieta HC (figura 4B). La oxidación de las LDL no se vio afectada por los suplementos de POX en condiciones NC.
No se detectaron diferencias en la capacidad de las LDL de alcanzar la oxidación (concentración máxima de dienos conjugados y velocidad máxima de formación de dienos conjugados) ni en las sustancias reactivas al ácido tiobarbitúrico en los cuatro grupos de animales (figura 4B).
Las HDL aisladas de animales a dieta HC que recibieron suplementos de POX mostraron una actividad antioxidante significativamente superior frente a la oxidación de las LDL, en comparación con los animales con dieta HC y sin suplementos de POX, y alcanzaron cifras comparables a las observadas en la situación inicial (figura 4C). En cambio, las partículas de HDL aisladas de animales con alimentación HC no pudieron contrarrestar la oxidación de las LDL y mostraron un potencial antioxidante significativamente inferior al de la situación inicial. No se observaron cambios en los animales alimentados con NC (con y sin suplementos de POX).
DISCUSIÓNEn el presente estudio se demuestra, en un modelo porcino in vivo con semejanzas con el ser humano, que la suplementación de la dieta con un extracto de granada rico en punicalaginas (POX, 200mg/día) previenen el deterioro inducido por la hiperlipemia en la vasorrelajación coronaria dependiente del endotelio, un efecto beneficioso que comporta activación del eje Akt/eNOS, menos expresión de MCP–1, disminución del daño oxidativo en las arterias coronarias y una disminución general del estrés oxidativo sistémico. En cambio, la suplementación con POX a animales sanos alimentados con un pienso ordinario y con células endoteliales plenamente funcionales no causó efecto alguno.
En este estudio se muestra en un modelo animal preclínico, determinando la reactividad del flujo coronario, que la suplementación con POX durante un periodo corto (10 días) previene la disfunción endotelial coronaria inducida por hipercolesterolemia, con lo que se adquiere una capacidad de vasodilatación vascular igual a la observada en los animales sanos normales con alimentación ordinaria. De hecho, no se detectó ninguna ventaja adicional en cuanto a la vasorrelajación en los animales sanos alimentados con una dieta NC, ya que el endotelio era ya totalmente funcional en la situación inicial. Sin embargo, en estudios previos en el ser humano se ha demostrado que los individuos que tienen mayor riesgo de enfermedad coronaria obtienen un efecto beneficioso de las propiedades de la granada mayor que los voluntarios sanos25,26.
Cada vez hay más evidencia de que la alteración de la vía de activación de la eNOS y/o la reducción de la disponibilidad de NO contribuyen a producir la disfunción endotelial, que es la característica distintiva de la aterosclerosis27. Se ha demostrado que el restablecimiento producido por POX de la disfunción endotelial coronaria inducida por la hipercolesterolemia en el cerdo se asocia a la activación del eje Akt/eNOS. De hecho, POX induce una relajación mediada por NO a través de un mecanismo en el que interviene la activación endotelial de Akt y la fosforilación de la eNOS en Ser1177 (es decir, activación de la eNOS) en grado comparable a lo observado en condiciones normales. Es interesante señalar que no se observaron cambios en la cantidad total de proteína NOS. Además, la activación de eNOS no solo es dependiente de la fosforilación, sino que también se asocia a un aumento del Ca2+ intracelular28. Se describe aquí que la suplementación con POX en animales con dislipemia restablece tanto la estimulación de eNOS dependiente de receptores muscarínicos como la dependiente de A23187 (un ionóforo de Ca2+), lo cual probablemente conlleve un aumento del calcio intracelular28. Dado que es probable que muchas enzimas intracelulares metabolicen las punicalaginas, sus efectos en la activación de la eNOS pueden deberse a los metabolitos derivados. Serán necesarios nuevos estudios para determinar si los metabolitos relacionados con las punicalaginas (p. ej., las urolitinas) pueden inducir realmente la actividad de la eNOS.
El estrés oxidativo, que es un desequilibrio entre la formación de radicales libres y la capacidad antioxidante, es un factor contribuyente principal en la ECV, que desencadena también reacciones inflamatorias29. El estrés oxidativo induce la inflamación mediante una acción sobre las vías que generan mediadores inflamatorios, como las moléculas de adhesión y las citocinas/quimiocinas proinflamatorias (p. ej., la MCP–1). Estudios recientes realizados en pacientes con ECV han mostrado asociaciones positivas significativas entre el estrés oxidativo y la inflamación y los indicadores del daño vascular, como el deterioro de la función endotelial30.
Estos resultados indican que un consumo a corto plazo de punicalaginas logró abolir las células positivas para 8-OHdG en la capa endotelial y la íntima de las arterias coronarias de animales con dislipemia, lo cual indica protección contra el daño celular inducido por la hipercolesterolemia en los vasos sanguíneos. Se ha demostrado que el 8–OHdG es un biomarcador sensible al daño del ADN intracelular inducido por el estrés oxidativo in vivo31. Al mismo tiempo, se ha observado un aumento significativo de la resistencia de las LDL circulantes a la oxidación y un mayor potencial antioxidante de las HDL. Estos efectos antioxidantes locales y sistémicos producidos por POX en situaciones de hiperlipemia, junto con una notable disminución de la expresión de MCP-1 coronaria (inducida por la dieta HC), pueden ser útiles para explicar la mejoría detectada en la función coronaria. Se sabe que la MCP-1 es esencial en el inicio de la aterosclerosis, pues interviene en el reclutamiento monocitario hacia los vasos dañados32. Hasta el momento, la granada ha mostrado actividad antiinflamatoria al inhibir la producción de citocinas/quimiocinas proinflamatorias en células cancerosas33 y en el modelo intestinal in vitro Caco–234.
Consideradas conjuntamente, estas observaciones respaldan la conclusión de que la suplementación con POX puede retardar la aparición de la enfermedad aterosclerótica. De hecho, los polifenoles de la dieta, a diferencia de las vitaminas y los betacarotenos, parecen ser más eficaces en la cardioprotección7. Los estudios realizados en pacientes con estenosis de la arteria carótida que tomaron zumo de granada durante 3 años mostraron claramente una reducción del tamaño de las lesiones ateroscleróticas, además de una reducción del estrés oxidativo sérico y un aumento de la actividad de paraoxonasa en suero (enzima antioxidante asociada a las HDL)35.
Por lo que respecta al posible efecto de la granada en el tratamiento de la hiperlipidemia/glucemia, describimos que un suplemento oral de POX durante 10 días no afecta a la concentración de glucosa, pero tiende a un mejor perfil lipídico (tabla). La administración diaria de zumo de granada (equivalente a 1,5 mmol de polifenoles totales) durante 3 meses a pacientes con diabetes mellitus tipo 2 no produjo ninguna modificación en los perfiles lipídico y glucídico16. Sin embargo, el consumo de 40 g de granada al día durante 2 meses por pacientes con diabetes mellitus tipo 2 e hiperlipemia manifiesta produjo una disminución significativa del colesterol total y el colesterol unido a LDL, aunque no se observaron cambios en el colesterol unido a HDL o la glucemia36. Estas observaciones discrepantes podrían explicarse por la composición o las dosis de granada utilizadas, así como por la duración de la ingesta. El contenido de punicalaginas del zumo de granada depende de múltiples factores (la variedad de granada, la época de recolección, el procesamiento del zumo, etc)37 y serían necesarias 3-4 piezas de fruta (340ml de zumo de granada exprimida) para alcanzar las dosis de punicalaginas evaluadas aquí (200mg). Más tiempo de suplementación con POX podría aportar también un efecto beneficioso adicional claro en cuanto a los parámetros lipídicos.
Por último, el posible beneficio en salud producido por la granada, tanto como fruta entera como en zumo o extracto de fruta entera, está respaldado por varios estudios de pequeño tamaño en humanos, que han mostrado posibles efectos beneficiosos en ECV, cáncer, diabetes mellitus, trastornos odontológicos, infecciones bacterianas y resistencia a antibióticos, entre otros38. Estos resultados pueden explicar, en parte, los mecanismos biológicos que subyacen a los efectos beneficiosos detectados en el contexto de salud cardiovascular humana tras el uso diario y crónico de suplementos de granada. Así, la mejora de la señalización de Akt/eNOS coronaria, con la consiguiente liberación de NO, junto con una reducción del estrés oxidativo y la inflamación, puede haber contribuido a la mejora de la isquemia miocárdica inducida por el estrés que se detecta en los pacientes con enfermedad coronaria25, así como la reducción de la carga aterosclerótica observada en los pacientes con estenosis de la arteria carótida35.
CONCLUSIONESEn general, este estudio respalda que la inclusión de POX en la dieta puede retardar la aparición de disfunción vascular y aterosclerosis en los estadios iniciales en individuos que tienen una dieta rica en grasas. De hecho, los resultados indican también que los posibles efectos beneficiosos de este suplemento enriquecido en polifenoles se detectan únicamente en un contexto de hiperlipemia. En consecuencia, se puede plantear la hipótesis de que la influencia clínica de la toma de POX en pacientes tratados con estatinas y con un perfil lipídico controlado mediante estatinas podría estar subestimado, sobre todo teniendo en cuenta que se ha demostrado ya que las estatinas mejoran la disfunción endotelial directamente mediante la modulación de los parámetros lipídicos u otros efectos bien conocidos no relacionados con los lípidos («los efectos pleotrópicos»)39.
Conviene mencionar que los resultados existentes indican una amplia presencia de enfermedad vascular en los adolescentes, así como en los adultos sanos40. El hecho de que la granada tenga efectos protectores contra la disfunción vascular temprana indica que puede ser un producto nutracéutico eficaz tanto para pacientes con factores de riesgo cardiovascular como individuos que llevan un estilo de vida cardiosaludable.
FINANCIACIÓNEste trabajo fue financiado por el PNS (Programa Nacional de Salud) —proyecto SAF2013-42962-R concedido a L. Badimon— y PNS-SAF012-40208 concedidos a Gemma Vilahur, y CEN-20101016 (HENUFOOD) del CDTI-MINECO (Centro para el Desarrollo Tecnológico Industrial-Ministerio de Competitividad y Economía) (concedido a L. Badimon). G. Vilahur es investigadora del programa Ramón y Cajal con un contrato con el MICINN (RyC-2009-5495, MICINN, España).
CONFLICTO DE INTERESESJ.A. López y S. Streitenberger son empleados de Probelte Biotecnología S.L.
Todos los autores leyeron y aprobaron el manuscrito final. Agradecemos y valoramos especialmente la ayuda prestada por P. Catalina, M.A. Canovas, F.J. Rodriguez, J.J. Andres, O.J. Babot y M.A. Velasco en el manejo y cuidado de los animales y en la realización adecuada del trabajo experimental y molecular.
Damos las gracias a Probelte Biotecnología S.L. por proporcionarnos Pomanox®. Agradecemos a la Fundación Jesús Serra de Barcelona su continuo apoyo.