Durante el embarazo se produce una serie de cambios en la función cardiovascular que son necesarios para la buena evolución de la gestación. Además, las adaptaciones que ocurren durante la gestación pueden agravar las enfermedades cardiovasculares preexistentes. Por lo tanto, estas modificaciones pueden suponer importantes desafíos terapéuticos en el manejo de la paciente cardiológica durante el embarazo. El número de mujeres embarazadas en riesgo de sufrir complicaciones cardiovasculares está aumentando significativamente, por lo que identificar los factores de riesgo que predicen enfermedades cardiacas es de vital importancia para una correcta detección sistemática en la gestante. En el caso de enfermedades preexistentes, como la hipertensión pulmonar, es importante que la paciente reciba asesoramiento antes del embarazo, y en el caso de alteraciones subyacentes enmascaradas por el embarazo o nuevas complicaciones como la preeclampsia, es estrictamente necesario realizar un seguimiento adecuado y tratar las complicaciones cardiovasculares. Por último, es esencial que los obstetras y los cardiólogos trabajen en conjunto para resolver adecuadamente la disfunción cardiovascular en la paciente obstétrica.
Palabras clave
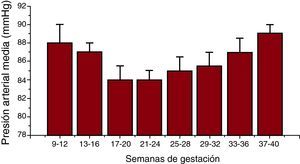
En un embarazo normal se produce una serie de cambios cardiovasculares, como el aumento del gasto cardiaco, la distensibilidad arterial y el volumen de líquido extracelular o la disminución de la presión arterial (PA) y la distensibilidad periférica total1. Durante el embarazo, la PA media disminuye gradualmente hasta llegar a su pico más bajo entre las semanas 16 y 202, y a partir de la mitad del tercer trimestre comienza a subir hasta llegar a unas cifras cercanas a las de antes del embarazo (Figura 1). Esta disminución de la PA afecta tanto a la PA sistólica (PAS) como a la PA diastólica (PAD), aunque la disminución de la PAD es mayor.
Figura 1. Presión arterial media en mujeres embarazadas (adaptado de Moutquin et al 2 ).
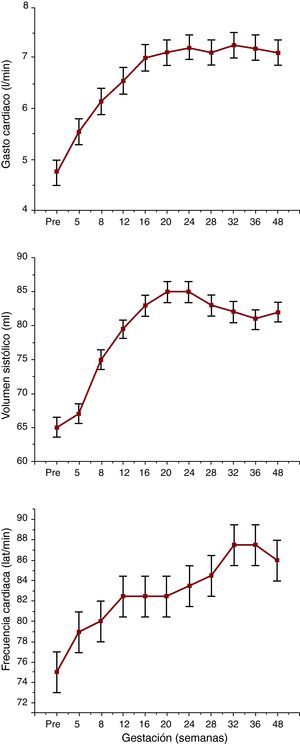
Además, el flujo sanguíneo hacia ciertos órganos aumenta para cubrir las mayores necesidades metabólicas de los tejidos, de modo que el retorno venoso y el gasto cardiaco aumentan drásticamente durante el embarazo. El gasto cardiaco va aumentando durante los primeros dos trimestres hasta alcanzar sus valores más altos hacia la semana 16 de gestación3. En la quinta semana de gestación ya encontramos establecido este aumento del gasto cardiaco, que llega hasta un 50% por encima de los valores previos al embarazo entre las semanas 16 y 20. A las 20 semanas deja de subir y permanece elevado hasta el parto. Esta elevación se asocia con un aumento del volumen sistólico y la frecuencia cardiaca (FC) (Figura 2). La presión circulatoria media de llenado, un determinante principal del retorno venoso, también sube durante el embarazo; por el contrario, la resistencia del retorno venoso se reduce sustancialmente.
Figura 2. Cambios en el gasto cardiaco, el volumen sistólico y la frecuencia cardiaca en el embarazo (adaptado de Hunter et al 3 ).
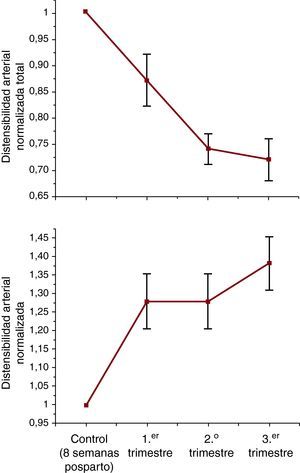
El aumento del gasto cardiaco y la ligera bajada de la PA en el embarazo se asocian con una importante disminución de la resistencia vascular sistémica4. La resistencia periférica total disminuye al principio del embarazo y sigue bajando durante el segundo y el tercer trimestre, cada vez con menos intensidad a medida que se aproxima el parto (Figura 3). La distensibilidad arterial también sufre ciertos cambios: va aumentando durante el primer trimestre y permanece elevada durante el resto del embarazo, de modo que en un embarazo normal se produce la disminución de la poscarga, tanto de la estática como de la pulsátil.
Figura 3. Cambios en la resistencia vascular total y la distensibilidad arterial en un embarazo normal (adaptado de Poppas et al 4 ).
Aunque todavía no conocemos con exactitud los mecanismos que median los cambios en la hemodinámica sistémica, hay una serie de factores implicados en los cambios fisiológicos del sistema vascular que ocurren durante el embarazo. Existen pruebas sustanciales de que la producción de óxido nítrico (NO) aumenta durante el embarazo normal, y que este aumento está implicado en la vasodilatación que ocurre en el embarazo5. La inhibición de la síntesis de NO en modelos animales disminuye el descenso de la resistencia periférica total y el aumento del gasto cardiaco asociados con el embarazo.
También hay ciertos factores hormonales, como los estrógenos y la relaxina, implicados en la estimulación de la producción de NO en el embarazo. Se ha comprobado que la relaxina, producida principalmente por el cuerpo lúteo, reduce permanentemente la resistencia periférica total y aumenta el gasto cardiaco y la distensibilidad arterial sistémica6. Además, la neutralización por anticuerpos de la relaxina endógena circulante durante la primera etapa del embarazo disminuye las alteraciones del gasto cardiaco, la resistencia vascular sistémica y la distensibilidad arterial. Por otro lado, se piensa que estos efectos de la relaxina están mediados por interacciones entre los receptores de la endotelina B y el NO, con lo que la relaxina parece estar implicada en muchas de las adaptaciones cardiovasculares del embarazo a través de mecanismos independientes del NO.
EMBARAZO Y CARDIOPATÍAA pesar de que afecta sólo a un pequeño número de casos, la cardiopatía en el embarazo causa una significativa morbimortalidad no obstétrica en la madre y el feto7. El embarazo es un estado que se asocia a cambios hemodinámicos importantes, específicamente a expansión del volumen y aumento del gasto cardiaco, lo que en el contexto de la cardiopatía subyacente en el embarazo puede originar una descompensación cardiaca y la muerte del feto. Además de los cambios hemodinámicos impuestos por el propio embarazo, durante el parto pueden darse factores, como la vasodilatación periférica inducida por la anestesia o la pérdida de sangre, que agraven la disfunción cardiaca en mujeres con una cardiopatía subyacente importante (Tabla 1).
Tabla 1. Enfermedades asociadas con alto riesgo de complicaciones en mujeres embarazadas
| Hipertensión pulmonar |
| Síndrome de Eisenmenger |
| Síndrome de Marfan con dilatación de la aorta |
| Disfunción sistólica grave del ventrículo izquierdo |
| Miocardiopatía periparto |
| Preeclampsia grave |
La detección de cardiopatías congénitas es cada vez más prevalente en mujeres en edad de concebir, gracias a las nuevas modalidades de diagnóstico y técnicas de reparación8. Es más, la cardiopatía adquirida es más prevalente ahora que muchas mujeres están posponiendo el embarazo, con el consiguiente aumento del riesgo de enfermedad cardiovascular por hipertensión (HT), diabetes mellitus y obesidad. Es de vital importancia realizar una evaluación de riesgos en mujeres con una cardiopatía subyacente. De hecho, de un estudio prospectivo que estudió a 562 mujeres con cardiopatía, el 13% de los embarazos se complicaron con eventos cardiacos primarios, definidos como edema, arritmia, infarto cerebral o muerte cardiaca9. Los predictores de eventos cardiacos utilizados en ese estudio fueron: episodios cardiacos previos o arritmias, una clase funcional deficiente (definida como insuficiencia cardiaca [IC] III-IV según la New York Heart Association [NYHA]) o cianosis, la obstrucción cardiaca izquierda (área de la válvula mitral < 2cm2, área de la válvula aórtica < 1,5cm2 o gradiente máximo de presión en el tracto de salida del ventrículo izquierdo [VI] > 30mmHg) y la disfunción del VI, definida como fracción de eyección (FE) del VI < 40%. En definitiva, es imprescindible que se aconseje a las mujeres con enfermedades cardiacas, adquiridas o congénitas, no quedarse embarazadas, y que se las someta a evaluación y seguimiento adecuados si es pertinente.
INSUFICIENCIA CARDIACAEspecialmente en el tercer trimestre del embarazo, los cambios hemodinámicos pueden causar una descompensación clínica en mujeres con miocardiopatías subyacentes. En la exploración física de las embarazadas es normal observar taquicardia, ritmo de galope S3, soplo sistólico, edema periférico y, en ocasiones, distensión venosa yugular, lo que puede dificultar el diagnóstico de IC. También es frecuente que muchas embarazadas sufran síntomas como disnea u ortopnea, que pueden ocultar una disfunción del VI subyacente. En estos casos puede ser útil el uso de pruebas diagnósticas que midan la concentración de péptido natriurético cerebral o el ecocardiograma.
Las mujeres con una disfunción sistólica del VI constante como enfermedad de base pueden tener un embarazo sin percances si el cardiólogo y el obstetra realizan un seguimiento coordinado, en el que se vigile la descompensación tanto de la madre como del feto, aunque bien es cierto que el riesgo asociado sigue siendo más elevado para ambos. En este tipo de pacientes, los objetivos del tratamiento médico son aliviar la sobrecarga de volumen con diuréticos y optimizar el tratamiento médico para controlar la PA y reducir la sobrecarga. El manejo de las embarazadas con IC debe ser similar al de los pacientes que no lo están, excepto en el caso del uso de inhibidores de la enzima de conversión de la angiotensina o antagonistas de los receptores de la angiotensina II, por su elevado riesgo de efectos adversos para el feto. A cambio, la reducción de la poscarga se puede conseguir con vasodilatadores arteriales como la hidralazina como único fármaco o en combinación con nitratos de acción prolongada. Los bloqueadores beta suelen ser seguros en embarazadas con disfunción sistólica crónica, pero deben evitarse en las que tengan IC aguda descompensada. Es preferible usar bloqueadores beta-1 selectivos para minimizar la vasodilatación periférica y la relajación uterina inducidas por los agentes que producen bloqueo beta-2. La digoxina, un agente inotrópico, es por lo general segura en el embarazo, pero se debe hacer un seguimiento de sus concentraciones, ya que un exceso de digoxina puede tener resultados perjudiciales10. Las mujeres que presentan IC descompensada suelen necesitar una terapia diurética más agresiva y, en ocasiones, agentes inotrópicos de refuerzo en combinación con dobutamina o inhibidores de las fosfodiesterasas, como la milrinona, que también ayuden a la vasodilatación.
Tanto la IC como el embarazo están asociados a un estado de hipercoagulación, y no existen unas guías claras sobre su manejo en embarazadas con disfunción sistólica significativa del VI, aunque en pacientes con una FE < 30-35% se puede usar la anticoagulación profiláctica para prevenir los trombos intracardiacos y las embolias11. La warfarina suele estar contraindicada durante el primer trimestre del embarazo por su teratogenicidad, pero en su lugar se puede usar heparina no fraccionada (HNF) o heparina de bajo peso molecular (HBPM). Las guías actuales recomiendan HBPM o HNF subcutánea dos veces al día durante el embarazo o dos veces al día hasta la semana 13, seguida de warfarina desde la semana 13 a la 35, para volver a la HBPM o HNF hasta el parto12.
MIOCARDIOPATÍA PERIPARTOLa miocardiopatía periparto (MCPP) se define como la aparición de disfunción sistólica del VI e IC entre el último mes de embarazo y los primeros 5 meses después de dar a luz, en ausencia de otro factor que cause la disfunción del VI13. Su etiología todavía no está clara, pero podría estar relacionada con la inflamación, la activación del sistema inmunitario o la miocarditis. Su presentación clínica es parecida a las otras formas de IC, y el tratamiento que se da a estas mujeres es similar que con otras miocardiopatías. Tampoco se ha establecido con exactitud la utilidad de la biopsia endomiocárdica, pero puede ayudar a identificar a pacientes con signos de miocarditis. En un estudio retrospectivo en el que se comparó a 6 mujeres con MCPP tratadas con inmunoglobulina intravenosa (IGIV) y 11 controles tratadas de manera convencional, las tratadas con IGIV experimentaron una mejoría significativamente superior de la FE (aumento del 26±8% frente al 13±13%) a los 6 meses14. También existe en un pequeño estudio sobre el tratamiento con bromocriptina, que obtuvo una mejoría significativa de la FE con respecto a la terapia convencional15. No obstante, al igual que con la IGIV, necesitamos más estudios sobre el uso de estos dos medicamentos, además del tratamiento estándar de la IC, para poder determinar su seguridad y su eficacia en el contexto de la MCPP. La función ventricular mejora en aproximadamente la mitad de las pacientes, pero es más difícil que la función sistólica del VI se normalice en pacientes con una FEVI < 30%16, una dimensión telediastólica del VI > 6cm17 y concentraciones de troponina T elevadas18 en el momento del diagnóstico. La probabilidad de recurrencia de la disfunción sistólica del VI es relativamente alta en mujeres en quienes se ha normalizado la FE, por lo que se debe aconsejarlas, al igual que a cualquier mujer con antecedentes de MCPP, no quedarse embarazadas de nuevo, ya que tienen mayor riesgo de sufrir IC y, posiblemente, muerte.
ENFERMEDAD VALVULARLa enfermedad valvular engloba lesiones congénitas y adquiridas, y los riesgos para la madre y el feto suelen variar en función de la lesión específica y la clasificación funcional de la madre. Como ya hemos comentado, las lesiones asociadas con una clase funcional más deficiente según la NYHA (III-IV) o con una FE más baja tienen peor pronóstico. La estenosis mitral (EM) secundaria a enfermedad reumática es la lesión valvular más común en las embarazadas. La taquicardia asociada al embarazo disminuye el tiempo de llenado diastólico del VI, lo que aumenta el gradiente de presión transmitral y la presión de la aurícula izquierda y puede comprometer el estado hemodinámico de la madre. Durante el parto, la FC aumenta todavía más debido al trabajo de parto y el dolor y puede originar una disminución significativa en el ya limitado gasto cardiaco. En estas pacientes, se pueden utilizar bloqueadores beta o antagonistas del calcio para reducir la taquicardia. Sin embargo, se debe tener cuidado y evitar una reducción drástica de la precarga (p. ej., con una diuresis agresiva o con la anestesia) porque estas pacientes normalmente requieren una presión de llenado del VI mayor que la normal para poder mantener el gasto cardiaco. La monitorización de la arteria pulmonar mediante catéter puede ser necesaria en pacientes con una obstrucción importante, y la valvuloplastia mitral percutánea con balón puede ser aconsejable en embarazadas que sufran síntomas atribuibles a la EM19.
La causa de estenosis aórtica (EA) en mujeres en edad de concebir en la mayoría de los casos es una valvulopatía bicuspídea congénita, en la que se produce un paso deficiente de la sangre del VI, los que sólo puede resolverse con el aumento de la FC. Ahora bien, un aumento excesivo de la FC puede reducir la precarga y el consumo de oxígeno miocárdico. La EA grave está asociada a vasodilatación sistémica, por lo que es crucial, sobre todo durante el parto y en el momento de dar a luz, evitar que disminuyan todavía más la precarga (p. ej., hemorragia, maniobra de Valsalva o anestesia) o la poscarga, ya que pueden empeorar el ya reducido gasto cardiaco.
Las lesiones vasculares por reflujo, como la insuficiencia aórtica o mitral, suelen ser bien toleradas si no van acompañadas de síntomas o sólo por síntomas leves de IC (clase I-II de la NYHA). La disminución de la resistencia vascular sistémica que va asociada al embarazo, a no ser que sea muy grave, reduce la poscarga y, por consiguiente, el volumen de reflujo que atraviesa la válvula. La anestesia epidural reduce aún más la resistencia periférica, con lo que mejora el gasto cardiaco.
ARRITMIASLa mayoría de las arritmias que ocurren en el embarazo, en ausencia de cardiopatías estructurales, son benignas y temporales. Se debe realizar una evaluación de las taquiarritmias sintomáticas y recurrentes para poder descartar factores agravantes como las cardiopatías estructurales, el hipertiroidismo o la embolia pulmonar. Según las guías de apoyo vital cardiovascular avanzado, ante cualquier arritmia hemodinámicamente inestable o potencialmente mortal, se debe realizar una terapia basada en la cardioversión eléctrica o desfibrilación. Las pacientes con arritmias sintomáticas constantes pueden recibir tratamiento con los medicamentos que tengan los menos efectos adversos posibles para el feto, y a las pacientes con fibrilación o aleteo auricular se les podría administrar un tratamiento anticoagulante.
PREECLAMPSIALa preeclampsia (PE) se caracteriza por la HT de nueva aparición, definida como PAS ≥ 140mmHg o PAD ≥ 90mmHg y proteinuria después de 20 semanas de gestación en mujeres que anteriormente eran normotensas. No se conoce con exactitud la patogenia de la PE, pero podrían estar implicadas las alteraciones del desarrollo vascular placentario al principio del embarazo, que conllevan una isquemia relativa de la placenta, o la hipoxemia y la secreción al torrente circulatorio materno de sustancias antiangiogénicas (p. ej., s-Flt-1 y endoglina solubles), que dan lugar a disfunción endotelial vascular y HT20. Algunos de los factores asociados al aumento del riesgo de PE son: los antecedentes en embarazos anteriores o una historia familiar de PE, la nuliparidad, la enfermedad renal, un índice de masa corporal alto o la edad > 40 años21. La HT y la proteinuria asociadas suelen aparecer en el tercer trimestre y evolucionan hasta el momento del parto.
Aparte de HT y proteinuria, la PE se asocia con edema generalizado, hipercoagulación, plaquetopenia y, en ciertos casos, lesión de órganos diana como el hígado o los riñones. Además, las pacientes pueden sufrir síntomas relacionados con el sistema nervioso central, como dolor de cabeza o visión borrosa; si tienen convulsiones, se les diagnosticará eclampsia. El tratamiento definitivo de la PE es adelantar el parto para prevenir complicaciones para la madre y el feto, aunque esta decisión dependerá de la edad gestacional, la estabilidad del feto y la madre y de la gravedad de la PE. Las mujeres con una PE leve que reciban un tratamiento conservador deben reducir la actividad física; también se deberá realizar un seguimiento de la madre y el feto y pruebas de laboratorio frecuentes. La HT grave (PAS ≥ 160mmHg o PAD ≥ 100mmHg) debe tratarse para prevenir complicaciones vasculares en la madre tales como el infarto cerebral; para ello, los fármacos que se suele prescribir con más frecuencia son hidralazina, labetalol y antagonistas del calcio. En los casos de PE grave, se suele adelantar el parto, independientemente de la edad gestacional, para prevenir futuras complicaciones tanto en la madre como en el feto. La HT y la proteinuria asociadas a la PE suelen resolverse unos días después del parto, aunque también pueden prolongarse algunas semanas.
CARDIOPATÍAS CONGÉNITASLa comunicación interauricular (CIA) es el trastorno congénito más común durante el embarazo y normalmente puede tolerarse bien si no hay HT pulmonar o taquiarritmias auriculares. La comunicación interventricular (CIV) se suele identificar más precozmente, y la mayoría de los cortocircuitos se corrigen antes de estar en edad para tener hijos. Los cortocircuitos pequeños suelen tolerarse bien, pero los grandes están asociados a mayor riesgo de IC o HT pulmonar, lo que aumenta el riesgo de muerte para la madre y el feto. El síndrome de Eisenmenger, sobre el que ya hemos hablado, puede evolucionar con grandes cortocircuitos y se asocia con altas tasas de mortalidad materna.
La tetralogía de Fallot (TF) es la forma más común de cardiopatía cianótica en adultos; la mayoría de las embarazadas que presentan TF necesitarán cirugía correctiva para poder conseguir embarazo y parto sin complicaciones. Si se practica la cirugía correctiva, la resistencia vascular periférica asociada al embarazo puede aumentar el cortocircuito de derecha a izquierda. Cuando la paciente presenta cianosis, esta se asocia a eritrocitosis, hiperviscosidad y tromboembolia, lo que aumenta el riesgo de complicaciones cardiovasculares maternas22. En pacientes que no se someten a cirugía correctiva, los síntomas dependerán normalmente del tamaño de la CIV, el grado de estenosis pulmonar y la hipertrofia ventricular derecha. La concentración de hemoglobina ≥ 20gm/dl y la saturación arterial de oxígeno ≤ 85% se asocian a resultados desfavorables para el feto, por lo que es importante tratar de evitar llegar a esos límites23. Por otro lado, las mujeres sometidas a cirugía correctiva pueden padecer insuficiencia pulmonar residual o tricuspídea y disfunción del ventrículo derecho, que además pueden empeorar en presencia de la hipervolemia que acompaña al embarazo.
HIPERTENSIÓN PULMONARLa HT pulmonar, independientemente de su etiología, se asocia a una mortalidad alta durante el embarazo, por lo que se debe intentar persuadir a estas pacientes de que eviten quedarse embarazadas. Las causas son varias: HT pulmonar primaria, tromboembolia crónica o HT pulmonar secundaria a cardiopatía vascular o cortocircuito intracardiaco congénito (síndrome de Eisenmenger). El síndrome de Eisenmenger puede aparecer en el contexto de cortocircuitos de izquierda a derecha no corregidos cuando se producen cambios vasculares pulmonares en respuesta al aumento del flujo sanguíneo pulmonar, lo que da lugar a un aumento de la resistencia vascular pulmonar y, en último término, a la reversión del cortocircuito en estos pacientes. Esto se puede observar en pacientes con CIA, CIV o ductus arteriosus permeable, y está asociado a una mortalidad del 8% de los fetos y el 40% de las madres24. Los cambios hemodinámicos asociados al parto y el alumbramiento, así como los que rodean al puerperio, no suelen tolerarse bien. De hecho, la mayoría de las muertes maternales se deben a la hipervolemia, los episodios tromboembólicos o las cesáreas, y casi siempre ocurren durante la primera semana posparto25. Teniendo en cuenta todo esto, se debe considerar la posibilidad de interrumpir el embarazo de pacientes con HT pulmonar grave o síndrome de Eisenmenger.
SÍNDROME DE MARFANEl síndrome de Marfan es una alteración autosómica dominante que afecta a varios sistemas de órganos y se asocia a complicaciones cardiovasculares, osteomusculares y oculares significativas. La mayoría de los pacientes con esta enfermedad presentan una mutación en el gen que codifica la proteína fibrilina-1, un componente esencial de las microfibrillas, que actúan como soporte estructural en arterias elásticas como la aorta. La hipervolemia, la taquicardia y el aumento del volumen sistólico y del gasto cardiaco asociados con el embarazo elevan la tensión de la pared aórtica y la tensión de cizallamiento. La dilatación de la aorta, la insuficiencia aórtica y las disecciones aórticas son las causas más importantes de morbimortalidad en pacientes con el síndrome de Marfan; su diagnóstico y tratamiento está dirigido a prevenir dichas complicaciones. El prolapso mitral, con o sin reflujo, es otra complicación cardiovascular asociada al síndrome de Marfan, por lo que se debe realizar a las mujeres con antecedentes o sospecha de este síndrome un ecocardiograma para evaluar el diámetro de la raíz, además de evaluaciones clínicas seriadas. Los bloqueadores beta se usan para frenar la dilatación de la aorta y la insuficiencia aórtica, y también pueden mejorar la supervivencia de los pacientes con síndrome de Marfan26. El embarazo está normalmente contraindicado cuando el diámetro de la raíz de la aorta supera los 4cm, ya que el riesgo de complicaciones cardiovasculares adversas mayores parece ser bajo cuando el diámetro es < 4cm27. Es recomendable realizar ecocardiografías mensuales o bimensuales a todas las embarazadas con dilatación de la aorta ascendente o de la raíz de la aorta; además, deberían dar a luz en hospitales que dispongan de medios para realizar cirugía cardiotorácica28. Como medida preventiva, se puede considerar la sustitución de la raíz aórtica y la aorta ascendente a pacientes que tengan un diámetro de raíz aórtica > 4cm y planeen quedarse embarazadas. Por otro lado, se debe hablar con las pacientes sobre la naturaleza hereditaria del síndrome de Marfan, ya que es una enfermedad autosómica dominante.
CONCLUSIONESLa mejora del diagnóstico y el tratamiento de los pacientes con cardiopatías congénitas, en combinación con el creciente número de mujeres que posponen el embarazo, han aumentado la incidencia del riesgo de complicaciones cardiovasculares en las gestantes. Se han identificado diferentes factores asociados con el aumento de complicaciones en la madre y el feto durante el embarazo: una clase funcional deficiente (clase III-IV de la NYHA) o la cianosis, antecedentes de eventos cardiacos o arritmias, la obstrucción del VI (EM o EA de moderada a grave) y una función sistólica del VI limitada (FEVI ≤ 40%). A las pacientes con ciertas características de riesgo, como la HT pulmonar, el síndrome de Marfan con dilatación de la aorta o una función sistólica del VI muy reducida, se les debe aconsejar que eviten el embarazo. Se debe aconsejar a las pacientes con estos problemas que descansen adecuadamente y hay que tratar las alteraciones que se puedan corregir, como la anemia. El parto vaginal supone un riesgo menor de complicaciones en la mayoría de las cardiopatías, pero en el caso de mujeres con ciertas enfermedades o con partos prolongados o difíciles, puede indicarse el parto por cesárea. Para optimizar los resultados en las mujeres embarazadas con una cardiopatía subyacente, el obstetra y el cardiólogo deben realizar su seguimiento y su evaluación con un enfoque de «trabajo en grupo».
CONFLICTO DE INTERESESNinguno.
Recibido 14 Julio 2011
Aceptado 16 Julio 2011
Autor para correspondencia: Department of Physiology and Biophysics, University of Mississippi Medical Center, 2500 North State Street, Jackson, MS 39216-4505, Estados Unidos. jgranger@umc.edu