La insuficiencia cardiaca con fracción de eyección conservada (IC-FEc) es un síndrome muy prevalente con alto riesgo de morbilidad y mortalidad. Hasta la fecha, la evidencia acerca del papel del consumo máximo de oxígeno (VO2máx) para predecir la carga de morbilidad en la IC-FEc es escasa. El objetivo de este estudio es evaluar la relación entre el VO2máx y el riesgo de ingresos recurrentes de los pacientes con IC-FEc.
MétodosA un total de 74 pacientes con IC-FEc sintomáticos y clínicamente estables, se les realizó una prueba de esfuerzo cardiopulmonar entre junio de 2012 y mayo de 2016. Se utilizó el método de regresión binomial negativa para determinar la asociación entre el porcentaje de VO2máx predicho (%VO2máx-p) y los ingresos recurrentes. Las estimaciones del riesgo se informaron como tasas de incidencia.
ResultadosLa media de edad era 72,5 ± 9,1 años, el 53% eran mujeres y todos los pacientes estaban en clase funcional II-III de la New York Heart Association. La media de VO2máx y la mediana de %VO2máx-p fueron 10 ± 2,8ml/min/kg y el 60% (47-67) respectivamente. Durante un seguimiento medio de 276 [intervalo intercuartílico, 153-1.231] días, se registraron 84 hospitalizaciones por cualquier causa de 31 pacientes (41,9%). También se determinó un total de 15 muertes (20,3%). En un análisis multivariable, teniendo en cuenta la mortalidad como evento terminal, el %VO2máx-p mantuvo la asociación independiente y lineal con el riesgo de ingresos recurrentes. Así, y modelado como continuo, una disminución del 10% del %VO2máx-p aumentó en un 32% el riesgo de ingresos recurrentes (IRR = 1,32; IC95%, 1,03-1,68; p = 0,028).
ConclusionesEn los pacientes de edad avanzada con IC-FEc sintomáticos, el %VO2máx-p predice los ingresos recurrentes por todas las causas.
Palabras clave
La insuficiencia cardiaca (IC) es un importante problema de salud pública que conlleva altas morbilidad y mortalidad en todo el mundo1. Más del 50% de los pacientes con IC tienen la fracción de eyección del ventrículo izquierdo (FEVI) conservada (IC–FEc), y ello es especialmente frecuente en los pacientes ancianos, las mujeres y los pacientes con gran comorbilidad2–4. La predicción del riesgo de hospitalizaciones repetidas en la IC es una cuestión que a menudo se ha pasado por alto, y la mayor parte de los estudios que respaldan la predicción del riesgo de hospitalizaciones se han centrado en el análisis del tiempo hasta el primer evento, sin tener en cuenta la repercusión clínica que tienen las hospitalizaciones repetidas que se dan con frecuencia en la IC5. Algunas iniciativas recientes recomiendan incluir las hospitalizaciones repetidas en la estratificación del riesgo6 con objeto de transmitir una imagen más realista de la carga que la enfermedad implica.
Aunque el valor clínico del consumo máximo de oxígeno en ejercicio (VO2máx) en la IC con fracción de eyección reducida está claramente documentado7,8, la evidencia que respalda su utilidad pronóstica en la IC–FEc es escasa7,9–11 o incluso inexistente, sobre todo por lo que respecta al riesgo de ingresos hospitalarios repetidos.
El objetivo de este estudio es determinar si el porcentaje del VO2máx predicho (%VO2máx–p) se asocia con el riesgo de ingresos repetidos en los pacientes ancianos con IC–FEc.
MÉTODOSDiseño del estudio y pacientesSe trata de un estudio prospectivo en el que participaron pacientes con diagnóstico de IC–FEc según los criterios de la Sociedad Europea de Cardiología12 y en clase funcional de la New York Heart Association (NYHA) II-III/IV en 2 periodos de tiempo: de junio de 2012 a mayo de 2013 y de junio de 2015 a mayo de 2016. El estudio se realizó en un único centro de nivel terciario de España. Todos los pacientes firmaron un documento de consentimiento informado antes de su participación en el estudio. El protocolo fue aprobado por el comité de ética de investigación de nuestro centro y se atuvo a los principios de la Declaración de Helsinki y las regulaciones nacionales.
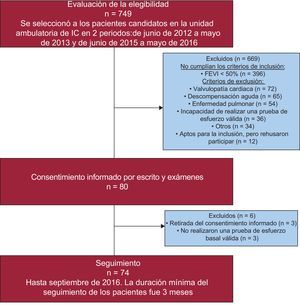
Se seleccionó a los pacientes candidatos a la participación en el estudio en la unidad de asistencia ambulatoria de la IC13. Todos los pacientes cumplían los siguientes criterios de inclusión: a) antecedentes de IC sintomática (NYHA ≥ II); b) FEVI normal (> 0,50 con el método de Simpson y diámetro telediastólico<60 mm); c) cardiopatía estructural (hipertrofia ventricular izquierda/dilatación auricular izquierda) y/o disfunción diastólica estimada mediante ecocardiografía bidimensional; d) ingreso previo por IC aguda, y e) estabilidad clínica, sin ingresos hospitalarios en los 3 meses anteriores. Se excluyó a los pacientes que no podían realizar una prueba de esfuerzo válida en la situación inicial o que presentaban algún trastorno médico previo, como los siguientes: angina inestable, infarto de miocardio o cirugía cardiaca en los 3 meses previos; enfermedad crónica metabólica, traumatológica/ortopédica, infecciosa o pulmonar (incluida la hipertensión arterial pulmonar, la enfermedad pulmonar tromboembólica crónica o la enfermedad pulmonar obstructiva crónica); corticoterapia, hormonoterapia u oncoterapia; IC aguda descompensada, o cualquier otra comorbilidad con una esperanza de vida inferior a 1 año. El diagrama de flujo de los pacientes se muestra en la figura 1.
Tras la firma del documento de consentimiento informado, 2 cardiólogos con la formación adecuada realizaron un examen completo con anamnesis, exploración física, determinación de parámetros antropométricos y otros exámenes.
ProcedimientosLos procedimientos utilizados en el estudio incluyeron electrocardiograma, ecocardiografía, prueba de esfuerzo cardiorrespiratoria y obtención de muestras de sangre para la determinación basal de una batería de biomarcadores. Todo ello se llevó a cabo el mismo día.
Prueba de esfuerzo cardiorrespiratoriaLa capacidad funcional máxima se determinó mediante una prueba de ejercicio cardiorrespiratorio incremental y limitada por los síntomas (CORTEX Metamax 3B) en un cicloergómetro, empezando con una carga de trabajo de 10 W, con un aumento escalonado en incrementos de 10 W cada 1 min. Durante la prueba de esfuerzo, los pacientes fueron objeto de monitorización continua con electrocardiograma de 12 derivaciones y determinaciones de la presión arterial cada 2 min. Los datos de gasometría y las variables cardiorrespiratorias se promediaron cada 10 s. El VO2máx fue el valor más alto de VO2 observado durante los últimos 20 s de ejercicio y el %VO2máx–p se calculó con la ecuación de Wasserman14. Se determinó la eficiencia ventilatoria en ejercicio (pendiente VE/VCO2) mediendo la pendiente durante todo el periodo de ejercicio15.
EcocardiografíaSe realizaron exploraciones de ecocardiografía Doppler en reposo mediante ecocardiografía bidimensional (iE33, Philips). Todos los parámetros, incluidos los de Doppler tisular, se determinaron según lo establecido en la guía actual de la Sociedad Europea de Ecocardiografía16.
BiomarcadoresTodas las muestras de sangre se obtuvieron entre las 9.00 y las 24.00. Todos los biomarcadores se determinaron mediante análisis comerciales bien establecidos.
Objetivos y seguimientoEl objetivo principal fue el número total de hospitalizaciones por cualquier causa no programadas. Los ingresos de causa cardiovascular fueron el objetivo secundario. Se consideraron ingresos cardiovasculares los que se produjeron a causa de una IC aguda, síndrome coronario agudo, arritmias, ictus u otras causas cardiovasculares, como rotura de aneurisma, isquemia periférica o disección aórtica. Las hospitalizaciones se identificaron a partir de las historias clínicas de los pacientes en la unidad de IC y en las salas hospitalarias, así como a partir de las historias clínicas electrónicas. Los eventos con desenlace mortal se identificaron a partir de las historias clínicas de la unidad de IC, las salas hospitalarias, el servicio de urgencias y los médicos generales, y contactando con los familiares de los pacientes. Todos los pacientes incluidos fueron objeto de seguimiento hasta septiembre 2016. La duración mínima del seguimiento de los pacientes fue 3 meses.
Análisis estadísticoLas variables continuas y discretas se presentan en forma de media±desviación estándar, mediana [intervalo intercuartílico] o porcentajes, según sea apropiado. Se presentan las tasas brutas (número de episodios cada 10 años-persona) para los cuartiles de %VO2máx-p (C%VO2máx-p). Se utilizó una regresión binominal negativa bivariable para evaluar la asociación independiente entre el %VO2máx–p y el objetivo evaluado17. Este método modeliza simultáneamente el número de ingresos junto con el evento de mortalidad y utiliza una fragilidad compartida para tener en cuenta la correlación entre estos 2 resultados clínicos. Así pues, en las estimaciones de los ingresos repetidos se incluye un ajuste interno respecto a la mortalidad como evento terminal (censura informativa). Con objeto de tener en cuenta las diferencias en el tiempo de observación por paciente, se utilizó el logaritmo natural del tiempo de observación como compensación en el modelo respecto a los resultados de ingresos y la mortalidad. Las estimaciones se presentan mediante el cociente de tasas de incidencia (CTI). Todas las variables mencionadas en la tabla 1 se evaluaron con fines pronósticos. Se utilizó una selección escalonada retrógrada, con el criterio de información de Akaike como criterio de detención, para elaborar un modelo con un pequeño número de variables. Se evaluó al mismo tiempo el supuesto de linealidad para todas las variables continuas y, si ello era apropiado, se transformaron las variables mediante polinomios fraccionales. En la modelización del %VO2máx–p, se utilizó una transformación con polinomios fraccionales de 0 (logaritmo natural), por disminución del 10%, y en forma de C%VO2máx–p. Las covariables incluidas en los modelos finales para las rehospitalizaciones por cualquier causa y las de causa cardiovascular se indican en el pie de la figura 2. Se consideró estadísticamente significativo un valor de p bilateral<0,05. Todos los análisis se realizaron con el programa Stata 14.0.
Características basales de la población del estudio
| Variables | Pacientes incluidos (n=74) |
|---|---|
| Características demográficas, antecedentes médicos y constantes vitales | |
| Edad (años) | 72,5±9,1 |
| Mujeres | 39 (53,0) |
| Peso (kg) | 82±15,1 |
| Área de superficie corporal (m2) | 1,9±0,2 |
| Hipertensión | 67 (90,5) |
| Dislipemia | 61 (81,0) |
| Diabetes mellitus | 37 (50,0) |
| Cardiopatía isquémica | 27 (36,5) |
| NYHA basal III/IV | 26 (35,1) |
| Ingreso previo por ICA | 74 (100) |
| Tabaquismo previo | 26 (35,1) |
| Fibrilación auricular | 44 (59,5) |
| Presión arterial sistólica (mmHg) | 129±16 |
| Frecuencia cardiaca (lpm) | 69±14 |
| Análisis de laboratorio | |
| Hemoglobina (g/dl) | 12,8±1,5 |
| Ferritina (ng/ml) | 91 [48-175] |
| TFGe (ml/min/m2) | 58,4±24,3 |
| NT-proBNP (pg/ml) | 1021 [363-2.109] |
| Ecocardiografía | |
| FEVI (%) | 68,4±9,8 |
| DSPAT (mm)* | 21,8±4,2 |
| IVAI (ml/m2) | 46 [39-58] |
| IMVI (g/m2) | 125 [104-125] |
| Cociente E/e’ | 16,9 [13,4-23,4] |
| PAPS* (mmHg) | 46 [39-53] |
| Capacidad de ejercicio | |
| VO2máx (ml/min/kg) | 10±2,8 |
| %VO2máx-p | 60 (47-67) |
| Pendiente VE/VCO2 | 35±7,6 |
| CIR | 1,04±0,1 |
| MET | 2,4±0,9 |
| 6MWT (m) | 262 [198-350] |
| Tratamiento | |
| Bloqueadores beta | 59 (79,7) |
| IECA | 14 (18,9) |
| ARA-II | 36 (48,6) |
| Antialdosterónicos | 21 (28,3) |
| Diuréticos del asa | 58 (78,4) |
| Tiacidas | 22 (29,7) |
| Digoxina | 5 (6,7) |
%VO2máx-p: porcentaje de consumo máximo de oxígeno en ejercicio predicho; 6MWT: prueba de marcha de 6 min; ARA-II: antagonistas del receptor de la angiotensina II; CIR: cociente de intercambio respiratorio; DSPAT: desplazamiento sistólico en plano anular tricuspídeo; FEVI: fracción de eyección del ventrículo izquierdo; ICA: insuficiencia cardiaca aguda; IECA: inhibidores de la enzima de conversión de la angiotensina; IMVI: índice de masa del ventrículo izquierdo; IVAI: índice de volumen auricular izquierdo; MET: equivalentes metabólicos; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: clase funcional de la New York Heart Association; PAPS: presión arterial pulmonar sistólica; pendiente VE/VCO2: relación entre la ventilación-minuto y la tasa de eliminación de CO2; TFGe: tasa de filtrado glomerular estimada con la fórmula de Modification of Diet in Renal Disease; VO2máx: consumo máximo de oxígeno en ejercicio.
Las variables continuas y discretas se presentan en forma de media±desviación estándar, mediana [intervalo intercuartílico] o n (%) según sea apropiado.
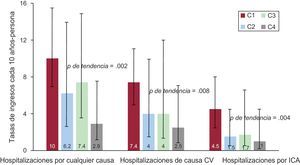
Tasas de hospitalización por cualquier causa, de causa CV y por ICA según el cuartil del C%VO2máx–p. C%VO2máx–p: porcentaje del consumo máximo de oxígeno en ejercicio predicho; CV: cardiovascular; ICA: insuficiencia cardiaca aguda.
C1: del 26,1 al 46,4% del consumo máximo de oxígeno en ejercicio predicho.
C2: del 47 al 60% del consumo máximo de oxígeno en ejercicio predicho.
C3: del 60 al 67,5% del consumo máximo de oxígeno en ejercicio predicho.
C4: del 67,7 al 102,8% del consumo máximo de oxígeno en ejercicio predicho.
La media±desviación estándar de la edad de los pacientes era 72,5±9,1 años, un 53% eran mujeres, el 35,1% se encontraba en NYHA III y la mediana de concentración de la fracción aminoterminal del propéptido natriurético cerebral (NT–proBNP) era 1.022 [363-2.109] pg/ml. La media y la mediana de VO2máx y %VO2máx–p fueron 10±2,8 ml/min/kg y 60 [47-67] respectivamente. Las demás características de la muestra de pacientes en la situación inicial se resumen en la tabla 1. No hubo ningún evento adverso grave durante las pruebas de esfuerzo cardiorrespiratorias.
El seguimiento de los pacientes fue de una mediana de 276 [153-1.231] días. Durante el seguimiento, se produjeron 15 muertes (20,3%) y 84 hospitalizaciones por cualquier causa en 31 pacientes (41,9%), con la siguiente distribución: 1 hospitalizaciónm n=11 (14,9%); 2, n=9 (12,2%); 3, n=4 (5,4%); 4, n=3 (4,1%); 5, n=5 (6,8%), y 6, n=1 (1,4%). La mayoría de las rehospitalizaciones se debieron a causas cardiovasculares (62 hospitalizaciones, el 73,8% de las de cualquier causa) incluida la IC aguda como motivo más frecuente entre las causas cardiovasculares (33 hospitalizaciones, el 39,3% de las de cualquier causa). La tasa bruta de rehospitalizaciones en los diversos C%VO2máx–p mostró un aumento significativo y continuo al ir pasando de los cuartiles superiores a los inferiores (p<0,01): 2,9, 7,4, 6,2 y 10 hospitalizaciones cada 10 años-persona para el C4 (67,7%-102,8%), el C3 (60%-67,5%), el C2 (47%-60%) y el C1 (26,1%-46,4%) respectivamente. Asimismo se observó un aumento de las tasas de ingresos cardiovasculares y por IC aguda en los cuartiles inferiores de C%VO2máx–p (figura 2).
Porcentaje de consumo máximo de oxígeno en ejercicio predicho y riesgo de nuevos ingresos por cualquier causaEn el análisis univariable, el %VO2máx–p mostró una asociación significativa e inversa con el riesgo de nuevos ingresos por cualquier causa. Así, las estimaciones del riesgo atribuible al %VO2máx–p evaluado como variable continua (por disminución del 10%) y como logaritmo natural (por disminución de 1 log) fueron: CTI, 1,30 (intervalo de confianza del 95% [IC95%], 1,06-1,61; p=0,014) y CTI, 3,94 (IC95%, 1,40-11,05; p=0,009) respectivamente.
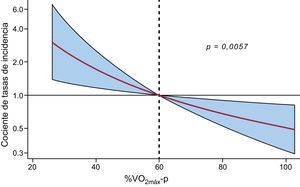
En el análisis multivariable que incluyó los factores pronósticos bien establecidos y los posibles factores de confusión (edad, fibrilación auricular, presión arterial sistólica, frecuencia cardiaca, cociente E/e’, hemoglobina y NT–proBNP) en el modelo de riesgo, la asociación inversa entre el %VO2máx–p y el riesgo de nuevas hospitalizaciones continuó siendo significativa (tabla 2). El gradiente de riesgo mostró relación inversa y casi lineal entre el %VO2máx–p y el riesgo de reingresos por cualquier causa (fig. 3). Al elaborar un modelo con el %VO2máx–p como variable continua, una disminución del 10% en el %VO2máx–p aumentaba el riesgo de nuevas hospitalizaciones en un 32% (CTI, 1,32; IC95%, 1,03-1,68; p=0,028) (tabla 2). En un análisis de sensibilidad, forzando la inclusión en el análisis multivariable de otros factores pronósticos importantes del ejercicio cardiorrespiratorio, como la pendiente VE/VCO2, el %VO2máx–p (por reducción de un 10%) continuó mostrando una asociación significativa con este resultado (CTI, 1,31; IC95%, 1,05-1,65; p=0,020) y la pendiente VE/VCO2 evidenció una asociación en el límite de la significación con el riesgo de hospitalizaciones repetidas (CTI, 1,03; IC95%, 0,99-1,06; p=0,088).
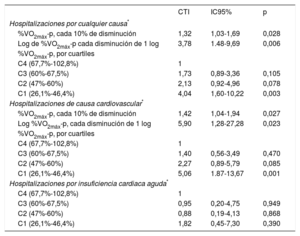
Estimaciones del riesgo de hospitalización por cualquier causa y de hospitalización de causa cardiovascular
| CTI | IC95% | p | |
|---|---|---|---|
| Hospitalizaciones por cualquier causa* | |||
| %VO2máx-p, cada 10% de disminución | 1,32 | 1,03-1,69 | 0,028 |
| Log de %VO2máx-p cada disminución de 1 log | 3,78 | 1.48-9,69 | 0,006 |
| %VO2máx-p, por cuartiles | |||
| C4 (67,7%-102,8%) | 1 | ||
| C3 (60%-67,5%) | 1,73 | 0,89-3,36 | 0,105 |
| C2 (47%-60%) | 2,13 | 0,92-4,96 | 0,078 |
| C1 (26,1%-46,4%) | 4,04 | 1,60-10,22 | 0,003 |
| Hospitalizaciones de causa cardiovascular* | |||
| %VO2máx-p, cada 10% de disminución | 1,42 | 1,04-1,94 | 0,027 |
| Log %VO2máx-p, cada disminución de 1 log | 5,90 | 1,28-27,28 | 0,023 |
| %VO2máx-p, por cuartiles | |||
| C4 (67,7%-102,8%) | 1 | ||
| C3 (60%-67,5%) | 1,40 | 0,56-3,49 | 0,470 |
| C2 (47%-60%) | 2,27 | 0,89-5,79 | 0,085 |
| C1 (26,1%-46,4%) | 5,06 | 1.87-13,67 | 0,001 |
| Hospitalizaciones por insuficiencia cardiaca aguda* | |||
| C4 (67,7%-102,8%) | 1 | ||
| C3 (60%-67,5%) | 0,95 | 0,20-4,75 | 0,949 |
| C2 (47%-60%) | 0,88 | 0,19-4,13 | 0,868 |
| C1 (26,1%-46,4%) | 1,82 | 0,45-7,30 | 0,390 |
%VO2máx-p: porcentaje de consumo máximo de oxígeno en ejercicio predicho; CTI: cociente de tasas de incidencia; IC95%: intervalo de confianza del 95%; log %VO2máx-p: logaritmo del %VO2máx-p; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral.
Las estimaciones se presentan mediante el CTI.
Relación entre el %VO2máx-p y el riesgo de reingreso por cualquier causa tras un ajuste multivariable. Ajustado por edad, fibrilación auricular, presión arterial sistólica, frecuencia cardiaca, cociente E/e’, hemoglobina y fracción aminoterminal del propéptido natriurético cerebral. %VO2máx-p: porcentaje de consumo máximo de oxígeno en ejercicio predicho.
Las estimaciones univariables mostraron una relación inversa entre el %VO2máx–p y los ingresos de causa cardiovascular. El %VO2máx–p (por cada 10% de disminución) y el logaritmo del %VO2máx–p (por cada disminución de 1 log) mostraron asociación inversa con un mayor riesgo de hospitalizaciones de causa cardiovascular (CTI, 1,28; IC95%, 0,99-1,66; p=0,063, y CTI, 3,73; IC95%, 1,05-13,24; p=0,042, respectivamente). Tras introducir un ajuste multivariable, esta asociación inversa era más intensa (tabla 2). Por lo que respecta a las hospitalizaciones por IC aguda, el análisis multivariable mostró que el %VO2máx–p (cada 10% de disminución) y el logaritmo del %VO2máx–p (por cada disminución de 1 log) no tenían una relación significativa con el riesgo de nuevos ingresos por IC aguda (CTI, 1,10; IC95%, 0,25-4,73; p=0,583, y CTI, 1,55; IC95%, 0,36-6,69; p=0,556, respectivamente). Tampoco los C%VO2máx–p estaban relacionados con el riesgo de nuevas hospitalizaciones por IC aguda (tabla 2).
DISCUSIÓNLos estudios epidemiológicos han puesto de relieve que la prevalencia de la IC–FEc en comparación con la IC con fracción de eyección reducida está aumentando con el paso del tiempo; sin embargo, sigue habiendo sombras sobre el pronóstico y el arsenal farmacológico óptimo para la IC–FEc4,12. El principal resultado de nuestro estudio fue que el %VO2máx-p mostraba una asociación independiente y lineal con los ingresos hospitalarios repetidos en una cohorte de pacientes ancianos con IC–FEc muy sintomáticos. Que nosotros sepamos, este es el primer estudio en el que se ha evaluado la utilidad pronóstica del %VO2máx–p en la predicción de rehospitalizaciones de este tipo de pacientes.
La evidencia disponible hasta la fecha muestra que los pacientes con IC–FEc presentan una notable reducción de la capacidad funcional medida de forma objetiva con el VO2máx18, pero es poco lo que se sabe de la relación entre el %VO2máx-p y el pronóstico en los pacientes con IC–FEc. Hasta la fecha, solo 3 estudios han evaluado el valor pronóstico (tiempo hasta el primer evento de hospitalización o mortalidad de causa cardiaca) del VO2máx y otros parámetros de la prueba de esfuerzo cardiorrespiratoria en los pacientes con IC y disfunción diastólica9–11. En 2005, Guazzi et al.11 estudiaron a 46 varones jóvenes (media de edad, 57,9±13 años) con IC que presentaban disfunción diastólica y FEVI ≥ 50%. Estos autores observaron que tanto el VO2máx como la pendiente VE/VCO2 eran factores predictivos de mortalidad y rehospitalización significativos en el análisis univariable; sin embargo, tras un ajuste multivariable, solo la pendiente VE/VCO2 mantuvo la relación independiente con un pronóstico adverso. En 2011, Yan et al.10 evaluaron a 224 pacientes con IC–FEc, predominantemente varones (71%) con una media de edad de 68,8±9 años. De modo parecido, estos autores observaron que la concentración plasmática de péptido natriurético cerebral y la pendiente VE/VCO2, pero no así el VO2máx, tenían un valor pronóstico incremental respecto a la mortalidad por cualquier causa y de causa cardiovascular. Más recientemente, en un estudio retrospectivo de 173 varones jóvenes, predominantemente negros, con IC y FEVI ≥ 50%, Shafiq et al.9 indicaron que el VO2máx y el %VO2máx–p tenían un valor pronóstico claro por lo que respecta a la predicción de la variable de valoración combinada de mortalidad por cualquier causa y/o trasplante cardiaco.
En nuestra opinión, los estudios previos y el actual avalan la utilidad de la prueba de esfuerzo cardiorrespiratoria para la estratificación del riesgo de los pacientes con IC–FEc. Las discrepancias existentes respecto al parámetro más exacto para la estratificación del riesgo pueden atribuirse al pequeño tamaño muestral de los estudios, las diferencias en las características iniciales, las covariables incluidas en los ajustes multivariables y el enfoque metodológico utilizado para evaluar los objetivos clínicos (eventos recurrentes frente a tiempo hasta el primer evento). El principal punto fuerte del presente estudio radica en las características clínicas de los pacientes incluidos (pacientes ancianos, con gran comorbilidad y un deterioro funcional importante19). Por último, desde nuestro punto de vista, el análisis del riesgo de hospitalizaciones repetidas, a diferencia de los enfoques basados en el tiempo transcurrido hasta la primera hospitalización, aportan más consistencia y validez a nuestros resultados.
Creemos que los resultados que se presentan aquí respaldan la utilidad clínica del VO2máx en comparación con otros parámetros tradicionales, más subjetivos, de la gravedad de la enfermedad, como la clasificación funcional de la New York Heart Association20. Además, el VO2máx aparece como un objetivo sustituto fiable y exacto para evaluar las nuevas estrategias terapéuticas en la IC–FEc. Por ejemplo, nuestro grupo ha observado recientemente un aumento significativo del VO2máx tras un programa domiciliario de entrenamiento de la musculatura inspiratoria en un pequeño estudio en pacientes con IC–FEc21.
LimitacionesEste estudio tiene ciertas limitaciones. En primer lugar, se trata de un estudio observacional llevado a cabo en un solo centro, y ello puede tener múltiples posibles factores de confusión; segundo, el bajo número de eventos adversos registrados, como mortalidad y hospitalizaciones por IC aguda, impidió evaluar la posible asociación independiente entre el %VO2máx–p y esos eventos; tercero, estos resultados no pueden extrapolarse directamente a los pacientes con formas más leves de la enfermedad, y cuarto, el uso de un protocolo de ejercicio en bicicleta en vez de la prueba de esfuerzo en cinta sin fin podría haber motivado una subestimación de la capacidad funcional de algunos pacientes14.
CONCLUSIONESEn pacientes ancianos con IC–FEc sintomáticos, el %VO2máx-p mostró una asociación inversa significativa con el riesgo de nuevas hospitalizaciones a largo plazo. Serán necesarios nuevos estudios para confirmar estos resultados.
FINANCIACIÓNEste trabajo fue financiado en parte por subvenciones de la Sociedad Española de Cardiología: Investigación Clínica en Cardiología, subvención SEC 2015, CIBER CV 16/11/00420, 16/11/00403, FEDER y PIE15/00013.
CONFLICTO DE INTERESESNo se declara ninguno.
- –
La insuficiencia cardiaca con fracción de eyección conservada es la forma más prevalente de IC.
- –
La insuficiencia cardiaca con fracción de eyección conservada es especialmente frecuente en la población anciana, las mujeres, los individuos con fragilidad y los pacientes con gran comorbilidad.
- –
La utilidad clínica del VO2máx en la IC-FEc no está bien documentada.
- –
La evidencia que respalda la utilidad pronóstica del VO2máx en la IC-FEc es escasa o incluso inexistente, sobre todo por lo que respecta al riesgo de ingresos hospitalarios repetidos.
- –
El principal resultado de nuestro estudio es que el %VO2máx–p muestra una asociación independiente y lineal con los ingresos hospitalarios repetidos en una cohorte de pacientes ancianos con IC–FEc muy sintomáticos.
- –
Que nosotros sepamos, este es el primer estudio que ha evaluado la utilidad pronóstica del %VO2máx-p en la predicción de las rehospitalizaciones de este tipo de pacientes.