El tacrolimus de liberación prolongada (TLP) permite una dosificación única diaria, lo que simplifica el régimen inmunosupresor. El presente estudio describe la eficacia y la seguridad del uso de TLP de novo y precoz para el trasplante cardiaco.
MétodosSe realizó un estudio observacional, retrospectivo y multicéntrico para comparar el uso de novo de TLP (grupo de TLP; n=94), tacrolimus de liberación estándar (grupo de TLE; n=42) y la conversión precoz (CP) de TLP a TLE (grupo de CP; n=44). El TLP se usó entre 2007 y 2012. Se analizaron la tasa de incidencia de rechazo agudo, infección e infección por citomegalovirus al primer año tras el trasplante, así como parámetros de seguridad.
ResultadosEntre los grupos no hubo diferencias significativas en la dosis diaria y las concentraciones séricas de tacrolimus durante el primer año tras el trasplante. La incidencia de rechazo fue de 1,05 (IC95%, 0,51-1,54), 1,39 (IC95%, 1,00-1,78) y 1,11 (IC95%, 0,58-1,65) eventos/pacientes-años en los grupos de TLE, TLP y CP respectivamente (p=0,48). La incidencia de infección fue de 0,75 (IC95%, 0,60-0,86), 0,62 (IC95%, 0,52-0,71) y 0,55 (IC95%, 0,40-0,68) en los grupos de TLE, TLP y CP respectivamente (p=0,46). Se produjo infección por citomegalovirus en el 23,8, el 20,2 y el 18,2% respectivamente (p=0,86). No hubo diferencias significativas entre los grupos en los parámetros de seguridad o la función del injerto. Falleció 1 paciente del grupo de TLE y 2 del grupo de TLP.
ConclusionesParece que el uso de novo de TLP o la CP de TLP a TLE tienen similares eficacia y seguridad que el TLE en el trasplante cardiaco.
Palabras clave
A pesar de la escasez de donantes, el trasplante cardiaco sigue siendo el patrón de referencia del tratamiento en casos seleccionados de insuficiencia cardiaca avanzada1. En la última década, el tacrolimus ha pasado a ser el inhibidor de calcineurina de uso más frecuente en el trasplante cardiaco2. El tacrolimus se comercializa en todo el mundo en una formulación oral de liberación inmediata, que se administra 2 veces al día (tacrolimus de liberación estándar [TLE]). Recientemente se ha desarrollado una formulación oral de liberación prolongada de tacrolimus (tacrolimus de liberación prolongada [TLP]), que permite la administración una sola vez al día. La evaluación farmacocinética realizada en pacientes trasplantados cardiacos estables3 ha demostrado que el TLP proporciona una exposición a tacrolimus similar (evaluada mediante el área de la curva de 24h y la variabilidad individual e interindividual) en comparación con el TLE. Además, ambas formulaciones mostraron una correlación similar entre el área bajo la curva de 24h y la concentración mínima, lo cual permite el uso de las concentraciones valle en suero para una eficaz monitorización del fármaco. Cuando se emplea el TLP, alrededor de un tercio de los pacientes trasplantados necesitan un aumento de la dosis de tacrolimus respecto a la dosis previa de TLE3,4. Sin embargo, 1 dosis diaria puede conllevar una simplificación de la pauta de inmunosupresión y, por consiguiente, una mejora de la adherencia5.
Hasta el momento, varios estudios han evaluado la seguridad, la eficacia y la tolerabilidad del paso del TLE al TLP en pacientes trasplantados cardiacos estables3-6. En cambio, los datos sobre la seguridad y la eficacia del uso del TLP de novo (es decir, desde el principio de la inmunosupresión posterior al trasplante) están limitados a estudios de pequeño tamaño muestral7-12. El objetivo de este estudio es conocer la seguridad y la eficacia del uso precoz de TLP en comparación con TLE en un estudio multicéntrico de mayor tamaño muestral.
MÉTODOSSe trata de un estudio multicéntrico retrospectivo, a iniciativa del investigador y financiado por la industria, que se llevó a cabo según el principio de intención de tratar. La coordinación de los 6 centros participantes de diversos lugares de España, el proceso de validación (adjudicación) y los análisis se realizaron de manera centralizada según las normas del Registro Español de Trasplante Cardiaco13. Los datos se obtuvieron del Registro Español de Trasplante Cardiaco y de una revisión de historias clínicas usando un formulario estandarizado y con variables predefinidas. El protocolo del estudio fue aprobado por el Comité de Ética de Investigación del Hospital Universitario Marqués de Valdecilla, Santander, Cantabria (España).
Pacientes del estudioSe incluyó a los pacientes sometidos a un único trasplante cardiaco antes del 31 de diciembre de 2012 que habían sobrevivido más de 7 días tras la operación. Los centros participantes identificaron a todos los pacientes que cumplían los criterios de inclusión y recibieron TLP (Advagraf, Astellas Pharma Europa Ltd.; Staines, Reino Unido) en los primeros 15 días tras el trasplante (grupo de TLP). Para la comparación se utilizó una serie consecutiva de pacientes trasplantados que inicialmente recibieron TLE (Prograf, Astellas Pharma Europa Ltd.; Staines, Reino Unido), con un tamaño muestral similar al del grupo de TLP. En esta muestra, se identificaron a continuación 2 subgrupos de pacientes: los tratados con TLE durante todo el estudio (grupo de TLE) y los que recibieron inicialmente TLE y luego pasaron sistemáticamente a TLP en los 6 meses siguientes al trasplante debido a una estrategia inmunosupresora específica del centro (grupo de conversión precoz [CP]). A algunos de los pacientes del estudio ya se los ha descrito en parte en publicaciones anteriores8.
Métodos y criterios de valoraciónLas pautas de inmunosupresión (tipo de fármaco inmunosupresor, dosis diarias y concentraciones valle), así como los datos analíticos y clínicos, se registraron 1 vez al mes durante los primeros 6 meses siguientes al trasplante y después a los 9 y los 12 meses. El objetivo principal fue la tasa de incidencia del rechazo a 1 año. Los objetivos secundarios fueron la tasa de incidencia de infecciones a 1 año y la evaluación de la seguridad (parámetros analíticos, función ventricular izquierda, retirada del fármaco y mortalidad).
La vigilancia del rechazo se basó en el uso convencional de la biopsia endomiocárdica sistemática en todos los centros, excepto 1 que realizó un seguimiento clínico y ecocardiográfico y la biopsia solo se tomó de algunos pacientes seleccionados. Para los fines de este estudio, el rechazo agudo se definió, según se ha descrito con anterioridad, como un evento clínico (observaciones de la biopsia endomiocárdica, una ecocardiografía que indicara disfunción del ventrículo o hemodinámica anormal) que motivara un aumento transitorio de la inmunosupresión, consistente en una tanda corta de corticoides por vía oral o intravenosa a dosis altas, con o sin tratamiento citolítico14. El deterioro hemodinámico se definió por 1 o más de las siguientes características: fracción de eyección del ventrículo izquierdo ≤ 30% o disminución en un 20% respecto al valor basal, índice cardiaco < 2,0 l/min/m2 o una disminución del 25% respecto al valor basal o necesidad de fármacos inotrópicos o de implante de un dispositivo de asistencia ventricular. Un evento infeccioso se definió como la infección que requiere ingreso hospitalario o que motiva que se prolongue una hospitalización ya en curso, o por la administración de un tratamiento antimicrobiano intravenoso o de un tratamiento específico (p. ej., por infecciones oportunistas). La infección por citomegalovirus (CMV) se definió por el aislamiento de CMV o por la detección de proteínas o ácido nucleico del virus en cualquier líquido corporal o muestra de tejido. La función renal se evaluó mediante el filtrado glomerular estimado según la ecuación de la Chronic Kidney Disease Epidemiology Collaboration15. La diabetes de nueva aparición después del trasplante se definió como el empleo de antidiabéticos orales y/o insulina por pacientes sin un diagnóstico de diabetes previo al trasplante.
Análisis estadísticoA menos que se indique otra cosa, las variables continuas se resumen en media ± desviación estándar. Las variables discretas se expresan como porcentajes. Las diferencias entre los 3 grupos en cuanto a las variables continuas se analizaron con ANOVA de una vía (prueba de Welch) y la prueba de correlación mínima significativa de Fisher para las comparaciones post-hoc. Las diferencias en las variables discretas se evaluaron con la prueba de la χ2. No se realizaron imputaciones de los valores no disponibles.
Se analizaron los cambios en las variables continuas furante el periodo de estudio mediante modelos lineales de efectos fijos con medidas repetidas. Los parámetros clínicos (rechazo, infección, infección por CMV) se evaluaron mediante las respectivas tasas de incidencia acumulada. La tasa de incidencia se estimó como el número de episodios aparecidos durante 1 año después del trasplantee/ppacientes-año de seguimiento acumulado. Para introducir un ajuste por las diferencias en las características basales de los grupos, se aplicó la regresión de Poisson o la regresión binomial negativa, según fuera apropiado, incluyendo como variables independientes el grupo de estudio y otras variables clínicas de interés. Se calcularon las odds ratio en comparación con el grupo de TLE, tomado como grupo de referencia. En todo el estudio se consideró significativo un valor de p < 0,05. Los análisis se realizaron con los paquetes comerciales SPSS 20.0 y Stata 12.
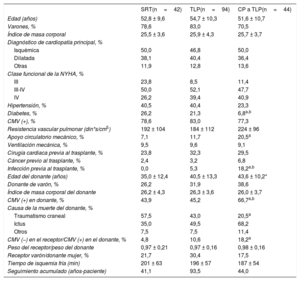
RESULTADOSCaracterísticas de los pacientesFormaron la población del estudio 42 pacientes del grupo de TLE, 94 del grupo de TLP y 44 del grupo de CP. La media de tiempo hasta la conversión de TLE a TLP en el grupo de CP fue 4,3 ± 1,4 (intervalo, 1-6) meses. Las principales características demográficas y clínicas de los receptores y los donantes y las intervenciones quirúrgicas realizadas en los 3 grupos de estudio se resumen en la tabla 1. Los grupos diferían respecto a algunas de las características basales. Las diferencias más notables se observaron entre los grupos de CP y TLE. No se observaron diferencias significativas entre los grupos de TLP y TLE.
Características basales de los grupos de estudio
| SRT(n=42) | TLP(n=94) | CP a TLP(n=44) | |
|---|---|---|---|
| Edad (años) | 52,8 ± 9,6 | 54,7 ± 10,3 | 51,6 ± 10,7 |
| Varones, % | 78,6 | 83,0 | 70,5 |
| Índice de masa corporal | 25,5 ± 3,6 | 25,9 ± 4,3 | 25,7 ± 3,7 |
| Diagnóstico de cardiopatía principal, % | |||
| Isquémica | 50,0 | 46,8 | 50,0 |
| Dilatada | 38,1 | 40,4 | 36,4 |
| Otras | 11,9 | 12,8 | 13,6 |
| Clase funcional de la NYHA, % | |||
| III | 23,8 | 8,5 | 11,4 |
| III-IV | 50,0 | 52,1 | 47,7 |
| IV | 26,2 | 39,4 | 40,9 |
| Hipertensión, % | 40,5 | 40,4 | 23,3 |
| Diabetes, % | 26,2 | 21,3 | 6,8a,b |
| CMV (+), % | 78,6 | 83,0 | 77,3 |
| Resistencia vascular pulmonar (din*s/cm5) | 192 ± 104 | 184 ± 112 | 224 ± 96 |
| Apoyo circulatorio mecánico, % | 7,1 | 11,7 | 20,5a |
| Ventilación mecánica, % | 9,5 | 9,6 | 9,1 |
| Cirugía cardiaca previa al trasplante, % | 23,8 | 32,3 | 29,5 |
| Cáncer previo al trasplante, % | 2,4 | 3,2 | 6,8 |
| Infección previa al trasplante, % | 0,0 | 5,3 | 18,2a,b |
| Edad del donante (años) | 35,0 ± 12,4 | 40,5 ± 13,3 | 43,6 ± 10,2* |
| Donante de varón, % | 26,2 | 31,9 | 38,6 |
| Índice de masa corporal del donante | 26,2 ± 4,3 | 26,3 ± 3,6 | 26,0 ± 3,7 |
| CMV (+) en donante, % | 43,9 | 45,2 | 66,7a,b |
| Causa de la muerte del donante, % | |||
| Traumatismo craneal | 57,5 | 43,0 | 20,5a |
| Ictus | 35,0 | 49,5 | 68,2 |
| Otros | 7,5 | 7,5 | 11,4 |
| CMV (−) en el receptor/CMV (+) en el donante, % | 4,8 | 10,6 | 18,2a |
| Peso del receptor/peso del donante | 0,97 ± 0,21 | 0,97 ± 0,16 | 0,98 ± 0,16 |
| Receptor varón/donante mujer, % | 21,7 | 30,4 | 17,5 |
| Tiempo de isquemia fría (min) | 201 ± 63 | 196 ± 57 | 187 ± 54 |
| Seguimiento acumulado (años-paciente) | 41,1 | 93,5 | 44,0 |
CMV: citomegalovirus; CP: conversión precoz; NYHA: New York Heart Association; TLE: tacrolimus de liberación estándar; TLP: tacrolimus de liberación prolongada.
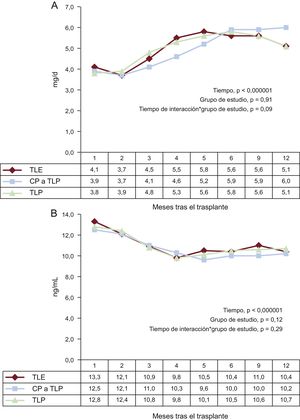
Los datos relativos a las dosis y las concentraciones séricas de tacrolimus se resumen en las figuras 1A y 1B respectivamente. La dosis media diaria de tacrolimus aumentó significativamente en el primer año después del trasplante (p < 0,000001). Esto se observó con independencia del grupo de estudio (p = 0,91) (figura 1A). Se observó una tendencia opuesta por lo que respecta a las concentraciones valle de tacrolimus (figura 1B), que mostraron una disminución muy significativa en el periodo de estudio (p < 0,000001). En general, las concentraciones séricas medias no mostraron diferencias entre los grupos (p = 0,12).
A: dosis diaria de tacrolimus según el grupo de estudio (TLE, TLP, CP de TLE a TLP); se presentan los valores medios (mg/día) en la tabla siguiente. B: concentraciones valle de tacrolimus en suero según el grupo de estudio (TLE, TLP, CP de TLE a TLP); se presentan los valores medios (ng/ml) en la tabla siguiente. CP: conversión precoz; TLE: tacrolimus de liberación estándar; TLP: tacrolimus de liberación prolongada.
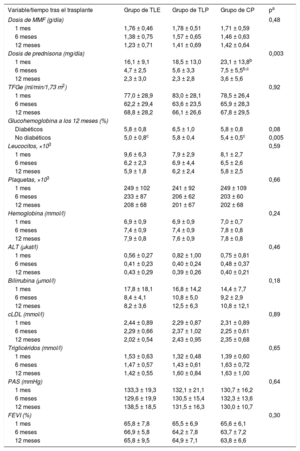
En el conjunto de la población, se utilizó un tratamiento de inducción en 152 receptores (84,4%): basiliximab en 148 (82,2%), daclizumab en 2 (1,1%) y OKT3 en 2 (1,1%). Hubo diferencias significativas entre los grupos por lo que respecta a la tasa de uso de tratamiento de inducción: el 73,8% en el grupo de TLE, el 90,4% en el de TLP y el 81,8% en el de CP (p = 0,002). En todos los pacientes, la inmunosupresión concomitante consistió en micofenolato (MMF) y prednisona. Los cambios en las dosis diarias de MMF y prednisona se resumen en la tabla 2. La dosis media diaria de MMF fue similar en los 3 grupos durante todo el estudio (p = 0,47). La dosis media diaria de prednisona fue significativamente mayor en el grupo de CP que en los de TLE (p = 0,001) y TLP (p = 0,009). Los porcentajes de retirada completa de la prednisona a 1 año fueron del 42,9, el 40,4 y el 38,6% de los grupos de TLE, TLP y CP respectivamente (p = 0,92).
Inmunosupresión concomitante, datos de análisis de laboratorio, presión arterial y función ventricular durante el estudio, por grupos
| Variable/tiempo tras el trasplante | Grupo de TLE | Grupo de TLP | Grupo de CP | pa |
|---|---|---|---|---|
| Dosis de MMF (g/día) | 0,48 | |||
| 1 mes | 1,76 ± 0,46 | 1,78 ± 0,51 | 1,71 ± 0,59 | |
| 6 meses | 1,38 ± 0,75 | 1,57 ± 0,65 | 1,46 ± 0,63 | |
| 12 meses | 1,23 ± 0,71 | 1,41 ± 0,69 | 1,42 ± 0,64 | |
| Dosis de prednisona (mg/día) | 0,003 | |||
| 1 mes | 16,1 ± 9,1 | 18,5 ± 13,0 | 23,1 ± 13,8b | |
| 6 meses | 4,7 ± 2,5 | 5,6 ± 3,3 | 7,5 ± 5,5b,c | |
| 12 meses | 2,3 ± 3,0 | 2,3 ± 2,8 | 3,6 ± 5,6 | |
| TFGe (ml/min/1,73 m2) | 0,92 | |||
| 1 mes | 77,0 ± 28,9 | 83,0 ± 28,1 | 78,5 ± 26,4 | |
| 6 meses | 62,2 ± 29,4 | 63,6 ± 23,5 | 65,9 ± 28,3 | |
| 12 meses | 68,8 ± 28,2 | 66,1 ± 26,6 | 67,8 ± 29,5 | |
| Glucohemoglobina a los 12 meses (%) | ||||
| Diabéticos | 5,8 ± 0,8 | 6,5 ± 1,0 | 5,8 ± 0,8 | 0,08 |
| No diabéticos | 5,0 ± 0,8c | 5,8 ± 0,4 | 5,4 ± 0,5c | 0,005 |
| Leucocitos, ×103 | 0,59 | |||
| 1 mes | 9,6 ± 6,3 | 7,9 ± 2,9 | 8,1 ± 2,7 | |
| 6 meses | 6,2 ± 2,3 | 6,9 ± 4,4 | 6,5 ± 2,6 | |
| 12 meses | 5,9 ± 1,8 | 6,2 ± 2,4 | 5,8 ± 2,5 | |
| Plaquetas, ×103 | 0,66 | |||
| 1 mes | 249 ± 102 | 241 ± 92 | 249 ± 109 | |
| 6 meses | 233 ± 87 | 206 ± 62 | 203 ± 60 | |
| 12 meses | 208 ± 68 | 201 ± 67 | 202 ± 68 | |
| Hemoglobina (mmol/l) | 0,24 | |||
| 1 mes | 6,9 ± 0,9 | 6,9 ± 0,9 | 7,0 ± 0,7 | |
| 6 meses | 7,4 ± 0,9 | 7,4 ± 0,9 | 7,8 ± 0,8 | |
| 12 meses | 7,9 ± 0,8 | 7,6 ± 0,9 | 7,8 ± 0,8 | |
| ALT (μkat/l) | 0,46 | |||
| 1 mes | 0,56 ± 0,27 | 0,82 ± 1,00 | 0,75 ± 0,81 | |
| 6 meses | 0,41 ± 0,23 | 0,40 ± 0,24 | 0,48 ± 0,37 | |
| 12 meses | 0,43 ± 0,29 | 0,39 ± 0,26 | 0,40 ± 0,21 | |
| Bilirrubina (μmol/l) | 0,18 | |||
| 1 mes | 17,8 ± 18,1 | 16,8 ± 14,2 | 14,4 ± 7,7 | |
| 6 meses | 8,4 ± 4,1 | 10,8 ± 5,0 | 9,2 ± 2,9 | |
| 12 meses | 8,2 ± 3,6 | 12,5 ± 6,3 | 10,8 ± 12,1 | |
| cLDL (mmol/l) | 0,89 | |||
| 1 mes | 2,44 ± 0,89 | 2,29 ± 0,87 | 2,31 ± 0,89 | |
| 6 meses | 2,29 ± 0,66 | 2,37 ± 1,02 | 2,25 ± 0,61 | |
| 12 meses | 2,02 ± 0,54 | 2,43 ± 0,95 | 2,35 ± 0,68 | |
| Triglicéridos (mmol/l) | 0,65 | |||
| 1 mes | 1,53 ± 0,63 | 1,32 ± 0,48 | 1,39 ± 0,60 | |
| 6 meses | 1,47 ± 0,57 | 1,43 ± 0,61 | 1,63 ± 0,72 | |
| 12 meses | 1,42 ± 0,55 | 1,60 ± 0,84 | 1,63 ± 1,00 | |
| PAS (mmHg) | 0,64 | |||
| 1 mes | 133,3 ± 19,3 | 132,1 ± 21,1 | 130,7 ± 16,2 | |
| 6 meses | 129,6 ± 19,9 | 130,5 ± 15,4 | 132,3 ± 13,6 | |
| 12 meses | 138,5 ± 18,5 | 131,5 ± 16,3 | 130,0 ± 10,7 | |
| FEVI (%) | 0,30 | |||
| 1 mes | 65,8 ± 7,8 | 65,5 ± 6,9 | 65,6 ± 6,1 | |
| 6 meses | 66,9 ± 5,8 | 64,2 ± 7,8 | 63,7 ± 7,2 | |
| 12 meses | 65,8 ± 9,5 | 64,9 ± 7,1 | 63,8 ± 6,6 |
ALT: alanina aminotransferasa; cLDL: colestrol unido a lipoproteínas de baja densidad; CP: conversión precoz; FEVI: fracción de eyección del ventrículo izquierdo; MMF: micofenolato mofetilo; PAS: presión arterial sistólica; TFGe: tasa de filtrado glomerular estimada; TLE: tacrolimus de liberación estándar; TLP: tacrolimus de liberación prolongada.
Los valores expresan media ± desviación estándar.
Los porcentajes de tratamiento con estatinas fueron menores en el grupo de TLP (75,5%) que en los de TLE (90,2%) y CP (93,2%) (p = 0,014).
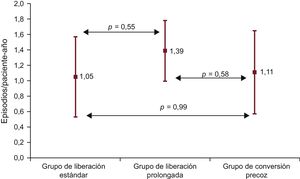
RechazoEn total, hubo 222 episodios de rechazo en 83 pacientes (tasa de incidencia, 1,23 episodios/paciente-año; intervalo de confianza del 95% [IC95%], 0,97-1,50). Se observaron 43 episodios de rechazo en 18 pacientes del grupo de TLE, 130 episodios en 47 pacientes del grupo de TLP y 49 episodios en 18 pacientes del grupo de CP. Las tasas de incidencia fueron, respectivamente, de 1,05 (IC95%, 0,51-1,54), 1,39 (IC95%, 1,00-1,78) y 1,11 (IC95%, 0,58-1,65) episodios/paciente-año (p = 0,48). Ninguna de las comparaciones entre los grupos alcanzó significación estadística (figura 2). En comparación con el grupo de TLE, la odds ratio del rechazo (ajustada por edad y sexo del receptor, diabetes previa al trasplante, infección previa al trasplante, uso de apoyo circulatorio mecánico, edad y sexo del donante, causa de muerte del donante, discrepancia de serología de CMV entre receptor y donante, uso de tratamiento de inducción y uso de estatinas) fue de 0,99 (IC95%, 0,56-1,75) en el grupo de TLP (p = 0,99) y 0,85 (IC95%, 0,44-1,65) en el de CP (p = 0,85) (tabla 1 del material suplementario). Se construyó un segundo modelo añadiendo el hecho de que se sometió a algunos pacientes del estudio a una vigilancia del rechazo no sistemática mediante biopsia endomiocárdica como covariable. Los valores de odds ratio del rechazo en ese modelo fueron 1,14 (IC95%, 0,63-2,04) en el grupo de TLP (p = 0,67) y 1,05 (IC95%, 0,53-2,12) en el de CP (p = 0,87) (tabla 2 del material suplementario).
Se observó deterioro hemodinámico en 28 (12,6%) de los episodios de rechazo, sin que hubiera diferencias significativas entre los grupos (el 20,9% en el grupo de TLE, el 10,8% en el de TLP y el 10,2% en el de CP; p = 0,19). Se utilizó un tratamiento citolítico contra el rechazo para el 11,6, el 10,0 y el 4,1% de los pacientes de los grupos de TLE, TLP y CP respectivamente (p = 0,37). No se produjo ninguna muerte relacionada con el rechazo.
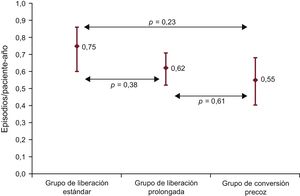
InfeccionesEn el conjunto de la población, hubo 113 episodios de infección no relacionados con CMV en 73 pacientes (tasa de incidencia, 0,63 episodios/paciente-año; IC95%, 0,56-0,70). Se observaron 31 episodios de infección en 18 pacientes del grupo de TLE, 58 episodios en 37 pacientes del grupo de TLP y 24 episodios en 18 pacientes del grupo de CP. Las tasas de incidencia fueron 0,75 (IC95%, 0,60-0,86), 0,62 (IC95%, 0,52-0,71) y 0,55 (IC95%, 0,40-0,68) episodios/paciente-año (p = 0,46). Ninguna de las comparaciones entre los grupos alcanzó significación estadística (figura 3). En comparación con el grupo de TLE, la odds ratio de la infección (ajustada por edad y sexo del receptor, índice de masa corporal del receptor, cirugía cardiaca previa, diabetes previa al trasplante, infección antes del trasplante, uso de apoyo circulatorio mecánico, ventilación mecánica antes del trasplante, discrepancia de serología del CMV entre receptor y donante, uso de tratamiento de inducción, uso de estatinas, urgencia de la intervención y tiempo de isquemia fría) fue 0,83 (IC95%, 0,51-1,34) en el grupo de TLP (p = 0,44) y 0,62 (IC95%, 0,34-1,13) en el de CP (p = 0,12) (tabla 3 del material suplementario).
El microorganismo causal y la localización de los episodios infecciosos se resumen en la tabla 3. Hubo una tendencia a mayores tasas de bacteriemia en los grupos de TLP y CP en comparación con el de TLE. En cambio, se observó una tendencia a mayores tasas de infecciones virales (principalmente por herpes zóster) en el grupo de TLE que en los grupos de TLE y CP. No hubo ninguna muerte relacionada con infecciones.
Características de los episodios infecciosos
| Grupo de liberación estándar | Grupo de liberación prolongada | Grupo de conversión precoz | p | |
|---|---|---|---|---|
| Microorganismo, o (%) | 0,089 | |||
| Bacterias | 27,3 | 59,5 | 56,5 | |
| Virus | 40,9 | 24,3 | 8,7 | |
| Hongos | 13,6 | 5,4 | 8,7 | |
| Desconocido | 18,2 | 10,8 | 26,1 | |
| Localización, n (%) | 0,085 | |||
| Bacteriemia | 9,1 | 21,6 | 21,7 | |
| Respiratoria | 22,7 | 8,1 | 43,5 | |
| Mediastinitis de herida quirúrgica | 13,6 | 18,9 | 8,7 | |
| Cutánea | 31,8 | 27,0 | 8,7 | |
| Otros | 22,7 | 24,3 | 17,4 |
Se produjo una infección/enfermedad por CMV en 10 receptores (23,8%) del grupo de TLE, 19 (20,2%) del de TLP y 8 (18,2%) del de CP (p = 0,86). Los valores de odds ratio (ajustados por edad y sexo del receptor, diabetes previa al trasplante, infección previa al trasplante, discrepancia de la serología de CMV entre receptor y donante, uso de tratamiento de inducción, uso de tratamiento profiláctico contra CMV y total de episodios de rechazo agudo del aloinjerto en 1 año) fueron 0,77 (IC95%, 0,29-2,03) en el grupo de TLP (p = 0,59) y 0,56 (IC95%, 0,18-1,86) en el de CP (p = 0,34) (tabla 4 del material suplementario).
Parámetros de seguridadEn el conjunto del grupo, la tasa de filtrado glomerular a 1 mes (80,5 ± 27,8ml/min) se había reducido significativamente a los 6 y a los 12 meses del trasplante (63,8 ± 26,0 y 67,1 ± 27,5ml/min respectivamente; p < 0,000001). No hubo diferencias significativas entre los grupos (p = 0,92) (tabla 2).
La diabetes aparecida después del trasplante se dio en un 26,0% de los receptores, sin diferencias significativas entre los grupos (TLP, 29,7%; CP, 24,4%; TLE, 19,4%; p = 0,52). Se dispuso de la concentración de glucohemoglobina a los 12 meses de 98 pacientes (54,4%). La glucohemoglobina fue significativamente superior en el grupo de TLP (6,2 ± 0,8%) que en los grupos de TLE (5,3 ± 0,9%; p = 0,0002) y CP (5,5 ± 0,6%; p = 0,001). Las diferencias entre los grupos fueron estadísticamente significativas solo en los pacientes no diabéticos (tabla 2), aunque los valores medios de glucohemoglobina fueron < 6% en los 3 grupos. Estos resultados no se modificaron tras un ajuste por la dosis diaria media de prednisona, la media de concentraciones valle de tacrolimus o el número total de rechazos.
Los principales resultados analíticos, la presión arterial sistólica y la fracción de eyección del ventrículo izquierdo durante el primer año siguiente al trasplante se resumen en la tabla 2. Se observaron diferencias sin significación estadística entre los grupos de estudio.
A 1 paciente del grupo de TLP se le cambió el tratamiento a TLE 6 meses después del trasplante a causa de un rechazo persistente del aloinjerto y la necesidad de dosis altas de TLP para alcanzar una concentración valle de tacrolimus suficiente. No hubo ningún otro efecto adverso relacionado con la formulación que motivara un cambio al otro grupo de tratamiento. Se produjeron 3 muertes durante el primer año siguiente al trasplante, 1 en el grupo de TLE y 2 en el de TLP.
DISCUSIÓNEl TLP, comercializado en Europa desde 2007, se diseñó a partir de una modificación galénica del tacrolimus destinada a su liberación en una zona distal del tubo digestivo. Dicha modificación permite la administración una sola vez al día y presumiblemente una mejor adherencia al tratamiento5. En pacientes receptores de trasplante cardiaco estables de manera crónica, se ha demostrado que la formulación de liberación prolongada es similar al preparado de liberación estándar en seguridad y eficacia3-6. Aunque ambas formulaciones de tacrolimus tienen en común un perfil farmacocinético similar, en este contexto clínico las concentraciones valle alcanzadas con la formulación de TLP parecen ser inferiores a las obtenidas con dosis equivalentes de la formulación de TLE, de manera que aproximadamente un tercio de los pacientes necesitan un ajuste al alza de la dosis para mantener el fármaco dentro del intervalo terapéutico3,4. La experiencia existente con el empleo de novo del TLP en el trasplante cardiaco es mucho menor. Se debe comparar los posibles efectos beneficiosos de una pauta de tratamiento inmunosupresor simplificada con las incertidumbres relativas a la absorción de la nueva formulación en el contexto específico de la fase aguda del trasplante. Esto incluye también la posibilidad de interacción con las múltiples medicaciones utilizadas en esa fase.
En el presente estudio multicéntrico, que incluye la población tratada con TLP en el contexto de uso de novo más amplia hasta la fecha, no hubo diferencias significativas entre las formulaciones de TLE y TLP por lo que respecta a las dosis medias de tacrolimus y las concentraciones séricas valle medias. Se observaron resultados similares con la CP de TLE a TLP. Solo 1 paciente (1,06%) del grupo de tratamiento con TLP tuvo que cambiar a TLE debido a un rechazo persistente del aloinjerto y concentraciones del fármaco insuficientes a pesar del aumento de las dosis de TLP. Ghodsizad et al.9 observaron unas concentraciones valle de tacrolimus más bajas con TLP que con TLE solo en los primeros 5 días siguientes al trasplante, observación similar a la descrita en el trasplante renal16. En cambio, Fuchs et al.10 señalaron la necesidad de usar dosis de TLP superiores a las de TLE para alcanzar unas concentraciones valle similares con ambas formulaciones más allá del primer mes siguiente al trasplante. De manera análoga, Helmschrott et al.12 observaron unos valores séricos de tacrolimus inferiores con TLP en comparación con las que se daban con dosis equivalentes de TLE. Es preciso reconocer que no hay una explicación clara a estos resultados discordantes. Una posible explicación sería que una eventual falta de adherencia al tratamiento tuviera una repercusión más profunda en la pauta de administración 1 vez al día que en la de 2 tomas al día.
Se observó que tanto el uso de novo como el uso precoz de TLP tenían similares incidencias de rechazo del aloinjerto, infección e infección/enfermedad por CMV que con la inmunosupresión convencional mediante TLE. Estos resultados se mantuvieron inalterados a pesar del ajuste por los principales factores de confusión clínicos en cada uno de los objetivos evaluados y concuerdan con los descritos con anterioridad7-12, si bien algunos autores9,10 han descrito una incidencia del rechazo de bajo grado superior en los receptores tratados con TLE que en los tratados con TLP, aunque sin ninguna influencia en los resultados clínicos. Los resultados deben interpretarse en el contexto de la inmunosupresión contemporánea, con altas tasas de tratamiento de inducción de anticuerpos, así como de uso de MMF y prednisona. Con independencia de cuál fuera la formulación de tacrolimus elegida, al años se habían retirado los corticoides a alrededor del 40% de los pacientes. De igual modo, las características clínicas de la cohorte presentada reflejan el perfil de pacientes actual, en especial en los grupos de TLP, con altos porcentajes de diabetes, apoyo circulatorio mecánico y uso de donantes marginales. Esto podría explicar la tendencia a una mayor incidencia de bacteriemia en los grupos de TLP que en el de TLE.
Los parámetros de seguridad (análisis de laboratorio, presión arterial sistólica, fracción de eyección del ventrículo izquierdo) no mostraron diferencias significativas entre los grupos de estudio. Es de destacar que, como se ha indicado anteriormente10-12, la evolución temporal de la función renal no mostró diferencias entre las formulaciones de TLP y TLE. Con el empleo de TLP no se produjo un aumento significativo de la incidencia de diabetes de nueva aparición tras el trasplante. Esto concuerda con los datos de un metanálisis sobre receptores de trasplante renal17. Sin embargo, se observa un aumento leve pero significativo de la glucohemoglobina con el TLP en comparación con el TLE, en especial en los pacientes no diabéticos. Esto concuerda con los resultados de los estudios realizados sobre trasplante hepático en tratamiento crónico18, aunque se ha descrito una observación contraria en receptores de trasplante renal estables19. En el presente estudio, el aumento de la glucohemoglobina no mostró dependencia de las concentraciones valle de tacrolimus y de la dosis acumulada de corticoides. Por consiguiente, esta observación plantea algunas dudas respecto a la posibilidad de un efecto diabetógeno específico del TLP que requerirá más estudio.
LimitacionesEl principal inconveniente de este estudio es su diseño retrospectivo, que conlleva claras limitaciones. Sin embargo, los resultados reflejan la práctica clínica diaria en un grupo de programas de trasplante que aplican una experiencia anteriormente favorable del uso de TLP en receptores de trasplante cardiaco en tratamiento crónico en un contexto clínico postrasplante más temprano. Podría haber también un efecto de la época de tratamiento, ya que algunos pacientes tratados con TLP eran de un periodo más reciente. Esto afectaba a las características basales de los grupos de estudio, que en términos generales fueron más desfavorables en el grupo de TLP que en el de TLE. Además, el tamaño de la muestra podría disminuir la potencia estadística de algunos de los análisis, especialmente el de la glucohemoglobina, disponible solo de la mitad de los pacientes.
El análisis se limitó al primer año siguiente al trasplante, que es la fase más crítica respecto a la incidencia y la gravedad del rechazo y la infección. Sin embargo, en publicaciones anteriores se ha demostrado ya la seguridad y la eficacia del TLP para pacientes estables en tratamiento crónico después del primer año. No se pudo evaluar la adherencia al tratamiento, que posiblemente sea la principal ventaja del TLP en comparación con el TLE. Sin embargo, la falta de adherencia podría ser un problema menos prevalente en la fase aguda del trasplante cardiaco que en las etapas posteriores.
Recientemente se ha desarrollado una nueva formulación de TLP20. Parece que esta formulación tiene una farmacocinética diferente que la evaluada en este estudio. Así pues, no se puede extrapolar los resultados a esa nueva formulación.
CONCLUSIONESLos resultados de este estudio indican que el TLP, utilizado de novo en el trasplante cardiaco, así como en la CP del TLE, puede tener un perfil de seguridad y eficacia similar al del TLE.
FINANCIACIÓNAstellas Pharma España, Madrid, España.
CONFLICTO DE INTERESESEste estudio se financió con una subvención no condicionada de Astellas Pharma España, Madrid, España. Astellas Pharma no participó en ninguna de las siguientes acciones: recogida de datos, análisis estadístico, interpretación de los resultados y elaboración/aprobación del manuscrito. F. González-Vílchez ha recibido de Astellas y Novartis pagos por conferencias y de Roche pagos para asistencia estadística.
- –
El tacrolimus es actualmente el inhibidor de la calcineurina utilizado con más frecuencia en el trasplante cardiaco.
- –
El uso de una formulación de liberación prolongada de tacrolimus permite la administración 1 sola vez al día.
- –
Esta formulación se ha evaluado detalladamente en el contexto de tratamiento crónico en el trasplante cardiaco, en comparación con la formulación estándar que requiere la administración 2 veces al día.
- –
Hasta donde se sabe, el presente estudio evalúa la seguridad y la eficacia del uso de TLP de novo y en las fases precoces (primeros 6 meses) del trasplante cardiaco en la serie más amplia presentada hasta la fecha. Los resultados se compararon con los obtenidos empleando el TLE.
Se puede consultar material adicional a este artículo en su versión electrónica disponible en http://dx.doi.org/10.1016/j.recesp.2017.03.015.