En los pacientes con insuficiencia cardiaca y diabetes tipo 2, las cifras bajas de glucohemoglobina se han relacionado con un riesgo más elevado de mortalidad, pero la información relativa a la morbilidad es escasa. El objetivo de este estudio fue evaluar la asociación existente entre la glucohemoglobina y el reingreso en un plazo de 30 días en los pacientes con diabetes tipo 2 e insuficiencia cardiaca aguda.
MétodosSe determinó la glucohemoglobina antes del alta en 835 pacientes consecutivos con insuficiencia cardiaca aguda y diabetes tipo 2. Se utilizó un análisis de regresión de Cox adaptado para eventos competitivos.
ResultadosLa media de edad fue de 72,9 ± 9,6 años y la mediana de la glucohemoglobina fue de 7,2% (6,5-8,0%). Los pacientes tratados con insulina o con insulina/sulfonilurea/meglitinidas constituyeron un 41,1 y un 63,2% de la cohorte, respectivamente. A los 30 días del alta, 109 (13,1%) pacientes habían tenido un reingreso en el hospital. El análisis multivariante reveló que el efecto de la glucohemoglobina sobre el riesgo de reingreso en 30 días se veía afectado de manera diferente según el tipo de tratamiento (p para la interacción < 0,01). La glucohemoglobina (por cada 1% de disminución) presentaba una asociación inversa con un mayor riesgo en los pacientes tratados con insulina (hazard ratio = 1,45; intervalo de confianza del 95%, 1,13-1,86; p = 0,003) o con insulina/sulfonilurea/meglitinidas (hazard ratio = 1,44; intervalo de confianza del 95%, 1,16-1,80; p = 0,001). En cambio, la glucohemoglobina (por cada 1% de aumento) no tenía efecto alguno en la diabetes no insulinodependiente (hazard ratio = 1,01; intervalo de confianza del 95%, 0,87-1,17; p = 0,897) o mostraba incluso un efecto positivo en los pacientes no tratados con insulina/sulfonilurea/meglitinidas (hazard ratio = 1,12; intervalo de confianza del 95%, 1,03-1,22; p = 0,011).
ConclusionesEn la insuficiencia cardiaca aguda, la glucohemoglobina mostró una asociación inversa con el riesgo de reingreso en 30 días en los pacientes insulinodependientes o en los tratados con insulina/sulfonilurea/meglitinidas. En el resto de pacientes se observó un efecto marginal. En futuros estudios deberá esclarecerse si esa asociación refleja un efecto relacionado con el tratamiento o bien es un indicador indirecto de una enfermedad más avanzada.
Palabras clave
El riesgo de reingreso temprano en los pacientes dados de alta recientemente del hospital tras un ingreso por insuficiencia cardiaca aguda (ICA) continúa siendo prohibitivamente alto1,2. Los reingresos suelen asociarse a un aumento de la mortalidad y comportan una carga de asistencia sanitaria excesiva1. Los programas e iniciativas institucionales actuales para la insuficiencia cardiaca (IC) establecen la reducción de la frecuencia de los reingresos tempranos como uno de los objetivos principales3–5. Lamentablemente, no hay factores de riesgo bien establecidos para permitir la identificación de los pacientes con un riesgo alto de reingreso6. La diabetes mellitus es una comorbilidad frecuente en la IC y su tratamiento óptimo continúa sin estar claro. Los estudios recientes y las guías actuales han resaltado los posibles efectos nocivos de las estrategias intensivas de reducción de la glucosa y el mayor riesgo que comportan de episodios de hipoglucemia en determinados subgrupos de pacientes, como los que tienen una enfermedad cardiovascular (CV) avanzada7–10. En consonancia con estas afirmaciones, algunos estudios epidemiológicos y observacionales han mostrado un patrón en forma de U o una relación inversa entre la glucohemoglobina (HbA1c) y la mortalidad en los pacientes con IC y diabetes mellitus11–13. No obstante, no se dispone de datos acerca del efecto de la HbA1c sobre el riesgo de reingreso, en especial después de un episodio de descompensación y teniendo en cuenta el tipo de tratamiento antidiabético utilizado.
La hipoglucemia, principalmente a través de la activación del sistema simpático, pero también mediante un fomento de la disfunción endotelial y la inflamación, incrementa la presión arterial sistólica, la frecuencia cardiaca, el riesgo de arritmias, la isquemia miocárdica y la acumulación/redistribución de los líquidos, todo los cual son factores desencadenantes de descompensación en la IC8,14,15. En este sentido, se propone que los valores inferiores de HbA1c en los pacientes con diabetes mellits tipo 2 (DM2) con una hospitalización reciente por ICA, en especial los tratados con fármacos antidiabéticos que aumentan el riesgo de hipoglucemia, podrían permitir la identificación de los pacientes con un mayor riesgo de presentar un reingreso temprano.
El objetivo de este estudio fue evaluar la asociación existente entre la HbA1c, determinada durante un ingreso índice por ICA, y el riesgo de reingreso no programado en un plazo de 30 días, y determinar si el tipo de tratamiento antidiabético utilizado modifica de manera diversa esta asociación.
MÉTODOSMuestra del estudioEn el estudio se incluyó un total de 2.079 pacientes consecutivos ingresados en el departamento de cardiología de un hospital de nivel terciario (Hospital Clínico Universitario de Valencia, España) entre el 1 de enero de 2006 y el 31 de diciembre de 2013, con el diagnóstico principal de ICA. Se definió ICA como una instauración rápida de signos y síntomas atribuibles a una función cardiaca anormal, junto con una evidencia objetiva de anomalía estructural o funcional del corazón en estado de reposo (cardiomegalia, tercer ruido cardiaco, soplo cardiaco, ecocardiografía anormal o aumento de péptidos natriuréticos)16–18. Al ingreso se prescribió en todos los pacientes un tratamiento intravenoso con furosemida por un mínimo de 48h. El diseño del estudio excluyó a los pacientes sin diagnóstico previo de DM2 en el momento de la hospitalización índice (n = 1.173). Asimismo se excluyeron las muertes ocurridas en el hospital durante esa hospitalización (n = 34) y los pacientes con diagnóstico final de síndrome coronario agudo (n = 20) o neumonía (n = 16). La muestra final la formaron 835 pacientes ().
Previo al alta se registró de manera sistemática información relativa a parámetros demográficos, antecedentes patológicos, constantes vitales, electrocardiograma de 12 derivaciones, análisis de laboratorio rutinarios, parámetros ecocardiográficos y tratamientos farmacológicos llevados por el paciente, siguiendo un cuestionario de registro preestablecido. Los datos de laboratorio de interés fueron recogidos a una mediana de 4 días [rango intercuartílico, 3-6 días]. El tratamiento con inhibidores de la enzima de conversión de la angiotensina, antagonistas de los receptores de la angiotensina, bloqueadores beta, antagonistas de la aldosterona, anticoagulantes, diuréticos y otras estrategias terapéuticas se individualizó según lo establecido en las guías en vigor en el momento en el que cada paciente fue reclutado para la inclusión en el registro16–18.
Tratamiento de la diabetes y determinación de la glucohemoglobinaSe registró el tratamiento antidiabético con el que se dio de alta al paciente, haciendo énfasis en insulina, sulfonilureas, meglitinidas, metformina, tiazolidinediona, inhibidores de la dipeptidilpeptidasa 4 e inhibidores de la alfa-glucosidasa. Las determinaciones utilizadas en el análisis, tanto de HbA1c en sangre, junto con análisis de laboratorio de interés, fueron dentro de la hospitalización índice hacia una mediana de 4 días [rango intercuartílico, 3-6 días]. Los pacientes se dividieron en 2 grupos, en función del tratamiento: a) aquellos con riesgo alto de episodios de hipoglucemia (insulina/sulfonilurea/meglitinidas [Ins/SU/MG], y b) aquellos con riesgo bajo de episodios de hipoglucemia (inhibidores de la dipeptidilpeptidasa 4 e inhibidores de la alfa-glucosidasa).
Parámetros de valoraciónLa variable de valoración principal fue el reingreso hospitalario por cualquier causa que hubiese ocurrido de manera no programada, y dentro de los 30 días siguientes al alta. Las variables de valoración secundarias fueron los reingresos debidos a ICA o de causa CV en los 30 días siguientes al alta. La definición de reingreso incluyó la estancia no planificada en el hospital durante más de 24h y se clasificó como de causa CV o no CV (incluidas las hospitalizaciones por ICA). Estas variables de valoración las evaluó un médico ajeno al manejo y seguimiento del paciente y a través de la revisión de historias clínicas. Este estudio se atiene a los principios expuestos en la Declaración de Helsinki y fue aprobado por un comité ético de investigación de nuestro centro. Todos los paciente (valores de HbA1c y tratamiento antidiabético) dieron su consentimiento informado.
Análisis estadísticoLas variables continuas se expresaron en forma media ± 1 des-viación estándar o de mediana [rango intercuartilíco] según fuera apropiado. Las variables discretas se resumieron mediante porcentajes. Se compararon las características basales en los diversos cuartiles (Q1, Q2, Q3 y Q4) de HbA1c. Para el análisis inferencial se utilizó el método de Fine y Gray, con el fin de analizar las variables de valoración ajustadas por eventos competitivos. En particular, los estimados de mortalidad de cualquier causa fueron simultáneamente ajustados por las tasas de reingresos y viceversa19. La selección de las covariables se llevó a cabo utilizando el método escalonado de dirección retrograda, con un valor de p para inclusión de 0,157 (similar al criterio AIC). Se evaluaron con fines pronósticos la mayor parte de las covariables presentadas en la tabla 1. Como parte del proceso de selección se evaluó el supuesto de linealidad para las variables continuas y, de no cumplirse, estas fueron transformadas con polinomios fraccionales20. El modelo multivariable final para el reingreso en 30 días por cualquier causa incluyó la edad, el ingreso previo por ICA, el índice de comorbilidad de Charlson, la interacción entre la fibrilación auricular y la frecuencia cardiaca, la interacción entre la fracción de eyección ventricular izquierda ≤ 35% y la presión arterial sistólica, el antígeno carbohidrato 125 en plasma, la urea y el equivalente de dosis de furosemida prescrito en el momento del alta. El modelo multivariable final para reingreso a 30 días de causa CV incluyó el ingreso previo por ICA, la etiología, el índice de comorbilidad de Charlson, la interacción entre la fibrilación auricular y la frecuencia cardiaca, la interacción entre la fracción de eyección ventricular izquierda ≤ 35% y la presión arterial sistólica, la troponina de alta sensibilidad y la dosis de furosemida en el momento del alta. El modelo multivariable final para reingreso por ICA incluyó el ingreso previo por ICA, el índice de comorbilidad de Charlson, la interacción entre la fibrilación auricular y la frecuencia cardiaca, la interacción entre la fracción de eyección ventricular izquierda ≤ 35% y la presión arterial sistólica, el antígeno carbohidrato 125 y la urea. Se verificó el supuesto de proporcionalidad para todos los modelos de regresión mediante los residuos de Schoenfeld y la capacidad de discriminación con el estadístico C de Harrell.
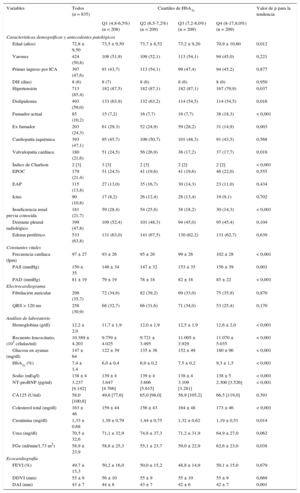
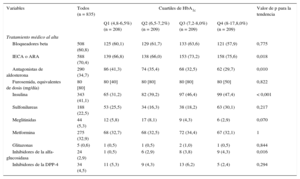
Características basales según los valores de glucohemoglobina
| Variables | Todos (n = 835) | Cuartiles de HbA1c | Valor de p para la tendencia | |||
|---|---|---|---|---|---|---|
| Q1 (4,8-6,5%) (n = 208) | Q2 (6,5-7,2%) (n = 209) | Q3 (7,2-8,0%) (n = 209) | Q4 (8-17,8,0%) (n = 209) | |||
| Características demográficas y antecedentes patológicos | ||||||
| Edad (años) | 72,8 ± 9,50 | 73,5 ± 9,50 | 73,7 ± 8,52 | 73,2 ± 9,20 | 70,9 ± 10,60 | 0,012 |
| Varones | 424 (50,8) | 108 (51,9) | 109 (52,1) | 113 (54,1) | 94 (45,0) | 0,221 |
| Primer ingreso por ICA | 397 (47,6) | 91 (43,7) | 113 (54,1) | 99 (47,4) | 94 (45,2) | 0,877 |
| DH (días) | 8 (6) | 8 (7) | 8 (6) | 8 (6) | 8 (6) | 0,950 |
| Hipertensión | 713 (85,4) | 182 (87,5) | 182 (87,1) | 182 (87,1) | 167 (79,9) | 0,037 |
| Dislipidemia | 493 (59,0) | 133 (63,9) | 132 (63,2) | 114 (54,5) | 114 (54,5) | 0,016 |
| Fumador actual | 85 (10,2) | 15 (7,2) | 16 (7,7) | 16 (7,7) | 38 (18,3) | < 0,001 |
| Ex fumador | 203 (24,3) | 61 (29,3) | 52 (24,9) | 59 (28,2) | 31 (14,9) | 0,003 |
| Cardiopatía isquémica | 393 (47,1) | 95 (45,7) | 106 (50,7) | 101 (48,3) | 91 (43,5) | 0,568 |
| Valvulopatía cardíaca | 180 (21,6) | 51 (24,5) | 56 (26,9) | 36 (17,2) | 37 (17,7) | 0,018 |
| Índice de Charlson | 2 [3] | 3 [3] | 2 [3] | 2 [2] | 2 [2] | < 0,001 |
| EPOC | 179 (21,4) | 51 (24,5) | 41 (19,6) | 41 (19,6) | 46 (22,0) | 0,555 |
| EAP | 115 (13,8) | 27 (13,0) | 35 (16,7) | 30 (14,3) | 23 (11,0) | 0,434 |
| Ictus | 90 (10,8) | 17 (8,2) | 26 (12,4) | 28 (13,4) | 19 (9,1) | 0,702 |
| Insuficiencia renal previa conocida | 181 (21,7) | 59 (28,4) | 54 (25,8) | 38 (18,2) | 30 (14,3) | < 0,001 |
| Derrame pleural radiológico | 399 (47,8) | 109 (52,4) | 101 (48,3) | 94 (45,0) | 95 (45,4) | 0,104 |
| Edema periférico | 533 (63,8) | 131 (63,0) | 141 (67,5) | 130 (62,2) | 131 (62,7) | 0,639 |
| Constantes vitales | ||||||
| Frecuencia cardiaca (lpm) | 97 ± 27 | 93 ± 26 | 95 ± 26 | 99 ± 26 | 102 ± 28 | < 0,001 |
| PAS (mmHg) | 150 ± 35 | 146 ± 34 | 147 ± 32 | 153 ± 35 | 156 ± 39 | 0,001 |
| PAD (mmHg) | 81 ± 19 | 79 ± 19 | 78 ± 18 | 82 ± 18 | 85 ± 22 | < 0,001 |
| Electrocardiograma | ||||||
| Fibrilación auricular | 298 (35,7) | 72 (34,6) | 82 (39,2) | 69 (33,0) | 75 (35,9) | 0,870 |
| QRS > 120 ms | 258 (30,9) | 68 (32,7) | 66 (31,6) | 71 (34,0) | 53 (25,4) | 0,170 |
| Análisis de laboratorio | ||||||
| Hemoglobina (g/dl) | 12,2 ± 2,0 | 11,7 ± 1,9 | 12,0 ± 1,9 | 12,5 ± 1,9 | 12,6 ± 2,0 | < 0,001 |
| Recuento leucocitario, (103 células/ml) | 10.389 ± 4.203 | 9.759 ± 4.025 | 9.721 ± 3.495 | 11.005 ± 3.929 | 11.070 ± 5.035 | < 0,001 |
| Glucosa en ayunas (mg/dl) | 147 ± 64 | 122 ± 39 | 135 ± 36 | 152 ± 49 | 180 ± 96 | < 0,001 |
| HbA1c (%) | 7,4 ± 1,4 | 6,0 ± 0,4 | 6,9 ± 0,2 | 7,5 ± 0,2 | 9,3 ± 1,5 | < 0,001 |
| Sodio (mEq/l) | 138 ± 4 | 139 ± 4 | 139 ± 4 | 138 ± 4 | 138 ± 5 | < 0,001 |
| NT-proBNP (pg/ml) | 3.237 [4.142] | 3.647 [4.766] | 3.606 [5.615] | 3.109 [3.281] | 2.300 [3.526] | < 0,001 |
| CA125 (U/ml) | 58,0 [100,8] | 49,6 [77,6] | 65,0 [98,0] | 56,9 [105,2] | 66,5 [119,0] | 0,391 |
| Colesterol total (mg/dl) | 163 ± 46 | 159 ± 44 | 156 ± 43 | 164 ± 48 | 173 ± 46 | < 0,001 |
| Creatinina (mg/dl) | 1,33 ± 0,68 | 1,39 ± 0,79 | 1,44 ± 0,75 | 1,32 ± 0,62 | 1,19 ± 0,51 | 0,014 |
| Urea (mg/dl) | 70,5 ± 32,6 | 71,1 ± 32,9 | 74,8 ± 37,3 | 71,2 ± 31,9 | 64,9 ± 27,0 | 0,062 |
| FGe (ml/min/1,73 m2) | 58,9 ± 23,9 | 58,8 ± 25,3 | 55,1 ± 23,7 | 59,0 ± 22,9 | 62,6 ± 23,0 | 0,038 |
| Ecocardiografía | ||||||
| FEVI (%) | 49,7 ± 15,3 | 50,2 ± 16,0 | 50,0 ± 15,2 | 48,8 ± 14,9 | 50,1 ± 15,0 | 0,679 |
| DDVI (mm) | 55 ± 9 | 56 ± 10 | 55 ± 9 | 55 ± 10 | 55 ± 9 | 0,669 |
| DAI (mm) | 43 ± 7 | 44 ± 8 | 43 ± 7 | 42 ± 6 | 42 ± 7 | 0,001 |
CA125: antígeno carbohidrato 125; DAI: diámetro auricular izquierdo; DDVI: diámetro diastólico ventricular izquierdo; DH: duración de la hospitalización; EAP: enfermedad arterial periférica; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección ventricular izquierda; FGe: filtrado glomerular estimado; HbA1c: glucohemoglobina; ICA: insuficiencia cardiaca aguda; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
Salvo otra indicación, los datos expresan n (%), media ± desviación estándar o mediana [rango intercuartílico].
En todos los análisis se consideró un valor de p bilateral < 0,05 como criterio de significación estadística. Todos los análisis de la supervivencia se llevaron a cabo con el empleo del programa STATA 13.1 (StataCorp. 2013. Stata Statistical Software: versión 13.1. College Station, Texas: StataCorp LP).
RESULTADOSLa media de edad fue de 72,9 ± 9,6 años, un 49,2% de los pacientes eran mujeres, un 48,7% presentaba una fracción de eyección ventricular izquierda < 50% y la mediana del valor de HbA1c fue de 7,2% (6,5-8,0%). El tratamiento antidiabético consistió en insulina (41,1%), metformina (32,9%), sulfonilureas (22,5%), meglitinidas (5,3%), inhibidores de la dipeptidilpeptidasa 4 (4,5%), inhibidores de la alfa-glucosidasa (2,9%) y tiazolidinedionas (0,5%). Los pacientes tratados con al menos un fármaco hipoglucemiante (Ins/SU/MG) constituían un 63,2% de la muestra total.
Características basales según los valores de glucohemoglobinaEn general, los valores más bajos de HbA1c se asociaron a un perfil de riesgo basal menos favorable. Se observó una relación proporcional de aumento en la edad, la fracción aminoterminal del propéptido natriurético cerebral, la creatinina sérica, el diámetro auricular izquierdo y el índice de comorbilidad de Charlson al pasar del HbA1c-Q4 al HbA1c-Q1 (tabla 1); lo mismo ocurrió en relación con la prevalencia de hipertensión, dislipidemia, tabaquismo previo, enfermedad valvular significativa e insuficiencia renal previa conocida. De forma análoga, los valores más bajos de presión arterial sistólica/diastólica, hemoglobina, colesterol total, recuento leucocitario y tasa de filtrado glomerular predominaban en los cuartiles inferiores (tabla 1). En cuanto a la medicación, los pacientes que se encontraban en los cuartiles inferiores de los valores de HbA1c presentaban una prevalencia más alta de prescripción de antagonistas de los receptores de la aldosterona y una prevalencia inferior de uso de insulina, inhibidores de la alfa-glucosidasa e inhibidores de la enzima de conversión de la angiotensina/antagonistas de los receptores de la angiotensina. No se observaron diferencias significativas para las variables relativas al uso de otros fármacos para la IC y de otros fármacos antidiabéticos orales al evaluarlos en los diferentes cuartiles de HbA1c (tabla 2).
Tratamiento farmacológico según los valores de glucohemoglobina
| Variables | Todos (n = 835) | Cuartiles de HbA1c | Valor de p para la tendencia | |||
|---|---|---|---|---|---|---|
| Q1 (4,8-6,5%) (n = 208) | Q2 (6,5-7,2%) (n = 209) | Q3 (7,2-8,0%) (n = 209) | Q4 (8-17,8,0%) (n = 209) | |||
| Tratamiento médico al alta | ||||||
| Bloqueadores beta | 508 (60,8) | 125 (60,1) | 129 (61,7) | 133 (63,6) | 121 (57,9) | 0,775 |
| IECA o ARA | 588 (70,4) | 139 (66,8) | 138 (66,0) | 153 (73,2) | 158 (75,6) | 0,018 |
| Antagonistas de aldosterona | 290 (34,7) | 86 (41,3) | 74 (35,4) | 68 (32,5) | 62 (29,7) | 0,010 |
| Furosemida, equivalentes de dosis (mg/día) | 80 [80] | 80 [40] | 80 [80] | 80 [80] | 80 [50] | 0,822 |
| Insulina | 343 (41,1) | 65 (31,2) | 82 (39,2) | 97 (46,4) | 99 (47,4) | < 0,001 |
| Sulfonilureas | 188 (22,5) | 53 (25,5) | 34 (16,3) | 38 (18,2) | 63 (30,1) | 0,217 |
| Meglitinidas | 44 (5,3) | 12 (5,8) | 17 (8,1) | 9 (4,3) | 6 (2,9) | 0,070 |
| Metformina | 275 (32,9) | 68 (32,7) | 68 (32,5) | 72 (34,4) | 67 (32,1) | 1 |
| Glitazonas | 5 (0,6) | 1 (0,5) | 1 (0,5) | 2 (1,0) | 1 (0,5) | 0,844 |
| Inhibidores de la alfa-glucosidasa | 24 (2,9) | 1 (0,5) | 6 (2,9) | 8 (3,8) | 9 (4,3) | 0,016 |
| Inhibidores de la DPP-4 | 34 (4,5) | 11 (5,3) | 9 (4,3) | 13 (6,2) | 5 (2,4) | 0,294 |
ARA: antagonista de los receptores de la angiotensina; DPP-4: inhibidores de la dipeptidilpeptidasa 4; HbA1c: glucohemoglobina; IECA: inhibidores de la enzima de conversión de la angiotensina.
Salvo otra indicación, los datos expresan n (%) o mediana [rango intercuartílico].
Los pacientes tratados con insulina o con Ins/SU/MG presentaban un perfil de riesgo basal más desfavorable. De forma sucinta, estos pacientes tenían más comorbilidad (enfermedad arterial periférica, insuficiencia renal e ingreso previo por ICA), mayor prevalencia de cardiopatía isquémica, una media de hemoglobina inferior y un perfil de glucemia superior. No se observaron diferencias significativas entre los grupos de traamiento de la IC ().
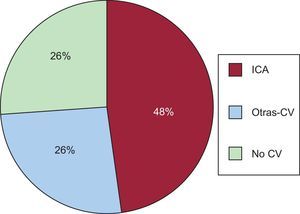
Glucohemoglobina, fármacos antidiabéticos y riesgo de reingreso a 30 díasA los 30 días del alta, 17 (2,0%) pacientes habían fallecido (3 de ellos sin reingreso) y 109 (13,1%) habían reingresado, principalmente por causas CV (n = 80 [73,4%]). De entre las causas CV, la ICA fue el diagnóstico más frecuente (n = 52 [65% CV]). En la figura 1 se resumen las causas más frecuentes de reingreso.
En el conjunto de la muestra, las tasas de reingreso a 30 días diferían en los distintos valores de los cuartiles de HbA1c. Se observó una relación proporcional de aumento en la tasa de reingresos al pasar de Q4 a Q1 (10,5, 11,0, 12,0 y 18,8%, respectivamente; valor de p para la tendencia = 0,016). Un análisis más detallado puso de manifiesto la existencia de una asociación divergente entre los cuartiles de HbA1c y las tasas de reingreso en 30 días en función del tipo de tratamiento antidiabético. Así, en los pacientes tratados con Ins/SU/MG se observó una relación inversa entre los cuartiles de HbA1c con la tasa de reingreso a 30 días (26,5, 15,3, 10,5 y 7,2%) para Q1, Q2, Q3 y Q4, respectivamente; valor de p para la tendencia < 0,001). Esta relación inversa también se identificó en el grupo de pacientes con DM2 tratados con insulina (26,2, 14,6, 12,4 y 7,1%, para los cuartiles Q1, Q2, Q3 y Q4, respectivamente; valor de p para la tendencia < 0,001) y sulfonilureas (30,2, 17,7, 10,5 y 9,5%, respectivamente; valor de p para la tendencia < 0,001). En cambio, en los pacientes no tratados con Ins/SU/MG se observó un aumento de la tasa de reingresos de significación estadistica limítrofe (8,8, 7,1, 12,0 y 19,6% para los cuartiles Q1, Q2, Q3 y Q4, respectivamente; valor de p para la tendencia = 0,087). Además, en los pacientes no tratados con insulina, no hubo diferencias a lo largo de los cuartiles de HbA1c (15,4, 10,2, 9,8 y 13,6%, respectivamente; valor de p para la tendencia = 0,443).
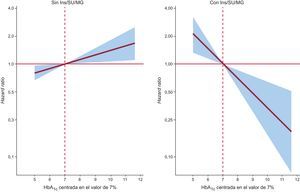
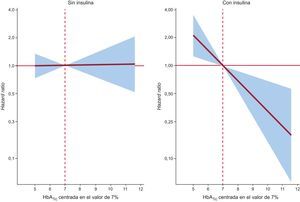
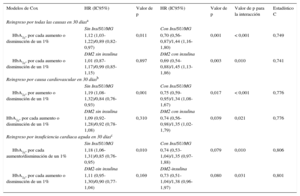
En un contexto multivariable, después de introducir un ajuste para los factores de riesgo y por mortalidad a 30 días como evento competitivo, este efecto pronóstico diferencial persistió (valor de p para las interacciones < 0,05). El valor de la HbA1c mostró una asociación inversa y lineal con un riesgo más elevado de reingreso en los pacientes tratados con insulina (hazard ratio = 1,45; intervalo de confianza del 95%, 1,13-1,86; p = 0,003, por cada 1% de disminución) o con Ins/SU/MG (hazard ratio = 1,44; intervalo de confianza del 95%, 1,16-,80; p = 0,001, por cada 1% de disminución) (figuras 2 y 3). Por ejemplo, en los pacientes tratados con insulina y los tratados con Ins/SU/MG, el HbA1c-Q1 (≤ 6,5%) observó un aumento del riesgo ajustado de 3,5 y 3,4 veces frente a los HbA1c-Q2-Q4 (p = 0,010 y 0,001, respectivamente). De igual modo, y con el empleo de un umbral de referencia de la HbA1c del 7%, los pacientes tratados con Ins/SU/MG y los pacientes con DM2 que tenían valores de HbA1c de entre 6,9 y 5,0% presentaron un aumento del riesgo que iba del 4 al 210% (figuras 2 y 3).
En cambio, el valor de HbA1c no mostró relación con la evolución de los pacientes que no recibían un tratamiento insulínico (hazard ratio = 1,01; intervalo de confianza del 95%, 0,87-1,17;, p = 0,897, por cada 1% de aumento) y evidenció una asociación positiva con un aumento del riesgo en los pacientes no tratados con Ins/SU/MG (hazard ratio = 1,12; intervalo de confianza del 95%, 1,03-1,22; p = 0,011, por cada 1% de aumento) (figuras 2 y 3). Se observó un efecto pronóstico diferencial similar para los reingresos de causa CV o los reingresos por ICA al evaluar estos parámetros como variables de valoración (tabla 3).
Hazard ratios de la glucohemoglobina para los reingresos en 30 días por todas las causas, por causa cardiovascular o por insuficiencia cardiaca aguda
| Modelos de Cox | HR (IC95%) | Valor de p | HR (IC95%) | Valor de p | Valor de p para la interacción | Estadístico C |
|---|---|---|---|---|---|---|
| Reingreso por todas las causas en 30 díasa | ||||||
| Sin Ins/SU/MG | Con Ins/SU/MG | |||||
| HbA1c, por cada aumento o disminución de un 1% | 1,12 (1,03-1,22)/0,89 (0,82-0,97) | 0,011 | 0,70 (0,56-0,87)/1,44 (1,16-1,80) | 0,001 | < 0,001 | 0,749 |
| DM2 sin insulina | DM2 con insulina | |||||
| HbA1c, por cada aumento o disminución de un 1% | 1,01 (0,87-1,17)/0,99 (0,85-1,15) | 0,897 | 0,69 (0,54-0,88)/1,45 (1,13-1,86) | 0,003 | 0,010 | 0,741 |
| Reingreso por causa cardiovascular en 30 díasb | ||||||
| Sin Ins/SU/MG | Con Ins/SU/MG | |||||
| HbA1c, por aumento o disminución de un 1% | 1,19 (1,08-1,32)/0,84 (0,76-0,93) | 0,001 | 0,75 (0,59-0,95)/1,34 (1,08-1,67) | 0,017 | < 0,001 | 0,776 |
| DM2 sin insulina | DM2 con insulina | |||||
| HbA1c, por cada aumento o disminución de un 1% | 1,09 (0,92-1,28)/0,92 (0,78-1,08) | 0,310 | 0,74 (0,56-0,98)/1,35 (1,02-1,79) | 0,039 | 0,021 | 0,776 |
| Reingreso por insuficiencia cardiaca aguda en 30 díasc | ||||||
| Sin Ins/SU/MG | Con Ins/SU/MG | |||||
| HbA1c, por cada aumento/disminución de un 1% | 1,18 (1,06-1,31)/0,85 (0,76-0,95) | 0,010 | 0,74 (0,53-1,04)/1,35 (0,97-1,88) | 0,079 | 0,010 | 0,806 |
| DM2-sin insulina | DM2-insulina | |||||
| HbA1c, por cada aumento o disminución de un 1% | 1,11 (0,95-1,30)/0,90 (0,77-1,04) | 0,169 | 0,73 (0,51-1,04)/1,38 (0,96-1,97) | 0,080 | 0,031 | 0,801 |
DM2: diabetes mellitus tipo 2; HbA1c,: glucohemoglobina; HR: hazard ratio; IC95%: intervalo de confianza del 95%; Ins/SU/MG: insulina/sulfonilurea/meglitinidas (fármacos que aumentan el riesgo de hipoglucemia).
Modelo de riesgos en competencia ajustado según la mortalidad por todas las causas en 30 días y las siguientes covariables: edad, ingreso previo por insuficiencia cardiaca aguda, índice de comorbilidad de Charlson (interacción entre la fibrilación auricular y la frecuencia cardiaca; interacción entre la fracción de eyección ventricular izquierda ≤ 35% y la presión arterial sistólica), antígeno carbohidrato 125 en plasma, urea y dosis equivalente de furosemida en el momento del alta.
Modelo de riesgos en competencia ajustado según la mortalidad por todas las causas en 30 días, el reingreso por causa no cardiovascular y las siguientes covariables: ingreso previo por insuficiencia cardiaca aguda, etiología, índice de comorbilidad de Charlson (interacción entre la fibrilación auricular y la frecuencia cardiaca; interacción entre la fracción de interacción (fracción de eyección ventricular izquierda ≤ 35% y la presión arterial sistólica), troponina de alta sensibilidad y dosis de furosemida en el momento del alta.
Modelo de riesgos en competencia ajustado según la mortalidad por todas las causas en 30 días, el reingreso por causa distinta de la insuficiencia cardiaca aguda y las siguientes covariables: ingreso previo por insuficiencia cardiaca aguda, índice de comorbilidad de Charlson (interacción entre fibrilación auricular y frecuencia cardiaca; interacción entre la fracción de eyección ventricular izquierda ≤ 35% y la presión arterial sistólica), antígeno carbohidrato 125 en plasma y urea.
Las tasas de rehospitalización temprana tras un ingreso por una descompensación de la IC continúan siendo inaceptablemente altas y constituyen un problema importante, tanto para los pacientes como para el sistema sanitario1,2. Iniciativas institucionales recientes han reconocido que la necesidad de reducir los reingresos en los primeros 30 días constituye una prioridad de la asistencia sanitaria3–5. Lamentablemente, la estratificación exacta del riesgo de reingreso continúa siendo una necesidad insatisfecha6 y varias intervenciones aplicadas durante la última década no han logrado reducir las tasas de hospitalizaciones relacionadas con la IC21.
En el presente estudio se observó que el valor de la HbA1c predecía la rehospitalización no programada a 30 días en pacientes con DM2 que habían estado ingresados recientemente por un episodio de ICA. Sin embargo, este efecto no fue uniforme en el conjunto de toda la población. De hecho, la capacidad predictiva de la HbA1c variaba en función del tratamiento recibido por los pacientes para el control de la glucemia en la DM2. Tiene interés señalar que los valores bajos de HbA1c predecían claramente un mayor riesgo de reingreso en los pacientes tratados con insulina, sulfonilureas o meglitinidas, y tenían un leve efecto protector en el resto de los pacientes. Hasta donde se sabe, estos resultados son novedosos, por cuanto sugieren que quizás sea la hipoglucemia asociada al tratamiento un factor importante que explique la relación inversa entre la HbA1c y el reingreso temprano en la DM2, o en los pacientes tratados con Ins/SU/MG. En el subgrupo de pacientes no tratados con Ins/SU/MG, el exceso de riesgo ligero atribuible a un valor más alto de la HbA1c podría deberse a un riesgo más elevado de complicaciones de causa metabólica, aunque también podría ser consecuencia de que este grupo tenga un perfil de riesgo basal más favorable. Es importante señalar que, si estos resultados se reproducen en nuevos estudios, podrían tener repercusiones clínicas como las siguientes: a) necesidad de una vigilancia del control de la glucemia durante un episodio de descompensación de la IC para una estratificación del riesgo a corto plazo, y b) evitación de las estrategias de control intensivo de la glucemia (es decir, de los objetivos de glucemia más estrictos) después de un episodio de ICA.
Control de la glucemia en la diabetes mellitus con insuficiencia cardiacaLas guías actuales para el tratamiento de la hiperglucemia en pacientes con DM2 resaltan la importancia de una individualización del tratamiento en función de las necesidades del paciente, la comorbilidad existente y los posibles efectos adversos de los tratamientos hipoglucemiantes10. El control intensivo de la glucemia, que obtiene unos valores de HbA1c bajos propensos a un mayor riesgo de episodios de hipoglucemia, se ha asociado a una mayor morbilidad y mortalidad, sobre todo en determinados subgrupos de pacientes diabéticos frágiles o con comorbilidades10. A este respecto, algunos estudios observacionales recientes llevados a cabo en pacientes con diabetes y una IC establecida han puesto de relieve un efecto paradójico entre el control de la glucemia y la evolución clínica adversa. La mayor parte de estos estudios han observado un patrón en forma de U o bien una relación inversa entre el valor de la HbA1c y la mortalidad11–13. Por ejemplo, en un estudio de 5.815 pacientes diabéticos con IC ambulatorios, los sujetos con un control modesto de la glucemia (HbA1c > 7,1-7,8%) presentaron una mortalidad inferior en comparación con los pacientes con unos valores de HbA1c superiores o inferiores a estos11. También se ha documentado una asociación inversa entre los valores de HbA1c y una evolución clínica adversa en cohortes de menor tamaño de pacientes con diabetes y una IC sistólica avanzada12,13. En el contexto de los estudios de intervención, la evidencia acerca de este efecto dual de la HbA1c en la IC es aún más escasa. Ensayos clínicos aleatorizados recientes llevados a cabo en pacientes con una DM2 establecida y, o bien una enfermedad CV o bien un riesgo alto de enfermedad CV, no han podido evidenciar una reducción significativa de los eventos CV mayores con un control más intensivo de la glucemia (HbA1c < 6,0-6,5%), a pesar de las mejoras significativas del control de la glucemia7–10. En esos ensayos, los pacientes con IC se han excluido o han estado infrarrepresentados. Tan solo en un análisis de subgrupo del ensayo ACCORD, un 5% (n = 494) de los sujetos incluidos tenía un diagnóstico previo de IC9,22. En este subgrupo de IC se registró un aumento significativo (25%) del riesgo de mortalidad en los pacientes que fueron asignados aleatoriamente a la estrategia de control intensivo de la glucemia22. Lamentablemente, hasta la fecha no se han realizado ensayos controlados que hayan abordado el tratamiento óptimo y los objetivos de glucemia de manera específica para los pacientes con IC y diabetes.
Hipoglucemia y acontecimientos adversosHay evidencia que respalda la teoría de que la hipoglucemia, principalmente a través de la activación del sistema simpático, eleva la presión arterial sistólica, la frecuencia cardiaca, el riesgo de arritmias, la isquemia miocárdica y la acumulación/redistribución de los líquidos, todos ellos factores que están relacionados con las descompensaciones de la IC8,14,15. Además se ha descrito que cuando los valores de glucemia son bajos, las células del músculo pasan a utilizar los ácidos grasos libres como fuente principal de energía. El uso a largo plazo de ácidos grasos libres incrementa la beta-oxidación y el H2O2 de origen mitocondrial, el estrés oxidativo y las señales que contribuyen a producir la disfunción y la apoptosis de las células musculares23. Este puede ser otro mecanismo fisiopatológico relevante que respalde la relación entre los valores bajos de HbA1c y los acontecimientos adversos en la IC.
Glucohemoglobina baja y acontecimientos adversos: ¿un epifenómeno o un efecto relacionado con el tratamiento?Los factores que están involucrados en la asociación paradójica existente entre los valores bajos de HbA1c y una evolución clínica adversa continúan siendo objeto de controversia. Por un lado hay datos que respaldan que la hipoglucemia constituye un factor de confusión de otros indicadores indirectos de la gravedad de la enfermedad más que un elemento con una relación causal con el éxito del tratamiento8,9,24. Por otro lado hay algunas observaciones que sugieren un efecto relacionado con el tratamiento. Por ejemplo, en una revisión sistemática reciente de estudios observacionales en la que se incluyó a 903.510 pacientes diabéticos, se observó que la hipoglucemia grave se asociaba a un riesgo de enfermedad CV aproximadamente doble. Un análisis del sesgo puso de manifiesto que la asociación observada entre la hipoglucemia grave y la enfermedad CV puede no deberse por completo a un efecto de confusión causado por la comorbilidad grave7.
En el contexto de los pacientes con diabetes e IC, esta controversia tiene especial relevancia, por 2 razones: a) estos pacientes suelen tener un perfil de riesgo alto para los episodios de hipoglucemia (antecedentes de diabetes de mayor duración, comorbilidades y fragilidad), y b) los datos existentes sobre este tema son escasos y heterogéneos. Por ejemplo, los pacientes diabéticos con IC incluidos en el estudio CHARM (Candesartan in Heart Failure: Assessment of Reduction in Mortality and Morbidity) tratados con insulina presentaron un aumento a aproximadamente el doble en el riesgo de morbilidad y mortalidad, en comparación con los no tratados con insulina25. Por el contrario, en una cohorte de 16.000 pacientes de Medicare con diabetes a quienes se había dado de alta recientemente con IC, el tratamiento con sulfonilureas o insulina no se asoció de manera independiente a un riesgo más alto de mortalidad a 1 año y de reingreso26. Lamentablemente, ninguno de estos estudios ha explorado las interacciones entre los fármacos hipoglucemiantes, el estado de control de la glucemia y los resultados clínicos. En el presente estudio, aunque los pacientes con valores inferiores de HbA1c presentaban un perfil de riesgo basal más desfavorable, un ajuste multivariable exhaustivo mostró que la HbA1c continuaba teniendo una asociación inversa e independiente con un riesgo más alto de reingreso en los pacientes tratados con Ins/SU/MG, lo cual sugiere, al menos en parte, un efecto relacionado con el tratamiento. A la vista de los resultados, y teniendo en cuenta que el riesgo de hipoglucemia grave o moderada aumenta de manera exponencial en los pacientes tratados con sulfonilureas, meglitinidas o insulina27, se propone que tanto el tratamiento excesivo para reducir la glucosa como el riesgo basal elevado de hipoglucemia podrían ser los factores subyacentes en la asociación entre los valores bajos de HbA1c y el reingreso en 30 días. Serán necesarios nuevos estudios controlados para esclarecer cuál es el control óptimo de la diabetes en los pacientes con un ingreso hospitalario reciente por ICA.
LimitacionesEste estudio es de carácter observacional y se ha llevado a cabo en un solo centro. En el registro de datos no se dispuso de información sobre factores de riesgo importantes para la hipoglucemia, como el tiempo de evolución de la diabetes, la fragilidad de los pacientes y la posología, lo que imposibilitó su inclusión como covariables en los modelos multivariables. Los tratamientos de la diabetes se agruparon por categorías, lo que impidió evaluar la contribución de cada producto farmacológico específico en los resultados obtenidos. Además, los episodios de hipoglucemia no se supervisaron durante el periodo de observación, por lo que no pueden establecerse relaciones temporales entre la hipoglucemia y la rehospitalización. Por último, en este estudio no se determinó la información relativa al control metabólico y los antecedentes terapéuticos previos a la hospitalización.
CONCLUSIONESEn resumen, en pacientes con DM2 que han sido dados de alta recientemente tras un ingreso por ICA, se ha observado que el valor de la HbA1c se asociaba de manera diferente al riesgo de reingreso en 30 días. De hecho, tenía una relación inversa con el riesgo aumentado de reingreso a 30 días en pacientes dados de alta con tratamiento de insulina o de Ins/SU/MG. En el resto de los pacientes diabéticos, el efecto fue marginal. Estudios subsecuentes deberán esclarecer si esa asociación refleja un efecto relacionado con el tratamiento o bien es simplemente un indicador indirecto de una enfermedad más avanzada.
FINANCIACIÓNEste trabajo se ha financiado en parte mediante subvenciones del Instituto de Salud Carlos III, Red de Investigación Cardiovascular, Programa 7 (RD12/0042/0010).
CONFLICTO DE INTERESESNinguno.