La cronología y la evolución de los trastornos de conducción (TdC) asociados con el implante percutáneo de válvula aórtica (TAVI) expandible con balón son poco conocidas. Este estudio examina la cronología de los TdC y el impacto de la valvuloplastia aórtica con balón (VAB) en su persistencia.
MétodosSe incluyó a 347 pacientes, y a 75 de ellos se les realizó una monitorización continua durante la TAVI y un electrocardiograma de 6 derivaciones en cada paso del procedimiento.
ResultadosEn los pacientes monitorizados, se registraron 48 (64%) bloqueos de rama izquierda (BRI) y 16 (21,3%) bloqueos auriculoventriculares completos, de los que el 51,5% apareció antes de implantar la válvula. Los BRI que aparecieron antes del implante valvular persistieron con mayor frecuencia al alta (el 53,8 frente al 22,7%; p=0,028) y en el seguimiento a 30 días (el 38,5 frente al 13,6%; p=0,054). Se realizó una VAB en 264 de los 347 pacientes (76,1%). En total, 78 pacientes (22,5%) presentaron un BRI o bloqueo auriculoventricular completo que requirió marcapasos permanente. Un BRI persistente o el bloqueo auriculoventricular no resuelto se observó más frecuentemente entre los pacientes con VAB (el 76,1 frente al 47,6%; p=0,021), y la VAB se asoció con la persistencia del TdC (OR=3,5; IC95%, 1,17-10,43; p=0,021).
ConclusionesMás de la mitad de los TdC observados después de una TAVI ocurren antes del implante de la válvula. La aparición precoz de los TdC se asocia con una mayor persistencia del mismo a los 30 días. El uso de VAB se asocia con un aumento del riesgo de persistencia de los TdC.
Palabras clave
El continuo desarrollo de los implantes percutáneos de válvula aórtica (TAVI) ha reducido significativamente las complicaciones de la intervención1. No obstante, los trastornos de la conducción (TdC) continúan siendo frecuentes y es improbable que su incidencia se reduzca en un futuro próximo1. De hecho, se ha descrito un aumento de la incidencia de TdC con algunas de las válvulas percutáneas de última generación1. Se han identificado factores predictivos de TdC tras el implante de prótesis percutáneas expandibles con balón y autoexpandibles2,3. Sin embargo, se desconocen todavía muchos aspectos de la cronología y los mecanismos que subyacen a la aparición de TdC durante el TAVI. Aunque en el caso de las prótesis autoexpandibles hasta un 50% de los TdC se producen durante la valvuloplastia aórtica con balón (VAB) o la manipulación de la guía durante el procedimiento, estas cuestiones no se han evaluado de manera sistemática en el contexto de los implantes de prótesis expandibles con balón4. Además, un número considerable de los TdC tras el implante de una válvula expandible con balón son de carácter transitorio y se resuelven durante el periodo de hospitalización o en las semanas siguientes a la intervención5–7. Actualmente se desconoce si la cronología y el mecanismo de los TdC influyen en la resolución o la persistencia de los TdC en el seguimiento. En estudios recientes se ha observado que el TAVI directo, sin predilatación con balón, es una técnica viable y segura que puede aportar un efecto beneficioso por lo que respecta a la duración de la intervención y la dosis de contraste8,9. Aunque no se ha esclarecido por completo el efecto de la predilatación con balón, algunos autores señalan que una VAB moderada puede reducir el riesgo de implante de marcapasos permanente (MPP)10. Sin embargo, no se sabe si el TAVI directo reduce el riesgo de TdC y, lo que es más importante, su persistencia. Así pues, los objetivos de este estudio son: a) evaluar la cronología y la evolución de los TdC en pacientes tratados con TAVI expandible con balón, y b) determinar la repercusión de la VAB en la aparición y la persistencia de los TdC tras el TAVI.
MÉTODOSPoblación del estudioSe trató con TAVI a un total de 707 pacientes en los 2 centros participantes entre mayo de 2010 y diciembre de 2015; y se implantó una válvula expandible con balón a 554 de ellos. Los criterios de exclusión fueron los siguientes: implante de válvula autoexpandible (n=153), MPP preexistente (n=82), bloqueo de rama izquierda (BRI) (n=41), bloqueo de rama derecha (n=52), TdC transitorio detectado durante una monitorización electrocardiográfica de 24 h previa al TAVI (n=9) e intervención sobre bioprótesis valvular disfuncionante (valve-in-valve) (n=23). Formaron la población final del estudio 347 pacientes. Se llevó a cabo un registro electrocardiográfico continuo durante la intervención en un subgrupo de 75 pacientes consecutivos a los que se practicó un TAVI con VAB en 1 de los 2 centros de estudio, entre febrero de 2013 y noviembre de 2015.
Los equipos cardiacos locales determinaron las indicaciones para TAVI y el método utilizado, y los datos se recogieron prospectivamente en las bases de datos. Los resultados se definieron según los criterios del Valve Academic Research Consortium-211. Los pacientes firmaron un documento de consentimiento informado antes de la intervención.
Intervención de implante percutáneo de válvula aórtica y valvuloplastia aórtica con balónLas intervenciones de TAVI se llevaron a cabo con la válvula expandible con balón SAPIEN XT o SAPIEN 3 (Edwards Lifesciences; Irvine, California, Estados Unidos) según el método descrito con anterioridad12,13. La decisión de realizar una VAB antes del implante valvular se dejó al criterio del operador. Cuando se practicó una VAB, esta fue moderada en todos los casos, con un balón de pequeño tamaño y estimulación rápida por marcapasos.
Monitorización continua del electrocardiograma y análisis de los datos electrocadiográficosSe obtuvo un electrocardiograma de 12 derivaciones en el momento del ingreso hospitalario de todos los pacientes. Se realizó un registro electrocardiográfico continuo durante las intervenciones de TAVI mediante electrocardiograma de 2 derivaciones. Además, en un subgrupo de 75 pacientes consecutivos tratados con TAVI en 1 de los 2 centros participantes, se registró un electrocardiograma de 6 derivaciones inmediatamente antes del TAVI e inmediatamente después de cada uno de los siguientes pasos de la intervención: posicionamiento de la guía rígida en el ventrículo izquierdo, VAB, implante de la válvula y posdilatación de la válvula o implante de una segunda válvula en caso necesario. Se registró, además, la aparición de cualquier nuevo TdC en el momento de su aparición (cualquier momento durante la intervención). Se realizó a todos los pacientes un electrocardiograma de 12 derivaciones inmediatamente después del TAVI y posteriormente 1 vez al día hasta el alta del hospital, además de una monitorización continua durante al menos 72 h después de la intervención.
Un cardiólogo analizó prospectivamente todos los electrocardiogramas en cada centro. El diagnóstico de las alteraciones de la conducción se basó en las recomendaciones de la American Heart Association, la American College of Cardiology Foundation y la Heart Rhythm Society para la estandarización e interpretación de los electrocardiogramas14. Las indicaciones para el MPP se atuvieron a lo establecido en las recomendaciones actuales15. El BRI transitorio se definió como la aparición de un nuevo BRI que se resolviera antes del seguimiento a 1 mes. La resolución del bloqueo auriculoventricular (BAV) en pacientes tratados con un MPP se definió como una estimulación ventricular<1% en el seguimiento realizado al mes16.
SeguimientoSe realizó un seguimiento de los pacientes mediante una visita ambulatoria al cabo de 1 mes. Se obtuvo un electrocardiograma de 12 derivaciones de todos los pacientes. Además, se evaluó el porcentaje de estimulación ventricular de los pacientes tratados con un MPP después del TAVI.
Análisis estadísticoLos datos se expresan en forma de media±desviación estándar o mediana [intervalo intercuartílico] para las variables continuas y como número y porcentaje para las variables discretas. Las variables continuas se compararon mediante la prueba de la t de Student bilateral y la prueba de la U de Mann-Whitney, en función de la normalidad de la distribución. Las variables categóricas se compararon con la prueba de la χ2 o la prueba exacta de Fisher, según fuera apropiado. Se consideró significativo un valor de p<0,05. Los análisis se realizaron con el programa Statistical Package for Social Sciences versión 22 (SPSS Inc., IBM; Armonk, Nueva York, Estados Unidos).
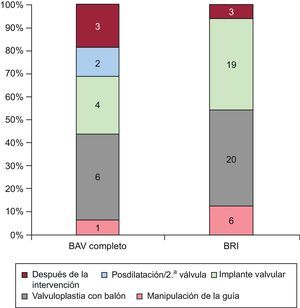
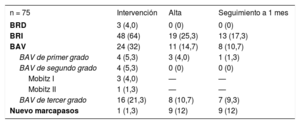
RESULTADOSCronología de los trastornos de la conducciónLas principales características basales de los 75 pacientes en monitorización/registro eletrocardiográfico continuo durante la intervención se presentan en la tabla 1. Se produjeron en total 75 TdC en 58 pacientes (77,3%) durante el periodo de hospitalización. Los tipos de TdC se detallan en la tabla 2. Se observó BRI en 48 pacientes (64%) y BAV de tercer grado en 16 (21,3%). La cronología de los BRI y BAV de tercer grado se muestra en la figura 1. Hasta el 54,2% de los BRI y el 43,7% de los episodios de BAV de tercer grado se produjeron antes del implante de la válvula.
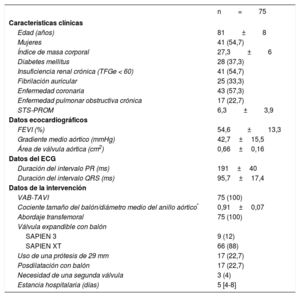
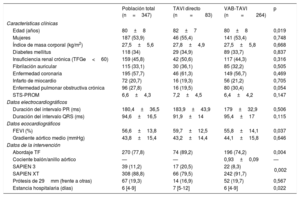
Principales características clínicas, ecocardiográficas y de la intervención de los pacientes sometidos a monitorización electrocardiográfica y registro sistemático del ECG durante el TAVI
| n=75 | |
|---|---|
| Características clínicas | |
| Edad (años) | 81±8 |
| Mujeres | 41 (54,7) |
| Índice de masa corporal | 27,3±6 |
| Diabetes mellitus | 28 (37,3) |
| Insuficiencia renal crónica (TFGe < 60) | 41 (54,7) |
| Fibrilación auricular | 25 (33,3) |
| Enfermedad coronaria | 43 (57,3) |
| Enfermedad pulmonar obstructiva crónica | 17 (22,7) |
| STS-PROM | 6,3±3,9 |
| Datos ecocardiográficos | |
| FEVI (%) | 54,6±13,3 |
| Gradiente medio aórtico (mmHg) | 42,7±15,5 |
| Área de válvula aórtica (cm2) | 0,66±0,16 |
| Datos del ECG | |
| Duración del intervalo PR (ms) | 191±40 |
| Duración del intervalo QRS (ms) | 95,7±17,4 |
| Datos de la intervención | |
| VAB-TAVI | 75 (100) |
| Cociente tamaño del balón/diámetro medio del anillo aórtico* | 0,91±0,07 |
| Abordaje transfemoral | 75 (100) |
| Válvula expandible con balón | |
| SAPIEN 3 | 9 (12) |
| SAPIEN XT | 66 (88) |
| Uso de una prótesis de 29 mm | 17 (22,7) |
| Posdilatación con balón | 17 (22,7) |
| Necesidad de una segunda válvula | 3 (4) |
| Estancia hospitalaria (días) | 5 [4-8] |
ECG: electrocardiograma; FEVI: fracción de eyección del ventrículo izquierdo; STS-PROM: riesgo de mortalidad predicho de la Society of Thoracic Surgeons; TAVI: implante percutáneo de válvula aórtica; TFGe: tasa de filtrado glomerular estimada; VAB: valvuloplastia aórtica con balón.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
Trastornos de la conducción e implante de marcapasos en relación con la intervención de TAVI y alteraciones de la conducción persistentes al alta y en el seguimiento al mes
| n = 75 | Intervención | Alta | Seguimiento a 1 mes |
|---|---|---|---|
| BRD | 3 (4,0) | 0 (0) | 0 (0) |
| BRI | 48 (64) | 19 (25,3) | 13 (17,3) |
| BAV | 24 (32) | 11 (14,7) | 8 (10,7) |
| BAV de primer grado | 4 (5,3) | 3 (4,0) | 1 (1,3) |
| BAV de segundo grado | 4 (5,3) | 0 (0) | 0 (0) |
| Mobitz I | 3 (4,0) | — | — |
| Mobitz II | 1 (1,3) | — | — |
| BAV de tercer grado | 16 (21,3) | 8 (10,7) | 7 (9,3) |
| Nuevo marcapasos | 1 (1,3) | 9 (12) | 9 (12) |
BAV: bloqueo auriculoventricular; BRD: bloqueo de rama derecha; BRI: bloqueo de rama izquierda; TAVI, implante percutáneo de válvula aórtica.
Los valores expresan n (%).
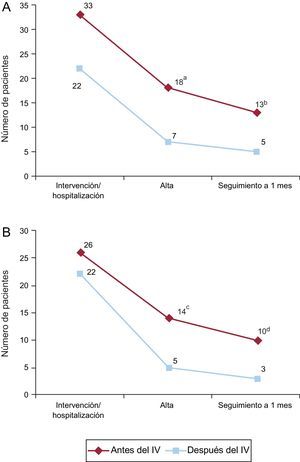
Los casos de BRI persistente o de BAV no resuelto con necesidad de implantar un MPP antes del alta hospitalaria se dieron en 25 de los 75 pacientes, un 46,3% de los que presentaron un BRI o un BAV de tercer grado relacionado con la intervención de TAVI. La aparición de un TdC antes del implante valvular (durante la manipulación de la guía o la VAB) tendió a asociarse con una tasa de BRI persistente o de BAV no resuelto en el momento del alta hospitalaria más alta (el 54,5 frente al 31,8%; p=0,097). En el seguimiento realizado al mes, 18 de los 74 pacientes (24,3%) con seguimiento completo disponible (el 33,3% de los pacientes con BRI o BAV de tercer grado) tenían un BRI persistente o un BAV no resuelto con estimulación ventricular del MPP durante más del 1% del tiempo. La aparición de un TdC antes de implantar la válvula no se asoció a mayor frecuencia de TdC persistente en el seguimiento al mes (el 39,4 frente al 23,8%; p=0,236) (figura 2A).
Persistencia de los trastornos de la conducción con el paso del tiempo. Número de pacientes con BRI o BAV no resuelto (A) y con BRI (B) en cada momento de evaluación según su aparición antes o después del implante valvular. BAV: bloqueo auriculoventricular; BRI: bloqueo de rama izquierda; IV: implante valvular. ap=0,097. bp=0,236. cp=0,028. dp=0,054.
Hasta el 60,4% de los episodios de BRI durante la intervención se resolvieron durante el periodo de hospitalización, la mayoría de ellos (86,2%) en las primeras 24 h tras el TAVI. De los 19 pacientes (39,6%) con BRI persistente al alta hospitalaria, en 6 (31,6%) se observó resolución del BRI en el seguimiento al mes. La persistencia del BRI según su momento de aparición (antes o después del implante de la válvula) se muestra en la figura 2B. El BRI persistía con mayor frecuencia al alta hospitalaria (el 53,8 frente al 22,7%; p=0,028) y en el seguimiento al mes (el 38,5 frente al 13,6%; p=0,054) cuando había aparecido antes del implante de la válvula.
La aparición del TdC se produjo después de la intervención en 6 pacientes: 3 (18,75%) BAV de tercer grado y 3 (6,25%) con BRI. Estos casos de BAV de tercer grado se produjeron durante las primeras 24 h tras la intervención y 2 de ellos persistían en el seguimiento a los 30 días. De los 3 pacientes con un BRI después de la intervención, solamente en 1 el inicio tuvo lugar después de las primeras 24 h. En 2 pacientes, el BRI se asoció con otro TdC que motivó el implante de un MPP y se observó un BRI persistente o un BAV no resuelto en el seguimiento a los 30 días.
Se implantó un MPP durante el periodo de hospitalización a 9 pacientes. Las indicaciones de MPP fueron un BAV completo en 8 (88,8%) y un BRI asociado con BAV de primer grado en 1. No se observaron diferencias en cuanto a la tasa de BAV no resueltos que requirieron el implante de MPP en relación con su momento de inicio (el 57,1% antes frente al 44,4% después del implante valvular; p=0,50). Todos los BAV de segundo grado fueron transitorios. En el seguimiento al mes, el porcentaje medio de estimulación ventricular de los pacientes que necesitaron un MPP antes del alta hospitalaria fue del 82,7±34,5%. La resolución del BAV con estimulación ventricular<1% del MPP ocurrió en 1 paciente, sin que hubiera diferencias entre los BAV iniciados antes o después del implante valvular (el 25% frente a 0; p=0,50).
Impacto de la valvuloplastia aórtica con balón en la persistencia de los trastornos de la conducciónSe sometió a TAVI con VAB previa al implante valvular a un total de 264 de los 347 pacientes (76,1%) y a TAVI directo sin VAB a 83 (23,9%). Las principales características, los datos ecocardiográficos y de la intervención en la población de estudio, según se usara VAB o no, se muestran en la tabla 3. Los pacientes sometidos a TAVI directo eran de más edad (82±7 frente a 80±8 años; p=0,019), tenían mayor fracción de eyección del ventrículo izquierdo (el 60±13 frente al 56±14%; p=0,037), su acceso más frecuente para el TAVI fue la vía transfemoral (el 89,2 frente al 74,3%; p=0,004) y en ellos se utilizó con mayor frecuencia la válvula SAPIEN 3 (el 20,5 frente al 8,3%; p=0,002).
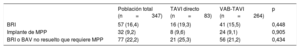
Características basales y de la intervención de la población del estudio, según el uso de VAB durante el TAVI
| Población total (n=347) | TAVI directo (n=83) | VAB-TAVI (n=264) | p | |
|---|---|---|---|---|
| Características clínicas | ||||
| Edad (años) | 80±8 | 82±7 | 80±8 | 0,019 |
| Mujeres | 187 (53,9) | 46 (55,4) | 141 (53,4) | 0,748 |
| Índice de masa corporal (kg/m2) | 27,5±5,6 | 27,8±4,9 | 27,5±5,8 | 0,668 |
| Diabetes mellitus | 118 (34) | 29 (34,9) | 89 (33,7) | 0,837 |
| Insuficiencia renal crónica (TFGe<60) | 159 (45,8) | 42 (50,6) | 117 (44,3) | 0,316 |
| Fibrilación auricular | 115 (33,1) | 30 (36,1) | 85 (32,2) | 0,505 |
| Enfermedad coronaria | 195 (57,7) | 46 (61,3) | 149 (56,7) | 0,469 |
| Infarto de miocardio | 72 (20,7) | 16 (19,3) | 56 (21,2) | 0,705 |
| Enfermedad pulmonar obstructiva crónica | 96 (27,8) | 16 (19,5) | 80 (30,4) | 0,054 |
| STS-PROM | 6,6±4,3 | 7,2±4,5 | 6,4±4,2 | 0,147 |
| Datos electrocardiográficos | ||||
| Duración del intervalo PR (ms) | 180,4±36,5 | 183,9±43,9 | 179±32,9 | 0,506 |
| Duración del intervalo QRS (ms) | 94,6±16,5 | 91,9±14 | 95,4±17 | 0,115 |
| Datos ecocardiográficos | ||||
| FEVI (%) | 56,6±13,8 | 59,7±12,5 | 55,8±14,1 | 0,037 |
| Gradiente aórtico medio (mmHg) | 43,8±15,4 | 43,2±14,4 | 44,1±15,8 | 0,646 |
| Datos de la intervención | ||||
| Abordaje TF | 270 (77,8) | 74 (89,2) | 196 (74,2) | 0,004 |
| Cociente balón/anillo aórtico | — | — | 0,93±0,09 | — |
| SAPIEN 3 | 39 (11,2) | 17 (20,5) | 22 (8,3) | 0,002 |
| SAPIEN XT | 308 (88,8) | 66 (79,5) | 242 (91,7) | |
| Prótesis de 29mm (frente a otras) | 67 (19,3) | 14 (16,9) | 52 (19,7) | 0,567 |
| Estancia hospitalaria (días) | 6 [4-9] | 7 [5-12] | 6 [4-9] | 0,022 |
FEVI: fracción de eyección del ventrículo izquierdo; STS-PROM: riesgo de mortalidad predicho de la Society of Thoracic Surgeons; TAVI: implante percutáneo de válvula aórtica; TF: transfemoral; TFGe: tasa de filtrado glomerular estimada; VAB: valvuloplastia aórtica con balón.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
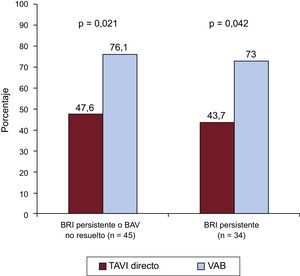
Se registró un BRI persistente al alta hospitalaria en 57 pacientes (16,4%), 16 (19,3%) del grupo de TAVI directo y 41 (15,5%) del grupo con VAB antes del implante valvular (p=0,45). Además, en 32 (9,2%) fue necesario implantar un MPP después del TAVI, sin diferencias entre los grupos (TAVI directo, el 9,6%; VAB antes del TAVI, el 9,1%; p=0,91) (tabla 4). Las indicaciones para implantar MPP fueron BAV de tercer grado en 22 pacientes (68,7%), BRI asociado con BAV de primer grado en 3 (9,4%), BAV de segundo grado en 2 (6,2%), BRI intermitente con bloqueo de rama derecha en 2 (6,2%), flutter auricular lento en 1 (3,1%) y disfunción del nódulo sinusal con bradicardia intensa en 2 (6,2%). En términos generales, 77 pacientes (22,2%) presentaron un BRI persistente o un BAV de tercer grado que requirió el implante de un MPP, sin diferencias significativas entre los grupos (TAVI directo, el 25,3%; VAB antes del TAVI, el 21,2%; p=0,434) (tabla 4). Se produjeron 4 muertes hospitalarias y 6 pacientes no acudieron a la visita de seguimiento al mes. En este, 45 pacientes tenían un BRI persistente o un BAV de tercer grado no resuelto con estimulación ventricular del MPP>1%, 10 (47,6%) del grupo de TAVI directo y 35 (76,1%) del de VAB antes del TAVI (p=0,021) (figura 3). Las principales características clínicas basales y los datos ecocardiográficos y de la intervención en los pacientes con un nuevo TdC, según se hubiera resuelto el TdC o no en el seguimiento al mes, se muestran en la tabla 5. Los resultados no se modificaron al introducir en un modelo multivariable las diferencias entre los grupos de VAB y de TAVI directo (edad, fracción de eyección del ventrículo izquierdo, enfermedad pulmonar obstructiva crónica, abordaje transfemoral y válvula SAPIEN 3). Los electrocardiogramas basales de los pacientes con TdC persistentes tenían con mayor frecuencia mayores duraciones de PR y QRS, pero estas diferencias no son estadísticamente significativas (175,4±26,3 frente a 195,7±40,6; p=0,114; 93,8±9,3 frente a 99,3±18,3; p=0,288). El uso de VAB antes del TAVI fue el único factor asociado con que no estuviera resuelto el TdC (BRI persistente o BAV de tercer grado no resuelto con estimulación ventricular del MPP>1%) en el seguimiento al mes (odds ratio=3,5; intervalo de confianza del 95%, 1,17-10,43; p=0,021).
Trastornos de la conducción persistentes al alta hospitalaria, según el uso de VAB durante el TAVI
| Población total (n=347) | TAVI directo (n=83) | VAB-TAVI (n=264) | p | |
|---|---|---|---|---|
| BRI | 57 (16,4) | 16 (19,3) | 41 (15,5) | 0,448 |
| Implante de MPP | 32 (9,2) | 8 (9,6) | 24 (9,1) | 0,905 |
| BRI o BAV no resuelto que requiere MPP | 77 (22,2) | 21 (25,3) | 56 (21,2) | 0,434 |
BAV: bloqueo auriculoventricular; BRI: bloqueo de rama izquierda; MPP: marcapasos permanente; TAVI: implante percutáneo de válvula aórtica; VAB: valvuloplastia aórtica con balón.
Trastornos de la conducción en el seguimiento al mes, en función del uso de VAB antes del implante valvular. Porcentajes de BRI persistente o BAV no resuelto con estimulación ventricular de marcapasos > 1% y BRI persistente en el seguimiento al mes tras TAVI directo o con VAB previa. BAV: bloqueo auriculoventricular; BRI: bloqueo de rama izquierda; TAVI: implante percutáneo de válvula aórtica; VAB: valvuloplastia aórtica con balón.
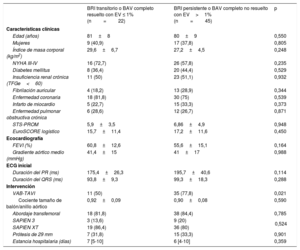
Características basales y datos de la intervención de los pacientes con trastornos de la conducción, según la persistencia de estos en el seguimiento al mes
| BRI transitorio o BAV completo resuelto con EV ≤ 1% (n=22) | BRI persistente o BAV completo no resuelto con EV>1% (n=45) | p | |
|---|---|---|---|
| Características clínicas | |||
| Edad (años) | 81±8 | 80±9 | 0,550 |
| Mujeres | 9 (40,9) | 17 (37,8) | 0,805 |
| Índice de masa corporal (kg/m2) | 29,6±6,7 | 27,2±4,5 | 0,248 |
| NYHA III-IV | 16 (72,7) | 26 (57,8) | 0,235 |
| Diabetes mellitus | 8 (36,4) | 20 (44,4) | 0,529 |
| Insuficiencia renal crónica (TFGe<60) | 11 (50) | 23 (51,1) | 0,932 |
| Fibrilación auricular | 4 (18,2) | 13 (28,9) | 0,344 |
| Enfermedad coronaria | 18 (81,8) | 30 (75) | 0,539 |
| Infarto de miocardio | 5 (22,7) | 15 (33,3) | 0,373 |
| Enfermedad pulmonar obstructiva crónica | 6 (28,6) | 12 (26,7) | 0,871 |
| STS-PROM | 5,9±3,5 | 6,86±4,9 | 0,948 |
| EuroSCORE logístico | 15,7±11,4 | 17,2±11,6 | 0,450 |
| Ecocardiografía | |||
| FEVI (%) | 60,8±12,6 | 55,6±15,1 | 0,164 |
| Gradiente aórtico medio (mmHg) | 41,4±15 | 41±17 | 0,988 |
| ECG inicial | |||
| Duración del PR (ms) | 175,4±26,3 | 195,7±40,6 | 0,114 |
| Duración del QRS (ms) | 93,8±9,3 | 99,3±18,3 | 0,288 |
| Intervención | |||
| VAB-TAVI | 11 (50) | 35 (77,8) | 0,021 |
| Cociente tamaño de balón/anillo aórtico | 0,92±0,09 | 0,90±0,08 | 0,590 |
| Abordaje transfemoral | 18 (81,8) | 38 (84,4) | 0,785 |
| SAPIEN 3 | 3 (13,6) | 9 (20) | 0,524 |
| SAPIEN XT | 19 (86,4) | 36 (80) | |
| Prótesis de 29 mm | 7 (31,8) | 15 (33,3) | 0,901 |
| Estancia hospitalaria (días) | 7 [5-10] | 6 [4-10] | 0,359 |
BAV: bloqueo auriculoventricular; BRI: bloqueo de rama izquierda; ECG: electrocardiograma; EV: estimulación ventricular por marcapasos; FEVI: fracción de eyección del ventrículo izquierdo; NYHA: New York Heart Association; STS-PROM: riesgo de mortalidad predicho de la Society of Thoracic Surgeons; TFGe: tasa de filtrado glomerular estimada; VAB-TAVI: valvuloplastia aórtica con balón durante el implante percutáneo de válvula aórtica.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
En el seguimiento al mes, el BRI persistía en 34 (64,1%) de los pacientes dados de alta con BRI: 7 (43,7%) del grupo de TAVI directo y 27 (73%) del de VAB antes del TAVI (p=0,042) (figura 3).
DISCUSIÓNEn los pacientes sometidos a TAVI con una VAB, más de la mitad de los nuevos TdC (BRI o BAV) se produjeron antes del implante de la válvula. Las alteraciones de la conducción, en especial el BRI, que se produjeron antes del implante valvular, tendieron más a persistir tanto al alta como en el seguimiento al mes. El uso de VAB durante el TAVI no tuvo repercusión alguna en la frecuencia del BRI persistente o el BAV avanzado no resuelto al alta hospitalaria. Sin embargo, la VAB sí se asoció con una tasa más alta de TdC (BRI o BAV avanzado) persistentes en el seguimiento al mes.
Al igual que ocurre en el reemplazo quirúrgico de válvula aórtica17, la lesión mecánica del sistema de conducción se considera el principal mecanismo subyacente a la aparición de los TdC relacionados con el TAVI18. Esta afirmación está respaldada por los estudios anatomopatológicos que muestran lesiones traumáticas con hemorragia y necrosis en el sistema de conducción de los pacientes con un TdC persistente después del TAVI19,20. El TAVI con válvula expandible con balón es el que implica la aplicación de más fuerza durante el despliegue de la válvula o después, por la propia prótesis. En consecuencia, cabría prever que la mayor parte de los TdC se produjeran en el momento del implante valvular o inmediatamente después. En cambio, en nuestro estudio, más del 50% de los TdC se produjeron antes del implante de la válvula, y este resultado concuerda con otras observaciones previas con el implante de dispositivos autoexpandibles4. Que el TAVI directo (sin VAB previa) no se asociara con una reducción del porcentajede de TdC indica que, más que la VAB en sí, es el inicio del TdC antes del implante valvular lo que identifica a los pacientes con un sistema de conducción más vulnerable, que conlleva un mayor riesgo de que en ellos aparezca un nuevo TdC durante el posicionamiento de la válvula y/o tras el implante, con independencia de la VAB. Las diferencias existentes en las relaciones anatómicas entre los diferentes componentes del sistema de conducción o las anomalías subclínicas preexistentes, que son 2 factores identificados como posibles predictores de TdC tras el TAVI3,5,21, pueden ser el origen de esta mayor vulnerabilidad.
Además, la tasa de TdC tras un procedimiento de VAB sin implante de TAVI es<10% en la mayoría de los estudios22,23, lo cual es muy inferior a la tasa del 44% observada en este estudio o la del 46% del estudio de Nuis et al.4, con independencia de que se usara o no una VAB moderada durante el TAVI. De hecho, la relación entre el tamaño del balón y el anillo aórtico, que predice la aparición de los TdC tras la valvuloplastia con balón22, fue menor en este estudio en comparación con lo descrito sobre el uso de VAB como tratamiento definitivo para pacientes con estenosis aórtica crítica (0,91 frente a>1,5)22. Teniendo en cuenta las similitudes existentes en los perfiles de los pacientes, estas diferencias en la frecuencia de nuevos TdC atribuibles a la VAB pueden deberse a un alto porcentaje de trastornos transitorios, que pueden resolverse antes del final de la intervención, a menos que se aplique una segunda fuerza mecánica (es decir, un implante valvular). Cabe destacar que no se conoce todavía la frecuencia de los TdC transitorios durante las intervenciones de VAB.
Una aumentada vulnerabilidad del sistema de conducción ante cualquier traumatismo, incluso el de la VAB, podría haber contribuido tanto a la mayor persistencia de los TdC al alta del hospital como a la menor resolución del BRI en el seguimiento al mes si el TdC se produjo antes del implante valvular. Además, y en consonancia con lo indicado por otros estudios previos24, hasta un 77% de los BRI que aparecieron durante o inmediatamente después del implante valvular se habían resuelto al alta hospitalaria y un 41% desapareció en menos de 1 h. La presencia de inflamación o edema, considerados causa de TdC transitorio, después de la primera compresión mecánica25 podría dar lugar a una lesión definitiva se después se ejerce más tensión mecánica. Estas observaciones son coherentes con los resultados de Nuis et al.4, que muestran una tasa superior de persistencia de los TdC cuando estos aparecen antes del implante valvular. Las diferencias intrínsecas en las características de las diversas prótesis valvulares podrían explicar las discrepancias existentes en la frecuencia y la evolución clínica de los TdC entre los dispositivos expandibles con balón y los autoexpandibles24. La fuerza persistente ejercida por el nitinol en los dispositivos autoexpandibles podría dificultar la resolución de las alteraciones de la conducción26.
A la vista de estos resultados, la aparición de un TdC antes del implante valvular puede facilitar la identificación de los pacientes en mayor riesgo de TdC persistente. Así pues, un mejor conocimiento de la cronología de los TdC durante el TAVI podría servir para predecir la necesidad de una monitorización electrocardiográfica más larga o la necesidad de MPP después del TAVI. La repercusión del BRI tras el TAVI en los resultados clínicos continúa siendo un tema controvertido, y se ha propuesto que para estos pacientes se debe utilizar periodos de monitorización electrocardiográfica más largos después del TAVI, dada la posibilidad de progresión a un BAV avanzado1. Sin embargo, el BRI que se produce durante o inmediatamente después del implante de una válvula expandible con balón parece ser transitorio en la mayoría de los casos y, por consiguiente, esos pacientes pueden no necesitar periodos tan largos de monitorización electrocardiográfica1. De hecho, más de tres cuartos de estos BRI habían desaparecido antes del alta hospitalaria. Sin embargo, no se sabe aún si el momento de aparición del TdC y el uso de VAB podrían tener alguna repercusión en la progresión a BAV avanzado en pacientes con BRI.
Asimismo, este estudio indica que el empleo de VAB durante la intervención de TAVI podría asociarse con una tasa de BAV no resueltos más alta. Estudios previos han señalado que hasta un 40% de los pacientes tratados con MPP después del TAVI no necesitan estimulación ventricular en el seguimiento27,28. Sin embargo, no pueden establecerse recomendaciones relativas a la indicación de MPP tras el TAVI a partir de los resultados de estos estudios, teniendo en cuenta que la ausencia de dependencia del ritmo de marcapasos no descarta la aparición de un BAV avanzado paroxístico.
LimitacionesLa principal limitación de este estudio es su pequeño tamaño muestral. Sin embargo, esto se debió en parte a la exclusión de los pacientes con un TdC preexistente. Además, este trabajo es actualmente el estudio más amplio realizado con monitorización electrocardiográfica continua y registro electrocardiográfico sistemático durante la intervención de TAVI. La elección de usar VAB antes del TAVI o TAVI directo no fue aleatorizada, y no se puede descartar la influencia de posibles factores de confusión en los resultados obtenidos. Se utilizaron 2 generaciones diferentes de válvulas expandibles con balón (SAPIEN XT y SAPIEN 3), y ello podría haber tenido impacto en el porcentaje de TdC. Aunque la estrategia de TAVI directo se utilizó con más frecuencia en los pacientes tratados con una válvula SAPIEN 3, los grupos de TdC persistente estuvieron bien igualados respecto a esta variable.
CONCLUSIONESMás de la mitad de los TdC tras un TAVI con válvula expandible con balón ocurren antes del implante de la válvula. En términos generales, los TdC que aparecen antes del implante valvular están resueltos con menor frecuencia al alta hospitalaria o en el seguimiento al mes. Evitar el uso de VAB no se asoció con una reducción de la incidencia de TdC, pero redujo significativamente el porcentaje de TdC persistentes en el seguimiento. Estos resultados mejoran nuestro conocimiento de los mecanismos de los TdC durante las intervenciones de TAVI y pueden ser útiles para determinar la necesidad de monitorización electrográfica prolongada tras el TAVI. En todo caso, serán necesarios nuevos estudios para determinar los posibles efectos beneficiosos de evitar la VAB antes del TAVI.
CONFLICTO DE INTERESESA. Regueiro y M. Del Trigo han recibido una subvención de la Fundación Alfonso Martín Escudero (Madrid/España). R. Puri cuenta con una financiación parcial a través de una subvención del Research Center del Quebec Heart and Lung Institute (Quebec/Canadá). J. Rodés-Cabau ha recibido subvenciones de investigación de Edwards Lifesciences y Medtronic. V. Auffret ha recibido una beca de la Fédération Française de Cardiologie y subvenciones de investigación de Abbott, Edwards Lifesciences, Medtronic, Biosensors, Terumo y Boston Scientific. C. Chamandi ha recibido una beca de Edwards Lifesciences.
- –
El continuo desarrollo del TAVI ha reducido significativamente las complicaciones de la intervención. No obstante, los TdC continúan siendo frecuentes y es improbable que su incidencia se reduzca en un futuro próximo. De hecho, se ha descrito un aumento de la incidencia de TdC con algunas de las válvulas percutáneas de última generación. Se han identificado factores predictivos de TdC en las prótesis expandibles con balón y autoexpandibles para TAVI, pero se desconocen todavía muchos aspectos de la cronología y los mecanismos que subyacen a la aparición de las alteraciones de la conducción durante el TAVI.
- –
Este es el primer estudio en el que se evalúa la cronología y la resolución de los TdC tras TAVI con válvula expandible con balón y se determinan las repercusiones de la VAB en la persistencia de los TdC tras el TAVI.
- –
Los principales resultados del estudio muestran que más de la mitad de los TdC tras TAVI con válvula expandible con balón se produjeron antes del implante de la válvula. En términos generales, los TdC (y en especial el BRI) que se produjeron antes del implante valvular estaban resueltos con menor frecuencia al alta hospitalaria o el seguimiento al mes. El TAVI directo sin predilatación con balón redujo el porcentaje de TdC persistentes en el seguimiento.
Este estudio ha sido realizado en el marco del Doctorado de Medicina de la Universidad Autónoma de Barcelona y será incluido en una tesis doctoral.