La enfermedad cardiovascular es la principal causa de mortalidad y morbilidad en los países desarrollados. La diabetes mellitus es un factor de riesgo importante para la enfermedad cardiovascular, que contribuye a producir sus devastadoras consecuencias económicas. El syndrome metabólico y la obesidad abdominal constituyen un problema de salud creciente, ligado a menudo a la diabetes (y la intolerancia a la glucosa). A diferencia del subcutáneo, el depósito de grasa intraabdominal pone en marcha una serie de mecanismos nocivos, como la liberación de marcadores inflamatorios que contribuyen a producir la elevada incidencia de enfermedad cardiovascular en esa población. De hecho, parece claro que la inflamación es un factor importante en la obesidad, el síndrome metabólico y la diabetes, no sólo contribuyendo a producir estos trastornos, sino también siendo un vínculo entre ellos. En realidad, hay varias vías que sugieren una interacción entre el sistema metabólico y el sistema inmunitario-inflamatorio, lo cual indica que estos procesos no son mecanismos diferentes sino más bien manifestaciones diferentes del mismo proceso.
Las exploraciones de imagen cardiovasculares no invasivas recientemente aparecidas son un instrumento preciso para evaluar la carga de aterosclerosis. La resonancia magnética se ha revelado como un instrumento de gran exactitud para determinar la carga de enfermedad (en los territorios extracoronarios). Sin embargo, el conocimiento del mecanismo involucrado en el desarrollo, la inflamación y la inestabilidad de la placa ha conducido al concepto de exploración de imagen funcional (además de las exploraciones de imagen anatómicas “clásicas”). La inflamación en el interior de la placa aterosclerotica puede cuantificarse con la tomografía de emisión de positrons con 18F-fluorodesoxiglucosa. Se han depositado muchas esperanzas en el papel que pueda desempeñar esta nueva modalidad de diagnóstico por la imagen combinada en el diagnóstico de las placas de alto riesgo y en la monitorización del tratamiento. Por último, los nuevos avances en las técnicas de imagen moleculares, con el empleo de medios de contraste dirigidos, han permitido una caracterización no invasiva de la composición de la placa tanto mediante la resonancia magnética como con la tomografía computarizada.
Palabras clave
La enfermedad cardiovascular (ECV) ha sido desde hace tiempo la principal causa de mortalidad y morbilidad en los países desarrollados1,2. La identificación y tratamiento de los factores de riesgo cardiovascular llevó a un descenso de las tasas de mortalidad cardiovascular en los años sesenta. A pesar de este avance en la batalla contra la ECV, el impacto socioeconómico de esta enfermedad continúa siendo monumental. Se estima que cada año son más de 1 millón las personas de Estados Unidos y más de 19 millones las del resto del mundo que sufren un síndrome coronario agudo o una muerte súbita cardiaca2.
El estado de salud y el perfil de enfermedad de una sociedad se han relacionado con su nivel económico. Tras la industrialización, las principales causas de muerte y discapacidad en los países desarrollados han pasado de un predominio de los déficit nutricionales y las enfermedades infecciosas al de las enfermedades degenerativas, como la ECV y la diabetes. Paradójicamente, estas enfermedades se asocian a la sobrenutrición. La ECV está pasando a ocupar el primer lugar entre las causas de muerte en los países desarrollados y en desarrollo3. Este cambio en la incidencia y la prevalencia de la ECV en los países en desarrollo es atribuible al aumento de los índices de urbanización y a los mayores niveles de factores de riesgo (diabetes, dislipidemia, obesidad, hipertensión, etc.)2.
Los índices de urbanización están aumentando en todo el mundo, y se ha pasado de un 37% de la población mundial residente en zonas urbanas en 1970 a un 45% en 1994. La urbanización se asocia a un cambio radical del estilo de vida, con un notable aumento del consumo de alimentos ricos en energía y una disminución del gasto de ésta, como consecuencia de la menor actividad física.
La diabetes mellitus es un factor de riesgo cardiovascular bien conocido. No es tan sólo una enfermedad frecuente en la actualidad, sino que se prevé que su prevalencia aumente, sobre todo en los países desarrollados4. En 1995, había en todo el mundo 135 millones de personas afectadas por la diabetes, pero resulta alarmante la previsión de que al llegar al año 2025 su prevalencia habrá aumentado hasta aproximadamente 300 millones5. Más de un 90% de los individuos diabéticos sufren una diabetes mellitus tipo 2, que es un trastorno progresivo con un inicio lento y sutil. Por consiguiente, la diabetes tipo 2 es un trastorno insuficientemente detectado y, de los 15,6 millones de adultos diabéticos que se estima que hay en Estados Unidos, se estima que 5,4 millones continúan sin haber sido diagnosticados6.
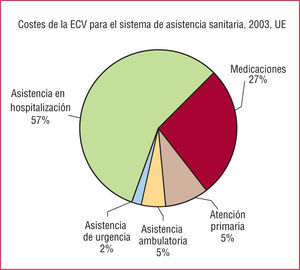
IMPACTO ECONÓMICO DE LA ENFERMEDAD CARDIOVASCULAR Y LA DIABETESComo se ha señalado antes, la ECV es el problema de salud de mayor relevancia en los países desarrollados en el siglo XXI, y está empezando a ocurrir algo similar en los países en desarrollo7. La magnitud de esta epidemia es tan importante que muchos países se están enfrentando a una verdadera crisis. La ECV supuso un coste para los sistemas de asistencia sanitaria de la Unión Europea (UE) de aproximadamente 105.000 millones de euros en 2003. Esto representa un coste per cápita de 230 euros al año, alrededor del 12% del gasto total de asistencia sanitaria en toda la UE. El coste de la asistencia de pacientes hospitalizados motivado por la ECV ascendió a alrededor del 57% de dichos costes, mientras que los fármacos supusieron un 27% (fig. 1). La enfermedad coronaria y el ictus representan casi la mitad del gasto de asistencia sanitaria derivado de la ECV en la UE (22% y 20%, respectivamente). Estas cifras ilustran el enorme coste secundario a la ECV en los países desarrollados, y las previsiones son similares para los países en desarrollo.
En todo el mundo, uno de los sectores económicos con un mayor aumento de gastos en los últimos 3 años es el sector médico8. Se estima que la asistencia de las personas con diabetes mellitus supone un 5% del total de presupuesto sanitario del Reino Unido. En los EE.UU., la diabetes motivó unos gastos directos de asistencia sanitaria de 44.000 millones de dólares en 1997, con 17.000 millones de dólares en pérdida de productividad como consecuencia de la mortalidad prematura9. La ECV y la diabetes están claramente asociadas. De hecho, la ECV es la complicación de la diabetes con una mayor proporción de costes directos y más de la mitad de los costes relacionados con la mortalidad como consecuencia de ésta9. Recientemente se ha demostrado que los costes anuales asociados a la diabetes tipo 2 aumentaron en más de un 50% cuando empezaron a aparecer las complicaciones cardiovasculares y en un 360% cuando se produjo un episodio cardiovascular10. Así pues, la carga económica de la ECV y la diabetes no pueden interpretarse como "presupuestos" diferentes, sino como comorbilidades frecuentemente asociadas, con unos efectos exponenciales sobre los gastos económicos. Dado el gran número de complicaciones asociadas a la diabetes, los pacientes diabéticos motivan 1 de cada 7 dólares gastados en asistencia sanitaria en los Estados Unidos11.
En la UE, el coste medio por paciente a causa de la diabetes tipo 2 se estima en aproximadamente 2.834 euros al año. Dentro de este coste, las hospitalizaciones suponen la mitad del total de gastos. Se estima que las hospitalizaciones de diabéticos tipo 2 son de una media de 23 días al año12.
Considerados conjuntamente, estos datos muestran claramente la carga económica desastrosa que supone la ECV y la diabetes mellitus.
SÍNDROME METABÓLICO Y OBESIDADConexión entre diabetes mellitus e inflamación: ¿es la obesidad abdominal el vínculo?La incidencia de la obesidad en todo el mundo ha aumentado de manera drástica durante las últimas décadas. La Organización Mundial de la Salud estima que en todo el mundo hay más de 1.000 millones de adultos con sobrepeso13. Resulta especialmente alarmante el aumento igualmente notable de la obesidad infantil14. La obesidad se asocia a muchos problemas de salud, entre los que se encuentran el aumento del riesgo de resistencia a la insulina, la diabetes tipo 2, la hepatopatía grasa, la aterosclerosis y algunas otras13.
El síndrome metabólico se define como una agrupación de factores de riesgo que a menudo se acompaña de obesidad y se asocia a un aumento del riesgo de diabetes tipo 2 y de enfermedad cardiovascular15. Los criterios clínicos para definir el síndrome metabólico incluyen un aumento del perímetro de cintura, hipertrigliceridemia, concentraciones bajas de colesterol de lipoproteínas de alta densidad, hipertensión y valores altos de glucosa. El tratamiento para cualquiera de estos trastornos se considera también un criterio clínico. En la actualidad es un hecho reconocido que el síndrome metabólico constituye un factor de riesgo de ECV importante y prevalente16.
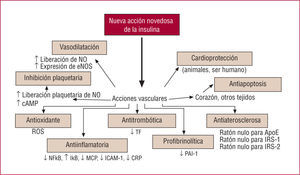
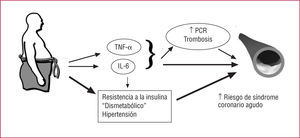
El estado hiperglucémico observado en la diabetes tipo 2 parece ser tan sólo la punta de un enorme iceberg dismetabólico, que es consecuencia en su mayor parte de una combinación de factores que se observan en pacientes con sobrepeso con un exceso de grasa abdominal y resistencia a la insulina17. La obesidad (que se mide con el perímetro de cintura) desempeña un papel importante en el síndrome metabólico. Es interesante señalar que, para cualquier cantidad dada de grasa corporal total, los individuos con un exceso selectivo de tejido adiposo intraabdominal (visceral) presentan un riesgo sustancialmente superior de que se les diagnostique una resistencia a la insulina y el síndrome metabólico18,19. Se ha sugerido que la alteración del metabolismo de los ácidos grasos no esterificados puede ser el principal factor que contribuya a producir la resistencia a la insulina en los pacientes con obesidad visceral. Esto adquiere una especial importancia si se tiene en cuenta que la resistencia a la insulina está directamente involucrada en el desarrollo y la perpetuación de la aterosclerosis20. De hecho, la insulina ejerce muchos efectos que van más allá de su acción hipoglucemiante (fig. 2). El tejido adiposo no es tan sólo una zona de almacenamiento de lípidos, sino también un importante "órgano" paracrino que libera numerosas citocinas. De entre ellas, la interleucina 6 (IL-6) y el factor de necrosis tumoral alfa (TNF-α) son moléculas proinflamatorias producidas por el tejido adiposo que tienen una importancia vital como se indica a continuación. La obesidad se caracteriza por una infiltración macrofágica del tejido adiposo21, que podría contribuir a producir el perfil inflamatorio descrito en los pacientes con obesidad visceral-abdominal22. Otra sustancia inflamatoria importante, la proteína C reactiva (PCR), es un marcador claramente establecido del riesgo cardiovascular que está también aumentado en los pacientes con obesidad abdominal23. El tejido adiposo sintetiza asimismo sustancias antiinflamatorias, como la adiponectina24,25. Es interesante señalar que la producción y liberación de adiponectina están reducidas en los pacientes con obesidad visceral26. Se ha demostrado que la adiponectinatiene muchos efectos compatibles con una mejora de la señalización de insulina y una posible protección frente a la aterosclerosis27,28. La reducción de las concentraciones de adiponectina que se observa en los pacientes con obesidad abdominal podría constituir, pues, un factor clave responsable del aumento del riesgo de aterosclerosis y diabetes observado en estos pacientes. Así pues, los pacientes con un exceso de grasa visceral presentan un exceso de concentración de PCR, IL-6 y TNF-α circulantes, que se asocia a una concentración reducida de adiponectina26, lo cual puede explicar el alto riesgo observado en esta población (fig. 3).
El exceso de acumulación de grasa intraabdominal constituye un indicador de una incapacidad relativa del tejido adiposo subcutáneo de actuar como "sumidero de energía" cuando un individuo tiene que manejar un exceso de energía/calorías como consecuencia de un consumo excesivo de energía y/o una reducción del gasto de ésta29. Este déficit relativo en la capacidad de la grasa subcutánea de almacenar el exceso de energía daría lugar a un aumento de la acumulación de grasa intraabdominal (alrededor de diversos órganos), un fenómeno al que se denomina depósito de grasa ectópico30. Las glitazonas aumentan el depósito de grasa en el "lugar correcto", el tejido subcutáneo31. Esta redistribución de la grasa después del tratamiento con glitazonas podría explicar los efectos beneficiosos de esta clase de fármacos sobre la sensibilidad a la insulina. Así, se ha descrito que la reducción de peso induce una movilización selectiva del tejido adiposo abdominal y visceral32,33, lo cual explica, al menos en parte, la mejora del perfil metabólico que se observa en la mayoría de los pacientes con síndrome metabólico tras una reducción de peso moderada34–36.
A pesar de la evidencia que indica que el síndrome metabólico y la diabetes tipo 2 están relacionadas con la inflamación37, el vínculo es todavía difícil de comprender. La capacidad de hacer frente a la inanición y la capacidad de poner en marcha una respuesta inmunitaria efectiva frente a los patógenos se encuentran entre los procesos más cruciales para la supervivencia de la especie. El primero de estos mecanismos fomenta el almacenamiento del exceso de calorías cuando el alimento es escaso. Sin embargo, en presencia de un superávit nutricional continuo, este beneficio metabólico que fuera una vez beneficioso pasa a ser nocivo al fomentar el exceso de adiposidad. Es interesante señalar que las unidades funcionales que controlan las funciones metabólicas e inmunitarias en los organismos superiores han evolucionado a partir de estructuras originarias comunes. Se ha sugerido que los órganos procedentes de la anterior unidad única continúan teniendo vías de señalización comunes o solapadas, que regulan las funciones inmunitarias y metabólicas13. Los receptores toll-like (TLR) constituyen la clave clásica para esta teoría. Los TLR son sistemas de percepción de patógenos que, con el contacto con algunos nutrientes, especialmente los ácidos grasos38–40, ponen en marcha respuestas inflamatorias inducidas de forma metabólica o nutricional38,39,41,42. Los procesos metabólicos, inflamatorios e inmunitarios son regulados también por los lípidos43. Hay varios factores de transcripción, en especial los de las familias del receptor activado por proliferador de peroxisoma (PPAR) y el receptor X hepático (LXR), que parecen ser cruciales para la modulación de la intersección de estas vías. Los ligandos para los tres componentes de la familia PPAR inhiben la producción de citocinas proinflamatorias a través de una supresión del NF-κB44,45. Es interesante el hecho de que la señalización derivada de los TLR inhibe la actividad de LXR en los macrófagos, con lo que fomenta la acumulación de colesterol en estas células, lo cual explica, al menos en parte, los efectos proaterógenos de la infección46.
Los mecanismos de defensa nocivos involucrados en la generación y perpetuación de la aterosclerosis, como la infiltración macrofágica de la pared arterial, tienen su equivalente en el tejido adiposo. La morfología del tejido adiposo en los pacientes obesos ilustra la convergencia de los macrófagos sobre los adipocitos necróticos, y ello sugiere que su presencia en el tejido adiposo podría tener predominantemente fines de eliminación47, tal como ocurre en la pared vascular ateromatosa. Todas las respuestas inflamatorias desencadenadas por los macrófagos pueden estar presentes también en el tejido adiposo de los pacientes obesos.
Así pues, parece claro que la inflamación es un factor importante en los pacientes con obesidad, síndrome metabólico y diabetes. Diversas vías sugieren una interacción entre el sistema metabólico e inmuno-inflamatorio, lo cual indica que estos procesos no corresponden a mecanismos diferentes sino a una manifestación diferente del mismo proceso.
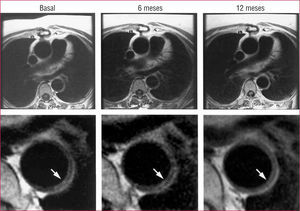
PAPEL DE LAS TÉCNICAS DE DIAGNÓSTICO POR IMAGEN EN LA ENFERMEDAD CARDIOVASCULAR Y LA DIABETESMás allá de la anatomía: diagnóstico por la imagen funcional (inflamación)Recientemente han aparecido las técnicas de diagnóstico por imagen cardiovasculares no invasivas, como un instrumento de gran exactitud para valorar no sólo la anatomía y la función del corazón48, sino también la de los vasos arteriales; estas técnicas hacen que sea factible el estudio de la carga de la aterosclerosis49,50. La resonancia magnética (RM) ha resultado extraordinariamente exacta para la valoración de la efectividad de las intervenciones destinadas a obtener una regresión de la placa51,52 (fig. 4). Nuestro grupo fue pionero en el planteamiento del concepto de que el depósito de ateroma en la pared vascular no era un fenómeno "unidireccional", al mostrar por primera vez el efecto de la apoA-I/HDL sobre la carga de ateroma53. Posteriormente, el desarrollo de la RM nos permitió demostrar que diversas intervenciones dirigidas a diferentes mecanismos permitían producir una regresión de las placas ateroscleróticas ya establecidas51,52,54,55. Los trabajos recientes se han centrado en el diagnóstico por imagen de procesos biológicos (diagnóstico por la imagen funcional) además de la anatomía. El conocimiento del mecanismo que interviene en el desarrollo, la inflamación y la inestabilidad de la placa llevó al concepto de diagnóstico por imagen funcional. La inflamación existente en la placa aterosclerótica puede cuantificarse mediante tomografía de emisión de positrones (PET) con 18F fluorodesoxiglucosa (FDG)56, puesto que la captación de FDG está confinada a las áreas ricas en macrófagos. Para superar las limitaciones de la exploración de PET en lo relativo a la resolución anatómica, la fusión de la FDG-PET con la RM de alta resolución permitió obtener una combinación sorprendente de caracterización del tamaño de la placa y cuantificación de la inflamación57 (fig. 5). En consecuencia, se ha dedicado mucho esfuerzo a la detección de áreas de alto riesgo (placas). La vulnerabilidad de la placa se ha asociado en gran medida al contenido de macrófagos de ésta. La composición de la placa ha sido objeto de una amplia investigación. A pesar de que nosotros demostramos que los nuevos medios de contraste pueden ser útiles para detectar placas ricas en lípidos en la RM58, la sensibilidad y especificidad de estos medios de contraste "no dirigidos" está lejos de ser la deseable. Los nuevos avances en las técnicas de imagen moleculares con el empleo de medios de contraste dirigidos han permitido una caracterización no invasiva de la composición de la placa49. Muy recientemente se ha demostrado que las micromicelas dirigidas a los macrófagos intensifican la pared vascular aterosclerótica de los ratones knockout para ApoE in vivo, lo cual sugiere que el grado de intensificación observado en la RM podría estar directamente relacionado con el contenido macrofágico del vaso aterosclerótico59 (fig. 6). Estos resultados preliminares aumentan la probabilidad de obtención de imágenes exactas de la composición de la placa. Una cuestión que no se ha abordado todavía es la de si las exploraciones de imagen funcionales y anatómicas seriadas en pacientes de alto riesgo permiten efectuar un seguimiento de la
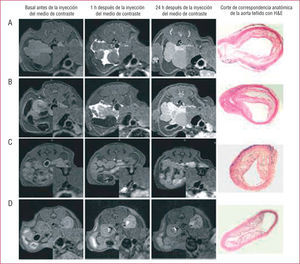
Imágenes transversales de resonancia magnética al mismo nivel de la aorta en un paciente tratado con estatinas. Obsérvese que tras 6 meses de tratamiento el volumen de la placa es muy similar, lo cual revela una detención de la progresión de ésta. A los 12 meses se aprecia una reducción del volumen de la placa. Tomado de Corti et al51.
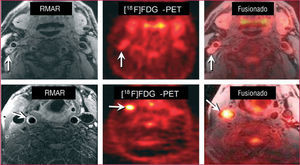
Resonancia magnética de alta resolución (RMAR) y tomografía de emisión de positrones (PET) con fluorodesoxiglucosa (FDG) correspondientes a un paciente que había sufrido un ictus del territorio de la carótida derecha. Recuadros superiores: imágenes transaxiales tomadas a la altura de la arteria carótida interna derecha (RIC) proximal. Se aprecia una gran placa aterosclerótica en la arteria RIC que causa una estenosis luminal intensa (flechas). A pesar de su tamaño, solamente se observa una captación de FDG baja (flechas). Recuadros inferiores: imágenes axiales tomadas a la altura de las arterias carótidas primitivas (CCA) proximales. Las flechas resaltan una placa no estenótica en la pared de la CCA derecha. La flecha del panel central señala una zona de alta captación de FDG, cuya localización se confirma en la imagen fusionada como la CCA derecha (recuadro derecho inferior). Tomado de Davies et al57.
Imágenes de resonancia magnética in vivo obtenidas antes y después de la inyección de inmunomicelas dirigidas a los macrófagos (A y B), micelas no dirigidas (C) y gadolinio (D) en ratones knockout para ApoE. Tomado de Amirbekian et al59.
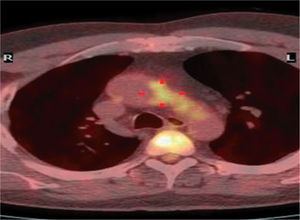
efectividad de las intervenciones. En un subestudio del ensayo Future Revascularization Evaluation in Patients with Diabetes Mellitus: Optimal Management of Multivessel Disease (FREEDOM), estamos investigando si la fusión de la RM con la PET-TC permite identificar la carga de pared vascular inflamatoria en los pacientes diabéticos, y si un tratamiento agresivo de estos pacientes dará lugar a un cese del proceso inflamatorio (o incluso a su regresión), según las evaluaciones efectuadas con estas nuevas modalidades de alta resolución (fig. 7).
Combinación de imágenes de tomografía de emisión de positrones (PET) y TC de fila multidetector en un paciente con diabetes del ensayo FREEDOM.
La neovascularización en el interior de la placa aterosclerótica es otra característica que se ha asociado recientemente a la vulnerabilidad a la lesión60. A pesar de que esta hipótesis no ha sido universalmente aceptada, ciertos estudios sugieren que los microvasos derivados de los vasa vasorum nutren la placa aterosclerótica, facilitando su progresión, al proporcionar una comunicación permanente entre la circulación sistémica y el ateroma, con lo que aumenta la extravasación de leucocitos, albúmina y hematíes. Es bien sabido, también, que la hemorragia en el interior de la placa conduce a la rotura y la trombosis. El consiguiente depósito de hierro puede aumentar la oxidación y la inflamación en el interior de la placa aterosclerótica. La haptoglobina es la proteína responsable de la defensa frente a la lesión causada por la hemoglobina. Se ha demostrado que el polimorfismo de la haptoglobina desempeña un papel crucial en la respuesta oxidativa e inflamatoria a la hemorragia en el interior de la placa61. Las nuevas técnicas de imagen tienen como objetivo la visualización directa de los neovasos de la placa62. Otros marcadores conocidos de la inestabilidad de la placa, como el contenido de factor tisular de ésta y la apoptosis macrofágica en el interior del ateroma63 serán futuras dianas para las técnicas de imagen destinadas a la estratificación del riesgo.
CONCLUSIONESLa enfermedad cardiovascular constituye un problema de salud creciente, de proporciones epidémicas en todo el mundo. Hay varios factores que influyen en este asombroso crecimiento, y uno de los principales es el cambio en el estilo de vida como consecuencia de la urbanización. Los cambios del estilo de vida han convertido lo que en un tiempo fuera un mecanismo ventajoso de almacenamiento del superávit de energía en un mecanismo nocivo que es el responsable del aumento exponencial de la obesidad, el síndrome metabólico y la diabetes. Hay una intensa interrelación entre la enfermedad cardiovascular-metabólica y el estado inflamatorio. La importante interacción entre el aparato inmuno-inflamatorio y el sistema metabólico implica que la obesidad (y específicamente la obesidad abdominal) se asocia a un estado altamente inflamatorio, con lo que aumenta el riesgo de manifestaciones cardiovasculares.
Las modalidades de diagnóstico por imagen no invasivas han resultado de gran exactitud en el estudio anatómico de los pacientes con aterosclerosis, pero más interesante aún es el hecho de que estas modalidades se estén convirtiendo también en un instrumento preciso para el estudio funcional y biológico. La inflamación puede cuantificarse de manera exacta mediante la fusión de nuevas modalidades de imagen. Los contrastes dirigidos para el diagnóstico por imagen no invasivo son también instrumentos prometedores para la caracterización de la placa.