Poco se conoce acerca de las características de los sujetos con hipercolesterolemia familiar (HF) menores de 18 años, así como del tratamiento hipolipemiante empleado en estos pacientes y la consecución de objetivos lipídicos en la vida real. Nuestro objetivo es valorar la consecución de objetivos de colesterol unido a lipoproteínas de baja densidad (cLDL) en pacientes con HF menores de 18 años incluidos en un gran registro nacional.
MétodosSe analizó a los pacientes menores de 18 años incluidos en un gran registro en marcha de pacientes con diagnóstico genético de HF en España. Se analizó la consecución de los objetivos recomendados de cLDL en plasma a la inclusión y en el seguimiento en relación con el uso de terapia hipolipemiante.
ResultadosSe incluyó a 392 individuos menores de 18 años, de los que 217 obtuvieron diagnóstico genético de HF y seguimiento completo. El tiempo de seguimiento medio fue 4,69 [intervalo intercuartílico, 2,48-6,38] años; el 68,2% de los casos con HF tomaban estatinas y el 41,5% de los pacientes tenían el cLDL < 130mg/dl. El uso de estatinas fue el único predictor de consecución de objetivos de cLDL.
ConclusionesEste estudio demostró que una alta proporción de pacientes con HF menores de 18 años tenía altas concentraciones de cLDL y no lograron alcanzar los objetivos de cLDL recomendados. El uso de estatinas fue el único predictor independiente asociado a conseguir el objetivo de cLDL recomendado. No se detectó ningún problema de seguridad durante el seguimiento. Estos resultados enfatizan que muchos pacientes con HF no están suficientemente controlados y aún es posible mejorar del tratamiento.
Palabras clave
La hipercolesterolemia familiar (HF) heterocigota es un trastorno genético frecuente que se asocia a enfermedad cardiovascular ateroesclerótica (ECVA) prematura. Los niños con una HF no tratada presentan un aumento del riesgo de ECVA prematura a partir de los 20 años de edad1. La elevación intensa de las concentraciones de colesterol unido a lipoproteínas de baja densidad (cLDL) empieza ya en el feto y conduce a una continua exposición de la pared arterial al cLDL, que acelera el depósito de colesterol y la inflamación vascular y predispone a un inicio temprano de la ateroesclerosis, en especial en las arterias coronarias y la aorta.
Las estatinas y otros tratamientos hipolipemiantes (THL) reducen de manera efectiva el cLDL, son seguros para niños y adolescentes y restablecen la función endotelial a una edad temprana2–4. Recientemente, se ha propuesto un cribado universal de los niños a partir de los 2 años y hasta los 85,6 para detectar a los que necesitan tratamiento. Sin embargo, este enfoque se basa en consideraciones teóricas y no se ha demostrado su eficacia en la práctica clínica real.
No obstante, se sabe poco sobre las características de los pacientes con HF de menos de 18 años, el THL utilizado en estos pacientes y los objetivos lipídicos que se alcanzan en la práctica clínica real. La falta de información es aún mayor por lo que respecta a los datos de seguimiento. Los registros nacionales pueden usarse para obtener esta información crucial para mejorar los modelos de asistencia de la HF, los protocolos terapéuticos y las políticas de salud7,8. El estudio SpAnish Familial HypErcHolEsterolaemiA CohoRt STudy (SAFEHEART) (NCT02693548) se diseñó para mejorar el conocimiento sobre los factores pronósticos y los mecanismos que influyen en la aparición de la ECVA y la mortalidad en una población con HF.
El objetivo del presente estudio es analizar las características de los pacientes y evaluar el THL y los objetivos lipídicos en el momento de la inclusión y durante el seguimiento en los pacientes con HF menores de 18 años incluidos en el estudio SAFEHEART y determinar los factores que predicen la probabilidad de alcanzar esos objetivos.
MÉTODOSDiseño y población del estudioEl SAFEHEART es un estudio de cohorte prospectivo, abierto, multicéntrico, de ámbito nacional y a largo plazo, en una población de pacientes de España con HF definida molecularmente. La identificación de los participantes de familias con HF se inició en 2004 y sigue en marcha. Los criterios de inclusión fueron los de casos índice con un diagnóstico genético de HF y sus familiares mayores de 15 años con un diagnóstico genético de HF, así como los familiares sin un diagnóstico genético e HF (grupo de control). No obstante, se incluyó también a participantes menores de 15 años si sus padres lo solicitaban. Este estudio fue aprobado por los comités de ética locales. Todos los individuos aptos o al menos 1 de sus progenitores o tutores legales dieron el consentimiento informado por escrito. La gestión del seguimiento de los participantes corrió a cargo de un centro de coordinación situado en Madrid. Se contactó con los pacientes o sus progenitores una vez al año mediante una llamada telefónica estandarizada, para registrar los cambios de interés en sus hábitos de modo de vida y en las medicaciones, así como cualquier evento cardiovascular u otro problema médico. Los médicos participantes que incluyeron a los pacientes y sus familias en el registro recibieron formación, según las guías de práctica clínica y con el apoyo de reuniones anuales a las que asistieron médicos expertos en este campo; además, se utilizó un programa electrónico y un sistema de consulta telefónica y se aplicó un programa de formación a través de Internet para respaldar el tratamiento en caso necesario. Las decisiones de tratamiento las tomó exclusivamente el médico de cada paciente.
Determinaciones clínicas y analíticasSe registraron las características demográficas y clínicas según lo descrito en otra publicación9. Las muestras de sangre se obtuvieron después de 12 h en ayunas. Se conservaron muestras alícuotas de suero, plasma y ADN a temperatura de –80°C. Las concentraciones séricas de colesterol total, triglicéridos y colesterol unido a lipoproteínas de alta densidad (cHDL) se determinaron en un laboratorio central usando métodos enzimáticos. La concentración sérica de cLDL se calculó mediante la fórmula de Friedewald. El ADN se aisló de la sangre total con métodos estándares y la HF se diagnosticó genéticamente con un método de microchip de ADN10. Los objetivos de cLDL se definieron según las recomendaciones y los objetivos actuales. El objetivo principal fue el cLDL < 130 mg/dl11. Un objetivo alternativo para los pacientes menores de 14 años fue cLDL < 160 mg/dl en ausencia de cualquier otro factor de riesgo cardiovascular (tabaquismo, cHDL < 40 mg/dl, lipoproteína (a) > 50 mg/dl o cLDL > 250 mg/dl) o enfermedad cardiovascular prematura de los padres y los abuelos6. La ECVA familiar prematura se definió por la aparición de un primer evento antes de los 55 años en los varones y antes de los 65 en las mujeres.
Clasificación del tratamiento hipolipemianteLa dosis máxima de estatina se definió como la de atorvastatina 40-80 mg/día o la de rosuvastatina 20-40 mg/día, que se consideraron dosis de estatinas de alta intensidad. El tratamiento combinado máximo se definió como el uso de una dosis máxima de estatina junto con ezetimiba a dosis de 10 mg/día. El THL máximo se definió como cualquier THL con el que se esperara obtener una reducción de al menos un 50% de las concentraciones basales de cLDL: simvastatina 20, 40 u 80 mg/día más ezetimiba 10 mg/día; pravastatina 40 mg/día en combinación con ezetimiba 10 mg/día; fluvastatina 80 mg/día más ezetimiba 10 mg/día; atorvastatina 40 u 80 mg/día con o sin ezetimiba 10 mg/día; atorvastatina 10 o 20 mg/día más ezetimiba 10 mg/día; rosuvastatina 20 o 40 mg/día con o sin ezetimiba 10 mg/día; rosuvastatina 10 mg/día más ezetimiba 10 mg/día, y pitavastatina 4 mg/día en combinación con ezetimiba 10 mg/día12,13.
Análisis genéticoLas mutaciones del receptor de cLDL (LDLR) se clasificaron según su efecto conocido en la función de la proteína receptora de LDL como nulo (receptor negativo) o defectuoso (receptor defectuoso) según lo descrito con anterioridad14. Las variantes causantes de una ausencia completa o un truncamiento de la proteína (pérdida de función), demostrada mediante análisis funcional in vitro o análisis por simulación por ordenador, se clasificaron como de receptor negativo. Estas variantes incluían las siguientes: a) mutaciones puntuales causantes de un codón de detención prematura; b) mutaciones de sentido alterado que afectan a la quinta repetición rica en cisteína en el dominio de fijación de ligando del gen RLDL (mutación de clase 2A); c) deleciones pequeñas causantes de un desplazamiento de marco de lectura y un codón de detención prematura, y d) reordenaciones grandes. Las mutaciones de receptor defectuoso fueron las demás mutaciones puntuales dentro del marco y las deleciones e inserciones pequeñas dentro del marco. Todas las mutaciones sin un análisis de funcionalidad conocido mediante estudios in vitro o análisis de simulación por ordenador se clasificaron como de «funcionalidad desconocida», ya que no se podía asegurar que el efecto en el receptor fuera de receptor negativo o defectuoso; sin embargo, se consideraron patógenas, ya que todos los individuos portadores de 1 de esas mutaciones tenían hipercolesterolemia, mientras que los familiares sin la mutación tenían unas concentraciones de colesterol normales14.
Análisis estadísticoLos análisis estadísticos se realizaron con el programa SPSS versión 18.0 (SPSS, Inc.; Chicago, Illinois, Estados Unidos). Se evaluó la normalidad de la distribución de las variables mediante la prueba de Kolmogorov-Smirnov. Los datos cuantitativos se expresan en forma de mediana [intervalo intercuartílico] y los datos cualitativos, en forma de número absoluto y porcentaje. Se definieron 2 poblaciones: población en la inclusión en el estudio (n = 241) y población en el seguimiento (denominada también cohorte), constituida por los pacientes de los que se dispuso de un perfil lipídico completo del plasma durante el seguimiento (n = 217). Todas las comparaciones entre los pacientes en la inclusión en el estudio y los pacientes en el seguimiento se realizaron en el estudio de cohorte. Las comparaciones de frecuencias entre variables cualitativas se realizaron con la prueba de la χ2. Los cambios en las variables binarias se analizaron con la prueba de McNemar. La mediana de valores de las variables cuantitativas se comparó con la prueba no paramétrica de Mann-Whitney o con la prueba de rango con signo de Wilcoxon para datos emparejados, según procediera. Se utilizó un análisis de regresión logística binario en el estudio de cohorte para determinar las variables asociadas al uso de estatinas. Incluimos las variables que eran estadísticamente significativas en los análisis univariables, así como los factores predictivos conocidos a priori y los factores de confusión: edad, sexo y seguimiento en el contexto de atención primaria/hospitalizada. Se realizó otro análisis de regresión logística binaria en el estudio de cohorte, con la exclusión de los pacientes que alcanzaron el objetivo en el momento de la inclusión, con objeto de determinar las variables asociadas al hecho de alcanzar un cLDL < 130 mg/dl. Incluimos las variables que eran estadísticamente significativas en los análisis univariables, así como los factores predictivos conocidos a priori y los factores de confusión: edad, sexo, tipo de mutación (nulo o defectuoso), uso de ezetimiba y seguimiento en un contexto de atención primaria/especializada. Las diferencias se consideraron estadísticamente significativas con un valor de p < 0,05.
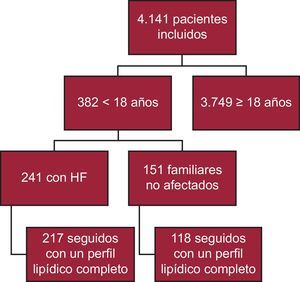
RESULTADOSHasta la fecha, se ha incluido a un total de 4.141 participantes en el registro SAFEHEART; 392 tienen menos de 18 años de edad. De ellos, 241 disponen de una confirmación molecular de la HF y 217 han sido objeto de un seguimiento con un perfil lipídico completo (90,0%) (figura 1). En total, se excluyó del análisis a 24 pacientes por falta de un perfil lipídico completo en el seguimiento. El seguimiento se llevó a cabo en un contexto de atención primaria en 40 pacientes (18,4%). La mediana de tiempo de seguimiento fue de 4,69 [2,48-6,38] años.
En la evaluación realizada en el momento de la inclusión (población en la inclusión), 129 pacientes con HF (53,5%) eran varones. La mediana de edad era 15,0 [14,0-16,0] años. Los 2 pacientes de menos edad tenían 8 años. No tenía antecedentes de ECVA ninguno de los pacientes y había una ECVA familiar prematura en 40 (16,6%). Se presenta una comparación de las características basales en la inclusión entre los pacientes de la cohorte y los pacientes que no fueron objeto de seguimiento en la tabla 1. No se observaron diferencias significativas entre los 2 grupos. Ninguno de los pacientes tenía antecedentes de ECVA, presión arterial elevada o diabetes mellitus. Hubo un porcentaje superior de pacientes del grupo sin seguimiento tratados en atención primaria, si bien la diferencia no tuvo significación estadística. En la cohorte, se observaron reducciones significativas de las concentraciones plasmáticas de colesterol total, cLDL, triglicéridos y colesterol no HDL; también se observó un aumento significativo del cHDL en el seguimiento (tabla 2).
Características basales de la población en el momento de la inclusión
| Pacientes con HF y seguimiento | Pacientes con HF sin seguimiento | p | |
|---|---|---|---|
| Pacientes, n | 217 | 24 | |
| Sexo (varones) | 117 (53,9) | 12 (50) | 0,72 |
| Edad (años) | 15,0 [14,0-16,0] | 15,0 [13,0-15,8] | 0,06 |
| ECVA familiar prematura | 36 (16,6) | 4 (16,7) | 1 |
| Fumador activo | 13 (6,0) | 2 (8,3) | 0,65 |
| Xantomas | 1 (0,5) | 0 (0,0) | 0,99 |
| Arco corneal | 6 (2,8) | 1 (4,2) | 0,53 |
| IMC | 21,09 [19,40-22,80] | 20,79 [17,80-22,70] | 0,64 |
| Perímetro de cintura (cm) | 72,0 (66,0-78,0) | 72,0 [66,0-75,8] | 0,94 |
| Colesterol total (mg/dl) | 223,5 [194,0-262,3] | 217,5 [194,5-277,5] | 0,76 |
| cLDL (mg/dl) | 162,6 [133,0-195,8] | 153,9 [13,1-209,3] | 0,71 |
| cHDL (mg/dl) | 49,0 [42,8-55,0] | 48,5 [41,5-56,0] | 0,96 |
| TG (mg/dl) | 62,0 [49,0-80,3] | 66,0 [42,1-82,3] | 0,90 |
| No-cHDL (mg/dl) | 174,0 [145,8-210,9] | 167,0 [146,5-225,3] | 0,74 |
| Lp (a) (mg/dl) | 18,80 [7,00-48,50] | 13,45 [9,10-28,10] | 0,46 |
| Tratamiento en atención primaria | 40 (22,9) | 7 (46,7) | 0,06 |
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; ECVA: enfermedad cardiovascular ateroesclerótica; HF: hipercolesterolemia familiar; IMC: índice de masa corporal; Lp (a): lipoproteína (a); TG: triglicéridos.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
Concentraciones plasmáticas de lípidos y lipoproteínas (cohorte)
| Cohorte en la inclusión | Cohorte en el seguimiento | p | |
|---|---|---|---|
| Colesterol total (mg/dl) | 221,0 [194,0-260,2] | 203,0 [183,0-233,5] | < 0,001 |
| cLDL (mg/dl) | 157,7 [132,8-194,5] | 138,0 [116,5-165,4] | < 0,001 |
| cHDL (mg/dl) | 49,0 [43,0-55,0] | 50,0 [44,0-58,0] | 0,002 |
| TG (mg/dl) | 62,0 [49,0-80,2] | 70,0 [54,5-91,0] | 0,004 |
| No-cHDL (mg/dl) | 171,0 [145,8-209,2] | 154,0 [132,0-182,5] | < 0,001 |
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; TG: triglicéridos.
Los valores expresan mediana [intervalo intercuartílico].
Identificamos a 212 pacientes con una mutación en RLDL (97,7%) y 5 pacientes con una mutación en el gen de la apolipoproteína B (2,3%). De las mutaciones en RLDL, 95 (43,8%) se clasificaron como mutaciones nulas; 92 (42,4%), como mutaciones defectuosas y 25 (11,5%), como mutaciones de funcionalidad desconocida.
Tratamiento hipolipemiante y consecución de objetivosEn la tabla 3 se muestra el uso de los diferentes regímenes de THL en la inclusión y en el seguimiento. Los resultados indican un aumento significativo del uso de estatinas (el 44,2% en la inclusión y el 68,2% en el seguimiento), ezetimiba (el 8,7 y el 15,2%), dosis máxima de estatinas (el 3,3 y el 13,9%) y THL máximo (el 7,9 y el 23,6%). La estatina más ampliamente prescrita en la inclusión (25,3%) y en el seguimiento (30,5%) fue la atorvastatina. La prescripción de rosuvastatina aumentó (pasando del 6,0% en la inclusión al 20,3% en el seguimiento). La mediana de duración del tratamiento con estatinas fue 7,0 [5,0-9,0] años. La edad de menarquia fue 12,0 [12,0-13,0] años en las niñas tratadas con estatinas y 12,0 [11,0-13,0] años en las no tratadas con estatinas (p = 0,77). No hubo un aumento de transaminasas hepáticas ni de creatincinasa. Los fibratos y los secuestradores de ácidos biliares se utilizaron solamente en 15 pacientes (7,0%) en la inclusión y 3 (1,5%) en el seguimiento. Se utilizó ezetimiba en monoterapia y sin una estatina en 18 pacientes (8,3%) en la inclusión y 24 (11,1%) en el seguimiento. Por lo que respecta a la adherencia al tratamiento, 10 pacientes (4,6%) indicaron que no tomaban la medicación al menos 1 día al mes durante el seguimiento. En el análisis multivariable, ninguna de las variables mostró asociación independiente con el uso de estatinas.
Tratamientos hipolipemiantes y consecución del objetivo de cLDL (cohorte)
| En la inclusión –/seguimiento – | En la inclusión –/seguimiento + | En la inclusión +/seguimiento – | En la inclusión +/seguimiento + | p | |
|---|---|---|---|---|---|
| Pacientes tratados con estatinas | 60 (27,6) | 61 (28,1) | 9 (4,1) | 87 (40,1) | < 0,001 |
| Pacientes tratados con estatinas a dosis máximas | 186 (85,7) | 24 (11,1) | 1 (0,5) | 6 (2,8) | < 0,001 |
| Pacientes tratados con ezetimiba | 177 (81,6) | 21 (9,7) | 7 (3,2) | 12 (5,5) | 0,013 |
| Pacientes tratados con dosis máximas de tratamiento combinado | 211 (97,2) | 6 (2,8) | 0 (0,0) | 0 (0,0) | ND |
| Pacientes tratados con dosis máximas de THL | 163 (75,1) | 37 (17,1) | 3 (1,4) | 14 (6,5) | < 0,001 |
| cLDL < 130 mg/dl | 111 (51,2) | 62 (28,6) | 16 (7,4) | 28 (12,9) | < 0,001 |
| cLDL < 160 mg/dl | 44 (20,3) | 64 (29,5) | 19 (8,8) | 90 (41,5) | < 0,001 |
cLDL: colesterol unido a lipoproteínas de baja densidad; THL: tratamiento hipolipemiante.
Los valores expresan n (%).
Véase en el texto la clasificación del THL.
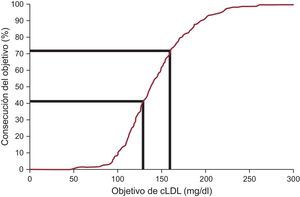
Las concentraciones plasmáticas de cLDL se redujeron en una media del 12,5%, y alcanzaron una mediana de 138,0 mg/dl en el seguimiento. Los objetivos de cLDL, definidos según las recomendaciones internacionales recientes sobre la HF, se alcanzaron en un 20,3% de los casos en la inclusión y un 41,5% en el seguimiento (tabla 3 y figura 2). Al aplicar un objetivo alternativo de cLDL < 160 mg/dl para los menores de 14 años, 8 (16,7%) de los 48 pacientes y 1 (16,7%) de los 6 pacientes alcanzaron el objetivo en la inclusión y en el seguimiento respectivamente. La única variable con asociación independiente con la consecución del objetivo de cLDL en el análisis multivariable fue el uso de estatinas (odds ratio = 13,83; intervalo de confianza del 95%, 2,98-64,15). El tipo de profesional de la salud encargado de la asistencia (médico especialista o de atención primaria), la edad, el sexo, la concentración de lipoproteína (a) y el tipo de mutación no se asociaron con la consecución del objetivo de cLDL.
DISCUSIÓNEn este estudio, se presentan las características de los pacientes, el uso de THL y la consecución del objetivo de cLDL en una cohorte longitudinal de pacientes con HF definida molecularmente, de menos de 18 años de edad, incluidos en el registro SAFEHEART. Este registro de pacientes con HF, que tiene unas características únicas, se basa en los datos obtenidos de la práctica clínica real en España, tanto en atención primaria como en asistencia especializada. Los resultados ponen de manifiesto que se alcanzó el objetivo terapéutico de cLDL < 130 mg/dl solo en el 20,3% de los pacientes en la inclusión y el 41,5% en el seguimiento, con un 68,2% de pacientes en tratamiento con THL. El uso de estatinas fue el único factor con asociación independiente con la consecución del objetivo de cLDL. Según nuestro conocimiento, no hay ningún otro estudio que haya demostrado la consecución del objetivo en pacientes con HF menores de 18 años, y este estudio es el primero que lo describe en una población amplia.
Recientemente, un registro del Reino Unido15 analizó los 207 niños con HF y se identificaron mutaciones en el 64% de ellos; se observó que un 48% recibía tratamiento con THL; se alcanzó una reducción del 35% en el cLDL. Sin embargo, los autores no presentaron resultados relativos a la consecución del objetivo. En otro estudio, en el que se analizó una muestra de pacientes pequeña (n = 89), se observó una reducción del cLDL del 43% en un seguimiento a largo plazo16. Esta mayor reducción probablemente se deba a un uso más frecuente del tratamiento combinado (56%). No se presentaron resultados en cuanto a la consecución del objetivo. En otro estudio retrospectivo de 207 pacientes de los Países Bajos, solo el 26% de los pacientes recibieron tratamiento con THL y, una vez más, no se presentaron resultados en cuanto a la consecución del objetivo17.
Este estudio de cohorte pone de manifiesto que las concentraciones de cLDL de los pacientes con HF menores de 18 años pueden cambiar con el tiempo como consecuencia de la modificación del THL y la formación del médico. La proporción de pacientes tratados con estatinas, dosis máximas de estatinas o THL máximo aumentó significativamente durante el seguimiento. Es interesante señalar que nuestra cohorte no está sesgada, ya que no hubo diferencias estadísticamente significativas entre los pacientes que no fueron objeto de seguimiento y la cohorte seguida.
El diagnóstico y el tratamiento iniciales de la HF son esenciales, en especial en los niños y adolescentes, para prevenir la aparición de una ECVA en la edad adulta. El cribado para la detección sistemática de la HF en los niños tiene un buen rendimiento y debe aplicarse antes de los 8 años de edad, ya que los niños con hipercolesterolemia presentan un aumento del riesgo de ECVA prematura. Además, el cribado puede identificar a los individuos con mayor riesgo y puede llevar a la instauración de un THL, que se ha demostrado que revierte de manera efectiva el proceso ateroesclerótico y reduce el riesgo de ECVA. Los niños con HF generalmente no presentan una ECVA clínica. No obstante, la existencia de un riesgo futuro respalda el uso del THL, y las estatinas son la piedra angular del tratamiento de la HF18.
La seguridad y la tolerabilidad del THL en la HF pediátrica son siempre controvertidas, si bien se ha descrito que son similares a las observadas en los adultos5,19,20. Recientemente, Ramaswami et al.15 han indicado que no hubo motivos de preocupación en cuanto a la seguridad, de manera similar a lo observado en nuestros resultados. No obstante, se recomienda una supervisión estricta, en especial de los pacientes tratados con las dosis de estatinas más altas. A las adolescentes se les debe recomendar que suspendan el tratamiento con estatinas cuando se planteen un embarazo. No obstante, aunque son necesarios más datos sobre las cuestiones de seguridad en los niños que reciben un tratamiento a largo plazo con THL, los estudios recientes de seguimiento a largo plazo han mostrado un perfil de seguridad excelente21. Nuestros datos respaldan esta observación indirectamente, ya que un elevado porcentaje de los pacientes iniciaron un THL durante el seguimiento y hubo pocos abandonos. Nuestros resultados ponen claramente de manifiesto un aumento del porcentaje de pacientes tratados con estatinas, dosis altas de estatinas o un THL máximo, y un bajo porcentaje de pacientes que abandonaron la medicación. Estos datos confirman la seguridad, la adherencia y la tolerabilidad de las estatinas, aun cuando se empleen en dosis altas, en los pacientes con HF menores de 18 años22. Además, nuestros resultados concuerdan con lo indicado por estudios previos que no han observado ningún efecto en la maduración sexual23. Todos estos resultados reafirman el concepto de «cuanto más joven, mejor» por lo que respecta a la edad ideal para iniciar el tratamiento con estatinas en esos pacientes jóvenes con HF23.
Nuestros resultados indican un elevado número de pacientes con HF menores de 18 años y, al igual que en estudios previos15,16, indican la voluntad de los pacientes con HF adultos de incluir a sus familiares inmediatos en las actuaciones de cribado y de registro. Este hecho refleja la seriedad con que estos pacientes afrontan su problema y las repercusiones que puede tener la recomendación de sus médicos en cuanto a la modificación de su estilo de vida. Este tipo de actitud de los pacientes adultos es la base de un estilo de vida saludable de sus familiares24.
Aunque el objetivo más frecuente para los pacientes con HF menores de 18 años es una concentración de cLDL < 130 mg/dl, puede utilizarse un enfoque alternativo consistente en cLDL < 160 mg/dl para los menores de 14 no fumadores, con cHDL ≥ 40 mg/dl, lipoproteína (a) < 50 mg/dl y cLDL < 250 mg/dl sin enfermedad cardiovascular prematura de los padres o los abuelos6. Otras guías recientes recomiendan una reducción del 50% del cLDL respecto a los valores previos al tratamiento para niños de 10 o más años, en especial si hay otros factores de riesgo cardiovascular, como concentración de lipoproteína (a) elevada, estableciendo un objetivo de cLDL < 130 mg/dl11. Nuestros resultados muestran también la dificultad a la que se enfrentan estos pacientes para alcanzar los objetivos lipídicos25. Además, la consecución del objetivo de cLDL fue similar tanto si los pacientes eran tratados por especialistas como por médicos de atención primaria. Así pues, es posible alcanzar un nivel de asistencia de los pacientes pediátricos con HF en atención primaria comparable al alcanzado con la asistencia especializada. Para alcanzar este objetivo, es importante resaltar el apoyo que reciben los clínicos a través de los registros y los programas de formación específicos. Los registros pueden optimizar el tratamiento de los pacientes con HF menores de 18 años, al permitir la integración de la atención primaria y la asistencia especializada, y pueden respaldar también a las autoridades sanitarias en la toma de decisiones8,26.
Limitaciones y fortalezasEn este amplio estudio de seguimiento de pacientes con HF menores de 18 años, la intervención no varió respecto a la aplicada por el médico del paciente. No se dispone de un perfil lipídico basal fiable en este registro, pues algunos pacientes ya estaban recibiendo tratamiento cuando se los incluyó en él. Además, los resultados obtenidos pueden haberse alterado por varias características, como los diferentes estilos de vida y la asociación con factores de riesgo cardiovascular diferentes.
CONCLUSIONESLos datos del registro SAFEHEART ponen de manifiesto que un elevado porcentaje de pacientes con HF menores de 18 años presentan altas concentraciones de cLDL y no alcanzan los objetivos de cLDL recomendados. Se observa un aumento de la intensidad del THL y una disminución significativa de las concentraciones de cLDL durante el seguimiento. El uso de estatinas fue el único factor con asociación independiente con la consecución del objetivo de cLDL. Además, no surgieron motivos de preocupación respecto a la seguridad durante el seguimiento. Estos resultados indican que muchos pacientes con HF no están suficientemente controlados y que queda todavía margen para una mejora del tratamiento. Además, el seguimiento de esta población con HF puede contribuir a aumentar el conocimiento respecto a la seguridad del uso de un THL durante toda la vida y de la edad óptima para iniciar el tratamiento para la prevención de la ECVA en la edad adulta.
FINANCIACIÓNEste trabajo fue financiado por la subvención G03/181 de la Fundación Hipercolesterolemia Familiar, la FIS PI12/01289 del Instituto de Salud Carlos III, y la subvención 08-2008 del Centro Nacional de Investigación Cardiovascular.
CONFLICTO DE INTERESESNinguno.
- –
Los niños con hipercolesterolemia familiar heterocigota no tratada presentan un aumento del riesgo de ECVA prematura a partir de los 20 años.
- –
Las estatinas y otros tratamientos con fármacos hipolipemiantes reducen de manera efectiva el cLDL y son seguros para niños y adolescentes.
- –
Es poco lo que se sabe sobre las características de los pacientes con HF menores de 18 años, el tratamiento hipolipemiante utilizado para estos pacientes y los objetivos lipídicos que se alcanzan en la práctica clínica real.
- –
Esta falta de información es aún mayor por lo que respecta a los datos de seguimiento.
- –
Un elevado porcentaje de pacientes con HF menores de 18 años no alcanzan los objetivos de cLDL recomendados.
- –
Se observa un aumento de la intensidad del THL y una disminución significativa de las concentraciones de cLDL durante el seguimiento.
- –
El uso de estatinas fue el único factor con asociación independiente con la consecución del objetivo de cLDL y no surgieron motivos de preocupación respecto a la seguridad durante el seguimiento.
- –
Estos resultados refuerzan el concepto de «cuanto más joven, mejor».
Los autores agradecen a Teresa Pariente su duro trabajo de gestión del cribado familiar en cascada desde el inicio del registro SAFEHEART, a toda la Fundación Española de Hipercolesterolemia Familiar su ayuda en la inclusión y seguimiento de los participantes y a las familias con HF su inestimable contribución y voluntad de participación.
Rocío Aguado (Hospital Universitario de León, León); Fátima Almagro (Hospital Donostia, Donostia-San Sebastián, Guipúzcoa); Rodrigo Alonso, Nelva Mata, Pedro Mata, Leopoldo Pérez de Isla, Adriana Saltijeral (Fundación Hipercolesterolemia Familiar, Madrid); Francisco Arrieta (Hospital Ramón y Cajal, Madrid); Lina Badimón, Teresa Padró (Instituto Catalán de Ciencias Cardiovasculares, IIB-Sant Pau, Barcelona); Miguel Ángel Barba (Hospital Universitario, Albacete); Ángel Brea, Daniel Mosquera (Hospital San Pedro, Logroño, La Rioja); José María Cepeda (Hospital de Vega Baja, Orihuela, Alicante); Raimundo de Andrés (Fundación Jiménez Díaz, Madrid); Gonzalo Díaz-Soto (Hospital Clínico, Valladolid); José L. Díaz (Hospital Abente y Lago, A Coruña); Rosaura Figueras, Xavier Pintó (Hospital de Bellvitge, L’Hospitalet de Llobregat, Barcelona); Francisco Fuentes, José López-Miranda (Hospital Reina Sofía, Córdoba); Jesús Galiana (Hospital de Ciudad Real, Ciudad Real); Juan Antonio Garrido (Hospital Arquitecto Marcide, Ferrol, A Coruña); Luis Irigoyen (Hospital Clínico Universitario Lozano Blesa, Zaragoza); Laura Manjón (Hospital de Cabueñes, Gijón, Asturias); Alberto Martín, Mar Piedecausa (Hospital General Universitario de Elche, Elche, Alicante); Ceferino Martínez-Faedo (Hospital Central de Asturias, Oviedo, Asturias); Marta Mauri (Hospital de Terrassa, Terrassa, Barcelona); Pablo Miramontes (Hospital Clínico Universitario, Salamanca); Ovidio Muñiz (Hospital Virgen del Rocío, Sevilla); Francisca Pereyra (Hospital Universitario Nuestra Señora de Candelaria, Santa Cruz de Tenerife); Leire Pérez (Hospital Universitario Araba, Vitoria, Álava); José Miguel Pinilla (Centro de Salud San Miguel de Salinas, Alicante); Pedro Pujante (Hospital Vital Álvarez Buylla, Mieres, Asturias); Patricia Rubio, Juan Maraver, Alfredo Michan (Hospital General de Jerez de la Frontera, Jerez de la Frontera, Cádiz); Enrique Ruiz (Hospital Universitario, Burgos); Pedro Sáenz (Hospital de Mérida, Mérida, Badajoz); Juan F. Sánchez (Hospital San Pedro de Alcántara, Cáceres); José I. Vidal, Rosa Argüeso (Hospital Universitario Locus Augusti, Lugo); Daniel Zambón (Hospital Clínic, Barcelona).