Las complicaciones mecánicas son unos de los más indeseables contratiempos que pueden aparecer en el infarto agudo de miocardio (IAM) y, a pesar de su baja incidencia (en gran parte gracias a la aparición de tratamientos de revascularización precoz eficaces como la angioplastia primaria), la gravedad que confieren necesita un rápido y acertado diagnóstico y un tratamiento precoz. Las tres clases principales de complicaciones mecánicas son las comunicaciones interventriculares tras el IAM, la rotura libre de pared de ventrículo izquierdo y la insuficiencia mitral aguda severa secundaria a rotura de músculo papilar. Su aparición suele ser precoz, dentro de las primeras 48 h desde el inicio de los síntomas del infarto y, generalmente, se asocia a enfermedad coronaria oclusiva en ausencia de colaterales. Su pronóstico es malo, con mortalidades de más del 50% y el tratamiento de elección es la cirugía, a pesar de que en determinados casos, como la comunicación interventricular, se están desarrollando técnicas percutáneas con resultados prometedores.
Palabras clave
A pesar de los avances de la medicina y del importante esfuerzo que se ha puesto en el estudio y el tratamiento de las enfermedades cardiovasculares en los últimos 50 años, la cardiopatía isquémica (CI) es una de las principales causas de morbilidad y mortalidad en el mundo y representa, junto con la enfermedad cerebrovascular, casi el 60% de la mortalidad cardiovascular total que, a su vez, es la principal causa de mortalidad en nuestro medio1. Las dos terceras partes de los fallecimientos por CI en los primeros 28 días tras un infarto suceden sin que los pacientes hayan llegado al hospital, y la muerte súbita es una de las principales formas de manifestación de la CI aguda2. Del tercio de pacientes restantes que fallecerá, la mitad lo hará en las primeras 24h tras su llegada al hospital3. De este importante grupo de fallecimientos precoces, una buena parte se debe a complicaciones mecánicas de la CI aguda.
Las complicaciones mecánicas son uno de los más indeseables y dramáticos contratiempos que pueden aparecer en el infarto agudo de miocardio (IAM). A pesar de su baja incidencia general, la gravedad que implican hace preciso un rápido y acertado diagnóstico y un tratamiento precoz. Hay tres modos principales de aparición de estas complicaciones mecánicas: la rotura del septo interventricular o comunicación interventricular tras el infarto, la rotura libre de la pared del ventrículo y la rotura del músculo papilar. Su incidencia ha disminuido progresivamente con la aparición de tratamientos que han permitido una reperfusión coronaria más precoz y eficaz4,5. A continuación se detallan las características más específicas de cada una de ellas.
ROTURA DEL SEPTO INTERVENTRICULAR O COMUNICACIÓN INTERVENTRICULARA la par que han aparecido tratamientos que han permitido mejorar la reperfusión de los pacientes con IAM con elevación del ST, la incidencia de la comunicación interventricular (CIV) tras el infarto ha disminuido, que pasó del 1-2% en la era pretrombolítica6,7 al 0,2% con el empleo de fármacos trombolíticos4, incluso con una incidencia menor con la generalización de la angioplastia primaria (ICP primaria)8. Su aparición oscila entre las primeras 24h y los 3 y 5 días desde el inicio de los síntomas9,10.
Factores de riesgoSe han asociado a una mayor incidencia de la CIV la localización anterior del IAM4,11, la hipertensión arterial, el sexo femenino, la edad avanzada12 y si se trata de un primer evento isquémico13,14; el desarrollo de colaterales es un factor protector15 (tabla 1). Recientemente se ha asociado el déficit de expresión de αE-catenina con el desarrollo de CIV tras el IAM; quedan aún por dilucidar los mecanismos que intervienen en esta hiporregulación16.
ClasificaciónEn función de su morfología, al igual que en las roturas libres de pared de ventrículo, se puede establecer cuatro tipos fundamentales17,18:
- –
Tipo I: trayectoria prácticamente recta con apenas sangre intramiocárdica.
- –
Tipo II: trayectoria multicanalicular irregular con disección miocárdica extensa e infiltrado de sangre.
- –
Tipo III: el orificio de la rotura está protegido por trombo o por pericardio (este último en el caso de las roturas libres de ventrículo y es lo que comúnmente se conoce como seudoaneurisma).
- –
Tipo IV: se produce una rotura incompleta, sin llegar a extenderse a todas las capas.
En función de la localización del IAM será más frecuente encontrar CIV en una u otra porción del septo. Así, en el caso de infartos anteriores, la localización más frecuente es apical, mientras que en el caso de infartos inferiores es más frecuente que sean posterobasales. En cuanto a su tamaño, éste puede oscilar entre pocos milímetros hasta varios centímetros19.
ClínicaLa presentación clínica más frecuente es la aparición de insuficiencia cardiaca biventricular; inicialmente predomina la insuficiencia cardiaca izquierda, como consecuencia del shunt izquierda-derecha que se genera tras la rotura del septo interventricular, que primero produce una sobrecarga de volumen en cavidades derechas, seguido de un hiperaflujo pulmonar con posterior sobrecarga en cavidades izquierdas que, unido a la probable disfunción ventricular generada por el infarto, reagudizaría la situación de insuficiencia cardiaca izquierda que predomina inicialmente en la clínica19. Así, los síntomas más frecuentes serán dolor torácico, disnea o shock cardiogénico. En la exploración física es típica la aparición de un soplo holosistólico, rudo, en el borde esternal izquierdo, en ocasiones acompañado de frémito.
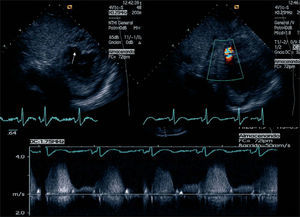
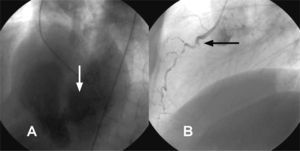
DiagnósticoEl ecocardiograma-Doppler transtorácico es la principal herramienta diagnóstica20 que permite establecer, además de la localización y la extensión de la CIV, la función ventricular, así como otras posibles complicaciones concomitantes, como puede ser la insuficiencia mitral (fig. 1). También se han mostrado de utilidad el ecocardiograma transesofágico o los estudios hemodinámicos, incluidos el cateterismo derecho e izquierdo, con ventriculografía y coronariografía, con vistas al posible tratamiento quirúrgico que incluya la revascularización coronaria (fig. 2).
Ecocardiograma transtorácico que muestra imagen subcostal del ventrículo izquierdo en eje corto, correspondiente a un varón de 70 años que presentó deterioro hemodinámico y soplo sistólico 2 días después de ingresar por infarto agudo de miocardio inferior; se aprecia tanto solución de continuidad de septo interventricular (flecha) como Doppler-color y continuo que confirman flujo desde el ventrículo izquierdo al derecho, correspondiente a comunicación interventricular tras el infarto.
Varón de 71 años que presenta infarto agudo de miocardio inferior complicado con insuficiencia cardiaca. A: imagen de ventriculografía en oblicua izquierda que muestra comunicación interventricular septomedial. B: oclusión aguda de la coronaria derecha proximal con imagen del muñón.
A menos que haya contraindicaciones, la cirugía urgente, incluido el bypass aortocoronario, es la técnica de elección (clase I, nivel de evidencia B y C, respectivamente)21,22, incluso aunque inicialmente el paciente permanezca estable, ya que la inestabilización brusca y el colapso hemodinámico posterior son la regla habitual.
La introducción de un balón de contrapulsación, además del empleo de fármacos inotrópicos y vasodilatadores junto con una monitorización invasiva, puede ayudar a la estabilización del paciente con vistas a una futura cirugía; está indicado prácticamente en todos los pacientes22. Además de estas técnicas, el empleo de dispositivos percutáneos de asistencia ventricular para mejorar el estado hemodinámico de determinados pacientes puede abrir una nueva puerta en el manejo del paciente con CIV tras infarto, antes de la cirugía de reparación23,24.
La mortalidad quirúrgica es alta, que oscila entre el 20 y el 50% según las series4,25,26, y es especialmente alta, como se vio en el registro SHOCK (Should we emergently revascularize Ocluded Coronaries in cardiogenic shock?) en el caso de los pacientes que entran en quirófano en situación de shock cardiogénico27. Cuando la decisión es únicamente tratamiento médico, la mortalidad llega hasta el 94%4.
Por último, aunque aún son limitados los pacientes tratados con dispositivos de cierre percutáneo, los resultados, a pesar de que la mortalidad sigue siendo alta, fundamentalmente en pacientes con shock cardiogénico (el 88% con shock frente al 38% sin shock), incitan a pensar que el mayor desarrollo de estos dispositivos y esta técnica acabará aportando una solución fiable a esta enfermedad28,29.
ROTURA DE LA PARED LIBRE DEL VENTRÍCULO IZQUIERDOLa incidencia de rotura de la pared libre del ventrículo izquierdo ha disminuido de forma significativa en los últimos años, del 6% en la era preintervencionista30 hasta menos del 1% con la aparición de la ICP primaria5,31. Aproximadamente, la mitad de las roturas se manifiestan como muerte súbita extrahospitalaria32, que representa el 8-17% de la mortalidad tras el IAM5,33. La cronología de la rotura de pared libre tiene 2 picos fundamentales: uno precoz, dentro de las primeras 24h del infarto y que es independiente del depósito del colágeno en la pared ventricular y del desarrollo de una cicatriz, y uno segundo, entre el tercero y el quinto día tras el infarto, más en relación con su extensión22,34,35.
Factores de riesgoLos principales factores de riesgo en relación con la rotura ventricular son la edad avanzada, el sexo femenino, un primer IAM, la ausencia de hipertrofia ventricular, la enfermedad monovaso oclusiva con infarto transmural secundario (aunque algunos autores la han relacionado más con la enfermedad multivaso32, parece más lógico pensar que, al igual que ocurre en el caso de las CIV tras infarto, la ausencia de colaterales, más asociada a enfermedad monovaso aguda, sería un factor más predisponente a la rotura), la localización anterior (fundamentalmente en los casos de presentación precoz), la elevación persistente del segmento ST, así como la angina persistente o recurrente, la hipertensión arterial en la fase aguda del infarto, el empleo de corticoides o antiinflamatorios no esteroideos o de fibrinolíticos más allá de las 14h del inicio de los síntomas (aunque en general la fibrinolisis disminuye el riesgo de rotura de pared, su empleo retrasado favorece su rotura precoz) (tabla 2)5,33,35–38.
Factores de riesgo para el desarrollo de una rotura libre de pared de ventrículo izquierdo
| Edad avanzada |
| Sexo femenino |
| Primer episodio de infarto |
| Ausencia de colaterales |
| Ausencia de hipertrofia venticular |
| Infarto agudo de miocardio transmural (asociado a enfermedad monovaso oclusiva) |
| Localización anterior |
| Hipertensión arterial durante la fase aguda |
| Uso de antiinflamatorios no esteroideos o corticoides en fase aguda |
| Uso de fibrinolíticos más allá de las 14h del inicio de los síntomas |
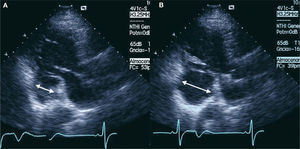
Como ya se adelantó en el apartado correspondiente a las CIV tras infarto, una clasificación mor fológica podría ser aquella que distingue entre cuatro tipos de rotura en función del recorrido y la afección de la pared ventricular; así se distingue la tipo 1, en la que el recorrido es más o menos directo; la tipo 2, en la que el trayecto es más o menos serpinginoso, con inicio y fin a alturas diferentes; la tipo 3, en la que la rotura estaría contenida por pericardio o por trombo, y la tipo 4, en la que no llega a producirse una rotura completa17,18. Inicialmente, esta clasificación englobaría otros términos o clasificaciones, como seudoaneurisma ventricular (fig. 3) o rotura simple o compleja18.
Imagen en plano paraesternal eje largo obtenida mediante ecocardiografía transtorácica en un varón de 64 años que había presentado infarto agudo de miocardio inferior complicado con derrame pericárdico; se evidencia en la zona inferobasal del ventrículo izquierdo una imagen de seudoaneurisma cuyo tamaño aumenta sustancialmente durante la sístole (B) y disminuye durante la diástole (A).
Además de la clasificación morfológica, también se puede establecer una clasificación en función del momento en que se produce la rotura (precoz, si es en las primeras 48h de los síntomas, o tardía, si es a partir de las 48h) y el modo de presentación (aguda o subaguda)38.
ClínicaEn función de la aparición, si es de forma aguda o subaguda, variará el modo de presentación. Así, en los casos de que sea aguda, la clínica más frecuente será la de muerte súbita secundaria a un hemopericardio masivo con hipotensión severa y disociación electromecánica38,39. En los casos en que la rotura se produzca de forma subaguda o el paciente sobreviva a la fase inicial, los síntomas más frecuentes serán dolor torácico, hipotensión, síncope, agitación, náuseas o vómitos38,40.
DiagnósticoLa principal herramienta diagnóstica es el ecocardiograma-Doppler, siendo el principal hallazgo la presencia de un derrame pericárdico masivo. La identificación de trombo en el pericardio, junto con un movimiento anormal de la pared del ventrículo, es un dato que aumenta la especificidad. El empleo de agentes de contraste puede determinar extravasación de éstos al pericardio; de este modo, se confirma la rotura de la pared37,41. En las situaciones en que el paciente se encuentre más estable, se puede realizar una coronariografía con vistas a una posible revascularización quirúrgica ulterior.
TratamientoActualmente, el tratamiento de elección es la cirugía, tanto en los casos de rotura libre como en los que se produce una rotura contenida (seudoaneurisma), dado el elevado riesgo a que ésta evolucione de forma fatal (clase I, nivel de evidencia B), igualmente, siempre que pueda ser posible, hay que realizar una revascularización coronaria quirúrgica (clase I, nivel de evidencia C)22.
En los casos en que se produzca un colapso hemodinámico, estará indicada una pericardiocentesis evacuadora inicial, como puente a una cirugía reparadora ulterior, además del empleo de fluidoterapia y fármacos inotrópicos positivos. Figueras et al38 postularon un esquema terapéutico en el que predominaba el manejo conservador, y recomiendan cirugía urgente sólo en las situaciones de manifestación aguda en que el paciente permaneciese inestable a pesar de la pericardiocentesis y el tratamiento médico inicial.
A pesar de que las series comunicadas de esta enfermedad no son demasiado extensas, la mortalidad de los pacientes que se someten a cirugía es elevada, por encima del 60%42,43.
INSUFICIENCIA MITRAL TRAS INFARTOLa incidencia de insuficiencia mitral tras IAM es alta, llegando, según las series, hasta el 74%44; su espectro clínico es muy variado, pasando desde la insuficiencia mitral leve secundaria a isquemia transitoria y sin apenas repercusión clínica hasta la insuficiencia mitral severa, con importante repercusión clínica y mal pronóstico45–48. A pesar de todos estos espectros, la insuficiencia mitral, cualquiera que sea su grado, aparece como un predictor de mortalidad y eventos cardiovasculares a largo plazo, como ya se vio en el ensayo SAVE (Survival and Ventricular Enlargement)45. Con la aparición en las últimas décadas de técnicas de reperfusión eficaces, su incidencia ha disminuido, y se atribuye un mayor beneficio a la ICP primaria frente a la fibrinolisis, tanto en la incidencia de la insuficiencia mitral en la fase aguda del infarto49 como en su evolución durante el seguimiento50.
Hay distintos mecanismos por los que se produce la insuficiencia mitral tras el infarto, como la insuficiencia mitral restrictiva secundaria a remodelado en el ventrículo y tethering de las valvas mitrales, la restrictiva secundaria a isquemia aguda del miocardio afecto (en estos casos la ICP de la arteria implicada ha mostrado poder aportar soluciones óptimas51), aquella secundaria a dilatación del anillo por disfunción ventricular importante, el empeoramiento de una insuficiencia mitral pre existente o aquellas que se producen, bien por la rotura de cuerdas tendinosas o, bien, por la rotura, total o parcial, de un músculo papilar45,48,52. De entre todos ellos, a continuación se tratará de detallar aquella secundaria a la rotura de músculo papilar.
Rotura de músculo papilarLa rotura de músculo papilar tras infarto es una complicación mecánica grave que produce una insuficiencia mitral aguda severa, que se considera una emergencia quirúrgica, con una mortalidad próxima al 50% en el caso de los pacientes que debutan con shock cardiogénico, oscilando entre el 40%, en el caso de aquellos pacientes que se someten a cirugía, y el 70% en el caso de aquellos en los que se opta por el tratamiento médico53.
La rotura suele producirse habitualmente unos días después del infarto (entre 1 y 14 días) y es mucho más frecuente que se produzca en el músculo posteromedial que en el anterolateral, ya que este último recibe riego coronario de dos arterias (descendente anterior y circunfleja), frente a una en el caso del posteromedial (coronaria derecha)40,54,55.
Factores de riesgoLos principales factores de riesgo relacionados con la rotura de músculo papilar son la edad avanzada, el sexo femenino, la localización inferoposterior del infarto con oclusión completa monovaso y la ausencia de diabetes mellitus40,48 (tabla 3).
ClínicaHabitualmente, la rotura de músculo papilar debuta en forma de edema agudo de pulmón secundario a la insuficiencia mitral masiva aguda que se genera, y que deriva, en muchas ocasiones, en shock cardiogénico secundario. Al contrario de lo que podría parecer, sólo en el 50% de los casos se encuentra un soplo holosistólico de nueva aparición, que se diferenciará fundamentalmente del que aparece en el caso de la CIV tras infarto por la ausencia de frémito48,56.
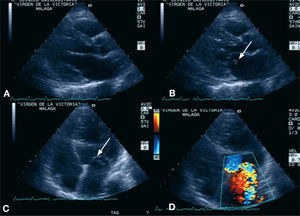
DiagnósticoLa principal herramienta diagnóstica será el ecocardiograma-Doppler que, en múltiples ocasiones, llega a demostrar el prolapso del músculo papilar en el interior de la aurícula izquierda; la técnica transtorácica es la mejor aproximación inicial56,57 (fig. 4). En muchas ocasiones, es necesario un ecocardiograma transesofágico para definir bien el mecanismo de la insuficiencia mitral aguda, especialmente en los casos en que haya dudas acerca de la rotura del músculo papilar58.
Siempre que sea posible será necesario realizar una coronariografía con vistas a determinar qué arterias se deberá revascularizar en la cirugía ulterior22.
TratamientoEl tratamiento de elección en los casos de insuficiencia mitral aguda secundaria a rotura (total o parcial) de músculo papilar es el quirúrgico (clase I, nivel de evidencia B); en la mayoría de los casos, es necesaria la sustitución valvular y sólo en unos cuantos casos seleccionados, la reparación quirúrgica; estando indicada, en el mismo procedimiento, la revascularización coronaria (clase I, nivel de evidencia B)22.
Inicialmente se tratará de estabilizar hemodinámicamente al paciente, empleando para ello tanto tratamiento médico (fármacos que reducen la poscarga, diuréticos o inotrópicos en los casos en que sea necesario) como medidas mecánicas (balón de contrapulsación, asistencia respiratoria)48. Incluso en los casos en que la respuesta inicial al tratamiento médico sea muy favorable, la cirugía continuará siendo la técnica de elección, debido al pobre pronóstico de los pacientes que reciben tratamiento médico59. Aunque la mortalidad de los pacientes sometidos a esta cirugía no es baja, y puede ser de hasta el 40%53, la supervivencia a largo plazo es buena, llegando a ser del 60-70% a 5 años22,55,60.
CONCLUSIONESEn resumen, las complicaciones mecánicas del IAM son situaciones muy graves, con una alta mortalidad, cuya incidencia ha disminuido en los últimos años con la introducción de tratamientos de reperfusión, especialmente la ICP primaria. El diagnóstico rápido y adecuado es fundamental para ofrecer un tratamiento, en la gran mayoría de los casos, quirúrgico que, a pesar de tener alta mortalidad, supera ampliamente la opción médica definitiva. La cardiología intervencionista tiene un papel fundamentalmente diagnóstico, con vistas a la futura cirugía, en ocasiones estabilizador (dispositivos percutáneos de asistencia ventricular), también con vistas a la futura cirugía y que sólo en el caso de la CIV tras el IAM podría tener un papel más activo, aún con un largo camino por recorrer.
A la Dra. Rodríguez-Bailón, responsable del Área de Ecocardiografía del Hospital Virgen de la Victoria de Málaga, por su imprescindible y desinteresada aportación iconográfica.