El objetivo del estudio es evaluar el efecto de aliskireno en la rigidez aórtica del paciente con síndrome de Marfan (SM).
MétodosSe reclutó a 28 pacientes con SM (media ± desviación estándar de edad, 32,6 ± 10,6 años) entre noviembre de 2009 y octubre de 2014. Todos estaban tratados con atenolol como terapia estándar con bloqueadores beta. Mediante un proceso prospectivo de aleatorización, se asignó a los participantes a tratamiento con aliskireno (150-300 mg/día vía oral) o sin tratamiento con aliskireno (controles negativos) en un diseño de etiquetado abierto. Se examinaron al inicio y a las 24 semanas la distensibilidad aórtica central y la velocidad de la onda de pulso (PWV) cuantificadas con resonancia magnética (RM), la PWV periférica, la presión aórtica central y el índice de aumento medidos por tonometría y la dilatación aórtica por ecocardiografía. El objetivo primario fue la distensibilidad aórtica central por RM.
ResultadosEn el análisis de la diferencia entre el examen basal y a las 24 semanas en el grupo tratado frente a los controles negativos, la distensibilidad aórtica central (general; p = 0,26) y la PWV central (0,2 ± 0,9 frente a 0,03 ± 0,7 m/s; p = 0,79) medidas con RM no fueron significativas. La presión sistólica central en la aorta era de 14 mmHg, menor en los pacientes tratados que en los controles (p = 0,09). Se observó una reducción significativa de la PWV periférica (brazo-tobillo) en el grupo tratado (–1,6 m/s) respecto a los controles (+0,28 m/s; p = 0,005).
ConclusionesEn los pacientes con SM, la incorporación de aliskireno a los bloqueadores beta no mejora la rigidez de la aorta central a las 24 semanas de tratamiento.
Palabras clave
El síndrome de Marfan (SM) es un trastorno hereditario del tejido conjuntivo causado por una mutación del gen de la fibrilina 1 (FBN1), que causa morbilidad y mortalidad como consecuencia de la dilatación y disección de la aorta1,2. Se ha propuesto el uso de bloqueadores beta como tratamiento estándar para este síndrome. Sin embargo, el grado de dilatación de la aorta y la respuesta a los bloqueadores beta muestran gran diversidad en los adultos con SM3.
La fibrilina 1 anormal o deficitaria probablemente afecte a la integridad estructural de la matriz extracelular y puede aumentar la liberación del factor de crecimiento transformador beta (TGF–β) activo4, lo que da lugar a un engrosamiento aberrante de la media de la aorta, con fragmentación y desorden de las fibras elásticas. El TGF-β interviene en la patogenia del SM y causa la rigidez de la aorta. Se ha demostrado que hay una interrelación entre el sistema del TGF-β y el sistema renina-angiotensina (SRA). Se sabe que el antagonista del receptor de la angiotensina II (ARA-II) losartán inhibe la señalización del TGF-β, y un tratamiento sistémico con un anticuerpo neutralizante del TGF-β o un ARA-II atenuó o evitó la aparición de cambios patológicos en la pared de la aorta y la dilatación progresiva de la raíz aórtica en un modelo del SM en el ratón5,6. En un pequeño estudio de cohorte, un tratamiento con ARA-II (losartán o irbesartán) redujo significativamente la tasa de dilatación aórtica progresiva en los pacientes con SM después de que un tratamiento con un bloqueador beta no hubiera logrado prevenir la dilatación de la raíz de la aorta7. Sin embargo, los ensayos aleatorizados amplios han mostrado discrepancias en el efecto del losartán en el crecimiento aórtico, y todavía hay controversia respecto al efecto de este fármaco en los pacientes con SM8–11.
El aliskireno es un inhibidor directo de la renina y forma parte de una nueva clase de inhibidores del SRA. Hay alguna evidencia de que el aliskireno inhibe la expresión y la producción de TGF-β en estudios realizados in vitro, in vivo y en el ámbito clínico12–14. Hasta la fecha, no se ha realizado ningún ensayo clínico prospectivo y aleatorizado en el que se haya investigado el efecto beneficioso del aliskireno en el tratamiento del SM.
La rigidez arterial es un conocido predictor de dilatación aórtica15 y complicaciones cardiovasculares en diversas enfermedades cardiovasculares16. Se trata de uno de los más tempranos signos detectables de las alteraciones estructurales y funcionales que se producen en la pared vascular17–19. Los tratamientos antihipertensivos han mostrado una mejora de la rigidez aórtica en ensayos de corta duración, de menos de 4 semanas20–22. La distensibilidad aórtica, la velocidad de onda del pulso (PWV) central, la PWV carotídea-femoral y el índice de aumento son parámetros útiles para evaluar la rigidez aórtica23,24. La rigidez aórtica está relacionada con el crecimiento de la aorta y el pronóstico en el SM. El tratamiento con bloqueadores beta en el SM redujo la distensibilidad aórtica y la PWV25. Tanto el diámetro aórtico como la distensibilidad de la aorta son factores independientes predictivos de la dilatación aórtica progresiva en el SM15. La PWV central regional y la distensibilidad aórtica están aumentadas en los pacientes con SM y han mostrado una especificidad moderada o alta en la predicción de la ausencia de crecimiento luminal aórtico, con valor pronóstico demostrado26. En consecuencia, la rigidez aórtica es un objetivo terapéutico lógico en los adultos con SM.
En este estudio se investigó si el aliskireno reduce de manera significativa la rigidez aórtica de los pacientes con SM tratados con atenolol en comparación con los controles negativos.
MÉTODOSDiseño y población del estudioSe realizó un estudio prospectivo y aleatorizado en un único centro. Se aleatorizó a los participantes al grupo de tratamiento con aliskireno o al grupo de control negativo, con un diseño de estudio abierto. La duración del estudio fue 24 semanas. El aliskireno se administró a los pacientes del grupo de tratamiento a una dosis oral de 150 a 300 mg/día. La administración de la medicación se inició después de un estudio basal con una dosis de 150mg de aliskireno, que se aumentó a 300mg a las 4 semanas de la evaluación de la tolerabilidad y la presencia de eventos adversos. Los pacientes dejaron de tomar aliskireno en caso de que se produjeran eventos adversos graves. Se consideró una reducción de la dosis para los pacientes que presentaron hiperpotasemia, elevación de la creatinina sérica al doble de los valores iniciales, hipotensión sintomática, gota o cálculos renales. La reducción de la dosis a 150mg tras el aumento se llevó a cabo por decisión de los investigadores si el paciente refería molestias y efectos adversos probablemente relacionados con la medicación.
Se incluyó a pacientes con SM del Centro Médico Samsung entre noviembre de 2009 y octubre de 2014. Todos los pacientes recibían atenolol como tratamiento bloqueador beta estándar. Todos dieron su consentimiento informado por escrito para participar en el estudio, que recibió la aprobación del comité ético de investigación del centro. Este ensayo se registró en ClinicalTrial.gov (Identificador: NCT01715207).
Los criterios de inclusión fueron: edad de 14 a 55 años, un diagnóstico de SM según los criterios de Gante, tratamiento bloqueador beta durante un mínimo de 3 meses y ausencia de tratamiento crónico con inhibidores del SRA (es decir, ARA-II o inhibidores de la enzima de conversión de la angiotensina) durante los 90 días previos al examen de selección. Los criterios de exclusión fueron los siguientes: antecedentes médicos de cirugía aórtica o disección de aorta, valvulopatía significativa con necesidad de cirugía, dimensión de la raíz aórtica > 5,0cm, disfunción renal (creatinina > límite superior de la normalidad), embarazo o previsión de embarazo en un plazo de 12 meses tras la inclusión en el estudio o lactancia materna actual, estenosis arterial renal conocida, hipersensibilidad al aliskireno o cualquiera de los excipientes, elevación de la creatinina sérica durante el seguimiento (> 30% del valor inicial), diarrea causante de deshidratación grave, aparición de gota o cálculos ureterales, hipotensión sintomática (presión arterial sistólica < 90mmHg con síntomas), hiperpotasemia y tratamiento concomitante con ciclosporina A.
Seguimiento y resultados clínicosTodos los pacientes incluidos fueron objeto de un seguimiento clínico para verificar los efectos adversos como angioedema, síntomas gastrointestinales, erupción, gota, hipotensión y cálculos renales en el examen inicial y tras 1, 4, 8, 16 y 24 semanas. Se obtuvieron los datos de electrocardiogramas y los siguientes datos de análisis de laboratorio y durante el mismo periodo: potasio, creatinina, ácido úrico y análisis de orina. La evaluación ecocardiográfica, las mediciones tonométricas periféricas de la PWV periférica, la presión arterial aórtica central y el índice de aumento, y la cardiorresonancia magnética (CRM) se analizaron en la situación inicial y a las 24 semanas de tratamiento.
Se obtuvo información relativa a la seguridad registrando todos los eventos adversos y todos los eventos adversos graves. Se requirió rellenar un formulario específico de acontecimientos adversos graves ante todo evento adverso grave que se produjera durante el estudio. Todos ellos fueron evaluados por los investigadores y se comunicaron a la unidad de recepción de datos de seguridad de Novartis antes de 24 h.
El objetivo principal fue la evaluación de la distensibilidad aórtica central mediante CRM a las 24 semanas, y se expresó mediante el cambio durante el periodo de 24 semanas tras la asignación aleatoria. Los objetivos secundarios fueron la PWV aórtica central determinada mediante CRM, el cambio de la presión arterial aórtica central (en adelante, presión arterial aórtica), el índice de aumento, la PWV periférica determinada mediante tonometría, el diámetro de la raíz aórtica y la gravedad de la insuficiencia aórtica determinadas mediante ecocardiografía y la disección/rotura/operación del aneurisma.
Diagnóstico por imagen cardiovascular: ecocardiografía y cardiorresonancia magnéticaCardiorresonancia magnéticaLa CRM se llevó a cabo mediante un escáner de 1,5 T (Magnetom Avanto, Syngo MR, Siemens Medical Solutions; Erlangen, Alemania). Se midió el diámetro aórtico a 4 niveles clave: nivel 1, la aorta ascendente a la altura de la bifurcación de la arteria pulmonar; nivel 2, la parte superior de la aorta torácica descendente a la altura de la bifurcación de la arteria pulmonar; nivel 3, la parte inferior de la aorta torácica descendente a la altura del diafragma, y nivel 4, la aorta abdominal inmediatamente por encima de la bifurcación iliaca. Se obtuvieron imágenes en vídeo a los mismos niveles para medir la rigidez aórtica.
Análisis de la cardiorresonancia magnética: distensibilidad aórtica central y velocidad de la onda de pulso aórtica centralEvaluadores con experiencia realizaron los análisis de las CRM con un programa informático comercial (Argus versión 4.02, Siemens Medical Systems; Alemania), sin disponer de información sobre el paciente. La distensibilidad aórtica central y la PWV aórtica se midieron con un método adecuadamente validado utilizando CRM24,27. Distensibilidad = (Amáx – Amín) / [Amín × (Pmáx – Pmín)] (10–3 mmHg–1), donde Amáx es el área aórtica (sistólica) máxima, Amín es el área aórtica (diastólica) mínima, Pmáx es la presión arterial sistólica y Pmín, la presión arterial diastólica. Se utilizó la presión arterial aórtica central, medida de manera no invasiva con SphygmoCor para las presiones arteriales sistólica y diastólica. La PWV se midió en 2 regiones: la aorta proximal (PWV proximal entre los niveles 1 y 2) y en la totalidad de la aorta (PWV total entre los niveles 1 y 4).
Medición del índice de aumento, la presión arterial aórtica y la velocidad de la onda de pulso periféricaEl análisis de la onda del pulso se llevó a cabo de manera no invasiva con el sistema SphygmoCor (AtCor Medical; Sydney, Australia). Se registraron las ondas de presión periférica de la arteria radial en la muñeca, utilizando tonometría por aplanamiento, con un micromanómetro de alta fidelidad. Tras la adquisición secuencial de 20 ondas, se generó una onda de presión aórtica central validada mediante la fórmula matemática que utiliza una transformación de Fourier rápida que proporcionaba un algoritmo aprobado por la Food and Drug Administration de Estados Unidos28. A partir de la presión aórtica central, se calcularon el índice de aumento y el índice de aumento ajustado según la frecuencia cardiaca a 75 lpm.
Se midieron simultáneamente los valores de PWV de brazo-tobillo en cada participante utilizando un dispositivo de examen vascular para tonometría por aplanamiento (VP-2000; Colin Medical Technology; Komaki, Japón)29.
EcocardiografíaLas mediciones de la raíz aórtica se realizaron con el método de borde externo a borde interno de la pared aórtica en telediástole durante hasta 5 ciclos y se promediaron. La puntuación Z correspondía a la desviación estándar del diámetro de los senos de Valsalva normalizada respecto al área de superficie corporal y la edad del paciente30.
Análisis estadísticoLas variables cuantitativas se presentan en forma de media ± desviación estándar. En las comparaciones de los 2 grupos, se utilizó la prueba de la U de Mann-Whitney para las variables continuas y la prueba exacta de Fisher para las variables discretas. Se consideraron estadísticamente significativos los valores de p < 0,05. Se comparó el cambio de la distensibilidad aórtica central a las 24 semanas respecto al valor inicial de los grupos de control negativo y de tratamiento con aliskireno9 mediante ecuaciones de estimación generalizada, para tener en cuenta las mediciones repetidas y otros posibles efectos de confusión derivados de la presión arterial, la edad y el sexo. Otros objetivos secundarios se analizaron por comparación simple de los 2 grupos con la prueba de la U de Mann-Whitney.
Dado que la PWV depende en gran medida de los valores de presión arterial, que se redujeron durante el tratamiento, se introdujo un ajuste del cambio de la PWV periférica a las 24 semanas respecto al valor basal en un modelo lineal que incluía los cambios de la presión arterial sistólica, la presión arterial diastólica, el sexo y la edad.
Todos los análisis se llevaron a cabo con el programa SPSS, versión 20.0 (SPSS Inc.; Chicago, Illinois, Estados Unidos) y el programa R versión 3.1.3.
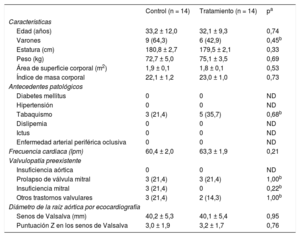
RESULTADOSCaracterísticas clínicas basalesEntre noviembre de 2009 y octubre de 2014, se incluyó a 28 pacientes (media de edad, 32,6 ± 10,6 años; 15 varones [53,6%]) y se los asignó aleatoriamente al grupo de tratamiento con aliskireno o al grupo de control negativo (n = 14 por grupo). Todos los pacientes recibían atenolol como tratamiento bloqueador beta estándar, al que luego se añadió aliskireno en el grupo de tratamiento. La dosis media de atenolol fue de 47,3 ± 20,9mg en el grupo de tratamiento con aliskireno y 50,0 ± 19,6mg en el grupo de control negativo (p = 0,73). Se añadió el aliskireno a los 14 pacientes del grupo de tratamiento, y la dosis media utilizada fue 289,3 ± 40,1mg.
En la tabla 1 se muestran las variables en la situación inicial. Los resultados clínicos en los grupos de tratamiento con aliskireno y de control negativo fueron similares. El diámetro aórtico medio a la altura de los senos de Valsalva fue de 40,1 ± 5,4 frente a 40,2 ± 5,3mm (p = 0,95) en la situación inicial, con medias de puntuación Z de 3,2 ± 1,7 frente a 3,0 ± 1,9 (p = 0,76) respectivamente. Los trastornos valvulares preexistentes no mostraron diferencias significativas entre los grupos.
Características clínicas iniciales de la población del estudio
| Control (n = 14) | Tratamiento (n = 14) | pa | |
|---|---|---|---|
| Características | |||
| Edad (años) | 33,2 ± 12,0 | 32,1 ± 9,3 | 0,74 |
| Varones | 9 (64,3) | 6 (42,9) | 0,45b |
| Estatura (cm) | 180,8 ± 2,7 | 179,5 ± 2,1 | 0,33 |
| Peso (kg) | 72,7 ± 5,0 | 75,1 ± 3,5 | 0,69 |
| Área de superficie corporal (m2) | 1,9 ± 0,1 | 1,8 ± 0,1 | 0,53 |
| Índice de masa corporal | 22,1 ± 1,2 | 23,0 ± 1,0 | 0,73 |
| Antecedentes patológicos | |||
| Diabetes mellitus | 0 | 0 | ND |
| Hipertensión | 0 | 0 | ND |
| Tabaquismo | 3 (21,4) | 5 (35,7) | 0,68b |
| Dislipemia | 0 | 0 | ND |
| Ictus | 0 | 0 | ND |
| Enfermedad arterial periférica oclusiva | 0 | 0 | ND |
| Frecuencia cardiaca (lpm) | 60,4 ± 2,0 | 63,3 ± 1,9 | 0,21 |
| Valvulopatía preexistente | |||
| Insuficiencia aórtica | 0 | 0 | ND |
| Prolapso de válvula mitral | 3 (21,4) | 3 (21,4) | 1,00b |
| Insuficiencia mitral | 3 (21,4) | 0 | 0,22b |
| Otros trastornos valvulares | 3 (21,4) | 2 (14,3) | 1,00b |
| Diámetro de la raíz aórtica por ecocardiografía | |||
| Senos de Valsalva (mm) | 40,2 ± 5,3 | 40,1 ± 5,4 | 0,95 |
| Puntuación Z en los senos de Valsalva | 3,0 ± 1,9 | 3,2 ± 1,7 | 0,76 |
ND: no disponible.
Los valores expresan n (%) o media ± desviación estándar.
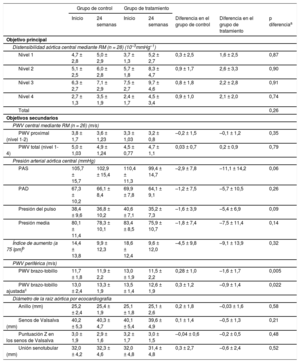
Se evaluó la distensibilidad aórtica central (10–3 mmHg–1) y la PWV central (m/s) mediante RM en la situación inicial y a las 24 semanas en 26 pacientes (tabla 2). No se pudo evaluar los datos de RM de 2 pacientes debido a la mala calidad de las imágenes. El cambio respecto la situación inicial de la distensibilidad aórtica central a las 24 semanas en el grupo de tratamiento con aliskireno indicó una mejora en todos los niveles evaluados (nivel 1, 1,6; nivel 2, 2,6; nivel 3, 2,2; nivel 4, 2,1 [10–3 mmHg–1]), mientras que los valores observados en el grupo de control negativo mejoraron tan solo marginalmente (nivel 1, 0,3; nivel 2, 0,9; nivel 3, 0,8; nivel 4, 0,9 [10–3 mmHg–1]). La diferencia de la distensibilidad central entre la situación inicial y las 24 semanas mostró tendencia a mayor mejora en el grupo de tratamiento con aliskireno que en el de control negativo. Sin embargo, tras un ajuste respecto a los factores de confusión con ecuaciones de estimación generalizada, se observó que las diferencias de distensibilidad estaban relacionadas principalmente con la presión arterial sistólica, la edad y el sexo, mientras que la diferencia entre los grupos era mínima y no alcanzaba significación estadística (p = 0,262 para el conjunto de todos los niveles). En consecuencia, las diferencias de la PWV central determinadas con la RM en la semana 24 frente a la inicial no difirieron significativamente entre el grupo de tratamiento con aliskireno y el de control negativo.
Efecto del aliskireno en los parámetros de rigidez arterial, presión arterial y diámetro de la raíz aórticaa
| Grupo de control | Grupo de tratamiento | ||||||
|---|---|---|---|---|---|---|---|
| Inicio | 24 semanas | Inicio | 24 semanas | Diferencia en el grupo de control | Diferencia en el grupo de tratamiento | p diferenciaa | |
| Objetivo principal | |||||||
| Distensibilidad aórtica central mediante RM (n = 28) (10–3mmHg–1) | |||||||
| Nivel 1 | 4,7 ± 2,8 | 5,0 ± 2,9 | 3,7 ± 1,3 | 5,2 ± 2,7 | 0,3 ± 2,5 | 1,6 ± 2,5 | 0,87 |
| Nivel 2 | 5,1 ± 2,5 | 6,0 ± 2,8 | 5,7 ± 1,8 | 8,3 ± 4,7 | 0,9 ± 1,7 | 2,6 ± 3,3 | 0,90 |
| Nivel 3 | 6,3 ± 2,7 | 7,1 ± 2,9 | 7,5 ± 2,7 | 9,7 ± 4,6 | 0,8 ± 1,8 | 2,2 ± 2,8 | 0,91 |
| Nivel 4 | 2,7 ± 1,3 | 3,5 ± 1,9 | 2,4 ± 1,7 | 4,5 ± 3,4 | 0,9 ± 1,0 | 2,1 ± 2,0 | 0,74 |
| Total | 0,26 | ||||||
| Objetivos secundarios | |||||||
| PWV central mediante RM (n = 26) (m/s) | |||||||
| PWV proximal (nivel 1-2) | 3,8 ± 1,7 | 3,6 ± 1,23 | 3,3 ± 1,03 | 3,2 ± 0,8 | –0,2 ± 1,5 | –0,1 ± 1,2 | 0,35 |
| PWV total (nivel 1-4) | 5,0 ± 1,03 | 4,9 ± 1,24 | 4,5 ± 0,77 | 4,7 ± 1,1 | 0,03 ± 0,7 | 0,2 ± 0,9 | 0,79 |
| Presión arterial aórtica central (mmHg) | |||||||
| PAS | 105,7 ± 15,7 | 102,9 ± 15,4 | 110,4 ± 11,3 | 99,4 ± 14,7 | –2,9 ± 7,8 | –11,1 ± 14,2 | 0,06 |
| PAD | 67,3 ± 10,2 | 66,1 ± 8,4 | 69,9 ± 7,8 | 64,1 ± 9,1 | –1,2 ± 7,5 | –5,7 ± 10,5 | 0,26 |
| Presión del pulso | 38,4 ± 9,6 | 36,8 ± 10,2 | 40,6 ± 7,1 | 35,2 ± 7,3 | –1,6 ± 3,9 | –5,4 ± 6,9 | 0,09 |
| Presión media | 80,1 ± 11,4 | 78,3 ± 10,1 | 83,4 ± 8,5 | 75,9 ± 10,7 | –1,8 ± 7,4 | –7,5 ± 11,4 | 0,14 |
| Índice de aumento (a 75 lpm)b | 14,4 ± 13,8 | 9,9 ± 12,3 | 18,6 ± 12,4 | 9,6 ± 12,0 | –4,5 ± 9,8 | –9,1 ± 13,9 | 0,32 |
| PWV periférica (m/s) | |||||||
| PWV brazo-tobillo | 11,7 ± 1,8 | 11,9 ± 2,2 | 13,0 ± 1,9 | 11,5 ± 2,2 | 0,28 ± 1,0 | –1,6 ± 1,7 | 0,005 |
| PWV brazo-tobillo ajustadac | 13,0 ± 2,4 | 13,3 ± 1,9 | 13,5 ± 1,4 | 12,6 ± 1,9 | 0,3 ± 1,2 | –0,9 ± 1,4 | 0,022 |
| Diámetro de la raíz aórtica por ecocardiografía | |||||||
| Anillo (mm) | 25,2 ± 2,4 | 25,4 ± 1,9 | 25,1 ± 1,8 | 25,1 ± 2,6 | 0,2 ± 1,8 | –0,03 ± 1,6 | 0,58 |
| Senos de Valsalva (mm) | 40,2 ± 5,3 | 40,3 ± 4,7 | 40,1 ± 5,4 | 39,6 ± 4,9 | 0,1 ± 1,4 | –0,5 ± 1,3 | 0,21 |
| Puntuación Z en los senos de Valsalva | 3,0 ± 1,9 | 2,9 ± 1,6 | 3,2 ± 1,7 | 3,0 ± 1,5 | –0,04 ± 0,6 | –0,2 ± 0,5 | 0,48 |
| Unión senotubular (mm) | 32,0 ± 4,2 | 32,3 ± 4,6 | 32,0 ± 4,8 | 31,4 ± 4,8 | 0,3 ± 2,7 | –0,6 ± 2,4 | 0,52 |
PAD: presión arterial diastólica; PAS: presión arterial sistólica; PWV: velocidad de la onda de pulso; RM: resonancia magnética.
La comparación del cambio de la presión arterial aórtica central determinada mediante el dispositivo SphygmoCor entre la situación inicial y las 24 semanas mostró que la presión arterial aórtica sistólica de los pacientes del grupo de tratamiento con aliskireno tendía a ser inferior (–11,1 mmHg) a la del grupo de control (-2,9mmHg); sin embargo, esta diferencia no alcanzó significación estadística (p = 0,09) (tabla 2).
La diferencia entre la situación inicial y las 24 semanas respecto a la PWV periférica medida con la PWV de brazo-tobillo (de 13,0 ± 1,9 m/s en la situación inicial a 11,5 ± 1,8 m/s a las 24 semanas en el grupo de tratamiento con aliskireno y de 11,7 ± 2,2 a 11,9 ± 2,2 m/s en el grupo de control negativo; p = 0,005) puso de manifiesto una disminución significativa en el grupo de tratamiento con aliskireno (tabla 2). Al ajustar un modelo lineal a la PWV periférica por lo que respecta a la presión arterial sistólica, la presión arterial diastólica y la edad, la siguiente relación explicaba el 72% de la varianza interindividual basal en el conjunto de todos los pacientes: PWV periférica (m/s) = –3,11 + 0,087 presión arterial sistólica (mmHg) + 0,065 presión arterial diastólica (mmHg) + 0,055 edad (años). Esto significa que la disminución puede explicarse fundamentalmente por una reducción de la presión arterial con el tratamiento, ya que se sabe que el tratamiento tiene un efecto de reducción de la presión arterial. En consecuencia, se intentó explicar la disminución de la PWV periférica respecto a estos efectos de confusión mediante un modelo lineal. El cambio de la PWV periférica a las 24 semanas respecto a la situación inicial se explicaba de manera significativa por las diferencias de presión arterial sistólica, edad y sexo con un valor de R2 del 82%. Sin embargo, incluso tras la eliminación de estas influencias, la diferencia entre los 2 grupos fue de aproximadamente 1,2 m/s y muy significativa (p = 0,022) (tabla 2).
Diámetros de la raíz de la aorta por ecocardiografíaEn el examen inicial, todas las variables ecocardiográficas de los 2 grupos eran comparables (tabla 2). La disminución de los diámetros de la raíz aórtica correspondientes al anillo (p = 0,58), los senos de Valsalva (p = 0,21) y la unión senotubular (p = 0,52) no mostraron una atenuación significativa en el grupo de tratamiento con aliskireno, y la diferencia de la puntuación Z en los senos de Valsalva entre la situación inicial y a las 24 semanas tampoco difirió significativamente entre los 2 grupos (p = 0,48).
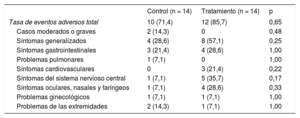
Eventos adversosEl número de pacientes que sufrieron eventos adversos fue mayor en el grupo de tratamiento con aliskireno, pero no hubo una diferencia significativa entre el grupo de aliskireno y el de control en la tasa general de eventos adversos (n = 12 [85,7%] frente a n = 10 [71,4%]) (tabla 3). En cuanto a las manifestaciones de cualquiera de los efectos adversos, la mayoría de los pacientes refirieron síntomas leves. Se produjeron eventos adversos moderados o graves en 2 pacientes (14,3%) del grupo de control y ninguno del grupo de tratamiento. Estos episodios consistieron en 1 caso de hernia inguinal derecha y 1 de neumotórax izquierdo, pero se consideró que ninguno estaba relacionado con la administración de aliskireno.
Eventos adversos totales y graves entre los pacientes de los grupos de control y de tratamiento
| Control (n = 14) | Tratamiento (n = 14) | p | |
|---|---|---|---|
| Tasa de eventos adversos total | 10 (71,4) | 12 (85,7) | 0,65 |
| Casos moderados o graves | 2 (14,3) | 0 | 0,48 |
| Síntomas generalizados | 4 (28,6) | 8 (57,1) | 0,25 |
| Síntomas gastrointestinales | 3 (21,4) | 4 (28,6) | 1,00 |
| Problemas pulmonares | 1 (7,1) | 0 | 1,00 |
| Síntomas cardiovasculares | 0 | 3 (21,4) | 0,22 |
| Síntomas del sistema nervioso central | 1 (7,1) | 5 (35,7) | 0,17 |
| Síntomas oculares, nasales y faríngeos | 1 (7,1) | 4 (28,6) | 0,33 |
| Problemas ginecológicos | 1 (7,1) | 1 (7,1) | 1,00 |
| Problemas de las extremidades | 2 (14,3) | 1 (7,1) | 1,00 |
Los valores expresan n (%).
El principal resultado de este estudio es que el tratamiento con aliskireno durante 24 semanas no redujo la rigidez aórtica central de los pacientes con SM en tratamiento con bloqueadores beta estándar en comparación con un tratamiento de control negativo. No se observa la ventaja esperada del tratamiento con aliskireno, aunque sí se aprecia una diferencia significativa favorable a este en la PWV de brazo-tobillo, que podría deberse a una reducción de la presión sistólica aórtica central.
Hasta un 90% de los pacientes con SM sufrirán un evento cardiovascular a lo largo de su vida, incluida la reparación quirúrgica de la raíz de la aorta, la disección aórtica o la cirugía valvular31. La rigidez aórtica puede tener un valor pronóstico adicional de dilatación, disección y rotura aórticas en la enfermedad degenerativa de la aorta y puede ser útil para la estratificación del riesgo de los pacientes en riesgo de complicaciones aórticas32. Además, la rigidez aórtica es uno de los primeros signos detectables de las alteraciones funcionales y estructurales de la pared vascular17. La CRM es una modalidad de diagnóstico por la imagen atractiva para evaluar la distensibilidad central y la PWV central, dada su capacidad de visualizar la longitud real de la aorta e identificar la rigidez regional33. En un estudio previo se evaluó el rendimiento diagnóstico del muestreo de PWV regional con la RM con codificación de velocidad para la predicción del aumento de la luz de la aorta de pacientes con SM. Se ha descrito que la evaluación de la PWV regional basada en la RM tiene una especificidad moderada o alta en la predicción de la ausencia de aumento de la luz regional de la aorta en todos los segmentos aórticos de los pacientes con SM26. En consecuencia, la rigidez aórtica es un objetivo terapéutico lógico en los adultos con SM.
A pesar de que el aliskireno no mejoró la rigidez aórtica medida con la distensibilidad aórtica central o la PWV central en la RM, la PWV periférica medida con la PWV de brazo-tobillo se redujo después del tratamiento con este fármaco. La discrepancia entre la PWV central y la periférica podría explicarse por la presión arterial sistólica aórtica central más baja en el grupo de tratamiento con aliskireno.
Recientemente se ha esclarecido la patogenia del SM. La fibrilina 1 se une al complejo latente de la citocina TGF-β y regula su activación y señalización5,34. Los estudios realizados en un modelo murino de SM pusieron de manifiesto que el déficit de fibrilina 1 se asocia a exceso de señalización del TGF-β. En un modelo de ratón knock-in para la mutación en FBN1, losartán limitó por completo la dilatación de la raíz de la aorta5. Se señaló que el exceso de señalización de TGF-β contribuye a la formación del aneurisma de la aorta ascendente y que el antagonismo entre el TGF-β y el losartán constituía una estrategia de tratamiento plausible. Se ha demostrado la existencia de una interrelación entre el sistema del TGF-β y el SRA34. Los bloqueadores del SRA se han desarrollado de 3 modos: inhibidores de la renina, inhibidores de la enzima de conversión de la angiotensina y ARA-II. Los efectos beneficiosos del bloqueo del SRA que el losartán y la adición de losartán a un tratamiento con bloqueadores beta producen se han demostrado en estudios retrospectivos o prospectivos a pequeña escala7,35. En 233 pacientes adultos con SM, de los que más del 70% estaban tomando un bloqueador beta, el tratamiento con losartán redujo la dilatación de la raíz de la aorta y la dilatación del arco aórtico tras la sustitución de la raíz aórtica8. Sin embargo, en estudios prospectivos a mayor escala, se ha puesto en duda la aplicabilidad al ser humano con SM de la hipótesis del TGF-β propuesta en el modelo murino. El Pediatric Heart Network Study no pudo demostrar la superioridad de losartán sobre atenolol para reducir la dilatación aórtica en 608 niños y adultos jóvenes con SM36. Muy recientemente, el Marfan Sartan Trial no observó efecto beneficioso alguno con la adición de losartán a un tratamiento bloqueador beta estandarizado, en 303 pacientes con SM10. El losartán, en comparación con el atenolol, no produjo diferencias significativas en la progresión de los diámetros de la raíz aórtica y la aorta ascendente en 140 pacientes con SM11.
En comparación con los ARA-II y los inhibidores de la enzima de conversión de la angiotensina, el inhibidor directo de la renina aliskireno tiene menos efectos adversos y es posible que no conlleve «fugas» del SRA, con lo que proporcionaría mayor bloqueo37,38. El aliskireno atenúa la expresión o la producción de TGF-β. Reduce la expresión génica de TGF-β en células de músculo liso aórtico humano en cultivo12. En un modelo de ratones sin hipertensión, el aliskireno redujo los valores de TGF-β y la acumulación de matriz extracelular en el riñón13. Otro estudio ha demostrado que la adición de aliskireno al valsartán proporciona una protección sinérgica contra la fibrosis renal a través de la atenuación de la expresión del ARN mensajero del TGF-β en un modelo de obstrucción ureteral unilateral en ratas39. En un estudio clínico, el aliskireno redujo la excreción urinaria de TGF-β de pacientes con enfermedad renal no diabética14. Además, los inhibidores de la renina se comportan como vasodilatadores y pueden mejorar la elasticidad de las arterias grandes36,40. La supresión del TGF-β con el aliskireno y su efecto protector en la dilatación aórtica no se han demostrado todavía en pacientes con SM. Nuestro estudio no pudo demostrar un efecto beneficioso del aliskireno por lo que respecta a la rigidez aórtica de los pacientes con SM en tratamiento estándar con bloqueadores beta.
LimitacionesPrimera, este estudio tiene como limitación su reducido tamaño muestral. Segunda, un periodo de seguimiento de 6 meses puede haber sido relativamente corto para observar mejoras de la integridad y la elasticidad de la aorta. En tercer lugar, en un subestudio del ensayo clínico COMPARE, Franken et al.41 señalaron que el losartán reduce el diámetro aórtico solo de los pacientes portadores de una mutación del FBN1 de haploinsuficiencia. Se ha planteado la hipótesis de que el bloqueo del SRA actúa solo en pacientes con determinados genotipos. Por último, dado que las diferencias en el diseño podrían haber contribuido a los resultados contradictorios respecto a la dilatación aórtica en distintos estudios del losartán (p. ej. en cuanto a la población del estudio, la posología de la medicación, la adherencia al tratamiento y los métodos de diagnóstico por la imagen utilizados41), serán necesarios nuevos estudios para determinar el efecto del tratamiento con aliskireno en el diámetro de la raíz de la aorta, la edad o el tipo de mutación génica en ciertos subgrupos.
CONCLUSIONESUn tratamiento de 24 semanas con aliskireno y atenolol no mostró una mejora significativa de la rigidez aórtica central ni del diámetro aórtico en comparación con lo observado con el atenolol solo. Serán necesarios estudios a largo plazo para determinar el efecto del aliskireno en los cambios estructurales de la pared aórtica de los pacientes con SM.
FINANCIACIÓNBeca de investigación financiada por Novartis.
CONFLICTO DE INTERESESNo se declara ninguno.
- -
Aunque las guías de práctica clínica lo recomiendan, la evidencia existente respecto a la eficacia del tratamiento con bloqueadores beta en el SM es escasa. Tras observarse la efectividad del losartán en un modelo murino de síndrome de Marfan, se planteó la hipótesis de que el losartán pudiera ser un tratamiento más causal a través de la interacción entre el SRA y el sistema del TGF-β. Sin embargo, en amplios ensayos recientes se han observado discrepancias en cuanto al efecto del losartán en el aumento de tamaño de la aorta. En comparación con el losartán, el inhibidor directo de la renina aliskireno tiene menos efectos adversos y es posible que no conlleve «escapes» del SRA, con lo cual podría aportar un bloqueo del SRA superior. Hasta la fecha, no se han realizado estudios en los que se haya analizado el posible efecto beneficioso del aliskireno en el tratamiento del SM.
- -
El tratamiento con aliskireno durante 24 semanas no redujo la rigidez aórtica central de los pacientes con SM en tratamiento con bloqueadores beta estándar en comparación con un tratamiento de control negativo, pero sí se observó una diferencia significativa favorable al aliskireno por lo que respecta a la PWV de brazo-tobillo, que podría deberse a una reducción de la presión sistólica aórtica central.