Esta publicación analiza la actualización1 de la Sociedad Europea de Cardiología (ESC) de la última guía sobre arritmias ventriculares y muerte súbita (MS) publicada en 20062. Se pone énfasis en la pre-vención de MS más que en el tratamiento de las arritmias ventricu-lares e introduce comentarios de interés práctico para el manejo de los pacientes. La adherencia a las guías constituye un indicador de calidad3.
DEFINICIÓN, EPIDEMIOLOGÍA Y PERSPECTIVAS FUTURASAutopsia y autopsia molecular de víctimas de muerte súbitaLa presente guía1 recoge como recomendación de clase I-C la reali-zación de autopsia para conocer la causa de la muerte inesperada. Se recomienda, además, el estudio histológico del corazón, así como el análisis toxicológico de la sangre y otros fluidos como recomendación de clase I. El estudio genético post mortem se considera recomenda-ción de tipo IIa cuando se sospeche una canalopatía. Sin embargo, la guía desaconseja el uso de amplios paneles de análisis genético para el estudio de la MS y recomienda los estudios genéticos dirigidos.
TRATAMIENTO DE LAS ARRITMIAS VENTRICULARESTratamiento farmacológicoBloqueadores betaSe ha demostrado su efecto favorable en la supervivencia de pacientes con disfunción ventricular con o sin insuficiencia cardiaca asociada. En la presente guía, sin embargo, se menciona un registro4 de pacientes con infarto agudo de miocardio (IAM) en el que se observó un efecto desfavorable en presencia de dos o más de los siguientes factores: edad mayor de 70 años, frecuencia cardiaca > 110 lpm y presión arterial < 110mmHg. En realidad, este efecto deletéreo parece confinado a pacientes especialmente enfermos con gran dis-función ventricular y no se ha confirmado en otros estudios, por lo que hay que tomarlo con reservas.
AmiodaronaEl estudio SCD-HeFT5 muestra un efecto neutro en la mortali-dad de los pacientes con disfunción ventricular (fracción de eyec-ción del ventrículo izquierdo [FEVI] < 35%). Puede utilizarse como «reductor» de la carga arrítmica de los pacientes a los que se indica un desfibrilador.
Sotalol/d-sotalolLa importancia de este fármaco ha ido disminuyendo con el paso del tiempo. Se puede utilizar para pacientes con cardiopatía isqué-mica sin insuficiencia cardiaca. El fármaco d-sotalol no se comercia-liza en España y ha producido aumento de la mortalidad de los pacientes con disfunción ventricular tras IAM.
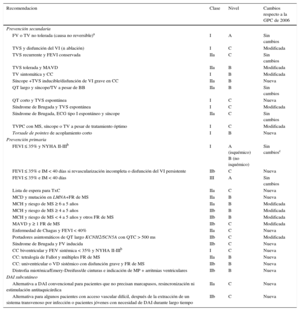
Desfibrilador automático implantableEs el tratamiento más eficaz para la prevención de la MS, tanto en prevención primaria como secundaria, y de uso creciente en nuestro entorno6. Desde la guía de 20062, se han publicado estudios a largo plazo que confirman el beneficio del desfibrilador automático implantable (DAI). Tradicionalmente se había considerado necesaria una ventana de espera de 40 días desde el IAM hasta el implante. Sin embargo, una novedad interesante es la posibilidad del implante «precoz» (< 40 días) cuando se dan condiciones específicas como FEVI previamente reducida, revascularización incompleta y presencia de taquicardia ventricular no sostenida tras 48h de evolución. Es uno de los aspectos más controvertidos de esta nueva guía, ya que no se basa en evidencia firme y existen alternativas como el chaleco desfibrilador (tabla 1).
Indicaciones de desfibrilador
| Recomendacion | Clase | Nivel | Cambios respecto a la GPC de 2006 |
|---|---|---|---|
| Prevención secundaria | |||
| FV o TV no tolerada (causa no reversible)a | I | A | Sin cambios |
| TVS y disfunción del VI (± ablación) | I | C | Modificada |
| TVS recurrente y FEVI conservada | IIa | C | Sin cambios |
| TVS tolerada y MAVD | IIa | B | Modificada |
| TV sintomática y CC | I | B | Modificada |
| Síncope +TVS inducible/disfunción de VI grave en CC | IIa | B | Nueva |
| QT largo y síncope/TV a pesar de BB | IIa | B | Sin cambios |
| QT corto y TVS espontánea | I | C | Nueva |
| Síndrome de Brugada y TVS espontánea | I | C | Modificada |
| Síndrome de Brugada, ECG tipo I espontáneo y síncope | IIa | C | Sin cambios |
| TVPC con MS, síncope o TV a pesar de tratamiento óptimo | I | C | Modificada |
| Torsade de pointes de acoplamiento corto | I | B | Nueva |
| Prevención primaria | |||
| FEVI ≤ 35% y NYHA II-IIIb | I | A (isquémico) B (no isquémico) | Sin cambiosc |
| FEVI ≤ 35% e IM < 40 días si revascularización incompleta o disfunción del VI persistente | IIb | C | Nueva |
| FEVI ≤ 35% e IM < 40 días | III | A | Sin cambios |
| Lista de espera para TxC | IIa | C | Nueva |
| MCD y mutación en LMNA+FR de MS | IIa | B | Nueva |
| MCH y riesgo de MS ≥ 6 a 5 años | IIa | B | Modificada |
| MCH y riesgo de MS ≥ 4 a 5 años | IIb | B | Modificada |
| MCH y riesgo de MS < 4 a 5 años y otros FR de MS | IIb | B | Modificada |
| MAVD y ≥ 1 FR de MS | IIb | C | Modificada |
| Enfermedad de Chagas y FEVI < 40% | IIa | C | Nueva |
| Portadores asintomáticos de QT largo KCNH2/SCN5A con QTC > 500 ms | IIb | C | Modificada |
| Síndrome de Brugada y FV inducida | IIb | C | Nueva |
| CC biventricular y FEV sistémica < 35% y NYHA II-IIIb | I | C | Nueva |
| CC: tetralogía de Fallot y múltiples FR de MS | IIa | B | Nueva |
| CC: univentricular o VD sistémico con disfunción grave y FR de MS | IIb | B | Nueva |
| Distrofia miotónica/Emery-Dreifuss/de cinturas e indicación de MP + arritmias ventriculares | IIb | B | Nueva |
| DAI subcutáneo | |||
| Alternativa a DAI convencional para pacientes que no precisan marcapasos, resincronización ni estimulación antitaquicárdica | IIa | C | Nueva |
| Alternativa para algunos pacientes con acceso vascular difícil, después de la extracción de un sistema transvenoso por infección o pacientes jóvenes con necesidad de DAI durante largo tiempo | IIb | C | Nueva |
BB: bloqueadores beta; FEVI: fracción de eyección del VI; FR: factores de riesgo; FV: fibrilación ventricular; IM: infarto de miocardio; LMNA: lamina A/C; MP: marcapasos; MS:muerte súbita; NYHA: clase funcional de la New York Heart Association; TVS: taquicardia ventricular sostenida; TxC: trasplante cardiaco; VD: ventrículo derecho; VI: ventrículo izquierdo.
Incluye situaciones como las miocardiopatías dilatada (MCD, nivel de evidencia A), hipertrófica (MCH, nivel B), arritmogénica del VD (MAVD, nivel C), restrictiva (MR, nivel C),infiltrativas (nivel C), síndromes de QT largo (nivel B), QT corto (nivel C), de Brugada (nivel C) y de TV polimórfica catecolaminérgica (TVPC, nivel C), cardiopatías congénitas (CC, nivel B), FV idiopática (nivel B), torsade de pointes de acoplamiento corto (nivel B), valvulopatías (nivel C), embarazo (nivel C) y edad pediátrica (nivel B), aunque con distintos niveles de evidencia (entre paréntesis) e incluso con un clase de recomendación menor, como en cardiopatías inflamatorias (clase IIa, nivel C), amiloidosis (clase IIa, nivel C) y miocarditis de células gigantes y sarcoidosis (clase IIb, nivel C).
Los electrodos transvenosos de desfibrilación son la parte más vulnerable del sistema. En los últimos años se ha desarrollado un desfibrilador con electrodos subcutáneos que es eficaz en prevenir la MS por arritmias ventriculares7. A la espera de los resultados de estudios aleatorizados, los estudios iniciales son prometedores (tabla 1).
Chaleco desfibrilador externoSe considera indicado durante un tiempo limitado para pacientes sin indicación de DAI, como puente al trasplante, tras un IAM con mala FEVI o en enfermedades susceptibles de mejorar con el tiempo (miocarditis, miocardiopatía periparto, etc.). Indicación de tipo IIb-C. Aunque no existen estudios prospectivos, se han publicado registros que han demostrado su eficacia en tratar los episodios de arritmias ventriculares.
Acceso público a un desfibriladorSe recomienda la colocación de desfibriladores externos en lugares concurridos donde la posibilidad de una parada cardiaca sea relativamente alta, como escuelas, estadios deportivos, estaciones, etc. Es una recomendación de clase I-B. Como recomendación IIb, se puede considerar en el domicilio de familias con alto riesgo de MS.
Ablación con catéterSe considera recomendación de tipo I-B para el tratamiento de la tormenta arrítmica y pacientes portadores de DAI con choques repetidos. La indicación después del primer episodio de taquicardia ventricular (TV) para pacientes con cardiopatía isquémica se considera indicación IIa-B. Sin embargo, la ablación de TV es difícil, con resultados muy dependientes del equipo (experiencia y volumen de pacientes), y por ello se recomienda el traslado precoz a un centro especializado en caso de tormenta arrítmica.
Cirugía de arritmiasSe la considera una rareza y se recomienda realizarla en centros con experiencia. Se podría considerar en caso de arritmias refractarias al tratamiento médico, tras haber fallado la ablación, sobre todo si el paciente va a ser revascularizado quirúrgicamente y presenta un aneurisma ventricular.
TRATAMIENTO DE LAS ARRITMIAS VENTRICULARES Y PREVENCIÓN DE LA MUERTE SÚBITA CARDIACA EN CARDIOPATÍA ISQUÉMICAApartado mucho más coherente y comprensible desde el punto de vista clínico que el de las guías previas. Incorpora un número limitado de novedades en relación con:
- •
Uso precoz de bloqueadores beta en el IAM.
- •
Papel de las asistencias mecánicas en fase aguda.
- •
Papel de la ablación por catéter para tratar arritmias rebeldes.
- •
La falta de eficacia del DAI en las primeras semanas tras un IAM.
- •
La confirmación del impacto pronóstico de las arritmias en fase aguda.
- •
El valor de la estimulación eléctrica programada en los pacientes con FEVI conservada tras un IAM o para definir un grupo de menor riesgo en el caso de ser negativa en pacientes con FEVI deprimida.
Un aspecto general importante viene dado por su nivel de eviden-cia. El 58% son de nivel C y solo el 8% son de nivel A. Por otra parte, el 55% son de tipo I y el 35%, de tipo IIa o IIb.
Un ejemplo es la indicación de coronariografía urgente (< 2h) para los pacientes en coma persistente tras MS recuperada de etiología incierta (IIa-B). En uno de los artículos citados8, se realizó solo a los pacientes en situación estable y en otro9 se limitó a menores de 75 años. Sin embargo, en la nueva guía se recomienda especialmente para los pacientes en situación hemodinámica inestable. Aunque la recomendación IIa se podría compartir con limitaciones, el nivel de evidencia es discutible (un único estudio grande no aleatorizado) y probablemente debería ser C, especialmente en caso de inestabilidad hemodinámica.
Las guías enfatizan la necesidad de revascularización precoz y completa de los pacientes con arritmias ventriculares o MS en el con-texto de un síndrome coronario agudo o ante la mera sospecha y en ausencia de otras causas que las justifiquen.
TERAPIAS PARA PACIENTES CON DISFUNCIÓN VENTRICULAR IZQUIERDA, CON O SIN INSUFICIENCIA CARDIACAEn prevención primara se ha simplificado la redacción y se ha dis-minuido la imprecisión. Desaparece el margen de FEVI del 30-40% y la diferencia entre miocardiopatía isquémica y no isquémica, y se esta-blecen recomendaciones iguales para los dos sustratos (FEVI < 35%). La nueva versión de la guía mantiene las recomendaciones de la guía de insuficiencia cardiaca10.
No se dan recomendaciones sobre la prevención de MS mediante DAI para pacientes con grados menores de disfunción ventricular (FEVI > 35%) por ausencia de estudios controlados. Aparece por pri-mera vez la indicación de DAI para pacientes en lista de espera de trasplante cardiaco, a pesar de que muchos de ellos no cumplen la condición de expectativa de vida ≥ 1 año, bien por la propia mortali-dad esperada, bien por estar en lista de espera menos de ese tiempo.
Otro aspecto en discusión es el beneficio de la terapia de resincronización para pacientes sin bloqueo de rama izquierda (BRI), especialmente si la duración del complejo QRS es < 150ms, recomendación con indicación de clase IIb-B, al igual que en la guía de resincronización11.
Para los pacientes con fibrilación auricular, se adoptan las recomendaciones de la guía de resincronización previa11 y se establece una recomendación de clase IIa para pacientes en clase funcional de la New York Heart Association (NYHA) III-IV, siempre que se pueda garantizar un porcentaje de estimulación biventricular cercano al 100%.
Finalmente, se menciona la indicación de ablación de extrasistolia ventricular (EV) para pacientes con disfunción ventricular. Se consi-dera de clase IIa si la EV es frecuente, especialmente con densidad superior al 24% de todos los complejos. No se han considerado otras variables, como la morfología de las EV, que podría ser de ayuda, ya que algunas de ellas indican un origen idiopático de las EV y mayor probabilidad de éxito con la ablación o la presencia de varias morfolo-gías que indicaría lo contrario.
MIOCARDIOPATÍASAl igual que en la previa2, la nueva guía se centra en el manejo de las arritmias ventriculares y la prevención de MS en la miocardiopatía dilatada (MCD), la miocardiopatía hipertrófica y la displasia arritmo-génica del ventrículo derecho.
Miocardiopatía dilatadaNo se recomienda el empleo de resonancia magnética (RM) como herramienta para estratificar el riesgo de MS. Como novedad, se con-sidera el estudio electrofisiológico en la estratificación pronóstica (IIb-B) de la MCD. Esta recomendación es controvertida, ya que es una práctica poco habitual por la baja sensibilidad del test. A diferencia de la guía previa, se recomienda (I-B) realizar una coronariografía a pacientes estables con MCD y riesgo intermedio de enfermedad coro-naria ante la aparición de arritmias ventriculares.
Se recomienda implantar un DAI a los pacientes con arritmias ven-triculares y mala tolerancia hemodinámica, independientemente de la FEVI (I-A) y a los pacientes con MCD y FEVI < 35% en NYHA II-III (I-B). Un aspecto ausente es el manejo del paciente con MCD que sufre un síncope. En las guías precedentes se recomendaba el implante de DAI en caso de síncope y disfunción ventricular izquierda significa-tiva. La desaparición de esta recomendación podría generar confu-sión. Finalmente, desaparece la recomendación de implantar DAI a pacientes en NYHA I.
La principal novedad terapéutica es la recomendación de implan-tar DAI (IIa-B) a pacientes con MCD tras confirmar una mutación cau-sal en el gen de la laminina en caso de variables clínicas de riesgo (TV no sostenida, sexo masculino y FEVI < 45%).
Finalmente, se recomienda identificar y tratar los factores proarritmogénicos (I-B). Se recomienda la utilización de amiodarona para pacientes con choques apropiados y recurrentes pese a una adecuada programación del DAI (IIa-C), mientras que no se recomienda para pacientes con episodios asintomáticos de TV no sostenida (III-A). Se contraindica el uso de dronedarona e inhibidores de los canales de sodio por su riesgo proarrítmico. Se describe en un apartado específico el papel de la ablación de la TV en pacientes con MCD; por un lado, se mantiene la recomendación de la ablación de la TV por reentrada rama-rama (I-B) y, por otro, se limita la ablación a pacientes con TV refractaria al tratamiento médico secundaria a otros mecanismos (recomendación IIb-C). El grado de recomendación es inferior al de consensos anteriores12 (IIa-B).
Miocardiopatía hipertróficaSe adopta la fórmula de estratificación del riesgo de la guía europeas de 201413,14. Se recomienda para pacientes mayores de 16 años (I-B) en el momento de la primera evaluación y cada 1-2 años o ante un cambio en la situación clínica (I-B). Además se desaconsejan los deportes competitivos (I-C). A diferencia de la previa, la actual guía desaconseja el estudio electrofisiológico para la estratificación pronóstica (III-C). Se recomienda implante de DAI en prevención secundaria (I-B) y prevención primaria, para pacientes con un riesgo de MS a 5 años > 6% (IIa-B) y entre el 4 y el 6% (IIb-B). Para pacientes con un riesgo estimado a 5 años < 4% cuando concurran otros hallaz-gos clínicos con valor pronóstico, también se aconseja el implante de DAI (IIb-B).
Para pacientes pediátricos, se mantienen las recomendaciones de implantar DAI de la guía europea: en prevención secundaria y en pre-vención primaria si hay al menos dos factores de riesgo infantiles. Además, se podría indicar individualizadamente en presencia de un solo factor de riesgo.
Displasia arritmogénica del ventrículo derechoSe incorporan unas recomendaciones generales, como evitar los deportes competitivos (I-C), el tratamiento con bloqueadores beta para pacientes sintomáticos con extrasistolia ventricular o rachas de TV no sostenida (I-C) y la amiodarona para pacientes que no toleren los blo-queadores beta o los tengan contraindicados (IIa-C). Se aconseja el implante de DAI en prevención secundaria ante arritmias con mala tolerancia hemodinámica (I-C), TV con buena tolerancia hemodiná-mica (IIa-C) y para pacientes con síncope. Se considera el DAI para pre-vención primaria en presencia de factores de riesgo (IIb-C frente a IIa-C de la guía previa). Finalmente, se aconseja la ablación con catéter para pacientes con episodios frecuentes de TV con el objetivo de mejorar los síntomas o reducir el número de choques del DAI (IIa-B).
Otras miocardiopatíasSe incorporan recomendaciones para varias miocardiopatías no presentes en las guías previas. Se recomienda el implante de DAI tras una arritmia ventricular con repercusión hemodinámica en pacientes con amiloidosis cardiaca (IIa-C) y en la miocardiopatía restrictiva (I-C) si la expectativa de vida es > 1 año. Finalmente, por primera vez, se incorpora la enfermedad de Chagas, para la que se recomienda implantar DAI a los pacientes con FEVI < 40% (IIa-C).
SÍNDROMES ARRÍTMICOS HEREDITARIOSAspectos generalesDesafortunadamente, en los síndromes arrítmicos de origen genético, la evidencia continua siendo escasa; por ello, el 86% (31 de 36) de las recomendaciones presentan nivel de evidencia C. Las únicas recomendaciones con nivel de evidencia B se encuentran en el síndrome de QT largo, ya que se basan en registros con gran número de pacientes y con seguimientos largos.
Como aspecto novedoso en el área de «síndromes arrítmicos pri-marios hereditarios», se incluyen criterios definidos para el diagnós-tico de cada una de las enfermedades (a excepción del síndrome de repolarización precoz). Estos criterios ya se habían propuesto en otro consenso de expertos15, aunque en algún caso han sufrido pequeñas modificaciones (tabla 2).
Recomendaciones para el diagnóstico de síndromes arrítmicos primarios hereditarios
| 2006 ACC/AHA/ESC Guidelines2 | 2013 HRS/EHRA/APHRS Expert Consensus Statement3 | 2015 ESC Guidelines1 | |
|---|---|---|---|
| SQTL | ND | 1. El SQTL se diagnostica en presencia de:a. Puntuación de riesgo de SQTL ≥ 3,516,37 en ausencia de una causa secundaria de prolongación del intervalo QT y/ob. Mutación inequívocamente patogénica en uno de los genes asociados a SQTLc. Intervalo QTc (fórmula de Bazett) ≥ 500ms en repetidos ECG de 12 derivaciones y en ausencia de una causa secundaria de prolongación del intervalo QT2. El SQTL se puede diagnosticar en presencia de QTc 480-499ms en repetidos ECG de 12 derivaciones en un paciente con síncope inexplicable en ausencia de una causa secundaria de prolongación del intervalo QT y en ausencia de una mutación patogénica | Clase I (nivel de evidencia C)1. El SQTL se diagnostica en presencia de:a. QTc ≥ 480ms en repetidos ECG de 12 derivaciones ob. Puntuación de riesgo de SQTL > 337c. Mutación inequívocamente patogénica en uno de los genes asociados a SQTL, independientemente de la duración del intervalo QTClase IIa (nivel evidencia C)3. El SQTL se debería considerar en presencia de QTc ≥ 460ms en repetidos ECG de 12 derivaciones de pacientes con síncope inexplicable en ausencia de causas secundarias de prolongación del intervalo QT |
| SQTC | ND | 1. SQTC se diagnostica en presencia de QTc ≤ 330ms | Clase I (nivel de evidencia C) |
| 2. SQTC se puede diagnosticar en presencia de QTc < 360ms y una o más de las siguientes: | 1. El SQTC se diagnostica en presencia de QTc ≤ 340ms | ||
| a. Mutación patogénica confirmadab. Historia familiar de SQTCc. Historia familiar de muerte súbita a edad ≤ 40 añosd. Supervivencia de un episodio de TV/FV en ausencia de cardiopatía | Clase IIa (nivel de evidencia C)2. El SQTC se debería considerar en presencia de QTc ≤ 360ms y una o más de las siguientes:e. Mutación patogénica confirmadaf. Historia familiar de SQTCg. Historia familiar de muerte súbita a edad < 40 añosh. Supervivencia a un episodio de TV/FV en ausencia de cardiopatía | ||
| Síndrome de Brugada | ND | 1. El síndrome de Brugada se diagnostica a pacientes conelevación del segmento ST con morfología tipo 1 ≥ 2mm en al menos una derivación precordial derecha (V1, V2) posicionadas en el segundo, el tercer o el cuarto espacio intercostal, que aparece espontáneamente o tras administración intravenosa de fármacos antiarrítmicos de clase I2. El síndrome de Brugada se diagnostica a pacientes con elevación del segmento ST con morfología tipo 2 o 3 en al menos una derivación precordial derecha (V1, V2) posicionadas en el segundo, el tercero o el cuarto espacio intercostal, que se convierte en tipo 1 tras administración intravenosa de fármacos antiarrítmicos de clase I | Clase I (nivel de evidencia C)1. El síndrome de Brugada se diagnostica a pacientes con elevación del segmento ST con morfología tipo 1 ≥ 2mm en una o más derivaciones precordiales derechas (V1 y/o V2) posicionadas en el segundo, el tercer o el cuarto espacio intercostal, que aparece espontáneamente o tras una prueba de provocación farmacológica con administración intravenosa de bloqueadores de los canales de sodio (como ajmalina, flecainida, procainamida o pilsicainida) |
| TVPC | NA | 1. La TVPC se diagnostica en presencia de un corazón estructuralmente normal, ECG normal, y TV bidireccional o latidos ventriculares prematuros polimórficos inducidos por ejercicio o catecolaminas en menores de 40 años2. La TVPC se diagnostica a pacientes (caso indice o miembro de la familia) que tienen una mutacion patogenica3. La TVPC se diagnostica a los familiares de un caso indice con corazon normal que sufren contracciones ventriculares prematuras inducidas por el ejercicio o TV bidireccional/ TV polimórfica4. La TVPC se puede diagnosticar en presencia de corazon y arterias coronarias estructuralmente normales, ECG normal y TV bidireccional o latidos ventriculares prematuros polimorficos inducidos por ejercicio o catecolaminas en mayores de 40 años | Clase I (nivel de evidencia C)1. La TVPC se diagnostica en presencia de corazón estructuralmente normal, ECG normal e inducción de TV bidireccional o polimórfica en relación con el esfuerzo o emociones2. La TVPC se diagnostica a pacientes portadores de mutación(es) patogenica(s) en los genes RyR2 o CASQ2 |
| Repolarización precoz | NA | 1. El síndrome de repolarización precoz se diagnostica en presencia de elevación del punto J ≥ 1mm en al menos dos derivaciones inferiores y/o laterales contiguas de un ECG estándar de 12 derivaciones en un paciente resucitado de FV/TV polimórfica inexplicable de otro modo2. El síndrome de repolarización precoz se puede diagnosticar a víctimas de muerte súbita cardiaca con autopsia negativa, al revisar la historia médica, si se observa ECG previo con elevación del punto J ≥ 1mm en al menos dos derivaciones inferiores y/o laterales contiguas de ECG de 12 derivaciones estándar3. El patrón de repolarización precoz se puede diagnosticar en presencia de elevación del punto J ≥ 1mm en al menos dos derivaciones inferiores y/o laterales contiguas de un ECG de 12 derivaciones estándar | NA |
FEVI: fracción de eyección del ventrículo izquierdo; FV: fibrilación ventricular; SQTC: síndrome de QT corto; SQTL: síndrome de QT largo; TV: taquicardia ventricular; TVPC:taquicardia ventricular polimórfica catecolaminérgica.
*En negrita subrayado, las diferencias principales en el diagnóstico de los síndromes arrítmicos primarios hereditarios.
La estimulación ventricular programada está desaconsejada en los síndromes de QT largo, QT corto y TV polimórfica catecolaminérgica. Sin embargo, analizar la inducibilidad de arritmias ventriculares sos-tenidas en el síndrome de Brugada sigue considerándose opcional (IIb-C) a pesar de la gran controversia suscitada por el resultado nega-tivo del estudio PRELUDE16. El DAI sigue siendo de elección para supervivientes a parada cardiaca secundaria a TV polimórfica o fibri-lación ventricular (FV). Sin embargo, la evidencia sobre la indicación de DAI para prevención primaria en este grupo de enfermedades es escasa, y se incluyen pocas recomendaciones.
Se echa de menos recomendaciones para el estudio familiar de las enfermedades arrítmicas primarias.
Síndrome de QT largoAspectos novedosos e importantesSe han modificado los criterios diagnósticos propuestos por el Consenso de Expertos de la HRS/EHRA/APHRS en 2013. El panel con-sideró que un QTc > 500ms en pacientes asintomáticos y > 480ms en pacientes con síncope inexplicado era demasiado conservador, por lo que se redujo a ≥ 480 y ≥ 460ms respectivamente. Una novedad es la recomendación de implantar DAI en prevención primaria para ciertos subgrupos de alto riesgo portadores de una mutación en KCNH2 o SCN5A con QT > 500ms (indicación IIb, nivel de evidencia C).
Aspectos sin tratarAunque hay evidencia de la utilidad de la prueba de esfuerzo en el diagnóstico del síndrome de QT largo, no se hace ninguna mención. Tampoco se aborda la conveniencia de realizar análisis de ADN a los casos índice de síndrome de QT largo.
Síndrome de QT cortoAspectos controvertidosDesde su descripción, han sido pocos los casos publicados sobre esta canalopatía, por lo que los criterios diagnósticos todavía son tema de discusión. El valor de corte propuesto (≤ 340ms en pacientes asintomáticos o ≤ 360ms con mutación patogénica, historia familiar síndrome de QT corto o de MS en menores de 40 años o supervivencia a un evento de arritmia ventricular sostenida en ausencia de cardio-patía) es empírico. Asimismo, la terapia recomendada (sotalol o qui-nidina) se basa en series pequeñas. Por lo tanto, se deberían tomar con cautela estas recomendaciones de la guía hasta que se obtenga nueva evidencia.
Síndrome de BrugadaAspectos novedosos e importantesActualmente se considera diagnóstica la elevación del segmento ST ≥ 2mm en al menos una derivación precordial derecha, posicio-nada en el segundo, el tercero o el cuarto espacio intercostal, ya sea basal o tras la administración de fármacos bloqueadores de los cana-les del sodio. Se destaca el papel prometedor de la ablación epicárdica a nivel del tracto de salida del ventrículo derecho para pacientes con episodios arrítmicos recurrentes.
Aspectos controvertidosLa estratificación de riesgo sigue siendo tema de debate y no hay novedades sustanciales. No se ha modificado la recomendación de DAI para pacientes con inducibilidad de FV durante la estimulación ventricular programada (clase IIb-C).
Taquicardia ventricular polimorfa catecolaminérgicaAspectos novedosos e importantesAparece la indicación de la flecainida como recomendación tera-péutica. Sin embargo, solo se recomienda para pacientes portadores de DAI, combinado con bloqueadores beta en el caso de arritmias ven-triculares recurrentes. Como segunda novedad, aparece la denerva-ción cardiaca simpática izquierda para el control de síntomas recu-rrentes o arritmias en pacientes ya tratados con bloqueadores beta o que no los toleran.
Síndrome de repolarización precozAspectos novedosos e importantesSe ha optado por no proporcionar ninguna recomendación dada la gran cantidad de incógnitas en torno a este síndrome. Se propone diagnosticar solo a los pacientes con patrón de repolarización precoz en derivaciones inferiores o laterales que hayan sufrido un episodio de FV idiopática/TV polimórfica.
ARRITMIAS PEDIÁTRICAS Y EN ENFERMEDADES CARDIACAS CONGÉNITASEn la sección correspondiente se desglosan las arritmias ventricu-lares en: a) arritmias en corazón estructuralmente normal; b) arrit-mias en pacientes con cardiopatía congénita, y c) indicaciones del desfibrilador en pediatría.
Para niños con cardiopatías congénitas, se recomienda implante de desfibrilador cuando se los haya recuperado de una MS cardiaca o para quienes hayan sufrido TV sintomáticas. También se recomienda el desfibrilador en casos con FEVI < 35%, insuficiencia cardiaca y NYHA II-III. Se recomienda la ablación con catéter en casos con taqui-cardias monomórficas recurrentes o con múltiples terapias del desfi-brilador apropiadas. Se apunta la posibilidad de implantar un desfibrilador en caso de síncope y disfunción ventricular o arritmias inducibles, para pacientes con tetralogía de Fallot y factores de riesgo asociados como disfunción ventricular, TV no sostenidas, QRS muy ancho o arritmias inducibles. Se propone también la posibilidad de realizar ablación a pacientes portadores de desfibrilador con TV monomórficas recurrentes. Se abre la posibilidad, pero sin recomen-dación formal, de utilizar la estimulación como herramienta de estra-tificación de riesgo para pacientes con tetralogía de Fallot o TV no sostenidas. Se desaconseja formalmente la utilización de fármacos o la ablación de pacientes con extrasistolia infrecuente asintomática y buena FEVI. Igualmente se desaconseja utilizar la estimulación pro-gramada en pacientes sin otros factores de riesgo.
TAQUICARDIAS VENTRICULARES Y FIBRILACIÓN VENTRICULAR EN CORAZONES ESTRUCTURALMENTE NORMALESTaquicardias ventriculares del tracto de salidaEn lo que respecta a las TV idiopáticas del tracto de salida del ventrículo derecho, se eleva desde I-C a I-B la recomendación de ablación para pacientes refractarios a tratamiento médico, con intolerancia a fármacos o que no desean tomar tratamiento antiarrítmico. Además se incluye a los pacientes con depresión de la FEVI atribuible a alta carga de extrasístoles ventriculares.
Otra importante novedad respecto al manejo de los sustratos arrit-mogénicos del tracto de salida consiste en la diferente actitud según su origen presunto. Se recomienda la ablación como primera línea de tratamiento (clase IB) si se sospecha origen en el tracto de salida del ventrículo derecho, mientras que, si se sospecha origen en el VI (cús-pide aórtica, tracto de salida del VI, epicardio del tracto de salida del VI o arteria pulmonar), la actitud inicial debería ser el tratamiento con fármacos bloqueadores del sodio (clase I-C). La guía refleja que la sos-pecha de origen izquierdo supone una complejidad añadida al proce-dimiento, que a menudo requiere diferentes vías de acceso, y se reco-mienda que se lleve a cabo solo en pacientes sintomáticos, tras fracaso del tratamiento con al menos un fármaco I-C y en centros con elevada experiencia en ablación (clase II-B).
Una limitación es que no se emite ninguna recomendación sobre los pacientes con sospecha específica de taquicardiomiopatía por TV/EV del tracto de salida del VI.
Taquicardias ventriculares idiopáticas de otros orígenesDe manera innovadora, se recoge un subapartado sobre el manejo de las TV idiopáticas de VI, de músculo papilar, submitrales y subtri-cuspídeas. Se considera la ablación como primera línea de trata-miento (I-B) para las taquicardias del VI idiopáticas (fasciculares, rama-rama, Purkinje o interfasciculares) y sintomáticas, mientras que el tratamiento farmacológico con antagonistas del calcio, bloqueado-res beta o fármacos I-C lo recomienda como segunda línea con indica-ción I-C. En cuanto a las TV de músculo papilar y subvalvulares, la guía emite una nueva indicación II-B para la ablación, mientras que los fár-macos serían el tratamiento inicial de elección (I-A).
Fibrilación ventricular idiopática y taquicardia ventricular helicoidal de acoplamiento cortoEl documento reconoce que, a pesar de posibles futuros avances en el conocimiento de la FV idiopática, a día de hoy continúa siendo un diagnóstico de exclusión. Se sigue considerando un estándar de trata-miento (I-B) el empleo de DAI en pacientes sin cardiopatía estructural que hayan sobrevivido a una fibrilación ventricular, y por primera vez se otorga el mismo nivel de evidencia a la ablación de EV en casos en los que se demuestra que son claros desencadenantes de TV/FV o de descargas del DAI repetitivas.
Se incluye por primera vez un apartado específico para los pacien-tes con TV tipo torsade de pointes de acoplamiento corto, se reco-mienda el manejo inicial con desfibrilador (clase I-B) y se posterga el verapamilo y la ablación de los desencadenantes como tratamiento para prevenir tormentas arrítmicas o descargas recurrentes.
ENFERMEDADES CARDIACAS INFLAMATORIAS, REUMÁTICAS Y VALVULARESMiocarditisAunque este apartado se ha modificado bastante, todas las reco-mendaciones siguen con nivel de evidencia C. Se incorpora una nueva recomendación (clase IIb) en la que se acepta tanto la persistencia de infiltrados inflamatorios en las biopsias como la fibrosis anormal en la RM como factores de riesgo de MS, para lo que se respalda el implante de DAI. Las arritmias ventriculares podrían aparecer en dos escena-rios diferentes:
- •
Miocarditis aguda que cursa con TV refractaria e IC grave. Se asocia a un pronóstico agudo muy grave en la miocarditis de células gigantes. Si el paciente sobrevive, el curso posterior es relativamente favorable. Esto justifica la inclusión de una nueva recomendación (clase I) de que referir a estos pacientes a centros especializados.
- •
Evolución hacia miocardiopatía inflamatoria con un perfil de riesgo de MS similar a la miocardiopatía dilatada.
Ya se ha citado la novedad en esta guía de la inclusión de los desfi-briladores cardioversores externos tipo chaleco LifeVest 4000® (ZOLL Lifecor Corp.; Estados Unidos) como terapia puente (clase IIa).
Endocarditis, carditis reumática y pericarditisEstas tres entidades han visto notablemente reducida su exten-sión, algo que parece lógico, ya que son causas raras de MS, y general-mente no debida a arritmias ventriculares, sino a bloqueo auriculo-ventricular (BAV) o alteraciones hemodinámicas.
SarcoidosisDada la alta recurrencia de TV en esta enfermedad, se indica el implante de DAI como clase IIa fuera del episodio agudo y como clase IIb cuando la presentación fuera parada cardiaca o TV mal tolerada. Realmente, son muy pocos los pacientes con sarcoidosis en nuestro país, con una incidencia de 1-4/100.000 habitantes, más baja que en el resto de Europa (unos 15/100.000).
ValvulopatíasEste apartado incorpora tres nuevas recomendaciones, ente las que destacan la que reconoce el beneficio del DAI para los pacientes que tras la cirugía presenten las indicaciones generales de prevención primaria o secundaria (clase I) y la que alerta sobre la necesidad de descartar una reentrada rama-rama en toda TV que aparezca tras la cirugía (clase IIa). La tercera, también nueva y de clase I, considera criterio de indicación de cirugía la TV que aparece en pacientes con insuficiencia aórtica aguda por endocarditis.
RIESGO ARRÍTMICO EN POBLACIONES SELECCIONADASPacientes psiquiátricosEste apartado ha crecido de forma desproporcionada y sin aportar novedades. El más importante mecanismo de MS parece una prolon-gación del intervalo QT que se asocia a la aparición de TV tipo torsade de pointes. Por ello, se introducen tres recomendaciones de clase I bastante obvias: a) ajustar la dosis del fármaco o suspenderlo si el QTc alcanza los 500ms o aumenta más de 60ms desde el basal; b) vigilar la concentración de potasio para evitar la hipopotasemia, y c) evitar el uso simultáneo de fármacos que prolonguen el QT. Sorprende que la cuarta recomendación, que es realizar un ECG para medir el QT antes de iniciar el fármaco, solo reciba un nivel IIa y se echa en falta una recomendación de que la segunda medición del QT debería ser inme-diata tras la primera o la segunda dosis del fármaco.
Pacientes neurológicosRespecto a la guía de 2006, se incluye como novedad una referen-cia a la epilepsia que describe la posibilidad de MS. Aunque se alerta para explorar la existencia de enfermedades cardiacas que podrían semejarse, se echa en falta una recomendación firme sobre este aspecto tan importante.
En las enfermedades neuromusculares se revisa el riesgo arrítmico de los pacientes con distrofias musculares. Se introduce un segui-miento cardiológico anual de estos pacientes aun estando asintomáti-cos como clase I, y se remite a las recomendaciones generales en caso de aparición de TV/FV o disfunción ventricular izquierda grave (clase I-C). Se mantiene la recomendación de clase IIb de implante de marcapa-sos ante cualquier grado de BAV que pueda aparecer en algunas dis-trofias (Steinert, Kearns-Seyre o de cinturas) por el riesgo de progre-sión rápida. También se ha incluido recomendación de DAI para la distrofia de Emery-Dreifuss y la de cinturas tipo 1B, asociadas a muta-ciones de la laminina A/C, especialmente malignas.
Pacientes embarazadasJunto a las dos recomendaciones que ya había en la guía de 2006 (cardioversión eléctrica [CVE] para TV mal tolerada/FV y bloqueado-res beta para el QT largo, ambas de clase I), se han añadido dos nuevas recomendaciones de clase I: permitir el empleo de metoprolol, pro-pranolol o verapamilo oral como tratamiento de mantenimiento para las TV sostenidas idiopáticas e implantar DAI durante el embarazo si aparece la indicación. No obstante, si se trata de una miocardiopatía periparto, se puntualiza que merece la pena esperar, ya que en casi la mitad de las pacientes remitirá espontáneamente. No se hace alusión al empleo del chaleco desfibrilador, pese a que cumpliría las mismas condiciones que en la miocarditis.
Se incluye como novedad una clasificación de los antiarrítmicos por su potencial teratogénico y recomendaciones respecto al tratamiento intravenoso agudo de la TV hemodinámicamente estable (sotalol o pro-cainamida, clase IIa) o inestable y refractaria a la CVE (amiodarona, IIa). Se destaca la contraindicación de fármacos IC (clase I), inhibidores de la enzima de conversión de la angiotensina (IECA) (teratogenicidad), antagonistas del receptor de la angiotensina II (ARA-II) (fetotoxicidad) y, aunque no hay datos en humanos, los inhibidores de la renina.
Resulta sorprendente que, en caso de taquicardias mal toleradas o refractarias a fármacos, la recomendación de ablación sea IIb. Además se echa en falta una recomendación expresa para la estrategia de «escopia 0».
Apnea obstructiva del sueñoTambién es una novedad la inclusión detallada de la apnea obstruc-tiva del sueño. Se indica que se debe considerar en el diagnóstico diferen-cial de las bradiarritmias (clase IIa) y como factor de riesgo de MS (IIb).
Fármacos inductores de proarritmiaSe simplifican las recomendaciones sustituyendo las tablas de la anterior por un enlace (http://www.crediblemeds.org) a una web de la Universidad de Arizona que recoge todos los medicamentos e inter-acciones que pueden afectar al QT. Se establecen solo dos recomenda-ciones respecto a los fármacos sospechosos de causar proarritmia: a) hay que retirarlos y descartar otras posibles causas (clase I), y b) valorar si, pese a retirarlos, el paciente sigue teniendo un riesgo sustancial de TV/FV que aconseje implantar DAI (clase IIa).
Muerte súbita tras trasplante cardiacoTras un trasplante cardiaco, el implante del DAI puede ser apro-piado para pacientes de alto riesgo: parada cardiaca, FEVI < 35%, vas-culopatía grave del injerto o síncope de origen no explicado.
Muerte súbita de deportistasSe mantiene la recomendación de clase I para la realización de una cuidadosa anamnesis de los atletas. Se insiste en la contradicción de recomendar (clase I) un estudio ecocardiográfico o una RM en caso de detectarse un ECG anormal que indique cardiopatía. La recomendación de ECG y exploración física tanto de jóvenes como en la mediana edad antes de iniciarse en el deporte es IIa (en la previa era de clase IIb).
Se ha añadido (IIa) un protocolo de evaluación de los «no jóvenes» que quieren empezar a practicar deporte, adaptado del propuesto por la European Association of Cardiovascular Prevention and Rehabilitation. Pivota en el nivel de deporte deseado y el SCORE de riesgo de la ESC, y recomienda historia clínica, examen físico y ECG para los pacientes de más riesgo. Es obvio que las razones para ello son económicas, de coste-efectividad, pero algunos estudios encuentran que el coste de esta estrategia es de 199 dólares por atleta, menor que el del equipo deportivo.
Finalmente, se introduce una recomendación de clase IIa para que entrenadores y personal de los recintos deportivos estén entrenados en reanimación cardiopulmonar y el uso de desfibriladores externos.
Síndrome de Wolff-Parkinson-WhiteSe definen dos recomendaciones para la ablación: pacientes recu-perados de parada cardiaca por FV inducida por fibrilación auricular (clase IB) y pacientes sintomáticos o con un periodo refractario (PRVAcc) ≤ 240ms (clase IIa-B). Esta última recomendación supone un cambio respecto a la última guía sobre taquicardias supraventricu-lares de la ACC/AHA/ESC de 2003, en la que la ablación de pacientes con síndrome de Wolff-Parkinson-White era de clase IB.
El paciente terminalSe incorporan dos recomendaciones de clase IIa y se reconoce la necesidad de: a) considerar la desactivación de las terapias antitaqui-cárdicas del DAI ante un deterioro de la situación clínica según los deseos del paciente o su familia, y b) recabar del paciente, antes de implantarle un DAI y durante el seguimiento, sus deseos sobre qué conducta seguir si sobreviniera esa situación.
CONFLICTO DE INTERESESNinguno.
Grupo de Trabajo de la SEC para la guía ESC 2015 sobre el tratamiento de pacientes con arritmias ventriculares y prevención de la muerte súbita cardiaca: Ignacio Fernández-Lozano (coordinador), Josep Brugada (coordinador), Javier Alzueta, Elena Arbelo, Fernando Arribas, Ignacio García-Bolao, José Luis Merino, Juan José Olalla, Joaquín Osca y Aurelio Quesada.
Revisores expertos para la guía ESC 2015 sobre el tratamiento de pacientes con arritmias ventriculares y prevención de la muerte súbita cardiaca: Jesús Almendral Garrote, Ignasi Anguera Camos, Ángel Arenal Maiz, Antonio Berruezo Sánchez, David Calvo Cuervo, Ernesto Díaz Infante, David Filgueiras Rama, Arcadio García Alberola, José Guerra Ramos, Javier Jiménez Candil, José Ormaetxe Merodio, Alonso Pedrote Martínez, Julián Pérez-Villacastín Domínguiez, Ricardo Ruiz Granell y Luis Tercedor Sánchez.
Comité de Guías de la SEC: Manuel Anguita (presidente), Ángel Cequier, Fernando Alfonso, Lina Badimón, José A. Barrabés, Ignacio Fernández Lozano, José Juan Gómez de Diego, Luis Rodríguez Padial, José Alberto San Román, Pedro-Luis Sánchez, Juan Sanchís y Alessandro Sionis.
En el anexo se relacionan los nombres de todos los autores del artículo.
Grupo de Trabajo de la SEC para la guía ESC 2015 sobre el tratamiento de pacientes con arritmias ventriculares y prevención de la muerte súbita cardiaca, revisores expertos para la guía ESC 2015 sobre el tratamiento de pacientes con arritmias ventriculares y prevención de la muerte súbita cardiaca y Comité de Guías de la SEC.