Recientemente hemos atendido a un paciente con endocarditis infecciosa (EI) que generó controversia sobre la indicación y el riesgo de realizar una colonoscopia.
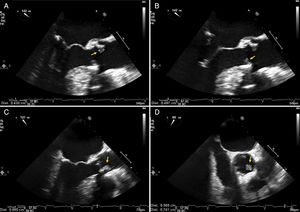
Un varón de 82 años, con antecedentes de hipertensión arterial y portador de una prótesis biológica en posición aórtica implantada 4 años antes, acudió con fiebre (39°C) de 2 días de evolución sin focalidad infecciosa. No se había sometido a tratamiento odontológico recientemente. En la exploración física destacaba el mal estado de varias piezas dentales y un soplo sistólico en el borde esternal izquierdo. El electrocardiograma no presentaba bloqueo auriculoventricular y la analítica mostraba ligera anemia (12,7 g/dl). La radiografía de tórax era normal. Se realizó una primera ecocardiografía transesofágica (ETE), que no evidenció alteraciones relevantes. En los hemocultivos se aisló Streptococcus agalatiae sensible a penicilina en los 4 frascos obtenidos. En una nueva ETE realizada el octavo día de ingreso, se evidenciaron en la prótesis aórtica vegetaciones de 3 y 8 mm (figura 1). Tras la primera ETE, se realizó una tomografía por emisión de positrones con 18F–FDG combinada con tomografía computarizada (PET/TC), que demostró una leve captación homogénea que no sugería EI (figura 2), aunque el paciente ya cumplía criterios de EI (1 mayor y 3 menores).
A y B: ecocardiografía transesofágica en la que se observan 2 imágenes móviles (flechas) sobre la cara ventricular de la válvula aórtica que corresponden a vegetaciones. C y D: el estudio de control demostró un aumento de tamaño (flechas) y ausencia de complicaciones periprotésicas.
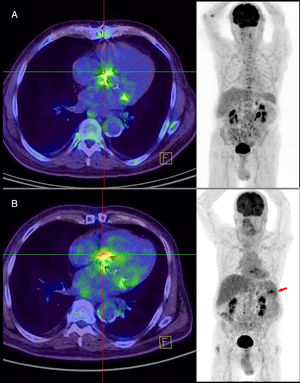
Tomografía por emisión de positrones con 18F-FDG. A: se muestra una captación indicio de endocarditis mucho más intensa que durante el primer episodio de endocarditis. B: se muestra una captación indicio de endocarditis en el segundo ingreso y se observa imagen de embolia séptica esplénica. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Se prescribió ceftriaxona 2g/24h durante 6 semanas y gentamicina 180 mg/24 h durante las primeras 2 semanas, ambas por vía intravenosa. Posteriormente, amoxicilina 1 g/6 h vía oral durante 2 semanas adicionales por artritis interapofisaria izquierda L3-L4. Mediante colonoscopia realizada en la quinta semana de tratamiento con ceftriaxona, se resecó un pólipo de 2 mm en el colon (adenoma tubular). A las 12 h de las exploración presentó fiebre; 4 días después de finalizar el tratamiento se obtuvieron nuevos hemocultivos, que evidenciaron aislamiento de Enterococcus faecium en los 4 frascos. El paciente refería febrícula desde hacía 7 días. No había nada reseñable en el examen físico. En la analítica se evidenció empeoramiento de la anemia (hemoglobina, 10,6g/dl) e incremento de la proteína C reactiva, 106mg/dl (0,1-10mg/dl). La ETE no evidenciaba ningún signo que indicara EI. La PET/TC puso de manifiesto una intensa captación de la prótesis aórtica, irregular, muy sospechosa de EI (figura 2), y una lesión esplénica hipometabólica con captación periférica, de aproximadamente 6 × 4cm, que indicaba embolia séptica. Por resistencia a ampicilina y gentamicina, se trató al paciente durante 6 semanas con daptomicina 700 mg/24 h y fosfomicina 2 g/6 h. La evolución clínica fue favorable y los hemocultivos de control, estériles.
Este caso nos ha permitido reflexionar, por una parte, sobre la intensidad de la búsqueda del posible foco infeccioso originario en la EI y, por otra, acerca de la prevención de la EI en pacientes sometidos a colonoscopia. En primer lugar, hay que destacar que, aunque la guía europea recomienda colonoscopia solo en los casos de EI por Streptococcus gallolyticus1, algunos autores aconsejan una búsqueda más intensa del probable foco originario en los mayores de 50 años (incluida la realización de colonoscopia)2. Considerando la edad del paciente y el posible origen intestinal de la infección (S. agalactiae), se decidió realizar la colonoscopia mientras se completaba el tratamiento antibiótico. La escasa relación entre la EI por S. agalactiae y el riesgo de cáncer de colon oculto encontrada en la literatura podrían justificar la omisión de colonoscopia. Lo más destacable del caso fue el desarrollo de un segundo episodio de EI por un microorganismo diferente (E. faecium). La administración tan prolongada de ceftriaxona pudo favorecer la proliferación colónica de E. faecium y la colonoscopia pudo generar un episodio de bacteriemia. No obstante, se debe destacar que en una revisión reciente3 solo se encontraron 25 casos de EI que se pudieran relacionar con procedimientos endoscópicos, lo que respalda la recomendación actual de no administrar profilaxis antibiótica1. Los microorganismos más frecuentemente implicados en estos casos son los enterococos y los estreptococos viridans4. Según la literatura revisada, este es el único caso de EI por enterococo tras colonoscopia realizada mientras el paciente cumplía tratamiento para EI. La bacteria causante del segundo episodio era resistente a la amoxicilina (antibiótico recomendado en esta antigua indicación). Se debe destacar que los recientes cambios en las guías de profilaxis antibiótica en los países occidentales han reducido sustancialmente el número de pacientes para los que se recomienda la profilaxis antibiótica. En paralelo con este hecho, se ha comunicado que la incidencia de EI podría estar aumentando significativamente desde la introducción de las nuevas recomendaciones5. Por todo lo expuesto, consideramos que, aunque el riesgo de EI de los pacientes sometidos a colonoscopia es bajo, no se puede descartar que haya un subgrupo de pacientes con mayor riesgo para quienes estaría justificada la profilaxis antibiótica.