La fibrilación auricular de origen no valvular (FANV) es la arritmia más frecuente en nuestro medio. Su incidencia guarda estrecha relación con la edad, con una prevalencia cercana al 25% en pacientes mayores de 80 años1. Entre los múltiples procesos asociados a la FANV, el accidente cerebrovascular de origen cardioembólico probablemente sea la complicación más grave, al tratarse de una patología con una elevada tasa de discapacidad y mortalidad2. Otro de los problemas asociados a la fibrilación auricular es la necesidad de tratamiento anticoagulante oral (ACO) para prevenir los eventos cardioembólicos. Esta necesidad se acentúa a edades avanzadas, pues el riesgo de presentar un evento es incluso superior1. Además, el riesgo de complicaciones asociadas al tratamiento anticoagulante y en especial el riesgo hemorrágico también aumenta en estos pacientes3. Actualmente, el cierre percutáneo de la orejuela izquierda (OI) es una alternativa para pacientes con FANV y contraindicación al tratamiento con ACO4,5.
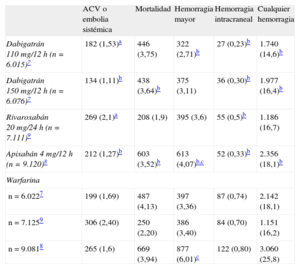
ANTICOAGULACIÓN ORAL: EFICACIA Y LIMITACIONESLa anticoagulación con antagonistas de la vitamina K se considera el tratamiento estándar de la FANV. El principal problema de estos fármacos es el incremento del riesgo de hemorragia, la necesidad de controles periódicos, la interacción con alimentos o fármacos y la inestabilidad de acción en algunos casos. Se estima que entre el 30 y el 50% de los pacientes con indicación de ACO no los reciben6. Con la introducción de los nuevos fármacos anticoagulantes como dabigatrán7, apixabán8 y rivaroxabán9, el manejo de estos pacientes podría cambiar. De todas maneras y pese a ofrecer un perfil de acción más estable y seguro, el riesgo de hemorragia, con una tasa anual entre el 2,1 y el 3,6%, continúa siendo el principal tendón de Aquiles de estos nuevos agentes (tabla). De hecho, registros más recientes indican que la incidencia de eventos cardioembólicos y hemorragias secundarias a dabigatrán podría ser similar a la de warfarina10. A pesar de la introducción de los nuevos agentes anticoagulantes, el porcentaje de pacientes con indicación que no reciben tratamiento con ACO persiste alrededor del 40%11. Ante el bajo cumplimiento terapéutico y la persistencia del riesgo hemorrágico, la necesidad de disponer de estrategias alternativas a la anticoagulación se ha convertido en una prioridad para estos pacientes.
Eficacia y seguridad de los nuevos anticoagulantes respecto a la warfarina
| ACV o embolia sistémica | Mortalidad | Hemorragia mayor | Hemorragia intracraneal | Cualquier hemorragia | |
| Dabigatrán 110 mg/12 h (n=6.015)7 | 182 (1,53)a | 446 (3,75) | 322 (2,71)b | 27 (0,23)b | 1.740 (14,6)b |
| Dabigatrán 150 mg/12 h (n=6.076)7 | 134 (1,11)b | 438 (3,64)b | 375 (3,11) | 36 (0,30)b | 1.977 (16,4)b |
| Rivaroxabán 20 mg/24 h (n=7.111)9 | 269 (2,1)a | 208 (1,9) | 395 (3,6) | 55 (0,5)b | 1.186 (16,7) |
| Apixabán 4 mg/12 h (n=9.120)8 | 212 (1,27)b | 603 (3,52)b | 613 (4,07)b,c | 52 (0,33)b | 2.356 (18,1)b |
| Warfarina | |||||
| n=6.0227 | 199 (1,69) | 487 (4,13) | 397 (3,36) | 87 (0,74) | 2.142 (18,1) |
| n=7.1259 | 306 (2,40) | 250 (2,20) | 386 (3,40) | 84 (0,70) | 1.151 (16,2) |
| n=9.0818 | 265 (1,6) | 669 (3,94) | 877 (6,01)c | 122 (0,80) | 3.060 (25,8) |
ACV: accidente cerebrovascular.
Las cifras expresan n (% anual).
La OI es un remanente embriológico cuya principal función es el control de la volemia. La OI está muy próxima a la arteria circunfleja izquierda y limita a nivel superior con la vena pulmonar superior izquierda y a nivel inferior con la válvula mitral. La morfología de la OI es extraordinariamente heterogénea de un paciente a orto, y es habitual que haya más de un lóbulo. En ritmo sinusal, la OI es una estructura contráctil que vacía todo su contenido en cada latido. En la fibrilación auricular, la OI pierde su capacidad contráctil y va dilatándose, lo que origina un enlentecimiento de la sangre, con el consecuente aumento del riesgo de trombosis. En estudios anatomopatológicos en pacientes con FANV, se ha observado que el 91% de los trombos localizados en la aurícula izquierda se encuentran dentro de la OI. Este hallazgo ha llevado a pensar que el cierre percutáneo de la OI podría ser una estrategia efectiva para prevenir el riesgo cardioembólico en pacientes con FANV.
El cierre percutáneo de OI está todavía en su fase inicial y deberán pasar unos años para tener una perspectiva más fiable de su papel en pacientes con FANV. A pesar que en un futuro podría constituir una alternativa real a los ACO para pacientes sin contraindicaciones, actualmente su uso debería reservarse a los pacientes con contraindicación al tratamiento anticoagulante tal y como recogen las guías europeas (indicación IIb)5. De hecho, la mayoría de los procedimientos se realizan en pacientes anticoagulados derivados del servicio de neurología tras un episodio de hemorragia intracraneal o del servicio de gastroenterología tras objetivar hemorragias digestivas recidivantes sin causa tratable. La ausencia de alternativas válidas a los ACO para prevenir el riesgo cardioembólico, que generalmente es alto por tratarse de pacientes añosos y pluripatológicos, convierte el cierre de OI en una opción muy atractiva para estos pacientes. La labilidad de la razón internacional normalizada o la aparición de un evento cardioembólico a pesar del tratamiento con ACO e razón internacional normalizada adecuada son otras situaciones en la que podría estar justificado el cierre percutáneo de OI. En todo caso, se hace necesaria una decisión multidisciplinaria e individualizada que evalúe no solo el riesgo cardioembólico y hemorrágico, sino también otros factores fundamentales como la efectividad del tratamiento, la fragilidad del paciente o el cumplimiento terapéutico, especialmente del tratamiento con ACO.
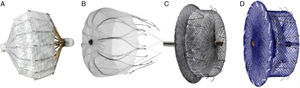
DISPOSITIVOS PERCUTÁNEOS DE CIERRE DE OREJUELA IZQUIERDAEl dispositivo PLAATO™ fue el primer sistema percutáneo de cierre de OI (fig. 1). A pesar de unos buenos resultados preliminares en cuanto a eficacia y seguridad, el programa de desarrollo se suspendió y el dispositivo desapareció del mercado.
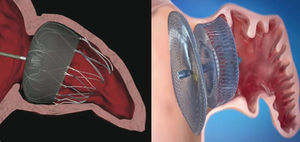
Actualmente, los dos dispositivos que más se utilizan en el mundo son el sistema Watchman™ (Boston Scientific; Boston, Massachusetts, Estados Unidos) y el Amplatzer™ Cardiac Plug (ACP) (St. Jude Medical; Minneapolis, Minnesota, Estados Unidos) (fig. 1). Al igual que el sistema PLAATO™, ambos dispositivos se implantan por vía transeptal a través de la vena femoral. Ambas prótesis son altamente flexibles y disponen de un sistema de guías estabilizadoras que se anclan a la pared de la OI y evitan así su embolización. No obstante, la principal diferencia entre los dos dispositivos radica en su forma. Mientras el sistema Watchman™ se implanta a 10 mm del ostium de la OI y por tanto no lo cubre, el ACP contiene un lóbulo que se implanta a 10-15 mm del ostium y un disco que cubre por completo el ostium de la OI (fig. 2). Una segunda generación del ACP llamada Amplatzer™ Amulet™ se ha introducido recientemente en el mercado. El dispositivo Amulet™ (fig. 1) mantiene la forma de lóbulo y disco del ACP, pero incorpora modificaciones que facilitan preparar e implantar el dispositivo y a la vez minimizan el riesgo de embolización y trombosis.
Posición de los dispositivos Watchman™ y Amplatzer™ Cardiac Plug tras el implante en orejuela izquierda. Dispositivo Watchman™ implantado a 10 mm del ostium de la orejuela izquierda (izquierda) y dispositivo Amplatzer™ Cardiac Plug con el lóbulo implantado a 10 mm del ostium y el disco cubriendo la entrada de la orejuela izquierda (derecha).
Tanto el sistema Watchman™ como el ACP disponen de numerosos registros que avalan su eficacia y su seguridad, pero ambos requieren una curva de aprendizaje de implantación no despreciable. El estudio PROTECT AF12, el único estudio aleatorizado que ha comparado warfarina con el cierre de OI (Watchman™) en pacientes con FANV, demostró que el cierre de la OI no es inferior a la warfarina para el objetivo primario (combinado de accidente cerebrovascular, embolia sistémica y muerte cardiovascular o no explicada), pero evidenció una preocupante tasa de eventos periprocedimiento, con una incidencia de derrame pericárdico grave del 4,4%. Este problema inicial se atribuyó a la curva de aprendizaje de los operadores, ya que a medida que aumentaba su experiencia, la tasa de complicaciones disminuía y el porcentaje de implantes con éxito mejoró de manera muy significativa. En la actualidad, con ambos dispositivos, los implantes exitosos son generalmente superiores al 95% y la tasa de derrames pericárdicos graves, < 2%.
CONSIDERACIONES TÉCNICASEl cierre percutáneo de OI es una técnica que requiere un equipo con experiencia en enfermedad congénita/estructural. A pesar que algunos grupos utilizan la ecografía intracardiaca o incluso tan solo el control angiográfico para guiar el procedimiento y evitar la intubación del paciente, la mayoría de los centros utilizan ecografía transesofágica (ETE) con anestesia general. La OI es una estructura de paredes muy finas y morfología heterogénea que puede contener microtrombos no visibles por ETE. La experiencia del operador es fundamental para minimizar la manipulación dentro de la OI y así reducir el riesgo de perforación y embolia periprocedimiento. Dos de los factores más importantes para minimizar la manipulación dentro de la OI son: a) realizar una punción transeptal baja y posterior que permita un abordaje frontal de la OI, y b) realizar una evaluación exhaustiva de la OI, a ser posible con ETE y angiografía, que permita conocer la morfología de la OI y disponer de unas medidas precisas que faciliten el proceso de selección del tamaño del dispositivo. En este sentido, se recomienda realizar las mediciones en situación de normovolemia, ya que el tamaño de la OI puede variar significativamente dependiendo del estado de hidratación del paciente. Durante el procedimiento, los pacientes tienden a estar deshidratados, y por eso se recomienda evaluar la presión en la aurícula izquierda y administrar líquidos para mantener una presión > 10 mmHg antes de realizar las mediciones.
Al ser un procedimiento relativamente nuevo, y pese a que la ETE es el estándar de imagen, la modalidad de imagen ideal aún no se conoce. La OI tiene una morfología oval en el 80% de los pacientes, por lo que es habitual tener diámetros dispares debido a la existencia de un eje corto y un eje largo. Esta discordancia puede pasar inadvertida utilizando técnicas de imagen bidimensional. Al igual que en otros procedimientos, como el recambio valvular aórtico percutáneo, la ETE tridimensional o la tomografía cardiaca deberían proporcionar información espacial que podría ayudar a optimizar la estrategia de implante y la selección del tamaño del dispositivo.
La presencia de fugas periprotésicas durante el seguimiento tiene todavía un significado incierto. En un subanálisis del estudio PROTECT AF no se detectó relación entre fugas y aparición de eventos clínicos. Por el contrario, en estudios realizados en pacientes sometidos a cirugía cardiaca coronaria a los que se practicó un cierre quirúrgico profiláctico de la OI, se observó que una escisión incompleta de la OI se asociaba a una tasa superior de eventos cardioembólicos. De momento y a la espera de disponer de nuevos estudios que confirmen o descarten esta relación, se debería intentar prevenir la aparición de fugas periprotésicas. En este sentido, se recomienda cierto grado de exceso de tamaño del dispositivo respecto a las medidas por ETE y angiografía, ya que se consigue reducir la tasa de fugas residuales sin aumentar el riesgo de rotura de la pared de la OI13.
Otro punto de controversia actual reside en las recomendaciones antitrombóticas tras el procedimiento. En el estudio PROTECT AF, se administraban ACO durante 45 días tras el implante y se suspendían si la ETE demostraba un cierre adecuado de la OI12. Recientemente, el estudio ASAP mostró que el tratamiento con ACO durante 45 días se puede sustituir por doble antiagregación (ácido acetilsalicílico 100mg/día y clopidogrel 75 mg/día)14. Actualmente la mayoría de los centros recomiendan doble antiagregación durante 1-3 meses y monoterapia antiagregante indefinidamente. La trombosis del dispositivo es una complicación poco frecuente pero que ya se ha descrito tanto con el dispositivo Watchman™ como con el ACP. Pese a ser una complicación que en la mayoría de los casos se resuelve con tratamiento anticoagulante durante 2 semanas, el potencial riesgo de embolia por migración del trombo hace que sea una de las complicaciones más temidas. En la única serie española publicada, se objetivó una alarmante tasa de trombosis de dispositivo en el 14% de los pacientes, en contraste con la tasa < 2% observada en otros registros mundiales15. Esta diferencia en el porcentaje de trombosis podría responder a una diferencia en la sensibilidad de detección, ya que en el registro español el protocolo de seguimiento con ETE fue mucho más extensivo (24 h y 1, 3, 6 y 12 meses) que en la mayoría de los centros donde solo se realiza una ETE entre los 3 y los 6 meses15. Dado que la mayoría de los casos de trombosis se produjeron durante el primer trimestre y todos se resolvieron con heparina sódica o enoxaparina durante 2 semanas, evaluar la posibilidad de tratamiento anticoagulante durante 3 meses o realizar un seguimiento más exhaustivo podría ser una opción futura, una vez se clarifique la verdadera incidencia de trombosis del dispositivo. En todo caso, es necesaria una valoración multidisciplinaria e individualizada en este tipo de pacientes, que en algunos casos presentan un riesgo hemorrágico tan elevado que incluso periodos cortos de anticoagulación podrían estar contraindicados.
CONCLUSIONES Y PERSPECTIVAS FUTURASA pesar de que la FANV ya es una de las enfermedades más frecuentes en nuestra sociedad, su prevalencia va aumentar en los próximos años debido al envejecimiento progresivo de la población. Por diferentes razones, entre un 30 y un 50% de los pacientes con indicación para ACO no los están tomando. El cierre de OI constituye hoy una alternativa para pacientes con FANV y contraindicación para el tratamiento anticoagulante. El cierre de OI es un procedimiento eficaz y seguro, pero requiere un equipo con experiencia en intervencionismo cardiaco estructural y se asocia a una curva de aprendizaje importante.
En el futuro, el cierre de OI podría ser una alternativa al tratamiento con ACO para todos los pacientes con FANV. Aunque el estudio PROTECT AF ya mostró que la eficacia del cierre de OI no era inferior al tratamiento anticoagulante, la curva de aprendizaje inicial condicionó una elevada tasa de complicaciones periprocedimiento. Los estudios PREVAIL y ACP son dos nuevos estudios aleatorizados que comparan el cierre de OI con el tratamiento con ACO en pacientes con FANV una vez superada la curva de aprendizaje inicial del procedimiento. El estudio PREVAIL compara el dispositivo Watchman™ frente a warfarina y el estudio ACP, el dispositivo ACP frente a warfarina y dabigatrán. Si los resultados de ambos estudios demuestran la no inferioridad del cierre de OI en comparación con la anticoagulación de pacientes con FANV, la utilización de este procedimiento podría ser mucho más amplia e incluso llegar a ser una alternativa a la anticoagulación para pacientes con un perfil de riesgo más bajo.
CONFLICTO DE INTERESESXavier Freixa es proctor de St. Jude Medical.