Desde el punto de vista epidemiológico, la importancia del problema de la cardiopatía isquémica en nuestro entorno es de primera magnitud por frecuencia, consumo de recursos y mortalidad. El aumento de la carga de enfermedad, unido al desarrollo tecnológico, aumenta el coste total. En un escenario de recursos limitados, es necesario administrarlos de la forma más eficiente posible. En España no existe una única agencia consolidada de evaluación de tecnologías sanitarias, y la fijación de precio y reembolso se rige fundamentalmente por criterios de oportunidad. En este artículo se recorre la forma de tomar decisiones clínicas en nuestro entorno y la eficiencia de los medicamentos, pruebas diagnósticas, procedimientos invasivos y dispositivos utilizados en la enfermedad coronaria. Se llama la atención sobre la necesidad de cambiar algunos paradigmas para afrontar de forma eficiente el reto del coste y la carga crecientes de la enfermedad coronaria en los próximos años, con unos recursos previsiblemente escasos. Para sostener nuestro sistema sanitario, los clínicos, los economistas de la salud, las autoridades sanitarias y la industria biomédica tendrían que intentar hablar un lenguaje común y buscar un punto de encuentro.
Palabras clave
Desde el punto de vista epidemiológico, la importancia del problema de la cardiopatía isquémica en nuestro entorno es de primera magnitud por frecuencia, consumo de recursos y mortalidad. Cuando hablemos de síndromes coronarios agudos (SCA), utilizaremos tasas de incidencia. En el término cardiopatía isquémica crónica englobamos la angina de esfuerzo estable y los pacientes con antecedentes de SCA pasada la fase aguda y utilizaremos tasas de prevalencia.
La carga económica y la mortalidad de la enfermedad coronaria (EC) se concentran en su fase aguda. Según los estudios clásicos, en 2002 hubo en España 68.500 casos de infarto agudo de miocardio (IAM)1. De ellos, 41.000 fueron hospitalizados y los demás murieron antes de llegar al hospital. El número de ingresos por angina inestable (AI) fue 33.500. Si tenemos en cuenta que el estudio de Framingham demostró que un 30% de los IAM son silentes, a los 68.500 IAM habría que añadir otros 30.000 silentes. Sumando a los IAM los 33.500 casos de AI, concluimos que en la primera década del siglo XXI hubo en España 132.000 SCA. Si tenemos en cuenta que la expectativa de vida promedio de los pacientes con SCA está en torno a 7 años, la cifra de pacientes con antecedentes de SCA ronda los 900.000 (132.000×7 años de expectativa de vida).
En estudios epidemiológicos más recientes, se diferencia entre SCA con y sin elevación del ST. El SCA sin elevación del ST es el más frecuente, con una incidencia anual del 3‰. La mortalidad hospitalaria del SCA con elevación del ST es mayor (el 7 frente al 4%), pero a los 6 meses son similares (el 12 y el 13%), y a los 2 años la mortalidad del SCA sin elevación del ST duplica la del SCA con elevación del ST, porque el primero lo sufren pacientes de más edad y con más comorbilidades2–4.
La prevalencia de angina en estudios poblacionales europeos fluctúa de un 0,1 a un 1% entre mujeres de 45–54 años y un 10–15% entre las de 65–74 años, y entre un 2–5% de los varones de 45–54 años y un 10–20% de los de 65–74 años. En la mayoría de los países europeos, la prevalencia es de unas 20.000–40.000 personas por millón. En España, tomando el límite bajo de 20.000 personas por millón (se trata de un país del área mediterránea), habría 940.000 personas con angina. La prevalencia de cardiopatía isquémica crónica se obtendría sumando a esta cifra la de los pacientes con antecedentes de SCA que nunca han tenido angina.
La cardiopatía isquémica ocasiona muchas muertes. De los pacientes ingresados con IAM en el estudio de Marrugat1, el 25% murió en el primer mes (el 31% del total: un 40% de los varones y un 24% de las mujeres). La tasa de morbilidad hospitalaria fue 352/100.000 habitantes (493/100.000 varones y 215/100.000 mujeres). En el año 2009, la tasa de mortalidad por EC fue 74,2 (61 mujeres, 86,8 varones)/ 100.000 habitantes5. Los avances en el tratamiento han reducido la mortalidad y el envejecimiento progresivo ha aumentado la morbilidad hospitalaria y la demanda asistencial. Hay tendencia a una menor incidencia de angina de esfuerzo y SCA debido al mejor control de factores de riesgo y a mejores tratamientos. Pero el aumento de la supervivencia aumenta la prevalencia, es decir, la carga de enfermedad6. Las cifras de hospitalizaciones por EC aumentaron de forma sostenida hasta la última década del siglo XX, pero han disminuido en la primera década del XXI7. Los supervivientes aumentan la demanda de tratamiento de las complicaciones de la EC como la insuficiencia cardiaca (IC) y el uso del intervencionismo coronario percutáneo (ICP) y de los dispositivos.
Costes de la enfermedad coronariaEl aumento de la carga de enfermedad, unido al desarrollo tecnológico que implica un mayor coste por paciente, aumenta el coste total. Para calcular los costes de la EC, se contabilizan los costes del control de los factores de riesgo, el uso de medicamentos, hospitalización, ICP, revascularización quirúrgica y uso de dispositivos en los pacientes con IC secundaria a EC. Los datos relativos al consumo de recursos por EC en nuestro país son escasos. Recientemente publicamos un estudio para describir el tratamiento del SCA en España y determinar sus consecuencias clínicas y económicas8. Se incluyó a pacientes con SCA con y sin elevación del ST. Se estudiaron variables sociodemográficas, comorbilidades, síndrome metabólico (SM), parámetros bioquímicos, uso de medicamentos, incidencia acumulada de eventos y costes.
Se incluyó a 1.020 pacientes; 632 (62%) con elevación del ST. Hubo un 56% de hipertensos, un 46% de dislipémicos y un 38% de diabéticos. El coste medio por paciente fue de 14.069 euros, el 87% debido a costes directos y un 13% por pérdida de productividad. Los costes se calcularon durante 2 años de seguimiento. Los costes de la atención primaria representaron el 20% y los de atención especializada el 67%. Los costes de hospitalización fueron el 63% del total. Los costes de los pacientes con más de un evento fueron de 22.750 euros, frente a 12.380 euros con un solo evento (p<0,001). La incidencia acumulada de mortalidad total fue del 14% y la de eventos cardiovasculares, del 16%. El estudio demostró que los pacientes con SCA tienen alto riesgo de sufrir nuevos eventos, lo que supone un coste extra. El 84,3% recibió ácido acetilsalicílico y el 78%, estatinas, porcentajes altos en comparación con otras series9–11.
El 87,1% fueron costes sanitarios directos, el 66,7% de atención especializada y el 20,4% de atención primaria. Los costes se desagregaron por cada capítulo de costes (tabla). Para estimar los costes futuros de la enfermedad coronaria, se puede emplear modelos que transforman eventos en costes, multiplicando el número de eventos por los costes directos e indirectos que generan. Con el creciente ritmo de desarrollo tecnológico y de prevalencia, los costes directos crecerían con tendencia exponencial de aquí a 2030, sin que esté claro cómo nuestra sociedad podrá asumir dichos costes12.
Detalle de los costes unitarios y de las pérdidas de productividad laboral.
| Coste unitario (euros) | |
| Visitas médicas | |
| Atención primaria | 22,74 |
| Urgencias | 115,23 |
| Hospitalización médica | 471,9 |
| Hospitalización quirúrgica | 786,5 |
| Visita atención especializada | 102,36 |
| Pruebas complementarias | |
| Laboratorio | 21,86 |
| Radiología convencional | 18,14 |
| Pruebas complementarias | 36,45 |
| Prescripción farmacéutica | (PVP + IVA) |
| Productividad laboral, costes indirectos, coste por día no trabajado | 54,65 |
IVA: impuesto al valor agregado; Procedimiento quirúrgico: realización de angioplastia coronaria; PVP: precio de venta al público.
En un escenario de recursos limitados, sobre todo si tenemos en cuenta la importancia social de la salud y la vida humana, es necesario administrar los recursos de la forma más eficiente posible. Paradójicamente, cuanto más creamos que el valor de la vida es incalculable, más importante es poner un precio a la salud para poder asignar los recursos de manera eficiente, es decir, obtener el mayor beneficio posible en salud con el menor gasto posible. En algunos países, como Canadá, Australia o Reino Unido, los criterios técnicos tienen mucho peso en la asignación de recursos. En Reino Unido, la agencia de evaluación de tecnologías sanitarias (National Institute for Clinical Excelence [NICE]) tiene mucha influencia. Francia dispone también de una única agencia de evaluación, la Comisión de Transparencia, que decide sobre el reembolso de medicamentos, pero sólo emplea marginalmente los criterios de eficiencia.
En España tenemos dos problemas: no existe una única agencia consolidada de evaluación de tecnologías sanitarias, sino múltiples agencias autonómicas, y la fijación de precio y reembolso se rige fundamentalmente por criterios políticos y de impacto presupuestario y no de coste-efectividad, por lo que en la toma de decisiones prevalecen las consideraciones de oportunidad frente a las de eficiencia. Muchos de los índices de calidad de prescripción al uso sólo son indicadores de ahorro y no de eficiencia, ya que no miden resultados en salud. La ausencia de una agencia única de evaluación contribuye a una desigualdad entre comunidades que vulnera el principio de equidad fundamentado en la igualdad de acceso y la administración de igual tratamiento para igual necesidad. Si ponemos como ejemplo el número de dispositivos implantados por millón de habitantes, en algunas comunidades autónomas duplica el de otras. En estas diferencias puede influir no sólo la diferente disponibilidad de la tecnología, sino también las preferencias profesionales o de planificación. Entre la población hay aversión a la desigualdad en salud y suele preferirse una intervención algo menos eficiente para toda la población que una más eficiente para una población privilegiada. La mortalidad por EC varía de una comunidad autónoma a otra. Aunque esto no implica desigualdad, ya que puede deberse a diferentes prevalencias de factores de riesgo, los datos son llamativos: la mortalidad por EC en Canarias, la más alta (108,6/100.000), duplica la del País Vasco, la más baja (55,4/100.000)5.
Umbrales de eficienciaUna de las herramientas para ayudar a las autoridades sanitarias a tomar decisiones es las evaluaciones económicas, que determinan cuánto cuesta obtener un resultado en salud con determinada estrategia de tratamiento. Una revisión de las evaluaciones publicadas entre 1999 y 2001 establece un umbral ampliamente aceptado para considerar eficiente una tecnología: 30.000 euros por año de vida ganado13. Esta cifra no es más que el umbral promedio que aceptaron los autores de las evaluaciones para considerar eficiente una tecnología, y es arbitrario. Hay que aceptar que estos umbrales son revisables y que no tienen por qué ser necesariamente los mismos para todos los países, dependiendo de los recursos y la disposición de la población a invertir en salud. Esto no implica discriminación, ya que puede haber el mismo acceso con precios más bajos.
La dificultad de incorporar las evaluaciones económicas a la toma de decisiones clínicas y las guías de práctica clínica reside en parte en la ausencia de un lenguaje común entre los expertos en evaluaciones económicas y los clínicos. Los primeros pueden tener dificultades para comprender el entorno asistencial. Los segundos no asumen fácilmente como propio el concepto de coste-efectividad.
Clínicos, sociedades científicas, guías y enfermedad coronariaLa toma de decisiones de los cardiólogos en la EC se articula en torno al concepto de disminución del riesgo a corto plazo (al menos, uno menor que la expectativa de vida del sujeto) que se evalúa en los ensayos clínicos. El análisis de decisión en economía de la salud y la investigación de resultados en salud utilizan como unidad básica de resultados el año de vida ganado o el año de vida ganado ajustado por calidad. Seguramente utilizar la disminución de riesgo a un plazo relativamente corto daría lugar a subestimar o sobrestimar la eficacia. A modo de ejemplo, una disminución de un 10% del riesgo de muerte hospitalaria de un varón de 40 años con SCA supone en torno a 5 años de vida ganados; un 20% de disminución del riesgo de muerte en un varón de 90 años, una ganancia de apenas 5 meses de vida. Si consideramos la carga futura de EC en nuestra sociedad, sería conveniente revisar si no tendría más sentido establecer las recomendaciones de las sociedades científicas midiendo la eficacia y la efectividad en términos de ganancia de expectativa de vida y no sólo de riesgo. De este modo se conseguiría, por un lado, hablar un lenguaje común y, por otro, tomar decisiones clínicas que maximicen el aumento de calidad y cantidad de vida, que sólo son equiparables a la disminución del riesgo en horizontes temporales largos.
Para transformar riesgo en expectativa de vida se puede medir directamente los años de vida en seguimientos muy largos o utilizar modelos de Markov, que permiten extrapolar y cuantificar los resultados de los ensayos clínicos en unidades analizables desde el punto de vista de la eficiencia. En otras palabras, no es lo mismo en términos de años de vida ganados salvar la vida a una persona de 20 años que a una de 90.
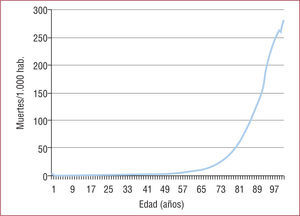
Edad avanzada y costes de la enfermedad coronariaSi consideramos que el gasto se acumula en edades avanzadas de la vida, en la que grandes gastos producen pequeños incrementos de expectativa de vida, resulta crucial cuantificar cuál es el impacto de las estrategias de tratamiento en las edades avanzadas. La mortalidad sigue una cinética gompertziana en función de la edad, es decir, que la tasa de mortalidad aumenta exponencialmente con esta14 (fig. 1).
Al incluir la edad como factor de riesgo en las guías de práctica clínica, se ignora el hecho de que es un factor no modificable y que, por lo tanto, las actuaciones en edades muy avanzadas producen muchas veces aumentos marginales de la expectativa de vida y, lo que es un argumento para actuaciones invasivas (identificar una población de alto riesgo), debería ser un argumento para lo contrario cuando el riesgo no es modificable. Con ciertas recomendaciones de las guías de práctica clínica, se corre el riesgo de concentrar los esfuerzos en poblaciones de mucha edad en las que el riesgo es alto, pero la expectativa de vida es corta y no modificable, lo que da lugar a actuaciones ineficaces e ineficientes. Las actuaciones invasivas producen un aumento del riesgo presente a cambio de un beneficio futuro que, cuando está amputado por comorbilidades o por la edad, condiciona, paradójicamente, una disminución de la expectativa de vida. Ciertas estrategias invasivas empiezan a mostrar su beneficio a partir de los 2 años y, por lo tanto, si la expectativa de vida es corta, el beneficio desaparece.
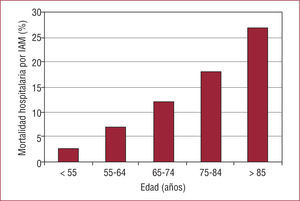
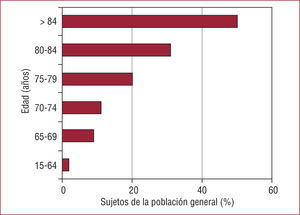
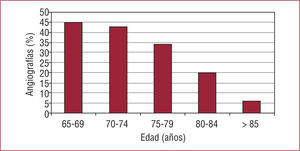
De manera intuitiva, muchos clínicos no aplican las recomendaciones para personas de edad avanzada, porque perciben que las actuaciones invasivas pueden ser estériles o contraproducentes. En el documento «El anciano con cardiopatía terminal», de la SEC, se explica que los ancianos constituyen un grupo heterogéneo y que es necesario limitar ciertos esfuerzos en un grupo con problemas particularmente graves15. Esta afirmación tiene mucho sentido, pero quizá lo tenga más aún considerar la relación de la edad con la mortalidad como un continuo. En este escenario, algunas actuaciones invasivas en sujetos ancianos con EC, en ausencia de ensayos clínicos específicos para esta edad, deben cuantificarse de forma precisa para evitar asumir un riesgo presente a cambio de un beneficio futuro que no existe. En las figuras se muestra cómo la mortalidad por EC aumenta exponencialmente con la edad y, además, lo hace con independencia de las intervenciones que se practiquen (fig. 2)16 y cómo la carga social y económica se concentra en el grupo de más edad (fig. 3). Además, se muestra cómo el número de angiografías coronarias indicadas disminuye con la edad, ya que refleja que los clínicos tomarían las decisiones intuitivamente en función de la expectativa de vida y no en función del riesgo (fig. 4). Es interesante que, en el pie de figura original, los autores señalen que esto ocurre a pesar de tratarse de grupos de más riesgo. En realidad, la pregunta que habría que contestar es si no será que la toma intuitiva de decisiones de los clínicos en la práctica diaria es más acertada que lo que recomiendan las guías de práctica clínica.
Tasa de mortalidad intrahospitalaria debida a infarto agudo de miocardio y estratificada según la edad de los pacientes. Se produce un aumento significativo del porcentaje de pacientes que mueren a medida que avanza la edad. Esta progresión es rápida e independiente de las intervenciones que se practiquen. Adaptado de Krunholz et al16, con permiso.
Porcentaje de la población general que necesita asistencia personal para realizar tareas cotidianas, según datos del Departamento de Comercio de Estados Unidos. La discapacidad aumenta drásticamente a partir de los 65 años, de forma que un 50% de la población alcanza los 85 años con algún tipo de asistencia personal.
. El número de angiografías coronarias practicadas a pacientes ancianos que han sufrido un infarto agudo de miocardio disminuye con la edad. Entre los 65 y los 69 años esta intervención se practica en un 45% de los casos, proporción que disminuye sensiblemente con la edad y apenas alcanza al 8% de los pacientes de edad ≥ 85 años. (Datos procedentes del registro nacional estadounidense de pacientes que han tenido un infarto de miocardio, de un total de 1.249 hospitales.)
Las nuevas guías de práctica clínica para el SCA sin elevación del ST de la Sociedad Europea de Cardiología (ESC) tienen el acierto de seleccionar la troponina y el electrocardiograma como criterios para identificar a los pacientes con alto riesgo reversible17. Incluyen recomendaciones de estratificar sistemáticamente el pronóstico utilizando una escala de riesgo isquémico (p. ej., GRACE) y otra de riesgo hemorrágico (p. ej., CRUSADE). Recomiendan el ticagrelor para pacientes de riesgo moderado o alto; el prasugrel para pacientes que no hayan tomado previamente un inhibidor del receptor P2Y12 y sean candidatos a ICP; el clopidogrel para los que no puedan tomar prasugrel o ticagrelor; el fondaparinux, por su perfil más favorable de eficacia-seguridad, en riesgo bajo o moderado-alto antes que la enoxaparina, etc. Todo ello con un sólido respaldo de ensayos clínicos, pero sin hacer ninguna evaluación de la eficiencia. Las guías recomiendan una estrategia invasiva urgente (< 2h) para pacientes de muy alto riesgo isquémico, una estrategia invasiva precoz (< 24h) para pacientes con puntuación GRACE > 140 y una estrategia invasiva diferida (< 72h) para pacientes con menor riesgo. Recomiendan utilizar stents recubiertos según la valoración individual del riesgo-beneficio y teniendo en cuenta la reducción en la necesidad de revascularización repetida. Otra vez, se echa de menos datos farmacoeconómicos en las guías de la ESC. En las guías del NICE18, que generalmente cuentan con más recomendaciones farmacoeconómicas, también se condiciona la estrategia de tratamiento a una escala de riesgo como GRACE, en que la edad resulta ser un factor determinante y da lugar a los problemas ya comentados.
Los ensayos que comparan estrategias basadas en GRACE solucionan en parte el problema de utilización del riesgo como paradigma19. En el estudio TIMACS20 se aleatorizó el cateterismo precoz (< 24h) y tardío (> 36h) y se demostró que la estrategia precoz redujo la frecuencia de eventos a los 6 meses, especialmente en el subgrupo de alto riesgo según el modelo GRACE. En otro ensayo21 se aleatorizó el SCA sin elevación del ST a intervención inmediata o diferida (24–48h). La frecuencia de eventos fue superior con la intervención inmediata debido a infarto periprocedimiento. Otra vez queda sin cuantificar en qué medida los infartos periprocedimiento modifican la expectativa de vida.
Eficiencia de los medicamentos en la enfermedad coronariaEl uso de medicamentos, al no concentrar el riesgo en un periodo limitado, no exige necesariamente una expectativa de vida larga para justificar su uso. Las evaluaciones económicas con antiagregantes arrojan a veces resultados contradictorios. Gaspoz et al22 publicaron en New England Journal of Medicine un artículo sobre el análisis de coste-efectividad de la aspirina, el clopidogrel o la combinación de estos en prevención secundaria, y demostraron que la aspirina tiene una relación coste-efectividad excelente (11.000 dólares por año de vida ganado), y la del clopidogrel es 31.000 dólares por año de vida ganado sólo en contraindicación a la aspirina. El uso de clopidogrel para todos los pacientes o la administración de los dos fármacos tenía una razón coste-efectividad excesiva, de 130.000 dólares por año de vida ganado. En otro trabajo23, el clopidogrel tuvo coste-efectividad de 8.132 euros por año de vida. Los autores del estudio CURE24 concluyeron que la doble antiagregación reduce significativamente los eventos en un 20%. En el estudio CREDO25 se produjo también una importante reducción de los eventos y sus autores mostraron también la eficiencia de la doble antiagregación24.
Desde el año 2002, las guías clínicas han incorporado el intervencionismo temprano en el SCA avaladas por varios estudios (FRISC, RITA). El trabajo de De Winter et al26 (ICTUS), sin embargo, no demuestra la superioridad del abordaje invasivo precoz sistemático sobre el guiado por clínica. El estudio ICTUS plantea la necesidad de una evaluación económica para aclarar cuál de las dos aproximaciones es más eficiente.
Eficiencia de estrategias diagnósticas en la enfermedad coronariaEs fácil aceptar que, fuera del ámbito de la investigación, sólo se justifica el uso de pruebas diagnósticas complejas y costosas cuando se espera un beneficio. Un estudio que ha despertado gran polémica analizó la utilidad de la tomogammagrafía de perfusión o la ecocardiografía con dobutamina para evaluar la viabilidad miocárdica y predecir el beneficio de la cirugía en pacientes con disfunción ventricular isquémica del ensayo STICH27. La detección de miocardio viable no predijo un mayor beneficio de la revascularización.
El uso de estudios de coste-efectividad para evaluar un test diagnóstico exige que el comparador sea adecuado. En un trabajo reciente, se concluye que la resonancia magnética cardiaca reduce el coste frente a la coronariografía directa en pacientes con sospecha de EC, pero no se compara con ecocardiografía de estrés28. Las técnicas de imagen pueden contribuir a reducir costes. La reducción del coste con la tomografía computarizada coronaria es llamativa, con una prevalencia del 50%: realizar una tomografía computarizada coronaria antes del cateterismo cardiaco produce un ahorro medio de 789 dólares por paciente. Por lo tanto, es una estrategia coste-efectiva en estos pacientes y puede ahorrar costes y evitar procedimientos invasivos innecesarios29.
Hablando de diagnóstico y haciendo una reivindicación de la clínica, se puede terminar este apartado comentando que algo tan sencillo como disminuir la ansiedad del paciente puede disminuir los costes hospitalarios, ya que los síntomas de ansiedad se solapan con los de la EC y la ansiedad resulta en un mayor coste en pruebas diagnósticas y estancia30.
Eficiencia del intervencionismo en la enfermedad coronariaSi con el uso de medicamentos hay cierta polémica en cuanto a la eficiencia, cuando hablamos de dispositivos la situación es más compleja aún, porque la regulación es mucho más laxa para los dispositivos que para los medicamentos y los datos de eficacia muchas veces están incompletos. Respecto a la utilización de stents recubiertos, el coste es el factor limitante. En nuestro medio, el precio es un 60–80% mayor que el de los convencionales, y sabemos que no disminuyen la mortalidad31.
En Canadá, el estudio de coste-utilidad de Shrive et al32 estimó el coste del stent con sirolimus por año de vida ajustado a calidad en 58.721 dólares canadienses, comparado con el convencional. Otro estudio33 encontró que el coste por revascularización evitada era de 23.067 dólares canadienses. Otro análisis de coste-efectividad realizado por una agencia de evaluación de tecnologías médicas de Canadá34 mostró un coste por revascularización evitada de 12.527 a 29.048 dólares canadienses desde la perspectiva del hospital y de 11.133 a 27.687 dólares canadienses desde la perspectiva del sistema de salud. Un análisis de subgrupo indica que el stent recubierto fue económicamente dominante en pacientes con lesiones largas en vasos pequeños35. Hay que destacar que este coste por revascularización evitada, si no se transforma en años de vida ajustados por calidad, simplemente no resulta interpretable.
En Reino Unido, Bagust et al36 estimaron la diferencia de precio necesaria entre el stent recubierto y el convencional para considerar que el primero es coste-efectivo en 309 euros. Los autores concluyeron que, con los actuales precios de los stents en Reino Unido, el stent recubierto no es coste-efectivo. Conviene destacar que sería suficiente con disminuir el precio para que resultaran coste-efectivos.
Eficiencia de los dispositivos en la enfermedad coronariaEn España ha aumentado significativamente el número de desfibriladores automáticos implantables (DAI). La relación coste-efectividad del DAI depende del subgrupo de pacientes analizados y de factores determinantes como el riesgo de muerte súbita cardiaca, la fracción de eyección del ventrículo izquierdo, el coste del dispositivo y otros aspectos tecnológicos, la calidad de vida y el horizonte temporal. Aunque hay variaciones en los estudios, los pacientes más graves se benefician más del DAI, con una relación coste-efectividad más atractiva37.
Respecto a los últimos años, en 2010 se reanudó la tendencia al crecimiento de las indicaciones de DAI por prevención primaria38. El número de implantes ha continuado creciendo en nuestro país, hasta situarse en 100 implantes por millón de habitantes. Los implantes de DAI por prevención primaria, generalmente en pacientes con EC, constituyen el 60% del total de primoimplantes realizados. El número de implantes en nuestro país sigue siendo ostensiblemente inferior a la media de los países más desarrollados de la Unión Europea y persisten importantes diferencias entre comunidades autónomas en los implantes comunicados al registro.
Un artículo recientemente publicado en REVISTA ESPAÑOLA DE CARDIOLOGÍA concluye que la terapia de resincronización cardiaca sin desfibrilador puede ser una opción coste-efectiva para pacientes seleccionados. El coste por año de vida ajustado a calidad de la resincronización frente a medicación fue de 28.612 euros y el de la resincronización con DAI, 53.547 euros/año de vida ajustado a calidad respecto a la resincronización sin DAI39.
Una mirada al futuroHay mucho camino por recorrer para afrontar de manera eficiente el reto del coste y la carga crecientes de la EC en los próximos años con los recursos previsiblemente escasos de que dispondremos. Para sostener nuestro sistema sanitario, los clínicos, las sociedades científicas, los economistas de la salud, los responsables políticos, las autoridades sanitarias y la industria biomédica tendrán que aprender un lenguaje común y buscar un punto de encuentro. Para ello parece imprescindible aceptar al menos que se pongan en cuestión algunos paradigmas universalmente aceptados en la EC y disponer de registros completos y complejos que ayuden a la toma de decisiones cuyo objetivo sea maximizar la expectativa y la calidad de vida con un coste asumible36.
Conflicto de intereses