Los avances en la detección precoz y el tratamiento del cáncer han reducido de manera significativa la mortalidad de los pacientes. Sin embargo, mejorar el pronóstico no es solo curar el tumor, sino prevenir, diagnosticar y tratar eficazmente las complicaciones derivadas de las terapias onco-hematológicas. La toxicidad cardiovascular es un problema ampliamente reconocido con múltiples esquemas terapéuticos; sin embargo, la evidencia científica en el manejo de las complicaciones cardiovasculares de pacientes onco-hematológicos es escasa, pues sistemáticamente se ha excluido de los ensayos clínicos a estos enfermos y las recomendaciones actuales están basadas en consensos de expertos. Es imprescindible crear equipos multidisciplinarios locales para optimizar los resultados en salud de los supervivientes al cáncer. Una preocupación excesiva por la aparición de toxicidad cardiovascular puede impedir terapias potencialmente curativas, mientras que la subestimación de este riesgo compromete el pronóstico vital a largo plazo. El objetivo de este documento, elaborado en colaboración con la Sociedad Española de Cardiología, la Sociedad Española de Oncología Médica, la Sociedad Española de Oncología Radioterápica y la Sociedad Española de Hematología, es actualizar los conocimientos aplicables a la práctica clínica diaria de la cardio-onco-hematología y promover el desarrollo de equipos multidisciplinarios locales que mejoren la salud cardiovascular de los pacientes con cáncer.
Palabras clave
Las enfermedades cardiovasculares (ECV) son, junto con las segundas neoplasias, la principal causa de muerte de los supervivientes al cáncer y su tratamiento plantea un enorme reto1. Los tratamientos onco-hematológicos triplican el riesgo de eventos cardiovasculares a medio y largo plazo2–4, pero la evidencia científica en su manejo es escasa. Los equipos de cardio-onco-hematología reúnen a los profesionales implicados en la atención de pacientes con cáncer, con el objetivo de facilitar el tratamiento y minimizar la toxicidad cardiovascular5,6. El desarrollo de protocolos locales de prevención y tratamiento precoz de la cardiotoxicidad evita las suspensiones precoces de los antitumorales, optimiza los resultados en salud y reduce costes. Los equipos de cardio-onco-hematología son herramientas de control de calidad en el cuidado de la salud y deben coordinar la investigación y la educación médica continuadas en su campo7.
DEFINICIÓN DE CARDIOTOXICIDAD SECUNDARIA A TRATAMIENTOS ONCO-HEMATOLÓGICOSLa cardiotoxicidad se define como el conjunto de ECV derivadas de los tratamientos onco-hematológicos, con criterios diagnósticos similares a los utilizados en la población general (tabla 1 y tabla 2 del material suplementario)8. Una de las complicaciones más frecuentes, pero que genera más controversia, es la disfunción ventricular (DV) secundaria a cardiotóxicos (DV-CTOX). Se define como una reducción de la fracción de eyección del ventrículo izquierdo (FEVI) > 10% respecto al valor basal con FEVI inferior al límite normal. La Sociedad Europea de Cardiología identifica el 50%9 como punto de corte de normalidad, al igual que registros previos10. Sin embargo, en pacientes tratados con antraciclinas11 y trastuzumab12, una FEVI en rango bajo-normal (50-55%) aumenta de forma significativa el riesgo de DV-CTOX. Por ese motivo, y en concordancia con las recomendaciones de cuantificación de cámaras cardiacas13, la Sociedad Americana de Ecocardiografía y la Asociación Europea de Imagen Cardiovascular utilizan el 53% como límite normal14. Ambos documentos destacan la importancia de una monitorización reproducible de la FEVI, así como la necesidad de iniciar precozmente el tratamiento de la DV-CTOX para favorecer la recuperación funcional15,16.
EVALUACIÓN DEL RIESGO Y ESTRATEGIAS PARA PREVENCIÓN DE LA CARDIOTOXICIDADEvaluación del riesgo de cardiotoxicidadCáncer y corazón comparten múltiples factores de riesgo17. Actualmente no se dispone de escalas prospectivas que valoren de forma conjunta el riesgo cardiovascular (RCV) y de cardiotoxicidad, y las escalas tradicionales subestiman el riesgo asociado al tratamiento del cáncer3. A pesar de esta limitación, se recomienda estratificar el RCV con las tablas SCORE antes de iniciar el tratamiento antitumoral (figura 1)18 y evaluar la presencia de los factores, detectados en estudios retrospectivos y registros, que aumentan el riesgo de eventos cardiovasculares durante el tratamiento antitumoral (tabla 1)9–12,14,19,20.
Estratificación del riesgo cardiovascular18. DL: dislipemia; DM: diabetes mellitus; ECV: enfermedad cardiovascular; FG: filtrado glomerular; FRCV: factor de riesgo cardiovascular; HTA: hipertensión arterial; IRC: insuficiencia renal crónica; RCV: riesgo cardiovascular. aEn la sección multimedia de la web de la Sociedad Española de Cardiología, está disponible una aplicación para el cálculo del SCORE. bIndependientemente del SCORE calculado (%), la presencia de estos factores se asocia con un RCV alto o muy alto.
Factores de riesgo de disfunción ventricular, en pacientes tratados con fármacos antitumorales y radioterapia (si el volumen de irradiación incluye, total o parcialmente, el corazón)9–12,14,19,20
| Factores de riesgo de DV-CTOX | Antraciclinas | Anti-HER2 | Anti-VEGF | Radioterapia torácica |
|---|---|---|---|---|
| Factores genéticos | X | |||
| Dosis acumulada | X | ≥ 35 Gy o ≥ 2 Gy/día | ||
| Mujeres | X | X | ||
| < 15 o > 65 años | X | X | X | |
| Hipertensión arterial | X | X | X | |
| Cardiopatía isquémica | X | X | X | X |
| FEVI en rango bajo de la normalidad (50–55%) antes del tratamiento11,12 | X | X | ||
| Historia de insuficiencia cardiaca/DV-CTOX | X | X | X | |
| Tratamiento combinado antitumorales* y radioterapia torácica | X | X | X | X |
| Insuficiencia renal | X | |||
| Obesidad (IMC > 30) y sedentarismo | X | |||
| Tiempo transcurrido desde el tratamiento | X |
anti-HER2: fármacos que bloquean el receptor 2 del factor de crecimiento epidérmico humano; anti-VEGF: fármacos inhibidores del factor de crecimiento del endotelio vascular; DV-CTOX: disfunción ventricular secundaria a cardiotóxicos; FEVI: fracción de eyección del ventrículo izquierdo; IMC: índice de masa corporal.
Para todos los pacientes, independientemente del tratamiento previsto:
- •
Promoción de un estilo de vida cardiosaludable con programas de ejercicio físico regular21.
- •
Identificación y control estricto de los factores de RCV (FRCV) antes, durante y después del tratamiento. Los objetivos terapéuticos, similares a los de población general, se resumen en la tabla 218,22.
FRCV Objetivos cLDL* Riesgo muy alto, < 70 mg/dl
Riesgo moderado/alto, < 100 mg/dlPresión arterial < 140/90 mmHg
< 140/85 mmHg (diabetes mellitus o insuficiencia renal crónica)HbA1c < 7% (> 75 años, 7,5–8%) Dieta Cardiosaludable Tabaco No Ejercicio ≥ 150 min semanales de ejercicio moderado cLDL: colesterol unido a lipoproteínas de baja densidad; FRCV: factores de riesgo cardiovascular; HbA1c: glucohemoglobina.
Durante la administración de tratamientos potencialmente cardiotóxicos:
- •
Reducción del efecto cardiotóxico directo mediante la utilización de esquemas terapéuticos menos cardiotóxicos (formulaciones liposomales)9,23.
- •
Uso de agentes cardioprotectores en prevención primaria.
- –
Dexrazoxano: reduce el riesgo de DV-CTOX por antraciclinas, pero su utilización es controvertida y excepcional en nuestro medio9.
- –
Bloqueadores beta (carvedilol y nebivolol): previenen la reducción de la FEVI y disminuyen la incidencia de insuficiencia cardiaca (IC) durante el tratamiento con trastuzumab y/o antraciclinas24,25.
- –
Inhibidores de la enzima de conversión de la angiotensina (IECA): el enalapril previene el deterioro de la FEVI en pacientes con elevación de troponinas durante el tratamiento con antraciclinas26.
- –
Terapias de combinación: el estudio OVERCOME demostró una disminución de la DV y una menor incidencia de muerte o IC en pacientes hematológicos tratados con carvedilol y enalapril frente a placebo27. En pacientes con cáncer de mama, el estudio PRADA demostró el efecto cardioprotector de candesartán (no de la combinación candesartán y metoprolol) frente a placebo28.
- –
Estatinas: se ha demostrado in vitro y en estudios retrospectivos que las estatinas de alta potencia reducen el daño celular y el riesgo de IC de los pacientes en tratamiento con antraciclinas9,23,24.
- –
Los datos iniciales respaldan el uso de inhibidores de la aldosterona23 en prevención de IC.
- –
Actualmente no se recomienda iniciar cardioprotectores sistemáticamente en todos los pacientes con cáncer, pero sí optimizar su uso si hay una cardiopatía previa y/o hipertensión arterial (HTA). Podría considerarse el tratamiento en prevención primaria para pacientes con RCV alto o muy alto o que hayan recibido fármacos cardiotóxicos en el pasado y precisen nuevos tratamientos antitumorales9,18.
ALGORITMOS DE MONITORIZACIÓN Y DIAGNÓSTICO DE LA CARDIOTOXICIDADSeguimiento clínicoAdemás de optimizar el RCV y considerar estrategias de prevención primaria, los equipos de cardio-onco-hematología deben coordinar la monitorización de los tratamientos antitumorales para identificar y tratar precozmente posibles complicaciones cardiovasculares (tabla 3)7,9,14. Se recomienda remitir a cardiología a aquellos pacientes con mal control de FRCV, alteraciones significativas en estudios de imagen o biomarcadores y/o síntomas indicativos de cardiopatía, para evaluar la necesidad de tratamiento cardiológico y/o monitorización intensiva9,14.
Equipos multidisciplinarios de Cardio-Onco-Hematología7,9,14
| Objetivos de los equipos locales de Cardio-Onco-Hematología |
|---|
| 1. Agilizar la comunicación entre los profesionales implicados en el proceso del cáncer |
| 2. Desarrollar protocolos locales de prevención, diagnóstico y tratamiento precoz de las complicaciones cardiovasculares |
| 3. Estratificar el riesgo cardiovascular del paciente oncológico |
| 4. Facilitar el tratamiento oncológico (evitar repeticiones de estudios, listas de espera, etc.) |
| 5. Evitar interrupciones en la administración del tratamiento antitumoral |
| 6. Registrar y analizar los resultados en salud y calidad |
| Consulta de Cardio-Onco-Hematología |
|---|
| 1. Optimizar el control de los factores de riesgo y/o enfermedad cardiovascular |
| 2. Optimizar medidas terapéuticas de protección cardiaca |
| 3. Identificar y tratar precozmente posibles toxicidades cardiovasculares (mantener alta sospecha clínica) |
| 4. Programar el seguimiento de los supervivientes al cáncer |
Son herramientas de detección precoz de daño miocárdico9,14,29,30. Se recomienda la determinación de troponinas en situación basal y antes de cada ciclo31. Se detecta elevación precoz (< 72 h) de troponina I (TnI) (> 0,08 ng/dl) en un tercio de los pacientes tratados con antraciclinas32. La elevación persistente de la TnI durante el tratamiento del cáncer identifica a pacientes con peor pronóstico cardiovascular, que podrían beneficiarse de tratamiento con IECA para reducir el riesgo de ECV sin necesidad de suspender o modificar el tratamiento antitumoral14,32. El uso de la fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP), marcador diagnóstico de IC, así como el de otros biomarcadores y/o con otros antitumorales, está menos definido como predictor de DV31.
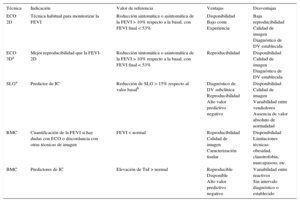
Técnicas de imagenLa ecocardiografía aporta una valoración cardiaca general y es la técnica de elección para la evaluación seriada de la FEVI. La FEVI bidimensional (2D) ha mostrado baja sensibilidad para detectar cambios menores en la función cardiaca, ya que su variabilidad está próxima al intervalo diagnóstico de DV-CTOX (8–11%)33. El uso de contrastes y la revisión sistemática de estudios previos13 mejoran la precisión diagnóstica. Siempre que esté disponible y en centros con experiencia, la FEVI tridimensional tiene menos variabilidad (5,8%)34 y es la técnica ecocardiográfica recomendada para monitorizar el tratamiento (tabla 4)9,14,35,36. Por falta de disponibilidad, el uso de la resonancia magnética cardiaca, patrón de referencia para la cuantificación de la FEVI, está limitado a pacientes con dudas en la valoración ecocardiográfica9,14,37. Actualmente la ventriculografía isotópica no se debe considerar de elección para monitorizar tratamientos onco-hematológicos, por el riesgo que conlleva la radiación ionizante9.
Técnicas de imagen cardiaca y biomarcadores en la monitorización del tratamiento antitumoral9,14,35,36
| Técnica | Indicación | Valor de referencia | Ventajas | Desventajas |
|---|---|---|---|---|
| ECO 2D | Técnica habitual para monitorizar la FEVI | Reducción sintomática o asintomática de la FEVI > 10% respecto a la basal, con FEVI final < 53% | Disponibilidad Bajo coste Experiencia | Baja reproducibilidad Calidad de imagen Diagnóstico de DV establecida |
| ECO 3Da | Mejor reproducibilidad que la FEVI-2D | Reducción sintomática o asintomática de la FEVI > 10% respecto a la basal, con FEVI final < 53% | Reproducibilidad | Disponibilidad Calidad de imagen Diagnóstico de DV establecida |
| SLGa | Predictor de IC | Reducción de SLG > 15% respecto al valor basalb | Diagnóstico de DV subclínica Reproducibilidad Alto valor predictivo negativo | Disponibilidad Calidad de imagen Variabilidad entre vendedores Ausencia de valor absoluto de normalidad |
| RMC | Cuantificación de la FEVI si hay dudas con ECO o discordancia con otras técnicas de imagen | FEVI < normal | Reproducibilidad Calidad de imagen Caracterización tisular | Disponibilidad Limitaciones técnicas: obesidad, claustrofobia, marcapasoss, etc. |
| BMC | Predictores de IC | Elevación de TnI > normal | Reproducible Disponible Alto valor predictivo negativo | Variabilidad entre reactivos Sin intervalo diagnóstico o establecido |
2D: bidimensional; 3D: tridimensional; BMC: biomarcadores; DV: disfunción ventricular; ECO: ecocardiografía; IC: insuficiencia cardiaca; FEVI: fracción de eyección del ventrículo izquierdo; RMC: resonancia magnética cardiaca; SLG: strain longitudinal global; TnI: troponina I.
En el desarrollo de DV-CTOX, el inicio del tratamiento de la IC basado solo en FEVI-2D no siempre asegura la recuperación funcional38. Las nuevas tecnologías, como el speckle-tracking 2D, identifican el daño miocárdico en una fase más precoz, estudiando la deformación miocárdica o strain39. En situación basal, el strain longitudinal global (SLG) mejora la estratificación del riesgo de DV-CTOX frente a la FEVI-2D40. Durante el tratamiento antitumoral, el SLG detecta daño miocárdico precozmente y con menos variabilidad que la FEVI (intraobservador, < 4%; interobservador, < 6%)41–45. Se recomienda evaluar los cambios relativos en el SLG, en lugar de valores absolutos, y siempre con el mismo equipo y software de cuantificación. Descensos del SLG > 15% con respecto al basal identifican daño estructural cardiaco (estadio B de la IC)9,14,46. El uso combinado de SLG y TnI mejora el valor predictivo negativo para DV y, por lo tanto, la estratificación del riesgo de IC9,14.
Algoritmos de monitorización de pacientes con riesgo de disfunción ventricular secundaria a cardiotóxicosValoración inicialPermite discutir opciones terapéuticas y programar la monitorización. Debe incluir: a) anamnesis y exploración física (excluir cardiopatía); b) electrocardiograma (descartar arritmias, signos de isquemia o anomalías en el intervalo QTc); c) valoración estructural y funcional del corazón mediante ecocardiograma y biomarcadores (tabla 3 del material suplementario y tabla 4); d) consejo estructurado sobre hábitos de vida cardiosaludable, y e) estratificación del RCV, optimización del tratamiento de los FRCV y la eventual cardiopatía, evitando inotrópicos negativos9,14.
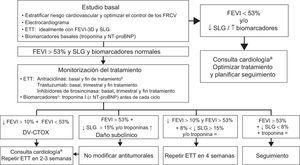
Monitorización del tratamientoEl objetivo es detectar precozmente síntomas o cambios en la función ventricular mediante ecocardiografía. El uso de biomarcadores y/o SLG, dependiendo de la experiencia y la disponibilidad locales, mejora la estratificación del riesgo. Tradicionalmente se ha diferenciado el seguimiento de pacientes tratados con agentes de tipos I y II; sin embargo, es excepcional que los pacientes reciban un único fármaco, por lo que la frecuencia de los estudios debe priorizarse según el RCV, el esquema terapéutico y la disponibilidad local9,14,29,30. La figura 2 y la figura 3 utilizan el criterio de FEVI < 53% propuesto por la Sociedad Americana de Ecocardiografía y la Asociación Europea de Imagen Cardiovascular14. De este modo se facilita un diagnóstico precoz de DV-CTOX, lo que no implica necesariamente interrumpir el tratamiento antitumoral.
Algoritmo de monitorización del tratamiento con fármacos antitumorales14. 3D: tridimensional; DV-CTOX: disfunción ventricular secundaria a cardiotóxicos; ETT: ecocardiograma transtorácico; FEVI: fracción de eyección del ventrículo izquierdo; FRCV: factores de riesgo cardiovascular; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; SLG: strain longitudinal global. aIdealmente, consulta específica de cardio-onco-hematología. bSe recomienda revaluar la FEVI antes de finalizar el tratamiento si se supera una dosis acumulada de 240 mg/m2. En estos casos, debe monitorizarse la FEVI periódicamente hasta el final del tratamiento. cEn pacientes de bajo riesgo cardiovascular y sin antecedentes de tratamientos cardiotóxicos, la determinación de troponinas antes de cada ciclo reduce el número de ecocardiogramas y los limita a pacientes con síntomas o elevación de troponinas.
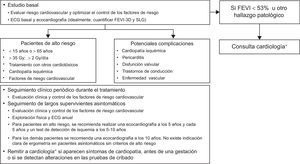
Algoritmo de monitorización del tratamiento con radioterapia en pacientes cuyo volumen de irradiación incluya, total o parcialmente, el corazón19. 3D: tridimensional; ECG: electrocardiograma; FEVI: fracción de eyección del ventrículo izquierdo; SLG: strain longitudinal global. *Idealmente se derivará a la consulta específica de cardio-onco-hematología.
El diagnóstico de IC requiere la presencia de síntomas y signos típicos junto con elevación de péptidos natriuréticos o alteraciones ecocardiográficas16,47. En presencia de IC, se recomienda seguir los algoritmos de tratamiento convencionales y descartar cardiopatía isquémica16,47.
El tratamiento con bloqueadores beta e IECA en pacientes con FEVI deprimida, sintomática o asintomática es obligado para evitar IC clínica y el remodelado ventricular11,16. La elevación de troponinas y/o disminución de SLG > 15% con FEVI normal identifican a pacientes con daño estructural asintomático (estadio B de la IC) y mayor riesgo de progresión a IC14,46. Estudios iniciales respaldan el inicio de IECA, con o sin bloqueadores beta, para evitar la suspensión de tratamientos antitumorales potencialmente curativos15,32,38,48.
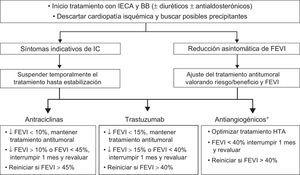
Es necesario individualizar la indicación de suspender/retrasar el tratamiento onco-hematológico valorando el riesgo de IC frente al de recidiva/progresión del cáncer (tabla 1 y tabla 2 del material suplementario y figura 4)9,14,29,49,50.
Tratamiento y monitorización de pacientes que toman cardiotóxicos y tienen FEVI < 53%9,14,16,29,49,50. BB: bloqueadores beta; IC: insuficiencia cardiaca; HTA: hipertensión arterial; IECA: inhibidores de la enzima de conversión de la angiotensina; FEVI: fracción de eyección del ventrículo izquierdo. *Véase la tabla 4 del material suplementario.
La duración del tratamiento de IC tras normalización de la FEVI es motivo de controversia. No se recomienda la suspensión precoz. Podría considerarse, bajo vigilancia estrecha, para pacientes asintomáticos sin FRCV y con parámetros normales y estables de función ventricular más de 1 año (FEVI, SLG, TnI y NT-proBNP)51. Para pacientes con DV a pesar de tratamiento óptimo, se recomienda seguir las guías de IC con respecto al implante de dispositivos o trasplante cardiaco cuando el pronóstico vital lo permita16,47.
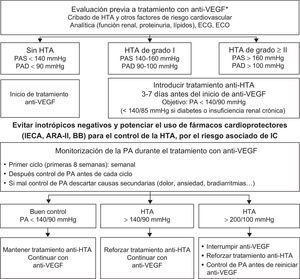
Hipertensión arterialLa HTA es la comorbilidad más frecuente en pacientes con cáncer8. Las terapias onco-hematológicas causan HTA por diferentes mecanismos, aunque los más frecuentes son los fármacos que inhiben la angiogénesis, interactúan con los factores de crecimiento del endotelio vascular (anti-VEGF) y disminuyen la producción de óxido nítrico52. Su incidencia y la gravedad dependen del tumor, el fármaco y la coexistencia de otros FRCV (tabla 1, tabla 2 y tabla 4 del material suplementario)53,54. Aunque la HTA por anti-VEGF puede ser un biomarcador de buena respuesta tumoral, controlarla no reduce la eficacia terapéutica55 y evita complicaciones cardiovasculares y la interrupción del tratamiento50. Se recomienda realizar una valoración inicial y una monitorización estrecha de la presión arterial durante el tratamiento siguiendo las recomendaciones farmacológicas y dietéticas de la población general. Para pacientes con HTA no complicada, el objetivo es una presión arterial (PA) < 140/90mmHg y para pacientes diabéticos o con insuficiencia renal, PA < 140/85 mmHg56. Los IECA, los antagonistas del receptor de la angiotensina II y los bloqueadores beta son los fármacos de primera línea, pues presentan un perfil de protección frente a la aparición de IC. En caso de mal control, se recomienda agregar amlodipino y antialdosterónicos. Las tiacidas deben ser usadas con precaución por el riesgo de hipopotasemia y prolongación del QTc. Es desaconsejable el uso de inotrópicos negativos (diltiazem y verapamilo), por el riesgo de IC y las interacciones farmacológicas (inhibidores del citocromo p450: aumentan la concentración de sorafenib) (figura 5)57.
Protocolo de inicio, monitorización y tratamiento de la presión arterial de pacientes con indicación de tratamiento con anti-VEGF9,46,57. anti-VEGF: inhibidores del factor de crecimiento del endotelio vascular; ARA-II: antagonistas del receptor de la angiotensina II; BB: bloqueadores beta; ECG: electrocardiograma; ECO: ecocardiografía; HTA: hipertensión arterial; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina; PA: presión arterial; PAD: presión arterial diastólica; PAS: presión arterial sistólica. *Véase la tabla 4 del material suplementario.
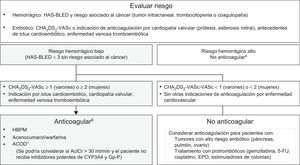
La arritmia sostenida más frecuente es la fibrilación auricular. En pacientes sin fibrilación auricular previa, la cirugía oncológica suele ser el escenario de presentación, junto con el uso de algunos fármacos (tabla 1 y tabla 2 del material suplementario). Para pacientes con tratamiento antitumoral activo, se recomienda inicialmente una estrategia de control de frecuencia cardiaca9,58. La indicación de anticoagulación se establece por la escala CHA2DS2-VASc junto con el riesgo hemorrágico (figura 6)59,60.
Algoritmo para la indicación de anticoagulación de pacientes con fibrilación auricular relacionada con el cáncer9,58–60. 5-FU: 5-fluorouracilo; AclCr: aclaramiento de creatinina; ACOD: anticoagulantes orales directos; CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75 (doble), diabetes mellitus, ictus (doble), enfermedad vascular, edad 65-74 años y sexo (mujer); CYP: citocromo P450; EPO: eritropoyetina; GP-P: glucoproteína P; HAS-BLED: hipertensión, función renal/hepática anormal, ictus, antecedentes de hemorragia o predisposición a ella, labilidad de la razón internacional normalizada, edad mayor 65 años y toma concomitante de fármacos o alcohol; HBPM: heparina de bajo peso molecular. aPara los pacientes con riesgo hemorrágico elevado e indicación de anticoagulación que no dependa del CHA2DS2-VASc, es necesario individualizar la decisión de no anticoagular. bLa selección del anticoagulante dependerá del estado clínico, las comorbilidades y las posibles interacciones con el tratamiento antitumoral del paciente. cActualmente no se dispone de evidencia científica sobre su uso en pacientes con tratamiento antitumoral activo.
En pacientes sin cardiopatía estructural, el riesgo de taquicardia ventricular depende de los efectos del tratamiento en el potencial de acción transmembrana (trióxido de arsénico) o en la circulación coronaria (vasospasmo por 5-fluorouracilo). Se debe considerar la suspensión, o la administración bajo vigilancia hospitalaria, de cualquier fármaco si el QTc es > 500 ms o aumenta más de 60 ms respecto al basal9.
BradiarritmiasEl tratamiento es similar al de los pacientes sin cáncer, considerando el implante de marcapasos ante bradicardias sintomáticas por taxanos o talidomida, si el tratamiento aporta claro beneficio en la supervivencia61.
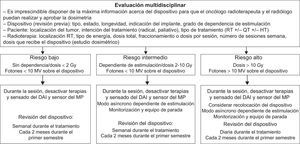
DispositivosLos dispositivos pueden verse afectados por la radioterapia. Cuando el generador se encuentra dentro del campo terapéutico, puede plantearse recolocarlo para evitar interferencias. El impacto clínico de la radioterapia en el dispositivo es directamente proporcional al tipo y la dosis de energía administrada y al grado de dependencia de la estimulación. Es imprescindible el empleo de elementos de protección, modelos de dosificación y protocolos de evaluación y seguimiento (figura 7)62. Para los pacientes con enfermedad terminal, no se debe modificar la estimulación antibradicardia si no deteriora la calidad de vida, pero debe considerarse, de acuerdo con el paciente, la opción de desconectar terapias antitaquicardia63.
Protocolo de evaluación y seguimiento de pacientes portadores de dispositivos (marcapasos, desfibriladores) durante la administración de tratamiento con RT a pacientes cuyo volumen de irradiación incluya, total o parcialmente, el corazón. DAI: desfibrilador automático implantable; HT: hormonoterapia; MP: marcapasos; QT: antitumorales; RT: radioterapia.
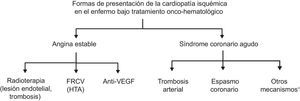
Aunque el cáncer puede causar cardiopatía isquémica (CI) por diferentes mecanismos, los más frecuentes son las secuelas de los fármacos antitumorales y la radioterapia (figura 8)9,19.
Formas de presentación de la cardiopatía isquémica en el paciente en tratamiento onco-hematológico. anti-VEGF: inhibidores del factor de crecimiento del endotelio vascular; FRCV: factores de riesgo cardiovascular; HTA: hipertensión arterial. *Aumento de la viscosidad sanguínea; compresión coronaria extrínseca.
No hay evidencia alguna de que los algoritmos de diagnóstico para identificar CI en pacientes con cáncer deban diferir de los de la población general. La principal recomendación es la detección y el tratamiento agresivo de los FRCV y mantener la alerta ante síntomas indicativos de enfermedad coronaria9.
Tratamiento del cáncer en pacientes con cardiopatía isquémicaLos pacientes con CI tratados con 5-fluorouracilo, etopósido, bleomicina, vinblastina, bevacizumab, sorafenib y taxanos deben ser vigilados para detectar precozmente eventos isquémicos8,9. Los fármacos que con mayor frecuencia se vinculan con isquemia aguda son el 5-fluorouracilo y su precursor, la capecitabina (tabla 1 y tabla 2 del material suplementario). No hay recomendaciones específicas de profilaxis, aunque se evita administrar 5-fluorouracilo durante más de 3 h o combinarlo con cisplatino64. Para pacientes que han sufrido angina, la administración de nitroglicerina o antagonistas del calcio puede ser eficaz en la prevención de nuevos episodios si no hay alternativa terapéutica64.
La trombosis arterial es una causa menos habitual de eventos isquémicos (< 1%)9. Su riesgo se relaciona con la extensión de la enfermedad, la predisposición hereditaria, algunos tumores (páncreas, ovario, pulmón y mieloma), el tratamiento con inhibidores de la tirosincinasa (ITK) y, en menor grado, con cisplatino54. No existen contraindicaciones absolutas de administración de ningún fármaco en ausencia de IC9.
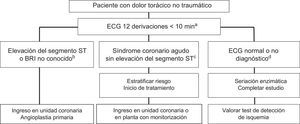
Manejo de las complicaciones isquémicas del tratamiento del cáncerNo existe una recomendación de antiagregantes profilácticos. Para pacientes con angina, se recomienda optimizar el tratamiento y controlar precipitantes como la anemia. En caso de síntomas persistentes, son candidatos a test de detección de isquemia y eventual revascularización que permita tolerar la terapia, valorando riesgo/beneficio. Los protocolos de evaluación de dolor torácico son similares a los de los pacientes no oncológicos (figura 9), individualizando la estrategia de revascularización y el régimen antitrombótico9.
Algoritmo para el tratamiento de los pacientes con dolor torácico en urgencias. BRI: bloqueo de rama izquierda; ECG: electrocardiograma. aDebe obtenerse e interpretarse correctamente un ECG de 12 derivaciones en < 10 min y seriar troponinas. Debe repetirse el ECG si este no es diagnóstico o el dolor cede o reaparece. bEn pacientes con elevación persistente del segmento ST, siempre que el pronóstico vital del paciente lo permita y no existan contraindicaciones hematológicas, debe realizarse una angioplastia primaria. cEn pacientes con síndrome coronario sin elevación del segmento ST, se debe estratificar el riesgo (escala GRACE) y valorar la necesidad de una estrategia invasiva. En caso de necesitar doble antiagregación, hay que optar por pautas cortas y evitar ticagrelor en pacientes con quimioterapia activa por el riesgo de interacciones con el citocromo P450 3A4. dSi el ECG es normal y la seriación enzimática es negativa, valorar test de isquemia según el protocolo preestablecido y consensuado del hospital.
La miocarditis es una complicación poco frecuente del tratamiento antitumoral (tabla 1 y tabla 2 del material suplementario)65 que debe confirmarse con resonancia magnética cardiaca. El manejo sigue los mismos criterios que en la población general66. La inmunodepresión puede complicar el pronóstico, sobre todo en miocarditis hemorrágica por ciclofosfamida o miocardiopatía tipo tako-tsubo inducida por 5-fluorouraciclo, citarabina o rituximab67. Por el riesgo de recidiva, es imprescindible revaluar el tratamiento del cáncer y mantener cardioprotectores, al menos hasta completarlo9.
Los cuadros de pericarditis aguda son poco frecuentes y su manejo es similar al de los pacientes sin cáncer68. Se relacionan con la radioterapia torácica, antraciclinas, ciclofosfamida, citarabina y bleomicina9,19. Hasta un 20% de los pacientes pueden adquirir formas crónicas, efusivo-constrictivas, años después de la radioterapia19.
ValvulopatíasLa radioterapia causa daño del endocardio valvular, con fibrosis, engrosamiento y calcificación distrófica69. El grado de afección se relaciona con el tiempo transcurrido desde la radioterapia19. En necropsias, hasta el 81% de los pacientes tienen evidencia de daño valvular, predominantemente insuficiencia mitral, estenosis aórtica y calcificación de la fibrosa mitroaórtica70. La probabilidad de tener estenosis aórtica aumenta en 13,9 veces por cada 10 años transcurridos69. Las recomendaciones de tratamiento son similares a las de la población general, recordando que la radioterapia aumenta el riesgo de la cirugía cardiaca y que el tipo de lesión hace improbable la reparación valvular71.
Enfermedad venosa tromboembólicaLa enfermedad venosa tromboembólica (EVT), definida como trombosis venosa profunda y/o embolia pulmonar, es de 4 a 7 veces más frecuente en pacientes onco-hematológicos, y se ha documentado en más del 20% de los pacientes hospitalizados con un proceso tumoral9. Los factores asociados con EVT son la edad, la predisposición hereditaria, la extensión y el tipo de tumor (más frecuente en cáncer de páncreas, ovario, pulmón, estómago, riñón, linfomas y mieloma) y el tratamiento activo principalmente con ITK, inmunomoduladores (talidomida, lenalidomida y pomalidomida), 5-fluorouracilo, cisplatino y tamoxifeno. Estos datos epidemiológicos justifican la prevención de la EVT (tabla 5)72,73.
Profilaxis y tratamiento de la enfermedad venosa tromboembólica de pacientes con cáncer72,73
| Profilaxis | |
|---|---|
| Cirugía oncológica | Antes de la cirugía: |
| – HBPM 12 h antes (alto riesgo) o 2 h antes (bajo riesgo) | |
| Después de la cirugía: | |
| – Reiniciar HBPM tras 8 h, salvo sangrado activo o alto riesgo hemorrágico | |
| – Duración mínima, 7–10 días, y se recomiendan 4 semanas para pacientes con factores de riesgo | |
| – Si el riesgo hemorrágico es alto o existe contraindicación para HBPM: compresión mecánica intermitente | |
| Cáncer y movilidad reducida | Se recomienda tromboprofilaxis con HBPM |
| Quimioterapia antineoplásica | No se hace tromboprofilaxis sistemáticamente |
| Tromboprofilaxis indicada (salvo alto riesgo hemorrágico en la escala HAS-BLED) en: | |
| – Cáncer de páncreas metastásico o localmente avanzado o cáncer de pulmón | |
| – Talidomida o lenalidomida en combinación con esteroides/doxorubicina | |
| – Leucemia aguda linfoblástica en tratamiento con L-asparraginasa (individualizar) | |
| Tratamiento |
|---|
| HBPM a dosis plenas (si > 50.000 plaquetas/μl) (menos tasas de recidivas trombóticas que los antagonistas de la vitamina K) |
| Duración del tratamiento: HBPM ≤ 3 meses, deseable 6 meses |
| Individualizar interrupción del tratamiento: mantener HBPM hasta completar el tratamiento curativo o mientras persistan factores de riesgo de recurrencia de EVT |
| Si recurre la enfermedad venosa tromboembólica con HBPM, aumentar la dosis y optimizar control de anti-Xa. Valorar un filtro de cava en embolia pulmonar |
| Situaciones especiales en el tratamiento de la EVT |
|---|
| Los tumores cerebrales no son contraindicación para HBPM |
| Iniciar la tromboprofilaxis posoperatoria en neurocirugía |
| En insuficiencia renal grave (< 30 ml/min), ajustar HBPM (niveles anti-Xa) |
| No se recomienda profilaxis sistemática para los catéteres centrales en la vena yugular derecha |
| Trombosis asociada a catéteres centrales: HBPM a dosis plenas, al ≤ 3 meses (individualizar retirada de catéter) |
| Los datos actuales de los anticoagulantes directos son escasos y no hay estudios frente a HBPM |
EVT: enfermedad venosa tromboembólica; HBPM: heparina de bajo peso molecular.
La hipertensión pulmonar es una complicación poco frecuente pero grave que aparece meses o años después de la exposición a algunos antineoplásicos (ITK, principalmente dasatinib)9. El cuadro puede ser reversible interrumpiendo el tratamiento. La ciclofosfamida puede producir hipertensión pulmonar grave por enfermedad pulmonar venooclusiva74. El diagnóstico se basa en la evaluación clínica, ecocardiográfica y de biomarcadores (NT-proBNP). La hipertensión pulmonar debe monitorizarse cada 3–6 meses con ecocardiografía en pacientes con ITK y sospecharla ante cambios significativos en la clase funcional. Estos pacientes requieren una evaluación multidisciplinaria para decidir la mejor estrategia terapeútica9,75.
Enfermedad vascular periféricaLa vasculopatía periférica tras radioterapia afecta principalmente a arterias y capilares y las lesiones son diferentes de la ateroesclerosis clásica (menor acumulación de lípidos y macrófagos, un marcado engrosamiento endotelial, destrucción de la lámina elástica interna, necrosis de los vasa vasorum y áreas de hemorragia dentro de la placa)9,19. Es difícil determinar su incidencia por la enorme heterogeneidad de las series, pero hay lesiones carotídeas hasta en el 70% de los pacientes con tumores malignos de cabeza y cuello a los 2–3 años de tratamiento76.
La administración de algunos antineoplásicos se asocia con fenómenos tromboembólicos arteriales (tabla 1 y tabla 2 del material suplementario) o ateroesclerosis precoz en la parte distal de las extremidades (nilotinib o ponatinib)54. La prevención y el tratamiento de la ateroesclerosis inducida por antitumorales o radioinducida requieren un control exquisito de los FRCV, especialmente de los pacientes con largas supervivencias9,19.
ALGORITMOS DE MONITORIZACIÓN EN LARGA SUPERVIVENCIA¿Por qué realizar un seguimiento a largo plazo?El 11% de los pacientes de 40 años que superan una neoplasia en la infancia sufren una cardiopatía grave, generalmente IC, o precisan tratamiento cardiovascular3. El cribado sistemático reduce la incidencia acumulada de IC un 18%77. La coordinación de los equipos hospitalarios con atención primaria es imprescindible para asegurar las necesidades de salud de aquellos con larga supervivencia7.
¿Qué pacientes precisan seguimiento?La mayoría de la información disponible proviene de supervivientes a cáncer infantil. Chow et al.78 han elaborado y validado un score de riesgo de IC clasificando a los supervivientes en riesgo bajo (incidencia acumulada de IC a los 40 años de edad del 0,5%), medio (2,4%) o alto (11,7%). El riesgo depende del tratamiento recibido (dosis acumulada de fármacos/radiación y tratamientos combinados) y de la edad de exposición. Se recomienda el seguimiento de los supervivientes que hayan recibido dosis de antraciclinas ≥ 250mg/m2 o ≥ 35Gy de radioterapia torácica o tratamiento combinado con ≥ 100mg/m2 de antraciclinas y ≥ 15Gy. El seguimiento de supervivientes de bajo riesgo (antraciclinas < 100mg/m2 o < 15Gy) no ha demostrado beneficio79.
¿Cómo y cuándo realizarlo?Hay acuerdo general en la necesidad de vigilancia, pero no en la forma de realizarla. Es imprescindible un seguimiento clínico que descarte síntomas y signos de cardiopatía y aporte un consejo estructurado que fomente conductas cardiosaludables y la práctica regular de ejercicio físico (tabla 2)18. Debe prestarse especial atención al riesgo aumentado de desarrollar FRCV y síndrome metabólico80,81.
Se recomienda realizar ecocardiografía para monitorizar la función ventricular (generalmente FEVI; el SLG podría aportar más información en casos seleccionados4), aunque falta información prospectiva sobre la frecuencia de los estudios. En supervivientes de cáncer infantil, Armenian et al.79 proponen realizar un ecocardiograma a los 2 años del tratamiento y después cada 5 años, así como un seguimiento cardiovascular antes y al final de la gestación.
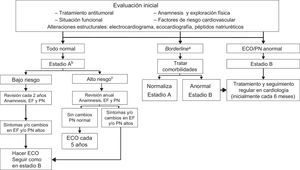
En supervivientes de cáncer de mama se recomienda realizar un ecocardiograma al finalizar el tratamiento antitumoral que permita planificar el seguimiento (si la FEVI y el SLG son normales se reduce el riesgo de IC)14. La presencia de hallazgos patológicos requiere tratamiento y controles periódicos por cardiología9,16. Una propuesta coste-efectiva es el algoritmo combinado de Carver et al.82 que valora síntomas, ecocardiografía y péptidos natriuréticos (figura 10).
Algoritmo de seguimiento de pacientes con larga supervivencia modificado de Carver et al.82. ECG: electrocardiograma; ECO: ecocardiografía; EF: exploración física; FEVI: fracción de eyección; IC: insuficiencia cardiaca; PN: péptidos natriuréticos. aAlteraciones menores en el ECG o trastorno de conducción intraventricular, arritmias no sostenidas; FEVI entre el 50 y el 55%. bPacientes con riesgo de IC. cCualquiera de las siguientes condiciones: edad durante el tratamiento < 15 o > 65 años, mujer, cualquier síntoma cardiaco o exploración física anómala, factores de riesgo cardiovascular, disfunción ventricular izquierda o cardiopatía previa, obesidad, antecedentes de cardiotoxicidad, antraciclinas > 350 mg/m2, radiación torácica ≥ 35 Gy, tratamiento combinado con antraciclinas y radioterapia, radioterapia premoderna, seguimiento > 10 años tras tratamiento.
Para supervivientes adultos asintomáticos con alto riesgo de cardiopatía por radiación, se recomienda realizar ecocardiograma a los 5 años, test de isquemia a los 5–10 años y revaluar cada 5 años (figura 3)19.
La tabla 6 resume las principales recomendaciones para la atención cardiovascular de pacientes con cáncer.
Recomendaciones para la atención cardiovascular de pacientes con cáncer
| 1 | Potenciar el desarrollo de equipos locales de cardio-onco-hematología y la elaboración de protocolos locales de prevención y diagnóstico y tratamiento precoz de la cardiotoxicidad |
| 2 | Estratificar el riesgo cardiovascular y optimizar el tratamiento de cardiopatías e hipertensión antes del inicio del tratamiento antitumoral, evitando inotrópicos negativos |
| 3 | Recomendar hábitos de vida saludable y control óptimo de factores de riesgo de todos los pacientes onco-hematológicos |
| 4 | Programar la monitorización del tratamiento antitumoral en función del esquema previsto y del riesgo de que se produzca cardiotoxicidad |
| 5 | Valorar el uso de fármacos cardioprotectores para pacientes con riesgo cardiovascular alto o muy alto o antecedentes de tratamientos cardiotóxicos o que durante la monitorización del tratamiento antitumoral muestren elevación persistente de biomarcadores o reducción significativa del strain longitudinal global |
| 6 | Tratar precozmente la disfunción ventricular (independientemente de la presencia de síntomas) y otras complicaciones cardiovasculares, según las guías de práctica clínica habitual |
| 7 | Evitar interrupciones en la administración del tratamiento antitumoral. Individualizar la decisión según riesgo/beneficio del tratamiento |
| 8 | Considerar con el equipo de cardio-onco-hematología estrategias para optimizar el tratamiento cardiovascular y antitumoral de los pacientes que sufran toxicidad cardiovascular |
| 9 | Programar el seguimiento de pacientes con larga supervivencia |
| 10 | Establecer criterios de calidad asistencial, promover la creación de registros e impulsar programas de formación y estudios de investigación |
Las complicaciones cardiovasculares derivadas de los tratamientos antitumorales son un problema clínico creciente. La reversibilidad del daño miocárdico en fases precoces ha despertado el interés en un enfoque centrado en estrategias de prevención, monitorización y tratamiento precoz. Este documento une por primera vez a expertos de todas las sociedades científicas españolas implicadas en la atención de los pacientes con cáncer (Sociedad Española de Cardiología, Sociedad Española de Oncología Médica, Sociedad Española de Oncología Radioterápica y Sociedad Española de Hematología) y resume las recomendaciones más significativas aplicables al cuidado de la salud de pacientes onco-hematológicos que van a recibir tratamientos antitumorales potencialmente cardiotóxicos. Como la evidencia científica es escasa en muchos aspectos, es imprescindible crear grupos multidisciplinarios de cardio-onco-hematología locales que permitan optimizar el tratamiento, profundizar en los mecanismos de desarrollo de la enfermedad cardiovascular y potenciar la investigación y la creación de registros de cardiotoxicidad.
CONFLICTO DE INTERESESNinguno.