El síndrome de tako-tsubo es una entidad de etiología y epidemiología inciertas, capaz de semejarse a un infarto y que, aunque suele tener buen pronóstico, no está exenta de complicaciones. El objetivo del presente trabajo es caracterizar esta enfermedad en nuestro medio a través de un registro (REgistro nacional multicéntrico sobre síndome de TAKOtsubo).
MétodosEl registro prospectivo incluyó a 202 pacientes incidentes en 23 hospitales entre 2012-2013. Se recogieron las características clínicas, analíticas, electrocardiográficas y de imagen, así como los eventos durante el seguimiento. Se incluyó a los pacientes cuando sus médicos consideraron probado el caso, y la incidencia de la enfermedad se calculó en función de los cateterismos solicitados con el diagnóstico presunto de síndrome coronario agudo.
ResultadosLos casos fueron predominantemente mujeres (90%), con una media de edad de 70 años y frecuentes factores de riesgo cardiovascular, hipertensión arterial (67%), dislipemia (41%), diabetes mellitus (15%) y tabaquismo (15%). Sin clara distribución semanal o estacional, se calculó una incidencia del 1,2%. El dolor torácico fue el síntoma predominante, con algún desencadenante (psíquico, físico o ambos) en el 72%, y la mayoría consultó en las primeras 6h. La estancia mediana fue de 7 días; apareció algún síntoma de insuficiencia cardiaca en el 34,0% y arritmias en el 26,7% y murió el 2,4%.
ConclusionesEl síndrome de tako-tsubo es una enfermedad poco incidente, que afecta predominantemente a mujeres posmenopáusicas, en más de la mitad de los casos tras una situación psicológicamente estresante. Se caracteriza por dolor anginoso, sin distribución estacional; aunque no está exenta de morbimortalidad, conlleva buen pronóstico.
Palabras clave
En 1990 se describió en Japón un síndrome consistente en dolor torácico, cambios electrocardiográficos y bioquímicos similares a los de un infarto agudo de miocardio, con alteraciones de la contractilidad apical del ventrículo izquierdo1. La peculiaridad de la nueva enfermedad, que entonces se achacó a espasmo multivaso, fue la presencia de coronarias sin lesiones y la práctica resolución de los marcados trastornos segmentarios ventriculares en días o semanas1,2. Se denominó a este síndrome apical ballooning, síndrome de tako-tsubo (STK) o discinesia apical transitoria. Destacaban respecto a los síndromes coronarios clásicos la afección segmentaria en varios territorios coronarios y el excelente pronóstico ulterior2,3. No obstante, aunque usualmente benigna, esta enfermedad no está exenta de complicaciones; las más frecuentes son la insuficiencia cardiaca o las arritmias, los trombos intraventriculares o incluso la muerte, principalmente en el momento agudo4.
En consonancia con estos hallazgos, grupos españoles y fuera de España han recogido varias series de casos hasta hoy1–6. Ello ha motivado la descripción de la primera serie en España de la variante medioventricular7, enfermedad reconocida fuera de España3. Otras publicaciones españolas han consistido en la descripción de pacientes con afección ventricular predominantemente inferior y en poner de manifiesto la posibilidad teórica de que esta afección concurra con cardiopatía isquémica crónica8. Asimismo, se ha estudiado la relación entre la hipertrofia ventricular izquierda y la evolución a medio-largo plazo de estos pacientes4, que podría no ser tan benigna como se ha señalado previamente en el grupo con ventrículos hipertróficos9. Además, investigadores españoles han estudiado intensamente la fisiopatología del cuadro, y han propuesto algunas interesantes teorías como la descendente anterior recurrente5 o la influencia del gradiente intraventricular9. Otros trabajos publicados han comparado los hallazgos electrocardiográficos en relación con la raza6,10. Respecto a la etiopatogenia, se han propuesto múltiples teorías con la intención de explicar la génesis del STK11–14. Aunque todavía no se ha conseguido aclararla, parece que hay una importante relación entre la elevación de catecolaminas circulantes (por una situación estresante psíquica o física) y la aparición de este síndrome4,11. Sin embargo, la causa cierta del STK continúa sin esclarecerse de manera definitiva, y no se dispone de claros datos epidemiológicos en España, ya que la mayoría de los trabajos publicados comprenden la experiencia aislada de uno o pocos centros.
El propósito del presente trabajo es llevar a cabo un registro multicéntrico colaborativo nacional, con la finalidad de describir de manera más detallada el STK en nuestro medio.
MÉTODOSEl REgistro nacional multicéntrico sobre síndrome de TAKOtsubo (RETAKO), auspiciado por la Sección de Cardiopatía Isquémica y Cuidados Agudos Cardiovasculares de la Sociedad Española de Cardiología, es un estudio prospectivo, de ámbito nacional y voluntario. Se incluyó a los pacientes que cumplían, a juicio de los médicos que los trataban los criterios (basados en los criterios modificados de Mayo15) de la enfermedad, como se ha publicado previamente4. Para este análisis concreto, se recogió a los pacientes con dicho diagnóstico ingresados consecutivamente entre el 1 de enero de 2012 y el 31 de diciembre de 2013 inclusive, aportados por 23 hospitales de todo el país (tabla 1). Se comparó el número de pacientes con la cantidad de coronariografías solicitadas en cada hospital con el diagnóstico de trabajo (se confirmara después o no) de síndrome coronario agudo, para calcular la incidencia aproximada de la enfermedad en España. Se recogieron las características clínicas y las complicaciones durante el ingreso, así como los hallazgos analíticos, electrocardiográficos, ecocardiográficos y de otras técnicas de imagen en cada centro (la resonancia magnética cardiaca era opcional en el protocolo); esta información se envió en un cuaderno de recogida de datos, inicialmente por correo electrónico a un centro de procesamiento de datos y después (a partir de 2014) directamente en un cuaderno de recogida de datos electrónico en línea. Algunas variables de aspectos difíciles de sistematizar se recogieron como campo de texto libre. Para incluirlos, los pacientes debían haberse sometido una coronariografía invasiva en la que se descartaran lesiones coronarias obstructivas significativas (> 50%) o de cualquier tipo potencial causa del cuadro (p. ej., trombo, disección, úlcera, etc.). El tratamiento, en todo momento, se decidió a criterio de los médicos que trataban a los pacientes. Se recomendaron al menos dos puntos de seguimiento, uno a los 3 meses y otro al año del evento índice. Se exigió la completa normalización de las alteraciones segmentarias por cualquier técnica de imagen, excepto en los casos que fallecieron antes. Como objetivos en el seguimiento, se consideraron el fallecimiento de causa cardiovascular y por cualquier causa y la necesidad de reingreso por cualquier motivo en un servicio de cardiología. El estudio contó con la aprobación del Comité Ético del Hospital Clínico San Carlos, y los pacientes debieron otorgar su consentimiento informado para participar en el registro.
Hospitales que incluyeron a pacientes entre el 1 de enero de 2012 y el 31 de diciembre de 2013
| Pacientes incluidosa | |
|---|---|
| Hospital Clínico San Carlos, Madridb | 33 |
| Hospital Virgen Macarena, Sevillab | 22 |
| Hospital Vall d’Hebron, Barcelona | 21 |
| Hospital Universitario de Salamanca, Salamanca | 21 |
| Hospital de Sant Pau, Barcelona | 17 |
| Hospital de la Princesa, Madridb | 14 |
| Complejo Hospitalario Universitario de Albacete, Albaceteb | 14 |
| Hospital Universitario Arnau de Vilanova, Léridab | 9 |
| Hospital Clínico Lozano Blesa, Zaragozab | 8 |
| Hospital Universitario de Canarias, Sta. Cruz de Tenerife | 6 |
| Consorcio Hospital General Universitario de Valencia, Valencia | 6 |
| Hospital Carlos Haya, Málaga | 5 |
| Hospital Puerta de Hierro, Majadahonda, Madrid | 5 |
| Hospital Fundación Jiménez Díaz, Madrid | 3 |
| Hospital General Universitario Gregorio Marañón, Madridb,c | 3 |
| Hospital General Universitario de Ciudad Real, Ciudad Real | 3 |
| Hospital Clínico Universitario de Santiago, Santiago de Compostela, A Coruña | 3 |
| Hospital Universitario Germans Trias i Pujol, Badalona, Barcelona | 2 |
| Hospital da Costa, Burela, Lugob | 2 |
| Hospital Príncipe de Asturias, Alcalá de Henares, Madridb | 2 |
| Hospital de Manacor, Baleares | 1 |
| Hospital Severo Ochoa, Leganés, Madridb | 1 |
| Hospital Clínico de Valencia, Valencia | 1 |
| Total | 202 |
Para el procesamiento estadístico, se utilizaron el programa SPSS versión 20.0 (IBM SPSS; Estados Unidos) y el paquete multimedia Office 2010 (Microsoft; Estados Unidos). Los datos se expresan como media ± desviación estándar o mediana (intervalo), en función de su distribución y su dispersión. El estudio es básicamente descriptivo y las diferencias entre grupos se analizaron mediante el estadístico más apropiado, que se detalla en el texto, en función de que incluyeran variables cuantitativas o cualitativas. En el análisis estadístico se consideró alcanzada la significación con un valor bilateral de p<0,05.
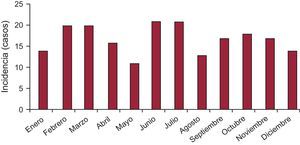
RESULTADOSPerfil del paciente y epidemiologíaSe incluyó a 202 pacientes, con una media de edad de 70,0±12,5 años, predominantemente mujeres (90,1%), el 98% caucásicos. La tabla 2 detalla el perfil epidemiológico de los pacientes. Para el cálculo de incidencias se consideró el número de pacientes a los que se realizó cateterismo con el diagnóstico presunto de síndrome coronario agudo (cualquier tipo, con o sin elevación de biomarcadores) en hospitales que facilitaron sus datos (tabla 1), respecto a los STK finalmente aceptados de estos mismos centros (108 de 8.950) y durante el periodo de estudio. Por lo tanto, la incidencia del STK estimada fue del 1,2%. No se observaron diferencias estadísticamente significativas entre las incidencias estacional, mensual (figura 1) y diaria.
Perfil epidemiológico general de los pacientes del REgistro nacional multicéntrico sobre TAKOtsubo (n=202)
| Edad (años) | 70,0±12,5 |
| Mujeres | 182 (90,1) |
| Hipertensión arterial | 135 (66,8) |
| Dislipemia | 83 (41,0) |
| DM | 31 (15,3) |
| DM tipo 2: antidiabético oral; + insulina | 27; 4 |
| Fumadores activos | 31 (15,3) |
| > 15 cigarrillos/día | 11 |
| Antecedentes familiares de cardiopatía isquémica precoz | 15 (7,4) |
| Obesidad (IMC > 30) | 33 (16,3) |
| Hiperuricemia | 4 (2) |
| Apnea obstructiva del sueño | 8 (4) |
| Alergias medicamentosas | 30 (14,9) |
| Insuficiencia renal | 4 (2) |
| Hepatopatía | 8 (4) |
| Colagenopatía | 2 (1) |
| Enfermedades pulmonares | 36 (17,8) |
| EPOC | 16 |
| Asma | 13 |
| Otras (cáncer, fibrosis, etc.) | 7 |
| Enfermedades neurológicas | |
| Ictus previo | 7 |
| Accidente isquémico transitorio | 4 |
| Demencia/deterioro cognitivo | 5 |
| Desmielinizantes/ELA | 2 |
| Tumores | 3 |
| Epilepsia | 1 |
| Migrañas | 4 (2) |
| Síndrome de Raynaud | 0 |
| Inmunodepresión | 8 (4) |
| Tumores | 28 (13,8) |
| Hipotiroidismo | 16 (7,9) |
| Hipertiroidismo | 1 (0,5) |
| STK previo | 5 (2,5) |
DM: diabetes mellitus; ELA: esclerosis lateral amiotrófica; EPOC: enfermedad pulmonar obstructiva crónica; IMC: índice de masa corporal; STK: síndrome de tako-tsubo.
Salvo otra indicación, los valores expresan n (%) o media±desviación estándar.
El principal motivo de consulta fue el dolor torácico, presente en 162 (80,1%) pacientes, la mayoría en buena clase funcional previa (el 81,2% en clase I). En general, dichos síntomas motivaron una pronta consulta, pues 138 (68,3%) consultaron antes de las 6h del inicio y solo un 10% más allá de las 24h. En el 72,8% se observó una situación posible desencadenante o favorecedora del cuadro, como un estrés psicológico intenso en 101 pacientes (50%). La estancia media fue de 8,2 (mediana, 7) días. La tabla 3 reúne más detalladamente estos aspectos y la tabla 4 muestra los tratamientos previos, durante el ingreso y al alta.
Parámetros clínicos y estancia hospitalaria (n=202)
| HTA al ingreso (PAS > 140 y/o PAD > 90 mmHg) | 66 (32,7) |
| FC (lpm) | 88±22 |
| Temperatura (°C) | 36,20±0,54 |
| Desencadenante (anamnesis) | |
| No | 55 (27,2) |
| Estrés psicológico aislado | 101 (50,0) |
| Estrés físico (cirugía, asma, etc.) | 40 (19,8) |
| Psicológico + físico | 6 (3,0) |
| Clase funcional de la NYHA previa | |
| I | 164 (81,2) |
| II-III | 38 (18,8) |
| Inicio de los síntomas | |
| < 6 h | 138 (68,3) |
| 6-12 h | 16 (7,9) |
| 12-24 h | 23 (11,4) |
| > 24 h | 21 (10,4) |
| No determinado | 4 (2,0) |
| Dolor torácico | |
| No | 40 (19,8) |
| Angina típica de esfuerzo | 16 (7,9) |
| Angina típica en reposo | 120 (59,4) |
| Angina mixta | 4 (2.0) |
| Atípico | 22 (10,9) |
| Cortejo vegetativo presente | 100 (49,5) |
| Disnea | 90 (44,5) |
| Palpitaciones | 24 (11,9) |
| Síncope | 18 (8,9) |
| Shock al diagnóstico/ingreso | 16 (7,9) |
| Ingreso | |
| Estancia (días) | 7 [4,5-9,0] |
| Arritmias durante el ingresoa | |
| No | 148 (73,3) |
| Fibrilación auricular/flutter/fibrilación supraventricular | 36 (17,8) |
| Taquicardia, sostenida o no/fibrilación ventricular | 11 (5,4) |
| Otras (bradicardia sinusal, bloqueos, extrasístoles, etc.) | 10 (4,9) |
| Grado máximo (Killip) de insuficiencia cardiaca | |
| 1 | 134 (66,3) |
| 2 | 28 (13,9) |
| 3 | 22 (10,9) |
| 4 | 18 (8,9) |
| Trombo apical | 6 (3,0) |
| Embolia sistémica | 5 (2,5) |
| Tromboembolia pulmonar | 1 (0,5) |
| Ictus | 9 (4,5) |
| Pericarditis | 2 (1,0) |
| Hemorragia clínicamente relevante | 9 (4,5) |
| Nuevo episodio/síntomas durante el ingreso | 15 (7,4) |
| Insuficiencia renal aguda | 19 (9,4) |
| Infección durante el ingreso | |
| No | 162 (80,2) |
| Urinaria | 13 (6,4) |
| Respiratoria | 20 (9,9) |
| Otra | 3 (1,5) |
| Desconocida | 4 (2,0) |
| Complicaciones del cateterismob | 10 (5,0) |
FC: frecuencia cardiaca; HTA: hipertensión arterial; NYHA: New York Heart Association; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
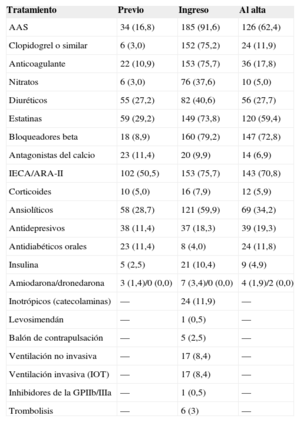
Tratamientos antes, durante el ingreso índice y al alta
| Tratamiento | Previo | Ingreso | Al alta |
|---|---|---|---|
| AAS | 34 (16,8) | 185 (91,6) | 126 (62,4) |
| Clopidogrel o similar | 6 (3,0) | 152 (75,2) | 24 (11,9) |
| Anticoagulante | 22 (10,9) | 153 (75,7) | 36 (17,8) |
| Nitratos | 6 (3,0) | 76 (37,6) | 10 (5,0) |
| Diuréticos | 55 (27,2) | 82 (40,6) | 56 (27,7) |
| Estatinas | 59 (29,2) | 149 (73,8) | 120 (59,4) |
| Bloqueadores beta | 18 (8,9) | 160 (79,2) | 147 (72,8) |
| Antagonistas del calcio | 23 (11,4) | 20 (9,9) | 14 (6,9) |
| IECA/ARA-II | 102 (50,5) | 153 (75,7) | 143 (70,8) |
| Corticoides | 10 (5,0) | 16 (7,9) | 12 (5,9) |
| Ansiolíticos | 58 (28,7) | 121 (59,9) | 69 (34,2) |
| Antidepresivos | 38 (11,4) | 37 (18,3) | 39 (19,3) |
| Antidiabéticos orales | 23 (11,4) | 8 (4,0) | 24 (11,8) |
| Insulina | 5 (2,5) | 21 (10,4) | 9 (4,9) |
| Amiodarona/dronedarona | 3 (1,4)/0 (0,0) | 7 (3,4)/0 (0,0) | 4 (1,9)/2 (0,0) |
| Inotrópicos (catecolaminas) | — | 24 (11,9) | — |
| Levosimendán | — | 1 (0,5) | — |
| Balón de contrapulsación | — | 5 (2,5) | — |
| Ventilación no invasiva | — | 17 (8,4) | — |
| Ventilación invasiva (IOT) | — | 17 (8,4) | — |
| Inhibidores de la GPIIb/IIIa | — | 1 (0,5) | — |
| Trombolisis | — | 6 (3) | — |
AAS: ácido acetilsalicílico; ARA-II: antagonistas del receptor de la angiotensina II; GPIIb/IIIa: glucoproteína IIb/IIIa; IECA: inhibidores de la enzima de conversión de la angiotensina; IOT: intubación orotraqueal. Los valores expresan n (%).
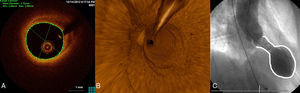
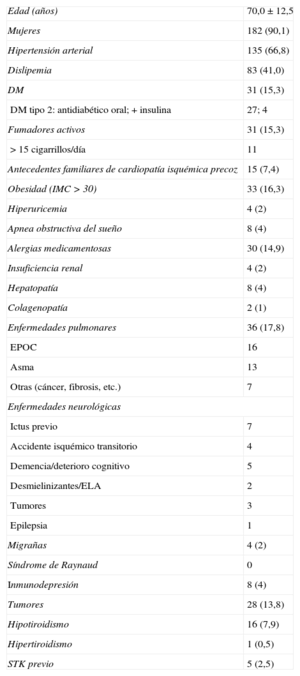
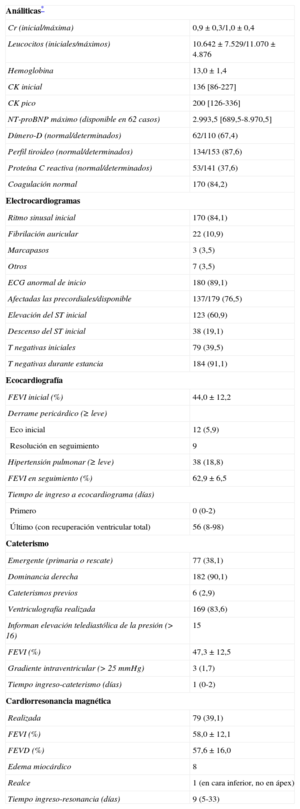
La tabla 5 reúne los datos analíticos y electrocardiográficos y los más relevantes de los ecocardiogramas seriados y el cateterismo. Como criterio de inclusión se precisaba la positividad en los biomarcadores de necrosis miocárdica en todos los casos (troponina T o I; la creatincinasa podía ser normal). No obstante, destacaron las bajas cifras observadas. En cuanto al electrocardiograma, generalmente en ritmo sinusal (83,7%), se observaron frecuentemente anomalías (89,1%) ya desde el primer trazado (figura del material suplementario). Las alteraciones se observan principalmente en derivaciones precordiales, y el 61,8% de los pacientes mostraban elevación del segmento ST en alguna derivación. La presencia ondas T negativas inicialmente se observa en el 39,5% y luego llega hasta el 94,4%. Esto justificó la frecuente aparición de un QT corregido (QTc) alargado en estos pacientes, considerando como tal > 450ms, que se observó en 130 de 165 pacientes (78,8%) (QTc máximo no determinado en 37). La media del QTc fue de 501±73ms. Se observaron dos episodios de torsades de pointes (1%), uno con QTc alargado (620ms) que degeneró en fibrilación ventricular y otro con marcapasos que cedió al aumentar la frecuencia de estimulación a 80 lpm. Comparando a los pacientes en que se registró algún tipo de taquicardia ventricular (sostenida o no) entre los pacientes con QTc máximo conocido en el registro, no se observaron claras diferencias significativas (test de Fisher, p=0,34). Sin embargo, a pesar de que las taquicardias ventriculares fueron poco frecuentes (4,8%), todas ocurrieron en el grupo con QT largo. La fracción de eyección del ventrículo izquierdo medida por ecocardiografía transtorácica inicialmente fue del 44,01±12,28% y en el seguimiento, 63,17±7,3% (medida una mediana de 56 días después del ingreso). En cuanto al cateterismo, se realizó con intención emergente (para angioplastia primaria/rescate) en el 38,0% de los casos y mostró dominancia derecha en el 90,1%. Se llevó a cabo coronariografía invasiva en el 100% de los casos, que descartó alteraciones en el árbol coronario que pudieran ser causa del cuadro (figura 2). La media de la fracción de eyección del ventrículo izquierdo por ventriculografía fue del 47,27±12,48%. En relación con otras pruebas diagnósticas, se efectuó una resonancia magnética, en momentos variables del seguimiento (mediana, 9 [intervalo intercuartílico, 5-33] días) en 79 casos, el 40% de los pacientes. Destaca que en ninguno de los casos se hiciera un test de provocación de vasoespasmo.
Pruebas complementarias (n=202): analítica, electrocardiografía e imagen
| Análiticas* | |
| Cr (inicial/máxima) | 0,9±0,3/1,0±0,4 |
| Leucocitos (iniciales/máximos) | 10.642 ± 7.529/11.070 ± 4.876 |
| Hemoglobina | 13,0±1,4 |
| CK inicial | 136 [86-227] |
| CK pico | 200 [126-336] |
| NT-proBNP máximo (disponible en 62 casos) | 2.993,5 [689,5-8.970,5] |
| Dímero-D (normal/determinados) | 62/110 (67,4) |
| Perfil tiroideo (normal/determinados) | 134/153 (87,6) |
| Proteína C reactiva (normal/determinados) | 53/141 (37,6) |
| Coagulación normal | 170 (84,2) |
| Electrocardiogramas | |
| Ritmo sinusal inicial | 170 (84,1) |
| Fibrilación auricular | 22 (10,9) |
| Marcapasos | 3 (3,5) |
| Otros | 7 (3,5) |
| ECG anormal de inicio | 180 (89,1) |
| Afectadas las precordiales/disponible | 137/179 (76,5) |
| Elevación del ST inicial | 123 (60,9) |
| Descenso del ST inicial | 38 (19,1) |
| T negativas iniciales | 79 (39,5) |
| T negativas durante estancia | 184 (91,1) |
| Ecocardiografía | |
| FEVI inicial (%) | 44,0±12,2 |
| Derrame pericárdico (≥ leve) | |
| Eco inicial | 12 (5,9) |
| Resolución en seguimiento | 9 |
| Hipertensión pulmonar (≥ leve) | 38 (18,8) |
| FEVI en seguimiento (%) | 62,9±6,5 |
| Tiempo de ingreso a ecocardiograma (días) | |
| Primero | 0 (0-2) |
| Último (con recuperación ventricular total) | 56 (8-98) |
| Cateterismo | |
| Emergente (primaria o rescate) | 77 (38,1) |
| Dominancia derecha | 182 (90,1) |
| Cateterismos previos | 6 (2,9) |
| Ventriculografía realizada | 169 (83,6) |
| Informan elevación telediastólica de la presión (> 16) | 15 |
| FEVI (%) | 47,3±12,5 |
| Gradiente intraventricular (> 25 mmHg) | 3 (1,7) |
| Tiempo ingreso-cateterismo (días) | 1 (0-2) |
| Cardiorresonancia magnética | |
| Realizada | 79 (39,1) |
| FEVI (%) | 58,0±12,1 |
| FEVD (%) | 57,6±16,0 |
| Edema miocárdico | 8 |
| Realce | 1 (en cara inferior, no en ápex) |
| Tiempo ingreso-resonancia (días) | 9 (5-33) |
Cr: creatinina; CK: creatincinasa: ECG: electrocardiograma; FEVD: fracción de eyección del ventrículo derecho; FEVI: fracción de eyección del ventrículo izquierdo; NT-proBNP: fracción aminoterminal del propéptido natriurético intercuartílico cerebral.
Los valores expresan n (%), media ± desviación estándar, mediana [intervalo intercuartílico] o mediana (intervalo).
Hallazgos típicos en pruebas de imagen. A: exploración con tomografía de coherencia óptica en uno de los casos, a nivel de la arteria descendente anterior; imagen a nivel medio que muestra una adecuada área luminal mínima (5,82mm2); se aprecia una imagen de placa aterosclerótica en la pared del vaso, sobre todo entre las 11:00 y las 16:00 del cuadrante, pero que no afecta a la luz. B: reconstrucción de tomografía de coherencia óptica tridimensional aproximadamente en la misma zona; se observa la ausencia de lesiones obstructivas o rotura de placa a lo largo del vaso; a las 12:00 del cuadrante aproximadamente, se aprecia la imagen de la guía y al fondo, el ostium del vaso. C: ventriculografía en sístole con la forma típica en «bote para cazar pulpos» («tako-tsubo» en japonés).
La mediana de seguimiento de los pacientes fue 3,20 [1,42-5,61] meses Una paciente concreta, de 51 años, se diagnosticó de feocromocitoma tras su inclusión en RETAKO, pero por su comportamiento típico se decidió mantenerla en el análisis. Se la intervino meses después, sin recurrencias de la enfermedad. Los 5 pacientes fallecidos, murieron durante el ingreso. Durante el seguimiento no hubo fallecimientos. Se recogieron 2 recurrencias de síntomas (dolor) y en 13 casos se observó la variable combinada (reingreso en cardiología, reaparición de síntomas y/o fallecimiento). Los reingresos por otros motivos (p. ej., cirugía general o infección respiratoria) no se contabilizaron como evento adverso (tabla 6).
Seguimiento y mortalidad (n=202)
| Seguimiento clínico (meses) | 3,20 (1,42-5,61) |
| Muertesa | 5 (2,4) |
| Taponamiento (posible rotura cardiaca)b | 1 |
| Variable combinadac | 13 (6,4) |
| Recurrencia de tako-tsubo que precisa ingreso | 0 |
| Recurrencia de síntomas | 2 (1) |
| Reingreso en cardiología | 6 (3) |
| Clase funcional de la NYHA en el seguimiento (valorable) | |
| I | 162 (82,2) |
| II | 30 (15,2) |
| III | 5 (2,5) |
GPIIb/IIIa: glucoproteína IIb/IIIa; NYHA: New York Heart Association.
Los valores expresan n (%) o mediana (intervalo).
RETAKO supone la mayor serie de STK captada en España, con información de primera mano proveniente del médico que atendió al paciente. A pesar de la limitación que impone una enfermedad con una incidencia baja y dispersa por toda la geografía nacional, los datos del registro dan una idea muy aproximada de la epidemiología de STK en España. Las características de los pacientes son muy superponibles a los de otras series extranjeras12,15–22, y predominan las mujeres hipertensas y posmenopáusicas, con frecuente aparición de insuficiencia cardiaca y algunas complicaciones durante el ingreso (arritmias, sobre todo supraventriculares, pero algunas ventriculares; complicaciones iatrogénicas, insuficiencia renal y otras derivadas de las comorbilidades)4. Si bien no es el propósito de este análisis, dado su seguimiento a corto plazo, se observa, como en otras publicaciones, que la evolución suele ser favorable tras el alta hospitalaria4.
Sin embargo, con una etiopatogenia no explicada, sin que quede muy clara la posibilidad de rotura de placa angiográficamente silente a pesar de algunos datos de imagen intracoronaria23,24, se ha postulado multitud de causas4 del síndrome. Posiblemente, entre las teorías más aceptadas por la comunidad científica están las que aceptan la influencia de las catecolaminas y la distribución de los receptores beta miocárdicos en la aparición transitoria de la disfunción ventricular11,12. Recientemente se han señalado otras hipótesis novedosas, como la posibilidad de un vasoespasmo de la microcirculación, por cierta alteración detectada en el metabolismo de la endotelina 125. Difícil de decir con seguridad, todavía se necesita refinar los conocimientos sobre la enfermedad para dar una respuesta definitiva a esta pregunta.
Así, de la información extraída de este registro y otras series previas, da la impresión de que el cuadro conocido como STK podría ser más bien un cajón de sastre que engloba orígenes posiblemente muy variados de una situación de aturdimiento miocárdico. Se han descrito casos en casi todas las circunstancias estresantes imaginables, desde el clásico duelo por el fallecimiento de un familiar, pasando por una caída con dificultad para levantarse durante horas, crisis asmática, tromboembolia pulmonar, cirugías, distiroidismo y enfermedad cerebrovascular, hasta por la medicación catecolaminérgica administrada en pruebas de esfuerzo16,26,27. Queda por aclarar por qué no todas las personas sometidas a situaciones estresantes importantes presentan el síndrome o por qué las que lo han tenido alguna vez no vuelven a presentarlo ante nuevos episodios de marcado estrés, dado que las recurrencias son poco frecuentes.
Con todo, todavía hay un número importante de casos (40-50%), en esta serie y en la literatura médica, en los que, aunque se haga una anamnesis cuidadosa, no se puede identificar ninguna circunstancia como potencial desencadenante (¿formas primarias?). Esto podría ser muy relevante desde el punto de vista pronóstico, ya que da la impresión de que los pacientes con enfermedades o comorbilidades más graves (¿formas secundarias?) podrían evolucionar peor, por ser la enfermedad de base o concomitante la que marque dicho pronóstico menos favorable28. Sin embargo, es difícil decir, hoy por hoy, si son las comorbilidades o las causas desecadentantes lo que marca el pronóstico (probablemente ambas). Esto es muy relevante a la hora de decidir dónde ingresa el paciente. Si no hay comorbilidades (o forma «secundaria»), la situación clínica es buena y la disfunción ventricular con su elevación de biomarcadores no es muy elevada, posiblemente sea seguro que el paciente ingrese unos pocos días en una planta. En esta cohorte, de 5 fallecimientos, 4 fueron por causas no achacables al STK. Obviamente, esta reflexión debe comprobarse con series mayores de STK, cuyos datos tienen que recogerse minuciosamente. En suma, se trata de una enfermedad que ha ganado en los últimos años suficiente entidad para hacerse acreedora de un hueco en diversas guías de práctica clínica (p. ej., las guías de insuficiencia cardiaca de 2012, aparece todavía como miocardiopatía no clasificada)29. En este sentido, RETAKO seguirá su andadura intentando responder con un poco más de precisión algunos de los interrogantes actuales en esta enigmática enfermedad (o grupo de enfermedades).
LimitacionesSe ha de considerar las limitaciones logísticas de un estudio de este diseño y de una enfermedad de incidencia relativamente baja. Es posible que algunos casos incidentes en los hospitales participantes no se hayan diagnosticado, hayan ingresado en otras especialidades, no se les haya realizado cateterismo, no se les hayan elevado las troponinas, no aceptaran participar o no se hayan comunicado al registro, con lo que se subestimaría el número real los STK captados. El cálculo de incidencia se ajustó a la solicitud de coronariografía por síndrome coronario agudo, lo que no permite relacionar el STK con el número total de síndromes coronarios agudos. Esto, sin embargo, no se aleja de la práctica clínica diaria, en la que cada vez es más frecuente la realización de coronariografías a los pacientes con sospecha de síndrome coronario agudo (el registro DIOCLES aporta información actualizada sobre el tema30) y, por otro lado, sigue dando buena idea de la magnitud del problema que el STK supone. La mayor parte de los centros cuentan con análisis de alta sensibilidad (o ultrasensibles) de troponina I o T, pero dado que el registro incluyó a pacientes de muchos hospitales diferentes, la heterogeneidad hizo imposible la comparación. En la tabla 5 se incluyen las cifras de creatincinasa a modo orientativo. Por último, los investigadores de cada centro realizaron el análisis de las coronariografías, igual que el resto de las pruebas, sin la participación de un laboratorio central.
CONCLUSIONESEl STK es una enfermedad poco incidente, que afecta predominantemente a mujeres posmenopáusicas, en la mitad de los casos tras una situación psicológicamente estresante. Caracterizada generalmente por dolor torácico anginoso, sin clara distribución semanal o estacional, una vez superada la fase aguda —que no está exenta de mortalidad o complicaciones—, suele conllevar buen pronóstico.
FINANCIACIÓNEl proyecto fue parcialmente sufragado por una beca de la FMMA (Fundación Mutua Madrileña Automovilista). El cuaderno de recogida de datos electrónico y la página web de RETAKO31 han sido financiados por AstraZeneca.
CONFLICTO DE INTERESESNinguno.
A todos los investigadores del RETAKO y a las entidades que lo han hecho posible.
Hernán D. Mejía, Gisela I. Feltes Guzmán y Corina Biagioni (Instituto Cardiovascular, Hospital Clínico San Carlos, Madrid); Juan Carlos García Rubira (Servicio de Cardiología, Hospital Virgen Macarena, Sevilla); Jaume Figueras y José Barrabés (Servicio de Cardiología, Hospital Vall d’Hebron, Barcelona); Pedro Luis Sánchez y Javier Jiménez Candil (Servicio de Cardiología, Hospital Universitario de Salamanca, Salamanca); Alberto Duran Cambra (Servicio de Cardiología, Hospital de Sant Pau, Barcelona); Álvaro Lozano (Servicio de Cardiología, Hospital de la Princesa, Madrid); Miguel Corbí Pascual (Servicio de Cardiología, Complejo Hospitalario Universitario de Albacete, Albacete); Ramón Bascompte y Fernando Worner (Servicio de Cardiología, Hospital Universitario Arnau de Vilanova, Lérida); José Ramón Ruiz Arroyo (Servicio de Cardiología, Hospital Clínico Lozano Blesa, Zaragoza); Martín Jesús García González (Servicio de Cardiología, Hospital Universitario de Canarias, Sta. Cruz de Tenerife); Oscar Fabregat Andres y Francisco Ridocci-Soriano (Servicio de Cardiología, Consorcio Hospital General Universitario de Valencia, Valencia); Beatriz Pérez y Manuel de Mora Martín (Servicio de Cardiología, Hospital Carlos Haya, Málaga); Juan María Escudier Villa (Servicio de Cardiología, Hospital Puerta de Hierro, Majadahonda, Madrid); Roberto Martin Reyes, Álvaro Aceña y Hans Paul Gaebelt (Servicio de Cardiología, Hospital Fundación Jiménez Díaz, Madrid); Alberto Pérez Castellanos (Servicio de Cardiología, Hospital General Universitario Gregorio Marañón, Madrid); Jesús Piqueras Flores, Andrea Moreno Arcinegas, Jaime Benítez Peyrat, Álvaro-León Moreno Reig y Luis Ruiz Valdepeas Herrero (Servicio de Cardiología, Hospital General Universitario de Ciudad Real, Ciudad Real); Cristina Cambeiro, José María García Acuña y Milagros Pedreira Pérez (Servicio de Cardiología, Hospital Clínico Universitario de Santiago, Santiago de Compostela, A Coruña); Ferrán Rueda Sobella e Irene Santos Pardo (Servicio de Cardiología, Hospital Universitario Germans Trias i Pujol, Badalona, Barcelona); Rafael Vidal Pérez (Servicio de Cardiología, Hospital da Costa, Burela, Lugo); Javier García (Servicio de Cardiología, Hospital Príncipe de Asturias, Alcalá de Henares, Madrid); Bernardo García de la Villa Redondo y Germán Alberto Madoz Peruzzo (Servicio de Cardiología, Hospital de Manacor, Baleares); María del Carmen Manzano Nieto (Servicio de Cardiología, Hospital Severo Ochoa, Leganés, Madrid); Vicente Bodí y Ernesto Valero Picher (Servicio de Cardiología, Hospital Clínico de Valencia, Valencia).