La terapia de resincronización cardiaca (TRC) es un tratamiento establecido para los pacientes con insuficiencia cardiaca, fracción de eyección reducida y con intervalo QRS ancho El objetivo actual de la TRC es «incrementar la tasa de pacientes respondedores a la resincronización». Si bien la tasa de no respondedores a la TRC ha ido decreciendo en los últimos 20 años, sobre todo en los pacientes con bloqueo de rama izquierda, en aquellos pacientes sin bloqueo de rama izquierda dicha tasa se ha mantenido inalterada. Ciertos avances tecnológicos recientes han contribuido a aumentar la tasa de respondedores a la TRC. Entre ellos los nuevos diseños de los cables (cable cuadripolar de ventrículo izquierdo con estimulación en varios puntos), o la posibilidad de ir más allá de la TRC convencional (estimulación endocárdica en ventrículo izquierdo, estimulación del haz de His). Además, para mejorar la tasa de respondedores, se tienen que abordar 3 aspectos: reducir la carga de fibrilación auricular, reducir el número de intervenciones apropiadas e inapropiadas y predecir con precisión los episodios de insuficiencia cardiaca. En esta revisión se presentan las últimas innovaciones tecnológicas en la TRC, las cuales prentenden transformar (mejorar), como en otras áreas de la cardiología, el manejo y cuidado de los pacientes.
Palabras clave
La terapia de resincronización cardiaca (TRC) es un tratamiento no farmacológico y bien establecido para la insuficiencia cardiaca (IC) sintomática de los pacientes con fracción de eyección del ventrículo izquierdo (FEVI) reducida, duración del QRS prolongada y morfología anormal del QRS. Según lo descrito recientemente por el registro ALTITUDE1, la mejora de los resultados obtenidos en los pacientes tratados con TRC que se ha observado en la última década está relacionada con una mayor adherencia al tratamiento farmacológico y el uso de dispositivos recomendados en las guías de práctica clínica2,3. Según la guía más reciente de la ESC2, hay evidencia que respalda (clase I, nivel de recomendación A) el uso de la TRC para los pacientes con IC (clase funcional de la New York Heart Association [NYHA] II-IV), FEVI < 35%, QRS > 150 ms y morfología de bloqueo de rama izquierda (BRI). En pacientes con IC y QRS < 150 ms o morfología de bloqueo distinto del BRI, la evidencia existente es menos sólida3.
El objetivo último de la TRC moderna es aumentar la proporción de pacientes que responden y mejora la calidad de la respuesta. Aunque el porcentaje de pacientes sin respuesta ha disminuido discreta pero progresivamente en los últimos 20 años de uso de la TRC, principalmente en pacientes con bloqueo de tipo BRI, en aquellos sin BRI la tasa de respuesta se mantiene casi inalterada. Esto se ha puesto claramente de manifiesto en el muy reciente ensayo RESPOND-CRT4, en el que se observó una tasa de respuesta clínica combinada del 76,8% de los pacientes tratados con TRC que tenían un BRI y de solo un 66% de los pacientes con TRC sin BRI. Además, la proporción de pacientes denominados «superrespondedores» a la TRC (pacientes que muestran una normalización casi completa de la función y los volúmenes ventriculares) se ha mantenido constante, y continúa representando tan solo alrededor del 30% del total de pacientes tratados con TRC.
Se han producido avances tecnológicos (tabla) que han contribuido a alcanzar algunos de los objetivos de la TRC moderna, y en este artículo se comentarán algunos de ellos. Entre esos avances se encuentran el nuevo diseño del cable del ventrículo izquierdo (VI), la mayor duración del dispositivo, la mejora de la elección automática de la cámara de estimulación del marcapasos, del retraso auriculoventricular (AV) y de los intervalos ventriculoventriculares (VV), una reducción de la frecuencia y el número de intervenciones apropiadas e inapropiadas y, por último, el desarrollo de algoritmos para la detección fiable de los episodios de inminente descompensación de la IC.
Puntos clave de los temas examinados en esta revisión
| Avances basados en el paciente: |
| • Aumento de la adherencia al tratamiento médico |
| La clínica de TRC: |
| • Seguimiento multidisciplinario |
| • Aplicación correcta de las guías de TRC |
| • Mejora del conocimiento sobre la tecnología que subyace a la TRC |
| • Algoritmos basados en dispositivos para predecir los eventos de IC |
| Reducción de la carga de la fibrilación auricular: |
| • Ablación de la unión AV |
| • Ablación percutánea de la arritmia |
| • Algoritmos automáticos para reducir los episodios de FA |
| Avances basados en los dispositivos y en los cables: |
| • Diseño de cable cuadripolar |
| • Estimulación en múltiples puntos |
| • Intervalos AV y VV automáticos (SonR, TRC Adaptive) |
| • Aumento de la cantidad de estimulación BiV |
| • Mayor duración de la batería |
| Estrategias de reducción de las descargas: |
| • Periodos de detección prolongados |
| • Marcapasos antitaquicardia |
| • Algoritmos para reducir el número de descargas de los DAI |
| Investigaciones en marcha: |
| • Estimulación endocárdica del VI |
| • Estimulación del haz de His |
| • Modelos informatizados para visualizar la activación del VI |
AV: auriculoventricular; BiV: biventricular; DAI: desfibrilador automático implantable; FA: fibrilación auricular; IC, insuficiencia cardiaca; TRC: terapia de resincronización cardiaca; VI: ventrículo izquierdo; VV: ventriculoventricular.
Varios estudios han confirmado la importancia de actuar sobre un área eléctrica/mecánica de activación tardía del VI para la estimulación del VI5,6. El diseño, la forma y las características de los cables de marcapasos de VI han evolucionado considerablemente durante las últimas décadas por la necesidad de adaptarse a una amplia variedad de anatomías de las venas cardiacas, al tiempo que se asegura una alta estabilidad mecánica y un buen rendimiento eléctrico. Los cables de VI han evolucionado del cable de un solo electrodo al diseño actual de cable de electrodo cuadripolar. Estos importantes avances tecnológicos en el diseño del cable de VI, junto con cambios profundos en la arquitectura del dispositivo para la emisión de energía (programación independiente de cada polo de estimulación del VI) y la mejora de la duración de la batería han hecho posible la estimulación en múltiples puntos (MPP) en el VI. La principal ventaja de la MPP es que no es necesario implantar múltiples cables, con lo que se evita el consiguiente aumento de las complicaciones de la intervención (p. ej., desalojo del electrodo, perforación de la pared o rotura del cable).
El diseño actual del cable cuadripolar permite un «reposicionamiento electrónico», es decir, la posibilidad de elegir vectores de estimulación diferentes o ajustar la energía de estimulación para asegurar la captura del VI, al tiempo que se evita la estimulación del nervio frénico. La estimulación del nervio frénico y un umbral elevado de captura del VI han sido las razones más frecuentes de la revisión repetida del cable de VI con los cables bipolares de VI7. Numerosos estudios de la seguridad y la eficacia de los cables cuadripolares de VI han indicado unas tasas de éxito del implante de hasta un 98%, y los datos a largo plazo describen una estabilidad en cuanto al umbral de estimulación y unas tasas de desalojo satisfactorias, de solo el 3%8. Recientemente, Turakhia et al.7, en una amplia cohorte de pacientes de Estados Unidos con implante reciente de un sistema de TRC, compararon la supervivencia de los pacientes, la desactivación del cable y la sustitución del cable con cables cuadripolares frente a bipolares. Estos autores observaron que el uso de un cable de VI cuadripolar, en comparación con el bipolar, se asociaba con menos riesgo de muerte, sustitución del cable de VI y desactivación del cable de VI, incluso tras ajustar por las características basales de los pacientes. Estos resultados fueron homogéneos en los pacientes con porcentajes de estimulación biventricular tanto bajos como altos. Los resultados indican también una mayor efectividad de la TRC asociada con los cables cuadripolares, lo que posiblemente se deba a que el uso de un cable de VI cuadripolar ayuda a evitar la estimulación en la cicatriz. Es bien sabido que el implante de un electrodo de VI en un área de cicatrización miocárdica puede asociarse con conducción lenta o incluso un bloqueo de la conducción que lleven menor mejora hemodinámica y mal resultado clínico9.
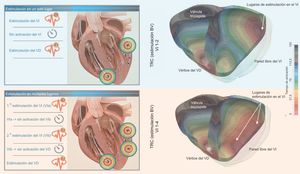
Como se ha indicado antes, una ventaja adicional del cable de VI cuadripolar deriva de la posible aplicación de la estimulación con un solo cable de manera simultánea o secuencial a través de múltiples electrodos (figura). Dado que se cree que el beneficio aportado por la TRC deriva predominantemente de una mejora de la resincronización eléctrica del VI, ha surgido el concepto de MPP como estrategia alternativa para mejorar las tasas éxito de la TRC. Varios estudios clínicos con un pequeño número de pacientes han demostrado una mejora aguda de la contractilidad del VI y los parámetros hemodinámicos, incluidos los bucles de presión-volumen10,11. Además, se ha demostrado que la MPP (en comparación con la estimulación biventricular convencional) reduce la amplitud del QRS y el tiempo de activación del VI y mejora los resultados tanto a medio como a largo plazo12. Sin embargo, estos datos contradicen las observaciones del muy reciente estudio iSPOT (Left Ventricular Multispot Pacing for CRT). En ese ensayo se observó que, en los pacientes con bloqueo de tipo BRI, la MMP del VI aporta una mejora de la contractilidad comparable a la de la mejor estimulación biventricular convencional13. El efecto crónico de la MPP se ha evaluado sobre todo en estudios pequeños y tan solo recientemente en un ensayo controlado y prospectivo amplio (el estudio MPP)12. El objetivo principal de eficacia del ensayo MPP se alcanzó al demostrarse la no inferioridad de la tasa de respuesta en el grupo de MMP en comparación con el grupo de estimulación biventricular convencional. En otros análisis adicionales se demostró la capacidad de la tecnología de MPP de alcanzar una tasa de respuesta del 87% de los pacientes con unos ajustes óptimos del programa. Más concretamente, la separación espacial > 30 mm entre los diferentes polos del cable de VI y un retraso de activación de 5 ms entre los diferentes lugares de estimulación produjeron el porcentaje más alto de pacientes «superrespondedores» a la TRC. Es importante señalar que en el estudio MPP se preseleccionó a los pacientes sin respuesta a la TRC convencional14. Sin embargo, actualmente la utilidad clínica de cualquier modo de MPP del VI, como modo por defecto de la estimulación, no está aún del todo clara15,16. También se debe tener en cuenta que la estimulación a través de electrodos adicionales reduce la duración de la batería del dispositivo.
Representación in silico del efecto de una estimulación en un solo lugar o en múltiples lugares. Representación esquemática de la estimulación en múltiples lugares del ventrículo izquierdo (VI) en comparación con la estimulación en un solo lugar (paneles de la izquierda). En los paneles de la derecha se muestra una simulación tridimensional 3D específica de un paciente in silico en cuanto al patrón de activación del VI el ventrículo derecho (VD). En el panel superior izquierdo, se muestra la estimulación convencional del VI en un solo lugar en combinación con la estimulación ventricular del VD convencional, mientras que en el panel superior derecho se muestra el mapa de activación BV 3D resultante. En el panel inferior izquierdo, se muestra una estimulación de múltiples puntos en el VI, en la que el primer ritmo del VI (VIa) precede inmediatamente al segundo ritmo del VI (VIb), creando un patrón de activación diferente, que se muestra en el panel inferior derecho. La estimulación de múltiples puntos en el VI muestra una mejor sincronización eléctrica del VI, tal como se muestra en la simulación 3D. BV: biventricular; TRC: terapia de resincronización cardiaca. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
En un futuro próximo, las simulaciones in silico tridimensionales del patrón de activación del VI y el ventrículo derecho durante la aplicación de diferentes modalidades de estimulación específicas para el paciente y el uso de múltiples electrodos de VI podrían ser de utilidad para un ajuste fino de la activación del ventrículo (figura) y posiblemente del patrón de activación mecánica resultante17.
MÁS ALLÁ DE LA APLICACIÓN CONVENCIONAL DE LA TRCEn los últimos años, diversas consideraciones fisiológicas han puesto en duda el concepto de aplicación tradicional de la TRC. El primero de esos conceptos (la estimulación endocárdica del VI) se basa en la observación de que la TRC convencional se aplica colocando el cable de estimulación en el endocardio del ventrículo derecho y un cable en la pared epicárdica del VI. Esta configuración de la estimulación es en sentido inverso a la activación fisiológica del VI18,19. El segundo concepto (la estimulación del haz de His) se basa en la observación de que el BRI es con frecuencia muy proximal en el sistema de conducción AV y de que, con la estimulación en la región del haz de His con un cable y una energía adecuados, es posible restablecer una conducción normal del BRI.
Estimulación endocárdica del VIUna de las opciones para realizar la estimulación endocárdica del VI es usar un cable de estimulación bipolar con atornillamiento convencional implantado a través de una punción transeptal20,21 o transapical del VI. Una alternativa a la estimulación desde el endocardio consiste en colocar un receptor de señal inalámbrico en la cavidad del VI22. Cada uno de esos enfoques tiene ventajas e inconvenientes. Entre estos últimos, la insuficiencia valvular mitral debida a la coaptación incompleta de las valvas, el aumento del riesgo de ictus a causa del implante permanente del marcapasos en el VI, el desalojo del cable, el desprendimiento del receptor y la consiguiente embolización.
La punción transapical para la estimulación del VI solo se ha descrito de manera anecdótica. En cambio, la fiabilidad, la seguridad y los beneficios clínicos de la estimulación endocárdica del VI a través de un abordaje transeptal se ha investigado sistemáticamente. La experiencia más amplia publicada con la estimulación endocárdica del VI es la del estudio ALSYNC (ALternate Site Cardiac ResYNChronization)20. En dicho estudio se evaluó la fiabilidad y la seguridad de la estimulación endocárdica del VI empleando un cable de estimulación comercializado implantado a través de un único acceso torácico, mediante un nuevo sistema de aplicación de marcapasos transeptal auricular. El ALSYNC es un ensayo de investigación clínica prospectivo con un seguimiento mínimo de 12 meses, realizado en 18 centros en los que se reclutó a pacientes aptos para TRC para quienes la TRC convencional había fallado o no era apropiada. Se realizó con éxito el implante endocárdico del VI en el 89,4% de los 138 pacientes incluidos. El cumplimiento de la definición del objetivo principal sin complicaciones fue del 82,2% a los 6 meses. En ese estudio, se observaron 14 accidentes isquémicos transitorios (9 pacientes, 6,8%), 5 ictus no invalidantes (5 pacientes, 3,8%) y 23 muertes (17,4%) durante el periodo de seguimiento. No hubo ninguna muerte como consecuencia de una complicación en cuanto al objetivo principal. A los 6 meses, la clase de la NYHA mejoró en un 59% de los pacientes, y un 55% de ellos presentaron una reducción del volumen telesistólico del VI ≥ 15%. En el subgrupo de pacientes específicos incluidos tras falta de respuesta a la TRC, se observó una mejora similar con la estimulación endocárdica del VI.
Una alternativa para la estimulación endocárdica del VI es la estimulación del VI sin cable. Esta tecnología novedosa y única se ha investigado en 2 estudios prospectivos, el Wireless Stimulation Endocardially for CRT Trial (WiSE-CRT)22 y el Safety and Performance of Electrodes Implanted in the Left Ventricle (SELECT-LV)23. Ambos incluyeron a pacientes que tenían indicada la TRC y en los que la TRC convencional había «fallado» o no habían obtenido respuesta. En el estudio WiSE-CRT, se consiguió implantar el sistema con éxito en 13 pacientes (76,5%). Se registró una estimulación biventricular en el 83 y el 92% de los pacientes al mes y a los 6 meses respectivamente. La amplitud del QRS durante la estimulación biventricular fue menor que la observada con la estimulación ventricular derecha al mes y a los 6 meses. En este último intervalo de seguimiento, 2 tercios de los pacientes tenían una mejora de como mínimo 1 grado en la clase funcional de la NYHA. La FEVI aumentó significativamente en 6 puntos en el seguimiento realizado a los 6 meses. El objetivo principal en el estudio SELECT-LV, es decir, la estimulación biventricular documentada en el electrocardiograma de 12 derivaciones al mes, se alcanzó en 33 de los 34 pacientes. En ese estudio, un total de 28 pacientes (84,8%) presentaron una mejora de la puntuación clínica combinada a los 6 meses y 21 (66%) tuvieron una respuesta ecocardiográfica positiva a la TRC (> 5% de incremento absoluto en la FEVI). En un pequeño número de pacientes (8,6%) se produjeron eventos graves relacionados con la intervención o con el dispositivo en las primeras 24 h, y en 8 pacientes (22,9%), entre las 24 h y 1 mes. Tanto el estudio WiSE-CRT como el SELECT-LV demostraron la viabilidad clínica del sistema de electrodo de VI inalámbrico. Este enfoque aportó beneficios clínicos no solo para los pacientes con una indicación estándar para la TRC, sino también especialmente para los pacientes que cumplían los criterios de aumento de la TRC, que no habían sido tratados anteriormente o a los que se había considerado no respondedores (la población con «fallo» de la TRC). Sin embargo, serán necesarios nuevos estudios con registros de vigilancia poscomercialización o ensayos controlados y aleatorizados para establecer los resultados a largo plazo, comparar otros resultados adicionales y explorar diferentes técnicas para elegir el lugar óptimo para la estimulación endocárdica.
Estimulación del haz de HisLa estimulación del haz de His se ha investigado en el pasado como posible opción para evitar los efectos nocivos de la estimulación del ventrículo derecho a largo plazo, pero actualmente se ha reavivado el interés por esta opción en el contexto de la TRC. En un subgrupo de pacientes en los que el BRI está situado en un lugar muy proximal del sistema de conducción, la estimulación del haz de His podría ser una alternativa favorable para restablecer un patrón de activación normal24. Es preciso establecer una distinción entre la estimulación selectiva del haz de His y la no selectiva, es decir, la estimulación en la proximidad del haz de His, presumiblemente con un alto nivel de energía. En un estudio comparativo recientemente publicado, se llegó a la conclusión de que tanto la estimulación selectiva del haz de His como la estimulación no selectiva eran capaces de restablecer la sincronía eléctrica y mecánica del VI normal. En 2015, un estudio de grupos cruzados en una pequeña muestra de pacientes mostró una respuesta igual de favorable con la estimulación del haz de His y la estimulación biventricular25. Además, la posibilidad técnica de colocar el electrodo de estimulación del Haz de His en el puerto de conexión del VI del generador de TRC tuvo éxito respecto a reducir la amplitud del QRS y conseguir la resincronización26. No obstante, será necesario continuar la investigación para determinar el valor añadido que aporta esta técnica, en especial para determinar qué subgrupos de pacientes podrían obtener el máximo beneficio de la estimulación del haz de His.
¿CÓMO SE PUEDE MEJORAR LA RESPUESTA A LA TRC?De entre los diversos factores que podrían influir negativamente en la respuesta a la TRC, la optimización deficiente del retraso AV y del intervalo VV del dispositivo de TRC es la variable más frecuente (y cabe suponer que la más fácil de corregir)27. Varios estudios han demostrado los beneficios hemodinámicos agudos de optimizar los intervalos AV y VV28. Aunque la optimización con guía ecocardiográfica es un método fácilmente accesible, continúa planteando dificultades logísticas y un proceso que requiere la dedicación de muchos recursos, con medición de los parámetros de programación en reposo y en decúbito supino. En consecuencia, la optimización basada en el dispositivo resulta especialmente atractiva. Sin embargo, los estudios que han utilizado los algoritmos de intervalos AV y VV denominados «estáticos», es decir, la elección de un determinado retraso AV o intervalo VV programados una vez en cada visita de seguimiento, han indicado unos resultados neutros en comparación con los de intervalos AV y VV ajustados mediante ecocardiografía. El fallo de este enfoque «estático» muy probablemente se deba a la incapacidad de adaptar de manera continua el retraso AV y el intervalo VV en situaciones fisiológicas como el ejercicio, pero también se debe a cambios en las propiedades de conducción subyacentes en el paciente.
El empleo de nuevas tecnologías que usan el sensor de contractilidad SonR o el algoritmo de TRC Adaptive podría ser útil para la aplicación de una estrategia individualizada basada en dispositivos que permitan optimizar automáticamente los intervalos eléctricos AV y VV y la cámara preferida para la estimulación de manera repetida durante el reposo y el ejercicio. Los resultados alcanzados con estos 2 algoritmos «dinámicos» diferentes apuntan a la superioridad de este enfoque respecto al de optimización ecocardiográfica.
El algoritmo SonR (LivaNova PLC; Londres, Reino Unido) consiste en un acelerómetro incluido en la punta del electrodo de la aurícula derecha. El acelerómetro registra las vibraciones mecánicas generadas por la contracción cardiaca que se propagan por todo el corazón. Ello proporciona una mediana de la contractilidad cardiaca y sirve de base para el cálculo de los intervalos AV y VV optimizados individuales. El algoritmo basado en el sensor se ha investigado recientemente en un amplio ensayo prospectivo, controlado y aleatorizado4 y se ha comparado su seguridad y eficacia con las de la optimización de los intervalos AV y VV mediante guía ecocardiográfica. El estudio RESPOND-CRT4 fue un ensayo prospectivo, multicéntrico, aleatorizado, doble ciego, de no inferioridad. Se asignó aleatoriamente a los pacientes (en relación 2:1) a optimización de la TRC automática semanal con el método SonR u optimización de los intervalos AV y VV con guía ecocardiográfica. El objetivo principal en cuanto a la eficacia se definió como el porcentaje de pacientes con respuesta clínica (pacientes que seguían con vida, sin eventos relacionados con IC validados, con mejora de la clase NYHA o de la calidad de vida) a los 12 meses. Se incluyó en el estudio a 1.039 pacientes. La tasa de pacientes con respuesta fue del 75,0% del grupo de SonR frente al 70,4% del grupo de control (p < 0,001 para un margen de no inferioridad del 10,0%). Tras una media de seguimiento total de aproximadamente 18 meses, el SonR se asoció con una reducción del riesgo relativo de hospitalizaciones por IC del 35% (hazard ratio [HR] = 0,65; intervalo de confianza del 95% [IC95%], 0,46-0,92; test de log rank, p < 0,01). Los pacientes con fibrilación auricular (FA) y aquellos con disfunción renal asignados al grupo de SonR presentaron un efecto beneficioso especialmente notable, en comparación con el grupo de control.
El algoritmo Adaptive TRC (Medtronic Inc.; Minneapolis, Minnesota, Estados Unidos) es un nuevo algoritmo que, en un contexto ambulatorio, mide periódicamente la conducción intrínseca y ajusta los parámetros de estimulación de la TRC de modo dinámico. Este algoritmo reduce al mínimo la frecuencia de la estimulación del ventrículo derecho (con lo que mejora la cantidad de estimulación del VI o biventricular). Más concretamente, si el intervalo de conducción de la aurícula derecha al ventrículo derecho es normal (retraso AV ≤ 200 ms en presencia de ritmo sinusal), el algoritmo produce la estimulación solo del VI. En este caso, el retraso AV se ajusta para producir un grado apropiado de fusión con la onda de activación que se propaga a través de la red de His-Purkinje29. De hecho, los estudios de hemodinámica iniciales28,30,31 mostraron que, en los pacientes con conducción AV normal, la estimulación del VI con fusión resincroniza la contracción ventricular mejor que la estimulación biventricular simultánea. Sin embargo, si el intervalo de conducción AV intrínseco está prolongado (AV > 200 ms en presencia de ritmo sinusal), el algoritmo produce una estimulación biventricular. Se presenta un comentario más detallado del algoritmo en otra publicación29. Este algoritmo se ha evaluado en un ensayo clínico controlado y aleatorizado, utilizando como tratamiento de comparación la optimización de la TRC con guía ecocardiográfica clásica. El porcentaje de estimulación del VI sincronizada en el grupo de la TRC Adaptive mostró una asociación independiente con reducción del riesgo de muerte o de hospitalización por IC, y con un porcentaje significativamente superior de mejora del resultado clínico a los 6 y los 12 meses, en comparación con el grupo de control32. Sin embargo, tiene interés señalar que, en un subestudio de Yamasaki et al.33, se observó que los efectos beneficiosos más considerables del algoritmo de TRC Adaptive se daban en un subgrupo de pacientes con BRI y morfología del QRS de 120-150 ms, y no en los pacientes con un QRS más amplio.
LA CARGA DE LA FIBRILACIÓN AURICULARAunque la FA se produce en más del 25% de los pacientes aptos para la TRC, la evidencia existente que respalda el efecto favorable de la TRC en los pacientes con algún tipo de FA se limita a estudios de observación y datos de registros. El pronóstico de los pacientes con IC que tienen FA suele ser peor que el de los que están en ritmo sinusal34, y el tratamiento con bloqueadores beta, aun siendo eficaz para reducir la frecuencia cardiaca, no influye en la mortalidad35.
El uso de la TRC en pacientes con IC y riesgo de FA o que tienen ya antecedentes de FA paroxística o permanente plantea varias cuestiones y retos. La influencia de la TRC en el inicio de la FA y la carga de esta se ha considerado hasta ahora más bien discreta. Sin embargo, los datos recientes del ensayo controlado y aleatorizado antes descrito sobre la TRC Adaptive mostraron que los pacientes tratados con TRC Adaptive presentaban una reducción del riesgo de FA en comparación con los tratados con la TRC convencional36. Tras una media de seguimiento de 20,2 meses, el 8,7% de los pacientes tratados con la TRC Adaptive y el 16,2% de los tratados con la TRC convencional habían presentado eventos de la variable de valoración principal (HR = 0,54; IC95%, 0,31-0,93; p < 0,03). La mayor parte de la reducción de la FA se produjo en los subgrupos con una conducción AV prolongada en la situación inicial y con un significativo remodelado inverso de la aurícula izquierda. Además, la carga de la FA y la progresión de la FA se vieron influidas de manera significativa por el algoritmo de marcapasos antitaquicardia (MAT) Reactive37,38. Este nuevo algoritmo de MAT tuvo un porcentaje de éxitos del 44% en la finalización de los episodios de taquicardia auricular/FA, especialmente en las duraciones de ciclo auricular prolongadas (> 210 ms) y en presencia de un ritmo auricular regular. Por otra parte, el estudio MINERVA (MINimizE Right Ventricular pacing to prevent Atrial fibrillation and heart failure) evidenció una reducción de la progresión de la FA (reducción del 48% en el riesgo de FA persistente a los 2 años, en comparación con el marcapasos estándar) y una reducción del número de hospitalizaciones por FA. Considerados conjuntamente, los resultados de los estudios más recientes de la TRC Adaptive y del estudio MINERVA son extraordinariamente alentadores, puesto que indican que el pronóstico de la TRC para los pacientes con FA paroxística o persistente puede mejorarse en mayor medida con la adopción adecuada y sistemática de los algoritmos basados en el dispositivo para la optimización del retraso AV o la finalización de la arritmia. Sin embargo, a los pacientes tratados con TRC que tienen FA paroxística o persistente, se les puede ofrecer también la opción de una ablación mediante catéter para el tratamiento de la FA. El estudio CASTLE-AF (Catheter Ablation versus Standard conventional Treatment in patients with LEft ventricular dysfunction and Atrial Fibrillation) es un amplio ensayo controlado, prospectivo y aleatorizado, con 397 pacientes aleatorizados en relación 1:1 a tratamiento médico convencional o aislamiento de las venas pulmonares (y finalmente a otras líneas adicionales a criterio del operador)39. Los pacientes tratados con TRC a los que se practicó una ablación de la FA presentaron mayor incremento de la FEVI y una reducción muy significativa del objetivo combinado formado por la mortalidad por cualquier causa y la hospitalización por agravamiento de la IC (HR = 0,62; IC95%, 0,43-0,87; p = 0,007). Es importante señalar que la ablación percutánea de la FA en pacientes con un «fallo» de la TRC se asoció también con una mejora en cuanto a la mortalidad cardiovascular y la hospitalización en comparación con el tratamiento convencional estándar40.
El efecto de la TRC está profundamente relacionado con la aplicación continua de la resincronización cardiaca, con una relación «dosis-efecto» muy intensa. Incluso unas pocas unidades porcentuales de pérdida de resincronización cardiaca conducen a un aumento significativo de la mortalidad y del riesgo de hospitalización por IC. Ousdigian et al.41 lo demostraron claramente, pues observaron que no se alcanzaba un gran porcentaje de estimulación biventricular en dos tercios de los 8.686 pacientes con FA persistente o permanente, y que estos pacientes tenían mayor riesgo de muerte. Sin embargo, uno de los problemas clave es documentar la aplicación efectiva de la TRC en los pacientes con FA permanente. Kamath et al.42 observaron que el porcentaje de estimulación biventricular puede haberse sobrestimado en los algoritmos que lo contabilizan basándose en el dispositivo de TRC. En consecuencia, se ha desarrollado un nuevo algoritmo basado en el dispositivo para la detección automática de la estimulación biventricular, que utiliza la morfología de los electrogramas intracardiacos de campo lejano del cátodo de estimulación del VI para diferenciar la captura plena y la seudofusión, y lo combinaron con otro nuevo algoritmo que aumenta la estimulación del VI efectiva durante la FA en los pacientes a los que se aplica la TRC. Ese enfoque combinado se ha evaluado recientemente en el ensayo CRTee43, en el que se demostró que este nuevo algoritmo basado en el dispositivo aumentaba significativamente el porcentaje de estimulación del VI efectiva durante la FA, con un aumento mínimo de la frecuencia cardiaca. En algunos pacientes, el algoritmo por sí solo podría aumentar el porcentaje de estimulación del VI efectiva a más del 95%. El enfoque no invasivo sencillo puede evitar que los pacientes reciban más tratamiento farmacológico e intervenciones de ablación invasivas. A pesar de todos estos algoritmos, en algunos casos no se alcanza el suficiente control de la frecuencia. Aunque no se han realizado ensayos controlados y aleatorizados para evaluar la importancia de realizar una ablación de la unión AV en los pacientes con FA y TRC (cuestión que continúa generando cierta controversia), las guías actuales recomiendan claramente la ablación de la unión AV para los pacientes tratados con TRC y FA permanente, y esta recomendación se basa en la evidencia aportada por estudios de observación amplios44. No obstante, todavía no se ha esclarecido detalladamente la estrategia de tratamiento apropiada para los pacientes sometidos a TRC que presentan diferentes tipos de FA.
ESTRATEGIAS DE REDUCCIÓN DE DESCARGAS PARA PACIENTES CON TRC CON DESFIBRILACIÓNLa producción de descargas tanto apropiadas como inapropiadas de un desfibrilador automático implantable (DAI) se asocia con un incremento de 3-5 veces en el riesgo de muerte de los pacientes portadores de este dispositivo para prevención primaria45. Las intervenciones destinadas a reducir el número de descargas se basan en la administración de fármacos antiarrítmicos, algoritmos de finalización de arritmias programados por el dispositivo y estrategias de ablación. Los datos del estudio MADIT-CRT (Multicenter Automatic Defibrillator Implantation with CRT) indicaron que el carvedilol fue superior al metoprolol por lo que respecta a la evitación del MAT y el tratamiento de descargas (reducción general del riesgo relativo de un 36% y reducción del riesgo relativo de hasta un 50% si la FA como causa se consideraba por separado)46. Además, se observaron resultados superiores con carvedilol, en comparación con metoprolol, por lo que respecta a la mortalidad, la hospitalización por IC y el tratamiento de la taquicardia ventricular/fibrilación ventricular en general.
Las estrategias de reducción de las descargas han incluido el uso generalizado de MAT empírico para las arritmias relativamente rápidas, la programación estratégica para retrasar la detección o el tratamiento por parte del DAI, y el desarrollo de mejores algoritmos de discriminación de la arritmia. Dos ensayos clave en cuanto a la prevención del tratamiento de descargas son el MADIT-RIT47 y el ADVANCE III48. Un metanálisis posterior49 puso de manifiesto que la programación de una reducción del tratamiento daba lugar a un riesgo de muerte un 30% inferior al existente con la programación convencional. La reducción de la mortalidad con una programación de reducción del tratamiento fue similar en todos los ensayos. Es importante señalar que no hubo diferencias significativas en el riesgo de síncope ni en el riesgo de descargas apropiadas con la programación de reducción del tratamiento en comparación con la programación convencional. Sin embargo, se observó una reducción del 50% en las descargas inapropiadas con la programación de reducción del tratamiento en comparación con la programación convencional. Estos resultados se han confirmado en una amplia población de pacientes con TRC con desfibrilación (TRC-D) de la «práctica clínica real», el estudio PainFree Smart Shock Technology (SST)50, que incluyó a pacientes con multitud de comorbilidades, con un porcentaje significativo de pacientes con FA. De hecho, aunque se trató con un DAI en prevención secundaria al 20% de los pacientes con TRC incluidos en el Painfree SST y un 37% de los del grupo de TRC tenían antecedentes de arritmias auriculares, la incidencia de descargas inadecuadas para la TRC-D fue una de las más bajas descritas en la bibliografía hasta el momento: el 1,5% a 1 año y el 3,9% a los 3 años de seguimiento. Fue igualmente baja la incidencia de los posibles tratamientos inapropiados en los pacientes con TRC-D, incluidos el tratamiento de descargas o el de MAT: el 2,3% a 1 año, el 3,7% a los 2 años y el 5,7% a los 3 años. En conjunto, estos datos indican que la aplicación sistemática de una estrategia de programación predefinida conjuntamente con la adopción de nuevos algoritmos de discriminación se asocia con una tasa muy baja de descargas inapropiadas en la TRC-D sin un aumento del riesgo de síncope.
PREDICCIÓN DE LOS EPISODIOS DE INSUFICIENCIA CARDIACALa predicción de los episodios de descompensación de la IC es un objetivo importante desde las perspectivas del paciente, del médico y de la economía de la salud. La mayor parte de las puntuaciones de riesgo utilizadas hasta ahora para identificar a los pacientes con riesgo de IC o fallecer evalúan el riesgo estático en la situación inicial o en un contexto de hospitalización. En cambio, los dispositivos médicos implantables, como marcapasos, DAI y TRC, pueden proporcionar mediciones diarias de múltiples parámetros «diagnósticos» para la posible evaluación del estado clínico del paciente. Así pues, los parámetros pronósticos basados en el dispositivo brindan una buena oportunidad de elaborar un algoritmo dinámico del riesgo de IC.
En otros estudios se ha demostrado que los parámetros «diagnósticos» basados en dispositivos implantables, como la impedancia intratorácica, la información sobre la carga de FA y el control de la frecuencia, la frecuencia cardiaca nocturna, la vitalidad de la frecuencia cardiaca, la ventilación y la actividad del paciente, pueden identificar cuándo un paciente tiene riesgo de presentar eventos de IC y podrían utilizarse solos o combinados para orientar el tratamiento del paciente. Sin embargo, estos estudios han indicado bajas sensibilidad y especificidad para identificar a los pacientes en riesgo de presentar eventos de IC y muerte51. Esta incapacidad de predecir una hospitalización inminente por IC se debe muy probablemente a que un solo parámetro diagnóstico basado en sensores o dispositivos (o una combinación de parámetros) no permite captar la multitud de procesos fisiopatológicos que interaccionan de manera compleja durante la IC y pueden culminar en la aparición de una descompensación aguda.
La elaboración y validación de una nueva puntuación de riesgo de IC dinámica basada en la combinación de varios parámetros diagnósticos detectados en dispositivos implantables fue evaluada por primera vez por Cowie et al.52. En una cohorte de 2.231 pacientes, esos autores observaron que la puntuación de riesgo de IC dinámica desarrollada en ese estudio permitía identificar cuándo un paciente con alto riesgo tenía más riesgo de hospitalización inminente por IC en el contexto ambulatorio, lo cual aporta una información adicional que va más allá de la aportada por una puntuación de riesgo estática. A diferencia de los algoritmos que realizan una evaluación diaria para la detección de episodios de agravamiento de la IC, este análisis estratificó a los pacientes en grupos de riesgo alto, medio y bajo basándose en evaluaciones mensuales, y demostró que el grupo de riesgo alto tenía un riesgo de hospitalización por IC más de 5 veces superior que el grupo de riesgo bajo. Un modelo bayesiano, desarrollado nuevamente para la evaluación mensual, identificó a pacientes con un riesgo de hospitalización 10 veces superior al comparar el grupo de riesgo alto con el de riesgo bajo, pero faltaron casi el 40% de las evaluaciones mensuales en el grupo de riesgo medio. Una puntuación de riesgo de IC dinámica varía con el tiempo: un mismo paciente puede tener un riesgo alto y luego un riesgo bajo en periodos diferentes, según el estado de los parámetros diagnósticos basados en el dispositivo que se supervisan de manera continua.
En el reciente estudio MultiSENSE 53, se confirmó la capacidad de un algoritmo basado en dispositivos de detectar el empeoramiento gradual de la IC a lo largo de días o semanas. En total, 900 pacientes (cohorte de derivación, n = 500; cohorte de validación, n = 400) fueron objeto de seguimiento durante un periodo de hasta 1 año. El índice HeartLogic tuvo una sensibilidad del 70%, con una mediana de ventana de alerta de 34 días antes de la aparición de la mayor parte de los eventos de IC (definidos como hospitalizaciones o visitas ambulatorias con tratamientos intravenosos como diagnóstico principal), y con una tasa de alertas inexplicadas de tan solo 1,47 por paciente y año con el umbral teórico de la cohorte de validación independiente. El índice multisensor HeartLogic y un algoritmo de alerta proporcionan un predictor sensible y oportuno de las descompensaciones inminentes de la IC. Sin embargo, serán necesarios nuevos estudios para evaluar el algoritmo HeartLogic en poblaciones con IC más amplias.
CONCLUSIONES Y PERSPECTIVAS FUTURASLa identificación, hace más de 90 años, por Carl Wiggers de que los trastornos de la conducción conducen a una disfunción del VI54 puede seguirse hasta los experimentos que llevaron al paradigma de la TRC55. La tecnología de los marcapasos, diseñada para corregir las alteraciones de la conducción ventricular, se evaluó finalmente en ensayos controlados y aleatorizados de la TRC impulsados por ingenieros, por clínicos y por la industria. Como ocurre probablemente en otros campos de la cardiología, la tecnología y las innovaciones para la aplicación de la TRC han estado en la vanguardia de la transformación (mejora) de la asistencia a los pacientes. La TRC es un ejemplo excepcional de un tratamiento que ha combinado los campos de la electrofisiología y la IC, 2 subespecialidades distintas de la cardiología que habían estado muy distantes. Dada la rápida evolución de los conocimientos y la tecnología, hay ya en el horizonte nuevas formas de aplicar la TRC y es muy probable que con ello se reduzca el porcentaje de pacientes sin respuesta.
CONFLICTO DE INTERESESA. Auricchio es consultor de Medtronic, Boston Scientific, Biosense Webster y LivaNova y ha recibido pagos por conferencias de Medtronic, Boston Scientific y LivaNova.