Las ecuaciones de riesgo empleadas en población general no son de utilidad en hipercolesterolemias genéticas (HG). Las placas carotídeas se han demostrado útiles en la predicción cardiovascular y la reclasificación del riesgo. Su utilidad en HG no se ha estudiado y es el objetivo del estudio.
MétodosSe incluyó a 1.778 sujetos con HG y una media de seguimiento de 6,26 años hasta la aparición de eventos cardiovasculares, en los que al inicio se estudió la presencia de placas en carótidas por ecografía de alta resolución.
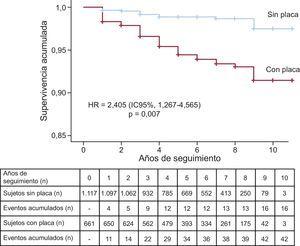
ResultadosSe encontraron placas en 661 (37,2%) sujetos: el 31,9% con hipercolesterolemia familiar, el 39,8% en hiperlipemia familiar combinada, el 45,5% en disbetalipoproteinemia y el 43,2% en hipercolesterolemia poligénica. Durante el seguimiento, 58 pacientes sufrieron un evento cardiovascular. La tasa de eventos fue 6.354/100.000 (IC95%, 4.432,4-8.275,6) en el grupo con placa y 1.432/100.000 (IC95%, 730,6-2.134,3) en el grupo sin placa, con diferencia significativa entre ambos grupos (p < 0,001). El riesgo de sufrir un evento de los sujetos con placa fue 4,34 (IC95%, 2,44-7,71; p < 0,001) veces superior en presencia de placa y 2,40 (IC95%, 1,27-4,56; p = 0,007) veces superior tras ajustar por los principales factores de riesgo. El número total de placas se asoció positivamente con el riesgo de eventos.
ConclusionesLa detección de placas carotídeas identifica a un subgrupo de pacientes que concentran la mayoría de los eventos cardiovasculares. Estos resultados respaldan la utilización de la detección de placas en esta población y deben ayudar en la estratificación del riesgo y la planificación del tratamiento en las HG.
Palabras clave
La enfermedad cardiovascular (ECV) es la principal causa de mortalidad e incapacidad en la mayoría de los países1. En cerca de un tercio de los casos, la primera manifestación de la ECV es mortal o deja secuelas irreversibles2,3 y la recurrencia de eventos sigue siendo muy alta4,5. El tratamiento de la ECV debe priorizarse en la prevención primaria estratificando la intervención según el riesgo individual6. En población general, la predicción del riesgo se establece con ecuaciones basadas en la presencia de factores de riesgo clásicos7. Aunque con muchas limitaciones8, estas ecuaciones son las herramientas recomendadas por las sociedades científicas para determinar el riesgo de ECV6,9.
Una excepción a la utilización de las ecuaciones de riesgo en prevención primaria son los sujetos con hipercolesterolemias genéticas (HG). Estas ecuaciones subestiman el riesgo de estos sujetos, por lo que no se recomienda utilizarlas con ellos y considerarlos en alto riesgo de ECV, pues tienen concentraciones de lipoproteínas aterogénicas muy elevadas desde el nacimiento6,7,9,10. Sin embargo, ni todas las HG tienen el mismo riesgo cardiovascular ni todas requieren la misma intervención, por lo que son imprescindibles nuevos procedimientos en la predicción de ECV y la estratificación del riesgo de estos pacientes10.
Se ha propuesto la detección de la aterosclerosis subclínica como herramienta para mejorar la predicción de ECV11. Tradicionalmente se ha utilizado el grosor intimomedial (GIM) de la arteria carótida12. Sin embargo, estudios posteriores han demostrado que aporta poco a la predicción basada exclusivamente en los factores de riesgo clásicos13, por lo que actualmente no se recomienda su utilización14. Por el contrario, la presencia de placas en carótidas se asocia intensamente con el riesgo de ECV12, mejora la predicción basada en factores de riesgo15 y ayuda a reclasificar hasta al 22,7% de los sujetos con riesgo intermedio16. La presencia de placas en arteria carótida como herramienta para predecir ECV en sujetos con HG no se ha estudiado hasta ahora.
Con el objetivo de identificar la asociación entre presencia de placas carotídeas y aparición de ECV en HG, se estudió prospectivamente a una cohorte de pacientes con HG atendidos en la unidad de lípidos del Hospital Universitario Miguel Servet de Zaragoza, España.
MÉTODOSPacientesSe trata de un estudio de cohortes prospectivo que incluyó a todos los pacientes entre 18 y 80 años con diagnóstico de HG atendidos en la unidad desde enero de 2006 hasta diciembre de 2014. El diagnóstico de HG se realizó cuando el colesterol total o el colesterol unido a lipoproteínas de baja densidad (cLDL) fueran superiores al percentil 95 de la población española ajustado por edad y sexo en presencia o ausencia de triglicéridos > 300mg/dl17. Para el diagnóstico de hipercolesterolemia poligénica, la concentración de cLDL debía ser superior al percentil 90. En todos los casos se excluyeron causas secundarias: índice de masa corporal > 35, TSH > 6 mIU/l, creatinina > 2,0 mg/dl, diabetes mal controlada (glucohemoglobina > 7,5%), colestasis (bilirrubina directa > 1 mg/dl) o uso de fármacos que favorecen los trastornos del metabolismo lipídico. La hipercolesterolemia familiar (HF) se diagnosticó con cLDL > percentil 95 con transmisión familiar vertical de la hipercolesterolemia, cLDL > percentil 95 en al menos 1 familiar de primer grado, y triglicéridos < 200mg/dl. Se diagnosticó hiperlipemia familiar combinada (HFC) a los pacientes con HG y triglicéridos > 200 mg/dl, apolipoproteína B > 120 mg/dl, transmisión vertical de la hiperlipidemia y al menos 1 familiar de primer grado con colesterol total o triglicéridos > percentil 9018. La disbetalipoproteinemia se consideró en las HG homocigotas para el alelo ¿2 o heterocigotas para el alelo p.Arg154Ser de APOE19. A los demás pacientes con HG se les diagnosticó hipercolesterolemia poligénica. Todos los participantes dieron su consentimiento por escrito antes de su participación en el protocolo, que fue aprobado por el Comité Ético de Investigación Clínica de Aragón, España.
Ecografía carotídeaDurante la inclusión en el estudio se realizó la exploración ultrasonográfica carotídea con el ecógrafo Acuson Sequoia (Siemens), con una sonda de 7 Mhz. De cada sujeto se adquirió una imagen de carótida común, bifurcación o bulbo y carótida interna (3 correspondientes al lado derecho y 3 al izquierdo). A través de la lectura de cada imagen, se obtuvieron los valores medios del GIM de cada territorio a partir de los cuales se calculó la media del GIM. La misma persona (A.M. Bea) hizo todas las cuantificaciones con el software Exetrack, todas al final de la diástole, usando un registro electrocardiográfico simultáneamente. La placa se definió como la estructura focal que protruye en la luz arterial más de 0,5 mm o más del 50% del GIM de una zona contigua o cualquier GIM ≥ 1,5 mm20. De cada sujeto, se cuantificó el número total de placas en los 6 territorios explorados. Se consideraron placas calcificadas las que generaban sombra hipoecogénica.
Estudio genéticoDe todos los pacientes con diagnóstico clínico de HF y aquellos con diagnóstico de HFC y concentraciones de colesterol total > 335 mg/dl o apolipoproteína B > 185 mg/dl, se estudiaron los genes LDLR y APOB con la plataforma Lipochip21. Se diagnosticó HF a los pacientes con diagnóstico clínico de HFC pero portadores de mutación patogénica en LDLR, APOB o PCSK921. Se realizó secuenciación del exón 4 de APOE de todos los sujetos19.
Definición de evento cardiovascularSe definió como evento el compuesto por cardiopatía coronaria (muerte coronaria, síndrome coronario agudo que requirió hospitalización y revascularización coronaria por angina), accidente cerebrovascular (ictus mortal y no mortal, accidente isquémico transitorio y revascularización carotídea) y arteriopatía periférica (revascularización arterial de extremidades inferiores)22.
SeguimientoDesde su inclusión, se revisó a todos los pacientes 1 o 2 veces al año. El tratamiento de la dislipemia a lo largo del estudio siguió las recomendaciones del International Panel on Management of Familial Hypercholesterolemia23, que establecen como objetivos terapéuticos la reducción de cLDL y/o colesterol distinto del unido a lipoproteínas de alta densidad (no cHDL), según los factores de riesgo. Desde noviembre de 2013, se modificó el objetivo terapéutico para los pacientes con ECV o diabetes, que se estableció en cLDL < 70 mg/dl10.
Entre el 1 de septiembre de 2015 y el 31 de mayo de 2016, se realizó una revisión de todos los sujetos con entrevista personal o telefónica y/o revisión de historia clínica electrónica. Todos los eventos se confirmaron por el informe hospitalario y/o el certificado de defunción.
Análisis estadísticoLos datos se expresan como media ± desviación estándar para las variables numéricas con distribución normal y se analizaron con la prueba de la t de Student, mientras que aquellas sin distribución normal se expresan como mediana [intervalo intercuartílico] y se analizaron con el test de la U de Mann-Whitney. Las variables cualitativas se expresan en porcentaje y se analizaron mediante la prueba de la χ2. Para la comparación de variables categóricas no dicotómicas, se utilizaron los tests de ANOVA y Kruskal-Wallis. Las tasas de eventos adversos hasta el final del seguimiento se calcularon mediante la estimación de Kaplan-Meier, y se compararon los grupos mediante log rank test. La asociación entre placa en carótida y eventos cardiovasculares se calculó utilizando la regresión de Cox de riesgos proporcionales. Se generó un modelo de regresión de Cox multivariable que incluía las covariables: edad, sexo, diabetes, hipertensión, tabaquismo, historia de ECV, índice de masa corporal, cLDL, cHDL, proteína C reactiva y tipo de HG. Como análisis exploratorio, se examinaron dichas asociaciones en los diferentes grupos de HG y en sujetos en prevención primaria o secundaria al inicio. Con el objeto de evitar sesgos asociados al tipo de HG, se hizo de manera complementaria un estudio de casos y controles anidado, en el que se seleccionó aleatoriamente, para cada caso con evento cardiovascular durante el seguimiento, un control sin evento ajustado por edad, sexo, colesterol total y tipo de HG.
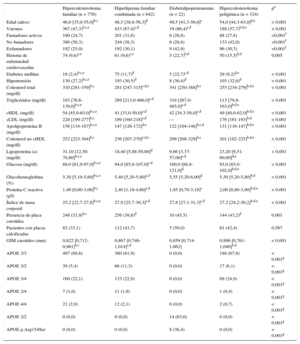
RESULTADOSLas características de los 1.778 pacientes incluidos en el seguimiento se describen en la tabla 1, distribuidos en los 4 tipos de HG. Los sujetos con HF eran más jóvenes que en las demás HG. Hubo un discreto predominio de mujeres en el grupo de HF (52,7%); sin embargo, el porcentaje de varones fue mayor en los otros 3 tipos de HG, especialmente en HFC (67,4%) y disbetalipoproteinemia (86,4%). Se encontraron placas en carótida en el 31,9% del grupo de HF, el 39,8% en el de HFC, el 45,5% en el de disbetalipoproteinemia y el 43,2% en el de hipercolesterolemia poligénica.
Características clínicas de los sujetos incluidos en el seguimiento según el tipo de hipercolesterolemia genética
| Hipercolesterolemia familiar (n = 776) | Hiperlipemia familiar combinada (n = 642) | Disbetalipoproteinemia (n = 22) | Hipercolesterolemia poligénica (n = 324) | pa | |
|---|---|---|---|---|---|
| Edad (años) | 46,0 [35,0-55,0]b,c | 48,5 [38,8-56,3]d | 49,5 [41,3-56,0]c | 54,0 [44,3-63,0]d,e | < 0,001 |
| Varones | 367 (47,3)b,c,e | 433 (67,4)c,d | 19 (86,4)c,d | 188 (57,7)b,d,e | < 0,001 |
| Fumadores activos | 190 (24,7) | 201 (31,6) | 6 (28,6) | 88 (27,8) | <0,001f |
| No fumadores | 386 (50,3) | 244 (38,3) | 6 (28,6) | 133 (42,0) | <0,001f |
| Exfumadores | 192 (25,0) | 192 (30,1) | 9 (42,9) | 96 (30,3) | <0,001f |
| Historia de enfermedad cardiovascular | 74 (9,6)c,e | 61 (9,6)c,e | 5 (22,7)b,d | 50 (15,5)b,d | 0,005 |
| Diabetes mellitus | 18 (2,4)b,c,e | 75 (11,7)d | 5 (22,7)c,d | 29 (9,2)d,e | < 0,001 |
| Hipertensión | 130 (27,2)b,c,e | 193 (30,5)d | 8 (36,4)d | 103 (32,6)d | < 0,001 |
| Colesterol total (mg/dl) | 310 [281-359]b,c | 281 [247-315]c,d,e | 341 [250-388]b,c | 255 [234-279]b,d,e | < 0,001 |
| Triglicéridos (mg/dl) | 103 [76,6-139,0]b,c,e | 289 [213,0-466,0]c,d | 319 [267,0-485,0]c,d | 113 [79,8-163,0]b,d,e | < 0,001 |
| cHDL (mg/dl) | 54 [45,0-65,0]b,c,e | 41 [33,0-50,0]c,d | 42 [34,3-58,0]c,d | 49 [40,0-62,0]b,d,e | < 0,001 |
| cLDL (mg/dl) | 228 [199-277]b,c | 189 [160-218]c,d | — | 176 [161-193]b,d | < 0,001 |
| Apolipoproteína B (mg/dl) | 158 [134-187]b,c,e | 147 [126-172]d,e | 122 [104-148]b,c,d | 131 [116-147]b,d,e | < 0,001 |
| Colesterol no cHDL (mg/dl) | 252 [223-304]b,c | 236 [207-270]c,d,e | 299 [208-329]b,c | 201 [182-225]b,d,e | < 0,001 |
| Lipoproteína (a) (mg/dl) | 31,10 [12,50-70,80]b,c,e | 18,40 [5,88-50,00]d | 9,66 [3,37-57,00]c,d | 23,20 [9,51-60,00]d,e | < 0,001 |
| Glucosa (mg/dl) | 88,0 [81,0-97,0]b,c,e | 94,0 [85,0-107,0]c,d | 100,0 [88,8-121,0]d | 93,0 [85,0-102,0]b,d,e | < 0,001 |
| Glucohemoglobina (%) | 5,30 [5,10-5,60]b,c,e | 5,40 [5,20-5,80]c,d | 5,55 [5,20-6,00]d | 5,50 [5,20-5,80]b,d | < 0,001 |
| Proteína C reactiva (g/l) | 1,40 [0,60-3,00]b,c | 2,40 [1,18-4,60]c,d | 1,95 [0,70-3,18]c | 2,00 [0,80-3,90]b,d,e | < 0,001 |
| Índice de masa corporal | 25,2 [22,7-27,8]b,c,e | 27,9 [25,7-30,3]c,d | 27,8 [27,1-31,3]c,d | 27,2 [24,2-30,2]b,d,e | < 0,001 |
| Presencia de placa carotídea | 248 (31,9)b,c | 256 (39,8)d | 10 (45,5) | 144 (43,2)d | 0,001 |
| Pacientes con placas calcificadas | 82 (33,1) | 112 (43,7) | 5 (50,0) | 61 (42,4) | 0,567 |
| GIM carotídeo (mm) | 0,822 [0,712-0,961]b,c | 0,867 [0,746-1,014]c,d | 0,859 [0,714-1,062] | 0,896 [0,761-1,040]b,d | < 0,001 |
| APOE 3/3 | 497 (68,6) | 360 (61,9) | 0 (0,0) | 188 (67,9) | < 0,001g |
| APOE 3/2 | 39 (5,4) | 66 (11,3) | 0 (0,0) | 17 (6,1) | < 0,001g |
| APOE 3/4 | 160 (22,1) | 133 (22,9) | 0 (0,0) | 69 (24,9) | < 0,001g |
| APOE 2/4 | 7 (1,0) | 11 (1,9) | 0 (0,0) | 1 (0,4) | < 0,001g |
| APOE 4/4 | 21 (2,9) | 12 (2,1) | 0 (0,0) | 2 (0,7) | < 0,001g |
| APOE 2/2 | 0 (0,0) | 0 (0,0) | 14 (63,6) | 0 (0,0) | < 0,001g |
| APOE p.Arg154Ser | 0 (0,0) | 0 (0,0) | 8 (36,4) | 0 (0,0) | < 0,001g |
APOE: apolipoproteína E; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; GIM: grosor intimomedial.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
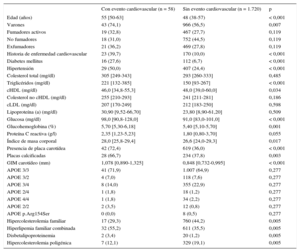
El seguimiento medio fue 6,26 (intervalo, 1-10) años, con un total de 11.130 pacientes/año de seguimiento. Durante el seguimiento, 58 pacientes sufrieron un evento cardiovascular: 48 coronarios (4 muertes súbitas, 10 infartos de miocardio no mortales, 26 síndromes coronarios agudos con o sin revascularización, 8 revascularizaciones coronarias); 8 cerebrovasculares (4 ictus isquémicos y 4 revascularizaciones carotídeas) y 2 arteriopatías de extremidades inferiores (ambas revascularizaciones). No hubo pérdidas en el seguimiento. Las características clínicas de los sujetos con y sin eventos durante el seguimiento se detallan en la tabla 2. Los pacientes que sufrieron un evento cardiovascular durante el seguimiento tenían más factores de riesgo clásicos (edad, sexo masculino, diabetes, hipertensión, triglicéridos, cHDL bajo e índice de masa corporal alto) que los pacientes sin evento. Las concentraciones de colesterol total, cLDL, no cHDL y apolipoproteína B no fueron diferentes entre los 2 grupos. El 72,4% de los sujetos con eventos cardiovasculares durante el seguimiento presentaban placas en carótidas al inicio, frente al 36,0% de los sujetos sin eventos (p < 0,001). Es decir, el 72,4% de los eventos aparecieron en el 37,2% de los pacientes con placa. Además, de los pacientes con placa, se detectó calcificación en un porcentaje mayor entre los que después sufrieron un evento respecto a los que no (el 66,7 frente al 37,8%; p = 0,003).
Características clínicas y analíticas de los pacientes con y sin evento cardiovascular durante el seguimiento
| Con evento cardiovascular (n = 58) | Sin evento cardiovascular (n = 1.720) | p | |
|---|---|---|---|
| Edad (años) | 55 [50-63] | 48 (38-57) | < 0,001 |
| Varones | 43 (74,1) | 966 (56,5) | 0,007 |
| Fumadores activos | 19 (32,8) | 467 (27,7) | 0,119 |
| No fumadores | 18 (31,0) | 752 (44,5) | 0,119 |
| Exfumadores | 21 (36,2) | 469 (27,8) | 0,119 |
| Historia de enfermedad cardiovascular | 23 (39,7) | 170 (10,0) | < 0,001 |
| Diabetes mellitus | 16 (27,6) | 112 (6,7) | < 0,001 |
| Hipertensión | 29 (50,0) | 407 (24,4) | < 0,001 |
| Colesterol total (mg/dl) | 305 [249-343] | 293 [260-333] | 0,485 |
| Triglicéridos (mg/dl) | 221 [132-385] | 150 [93-267] | < 0,001 |
| cHDL (mg/dl) | 46,0 [34,8-55,3] | 48,0 [39,0-60,0] | 0,034 |
| Colesterol no cHDL (mg/dl) | 255 [210-293] | 241 [211-281] | 0,186 |
| cLDL (mg/dl) | 207 [170-249] | 212 [183-250] | 0,598 |
| Lipoproteína (a) (mg/dl) | 30,90 [9,52-66,70] | 23,80 [8,90-61,20] | 0,509 |
| Glucosa (mg/dl) | 98,0 [90,8-128,0] | 91,0 [83,0-101,0] | < 0,001 |
| Glucohemoglobina (%) | 5,70 [5,30-6,18] | 5,40 [5,10-5,70] | 0,001 |
| Proteína C reactiva (g/l) | 2,35 [1,23-5,23] | 1,80 [0,80-3,70] | 0,055 |
| Índice de masa corporal | 28,0 [25,8-29,4] | 26,6 [24,0-29,3] | 0,017 |
| Presencia de placa carotídea | 42 (72,4) | 619 (36,0) | < 0,001 |
| Placas calcificadas | 28 (66,7) | 234 (37,8) | 0,003 |
| GIM carotídeo (mm) | 1,078 [0,890-1,325] | 0,848 [0,732-0,995] | < 0,001 |
| APOE 3/3 | 41 (71,9) | 1.007 (64,9) | 0,277 |
| APOE 3/2 | 4 (7,0) | 118 (7,6) | 0,277 |
| APOE 3/4 | 8 (14,0) | 355 (22,9) | 0,277 |
| APOE 2/4 | 1 (1,8) | 18 (1,2) | 0,277 |
| APOE 4/4 | 1 (1,8) | 34 (2,2) | 0,277 |
| APOE 2/2 | 2 (3,5) | 12 (0,8) | 0,277 |
| APOE p.Arg154Ser | 0 (0,0) | 8 (0,5) | 0,277 |
| Hipercolesterolemia familiar | 17 (29,3) | 760 (44,2) | 0,005 |
| Hiperlipemia familiar combinada | 32 (55,2) | 611 (35,5) | 0,005 |
| Disbetalipoproteinemia | 2 (3,4) | 20 (1,2) | 0,005 |
| Hipercolesterolemia poligénica | 7 (12,1) | 329 (19,1) | 0,005 |
APOE: apolipoproteína E; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; GIM: grosor intimomedial.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
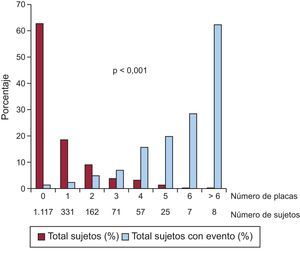
La tasa de eventos fue 6.354/100.000 (intervalo de confianza del 95% [IC95%], 4.432,4-8.275,6) en el grupo con placa y 1.432/100.000 (IC95%, 730,6-2.134,3) en el grupo sin placa, con diferencia significativa entre ambos grupos (p < 0,001) (figura 1). El riesgo de evento fue 4,34 veces superior (IC95%, 2,44-7,71; p < 0,001) en aquellos con placa. La separación de las curvas apareció ya en el primer año de seguimiento, para seguir aumentando progresivamente hasta el final. El número total de placas de cada sujeto mostró una fuerte asociación con la probabilidad de tener un evento, que fue ascendiendo progresivamente desde el 2,4% en los pacientes con 1 única placa hasta el 62,5% en aquellos con más de 6 placas (figura 2).
Las variables asociadas de manera prospectiva a sufrir un evento fueron: edad, sexo y presencia de un evento anterior (tabla 3). Al introducir la presencia de placas en el modelo con las variables anteriores, los pacientes con placas presentaron un riesgo de sufrir un evento, ajustado por las variables anteriormente descritas, 2,405 (IC95%, 1,267-4,565; p = 0,007) veces superior. Seleccionando únicamente a los sujetos que no habían tenido previamente un evento cardiovascular, la presencia de placas confirió un riesgo 2,76 (IC95%, 1,40-5,43; p = 0,003) veces superior de sufrir un nuevo evento cardiovascular en prevención primaria. Este riesgo fue 10,5 veces superior (p = 0,023) en los pacientes que sí habían tenido un evento anteriormente y presentaban placa de ateroma en carótidas, aunque con un intervalo de confianza elevado por el pequeño número de sujetos.
Análisis multivariable con regresión de Cox de los factores predictores de un evento de forma prospectiva
| HR (IC95%) | |
|---|---|
| Historia de enfermedad cardiovascular | 2,79 (1,56-5,01) |
| Presencia de placa carotídea | 2,40 (1,27-4,56) |
| Edad | 1,03 (1,00-1,05) |
| Sexo, varón | 1,86 (0,99-3,47) |
HR: hazard ratio; IC95%: intervalo de confianza del 95%.
Variables introducidas en el modelo: edad, sexo, diabetes, hipertensión, tabaquismo, historia de enfermedad cardiovascular, índice de masa corporal, colesterol unido a lipoproteínas de baja densidad, colesterol unido a lipoproteínas de alta densidad, proteína C reactiva, tipo de hipercolesterolemia genética y presencia de placa carotídea; permanecieron las estadísticamente significativas.
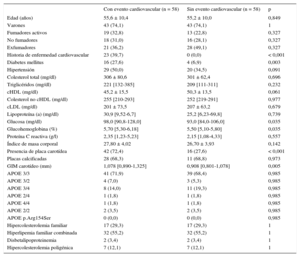
En la tabla 4 se describen las características clínicas del estudio de casos y controles, con selección aleatoria ajustada por edad, sexo, concentración de colesterol total y tipo de HG. Los antecedentes de ECV previa, diabetes e hipertensión arterial fueron más frecuentes en los casos. La frecuencia de placas en carótidas fue del 72,4% de los casos frente al 27,6% de los controles (hazard ratio [HR] = 6,89; IC95%, 3,05-15,56; p < 0,001). Los resultados fueron semejantes cuando se incluyó únicamente a los pacientes con evento coronario durante el seguimiento (HR = 5,25; IC95%, 2,28-12,06; p < 0,001). Sin embargo, no hubo diferencia entre ambos grupos en el porcentaje de sujetos con placas calcificadas.
Características clínicas y analíticas de los pacientes con evento cardiovascular durante el seguimiento y sus controles ajustados por edad, sexo, colesterol total y tipo de hipercolesterolemia genética
| Con evento cardiovascular (n = 58) | Sin evento cardiovascular (n = 58) | p | |
|---|---|---|---|
| Edad (años) | 55,6 ± 10,4 | 55,2 ± 10,0 | 0,849 |
| Varones | 43 (74,1) | 43 (74,1) | 1 |
| Fumadores activos | 19 (32,8) | 13 (22,8) | 0,327 |
| No fumadores | 18 (31,0) | 16 (28,1) | 0,327 |
| Exfumadores | 21 (36,2) | 28 (49,1) | 0,327 |
| Historia de enfermedad cardiovascular | 23 (39,7) | 0 (0,0) | < 0,001 |
| Diabetes mellitus | 16 (27,6) | 4 (6,9) | 0,003 |
| Hipertensión | 29 (50,0) | 20 (34,5) | 0,091 |
| Colesterol total (mg/dl) | 306 ± 80,6 | 301 ± 62,4 | 0,696 |
| Triglicéridos (mg/dl) | 221 [132-385] | 209 [111-311] | 0,232 |
| cHDL (mg/dl) | 45,2 ± 15,5 | 50,3 ± 13,5 | 0,061 |
| Colesterol no cHDL (mg/dl) | 255 [210-293] | 252 [219-291] | 0,977 |
| cLDL (mg/dl) | 201 ± 73,5 | 207 ± 63,2 | 0,679 |
| Lipoproteína (a) (mg/dl) | 30,9 [9,52-6,7] | 25,2 [6,23-69,8] | 0,739 |
| Glucosa (mg/dl) | 98,0 [90,8-128,0] | 93,0 [84,0-106,0] | 0,035 |
| Glucohemoglobina (%) | 5,70 [5,30-6,18] | 5,50 [5,10-5,80] | 0,035 |
| Proteína C reactiva (g/l) | 2,35 [1,23-5,23] | 2,15 [1,08-4,33] | 0,557 |
| Índice de masa corporal | 27,80 ± 4,02 | 26,70 ± 3,93 | 0,142 |
| Presencia de placa carotídea | 42 (72,4) | 16 (27,6) | < 0,001 |
| Placas calcificadas | 28 (68,3) | 11 (68,8) | 0,973 |
| GIM carotídeo (mm) | 1,078 [0,890-1,325] | 0,908 [0,801-1,078] | 0,005 |
| APOE 3/3 | 41 (71,9) | 39 (68,4) | 0,985 |
| APOE 3/2 | 4 (7,0) | 3 (5,3) | 0,985 |
| APOE 3/4 | 8 (14,0) | 11 (19,3) | 0,985 |
| APOE 2/4 | 1 (1,8) | 1 (1,8) | 0,985 |
| APOE 4/4 | 1 (1,8) | 1 (1,8) | 0,985 |
| APOE 2/2 | 2 (3,5) | 2 (3,5) | 0,985 |
| APOE p.Arg154Ser | 0 (0,0) | 0 (0,0) | 0,985 |
| Hipercolesterolemia familiar | 17 (29,3) | 17 (29,3) | 1 |
| Hiperlipemia familiar combinada | 32 (55,2) | 32 (55,2) | 1 |
| Disbetalipoproteinemia | 2 (3,4) | 2 (3,4) | 1 |
| Hipercolesterolemia poligénica | 7 (12,1) | 7 (12,1) | 1 |
APOE: apolipoproteína E; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; GIM: grosor intimomedial.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
Este es el primer estudio que analiza prospectivamente la asociación entre la presencia de placas de arterioesclerosis detectadas mediante ecografía de carótida en sujetos con HG y la aparición de eventos cardiovasculares. Su principal conclusión es que la presencia de placas en carótidas es un factor independiente del riesgo de eventos cardiovasculares y que podría ayudar a los factores de riesgo clásicos en la estratificación del riesgo de esta población.
Tradicionalmente, se ha considerado a los pacientes afectados de HG como con alto riesgo vascular debido a que, sin tratamiento, aproximadamente el 50% de los varones y el 30% de las mujeres con HF sufrirán un evento cardiovascular antes de los 60 años24. Se había estimado que los jóvenes adultos con HF heterocigotos tenían en la década de los años setenta un aumento de 100 veces en la mortalidad por enfermedad coronaria, lo que suponía una esperanza de vida limitada en unos 20 años para los varones y 12 años para las mujeres25. Datos semejantes se han comunicado sobr la HFC18,26 y la disbetalipoproteinemia27. Sin embargo, el tratamiento con estatinas ha supuesto un hito para las personas con HG. Desde finales de los años ochenta del siglo pasado, este grupo farmacológico ha reducido sustancialmente las concentraciones de colesterol de estos pacientes y ha modificado la historia natural de la enfermedad. Dos informes del Registro Simon Broome en Reino Unido y el registro de HF noruego indican que la mortalidad por cardiopatía isquémica ha caído significativamente en los últimos años, si bien todavía persiste elevada respecto a la población general28,29.
Actualmente, todas las sociedades científicas reconocen el valor del tratamiento con estatinas en las HG; sin embargo, no existe un criterio uniforme al indicar intensidad, objetivos e indicaciones del tratamiento combinado con ezetimiba o los nuevos inhibidores de PCSK910,23,30–32. La incorporación de nuevos tratamientos en las HG no puede plantearse sin conocer el beneficio absoluto de la intervención sobre la reducción del cLDL6,9. El beneficio relativo está bien establecido gracias a los metanálisis de los grandes estudios con estatinas, y especialmente los realizados por el grupo Cholesterol Treatment Trialists Collaborators33. Pero el beneficio absoluto, es decir, el número de sujetos a tratar para evitar un evento, va a depender de la magnitud de la reducción de cLDL y del riesgo cardiovascular basal del sujeto.
No existen herramientas para calcular de forma precisa el riesgo cardiovascular de los sujetos con HG, que además presenta gran variabilidad10. Se han publicado diferentes factores de riesgo asociados a la presencia de ECV en estudios transversales observacionales, principalmente en ausencia de tratamiento con estatinas, y con base en ellos se ha intentado definir las formas más graves34. Pero no existían estudios prospectivos para conocer el riesgo de estos pacientes, especialmente en tratamiento con estatinas. Nuestro estudio aporta información relevante con importantes implicaciones clínicas: los pacientes con HG y placas tienen un riesgo cardiovascular 4 veces superior que los sujetos sin placas, y se mantiene a pesar de ajustar por los principales factores de riesgo. Nuestro estudio señala a un subgrupo de HG que supone una tercera parte de los pacientes, pero en el que ocurren más del 70% de los eventos, lo cual los hace susceptibles de una intervención preventiva más intensa.
Nuestros resultados en HG, una población no explorada de manera prospectiva previamente, confirman la asociación de la presencia de placas en carótidas en otras poblaciones. Un metanálisis de 11 estudios de base poblacional con más de 54.000 sujetos mostró que la presencia de placa carotídea tiene un buen poder predictivo de eventos cardiovasculares, superior al GIM15. Resultados semejantes se obtuvieron en el estudio BioImage, en el que la presencia de placas en carótidas se asoció de manera independiente con la aparición de eventos cardiovasculares, especialmente coronarios35.
La asociación entre presencia de placas y eventos coronarios es una demostración de que la arterioesclerosis es una enfermedad sistémica que afecta a un gran número de arterias en diferentes órganos36. Esto es relevante en las HG, ya que la predisposición a la ECV es preferentemente coronaria, pero muestra que las lesiones coronarias no son un fenómeno aislado. La asociación entre lesiones coronarias y placa carotídea fue demostrada por Ten Kate et al.37, quienes compararon la arterioesclerosis subclínica coronaria y carotídea medida por ecografía carotídea y angiografía coronaria, respectivamente, en un grupo de 67 sujetos con HF, lo que demuestra una fuerte asociación con la presencia de placas en ambas localizaciones.
Nuestro estudio es una primera aproximación prospectiva para la estratificación del riesgo de los pacientes con HG. Este hecho es importante debido a la ausencia de herramientas de estratificación para esta población hasta el momento. Asimismo pone en valor la detección de la arterioesclerosis subclínica como herramienta de estratificación para poblaciones especiales como aquellas con factores de riesgo extremos38.
Limitaciones y fortalezasLa principal limitación es la ausencia de un tratamiento uniforme durante el seguimiento de los pacientes, ya que se trata de un estudio con pacientes de práctica clínica habitual. No se puede descartar que potenciales diferencias en el tratamiento prescrito pudiesen originar parte de las asociaciones encontradas. Este extremo parece poco probable, ya que todos los pacientes han seguido un protocolo de diagnóstico y tratamiento uniforme y los ha seguido el mismo equipo médico (F. Civeira y E. Jarauta) durante todo el seguimiento. Nuestra cohorte es una población joven, con una media de edad < 50 años, atendida en una unidad especializada con objetivos de control de factores de riesgo estrictos. La extrapolación de nuestros resultados a otras poblaciones de más edad y otro contexto clínico pudiera no ser adecuado. El pequeño número de eventos durante el seguimiento supone también una limitación en la solidez del estudio.
Entre las fortalezas, destacan el alto número de pacientes, la larga duración del seguimiento, los criterios estrictos de diagnóstico de HG, ateroesclerosis subclínica y tratamiento terapéutico basado en directrices establecidas antes del seguimiento y la generación de resultados desde un único centro, lo que limita la variabilidad clínica.
CONCLUSIONESEn resumen, para los pacientes con HG en quienes la predicción de riesgo no puede hacerse mediante las ecuaciones utilizadas en la población general, la detección de placas en carótida por ecografía identifica a un subgrupo de pacientes en los que se concentran los eventos cardiovasculares. Nuestros resultados respaldan la utilización de la detección y cuantificación de la arterioesclerosis subclínica en esta población y deben ayudar en la estratificación del riesgo y la planificación del tratamiento en las HG.
- –
Las HG conllevan un alto riesgo cardiovascular, aunque varía entre sujetos.
- –
Las ecuaciones de riesgo utilizadas en población general no son de utilidad en HG.
- –
No existen herramientas fiables para estratificar el riesgo en las HG.
- –
Los nuevos tratamientos hipolipemiantes requieren una buena selección de pacientes basada en el riesgo basal de los sujetos.
- –
La presencia de placas en carótidas se asocia con un riesgo de ECV 4 veces superior al de los sujetos sin placas.
- –
La presencia de placas carotídeas puede ayudar a estratificar mejor el riesgo en las HG e individualizar el tratamiento.
- –
La presencia de placas carotídeas incrementa el riesgo en prevención primaria y secundaria.
Este estudio se ha realizado con ayudas del Ministerio de Economía y Competividad de España: PI12/01087, PI12/01703 y PI12/01321 integrados en el Plan Nacional de I+D+I y cofinanciado por el Instituto de Salud Carlos III, el Fondo Europeo de Desarrollo Regional y la Red de Investigación Cardiovascular RD12/0042/0055.
CONFLICTO DE INTERESESNinguno.