El espasmo posoperatorio localizado de los vasos nativos o de los injertos en cirugía coronaria se observa hasta en el 11% de los pacientes y suele revertirse espontáneamente o tras la administración de vasodilatadores1,2. Por el contrario, el espasmo difuso afecta a un 0,8-1,3%, es de difícil tratamiento y se acompaña de gran mortalidad1,2. Entre los mecanismos relacionados con el espasmo posoperatorio, se incluyen la administración de vasoconstrictores y bloqueadores beta, la lesión iatrogénica por manipulación del vaso o insuflación de CO2, la vasoconstricción mediada por autacoides, la hipotermia, la hipomagnesemia, el tabaquismo, la diabetes mellitus y el daño por isquemia-reperfusión1–3. El espasmo difuso suele presentarse al final de la intervención o en el posoperatorio inmediato y se manifiesta por elevación del segmento ST, arritmias ventriculares, hipotensión y finalmente fracaso cardiocirculatorio1,2.
El tratamiento del espasmo difuso incluye la administración de vasodilatadores y el uso del balón de contrapulsación1-3. Sin embargo, estas medidas pueden resultar insuficientes evolucionando el cuadro rápidamente al shock cardiogénico1,2.
La asistencia circulatoria con oxigenador extracorpóreo de membrana venoarterial (ECMO-VA) ha proporcionado resultados prometedores en el espasmo difuso refractario al tratamiento convencional1,3. Se presenta un caso de espasmo coronario difuso posoperatorio que precisó ECMO-VA e implante de Impella.
Se trata de un varón de 62 años, fumador, sin otros antecedentes de interés, con función ventricular conservada, al que se remitió para cirugía por lesión del tronco coronario izquierdo. Se intervino con circulación extracorpórea utilizando cardioplejía fría hemática hiperpotasémica, y se practicó un doble injerto aortocoronario con la mamaria izquierda a la interventricular anterior y la mamaria derecha en «Y» a la primera marginal. Se desconectó de la circulación extracorpórea sin incidencias; se demostró un flujo de 36 ml/min por el injerto de la interventricular anterior y 28 ml/min por la marginal, con índices de pulsatilidad de 1,9 y 2,1 respectivamente.
Inmediatamente después del cierre esternal, el paciente presentó elevación del segmento ST e hipotensión, por lo que se reabrió el tórax y se comprobó la permeabilidad de los injertos. Transcurridos unos minutos y después de la administración de inotrópicos, vasoconstrictores y volumen, se recuperó la normalidad electrocardiográfica y hemodinámica. Los episodios de elevación transitoria del ST acompañados de hipotensión se repitieron varias veces durante unos 15min, por lo que se insertó un balón de contrapulsación por punción femoral. A pesar de ello, el deterioro hemodinámico (hipotensión y dilatación biventricular) fue progresivo, con persistente elevación del ST, por lo que se implantó un ECMO-VA por vía femoral (Cardiohel Maquet Cardiopulmonary, Hirlinge, Alemania). El ECMO proporcionó estabilidad hemodinámica y permitió cerrar el tórax, pero el ensanchamiento del QRS, las rachas de taquicardia ventricular y la bradicardia persistían.
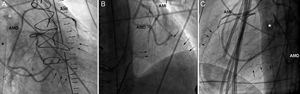
A continuación se trasladó al paciente al laboratorio de hemodinámica, donde la coronariografía demostró espasmo generalizado y difuso del árbol coronario izquierdo, más marcado en los segmentos distales, con injertos de mamaria permeables (figura 1). El espasmo no se revirtió a pesar de la administración de nitroglicerina intracoronaria, por lo que se implantó un stent en el tronco izquierdo, pero no se observó mejoría angiográfica significativa.
Angiografía posoperatoria oblicua izquierda (A), posteroanterior (B) y lateral (C). Se aprecian AMD y AMI permeables y espasmo difuso del árbol coronario distal a las anastomosis (flechas). Cánula venosa del oxigenador extracorpóreo de membrana (asterisco). AMD: injertos de mamaria derecha; AMI: injertos de mamaria izquierda.
Se trasladó al paciente a la unidad de reanimación, y durante las 6 h siguientes permaneció con asistencia con ECMO a 3,8-4 l/min, buena diuresis y presión pulmonar sistólica en torno a 60mmHg. El ecocardiograma transesofágico demostró un ventrículo izquierdo acinético, distendido e incapaz de abrir la válvula aórtica.
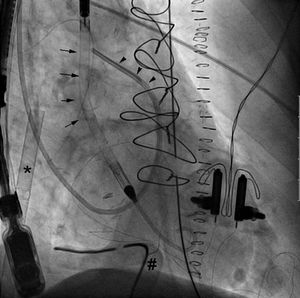
Se decidió descargar el ventrículo izquierdo mediante el implante de un Impella CP por punción femoral, previa retirada del balón de contrapulsación (figura 2). Se obtuvo de modo simultáneo un flujo a 3,8-4,2 l/min con ECMO y 1,2-1,9 l/min con Impellla, y se observó un correcto vaciado del ventrículo izquierdo y reducción de la presión arterial pulmonar. El lactato descendió de 9,41 a 2,06 mmol/l 8 h después de implantar el Impella. El pico máximo de troponina I fue de 320 ng/ml el primer día posoperatorio.
La asistencia con Impella se redujo paulatinamente a partir de las 72 h y tras comprobar la mejoría de la función ventricular. El Impella y el ECMO se retiraron quirúrgicamente tras 96 h y 6 días respectivamente. La evolución del paciente fue satisfactoria, aunque al alta persistía un deterioro moderado de la función sistólica.
El ECMO-VA es una alternativa segura y eficaz para el espasmo coronario, pues proporciona un gasto adecuado, si bien puede resultar insuficiente para descargar el ventrículo izquierdo. Entre las medidas para facilitar el vaciado ventricular y evitar la distensión de las cámaras cardiacas, se incluyen el balón de contrapulsación (que en nuestro paciente resultó ineficaz), la auriculoseptostomía percutánea, la canulación central para el ECMO y el implante del Impella4,5. Recientemente se ha observado que el uso combinado de ECMO e Impella puede mejorar los resultados del ECMO solo6, si bien se debe recordar que ambas son técnicas invasivas, no exentas de complicaciones vasculares, trombóticas y hemorrágicas. El caso presentado describe por primera vez el uso combinado de ECMO e Impella en el shock cardiogénico por espasmo coronario refractario posoperatorio.