Palabras clave
¿QUÉ ES UNA ANOMALIA CONGÉNITA DE LAS ARTERIAS CORONARIAS?
Asistimos a un debate, aún inconcluso, sobre lo que debe ser considerado normal y lo que debe ser considerado como anomalía coronaria (AC). Según Angelini1, las AC se definen por exclusión, es decir, serían aquellas cuya morfología coronaria no es normal, definiendo la normalidad según un criterio estadístico (intervalo comprendido entre ± 2 desviaciones estándar del valor principal). Así, una AC sería aquella morfología coronaria observada en < 1% de la población general1,2. Las AC pueden producirse durante la cardiogénesis normal o durante la cardiogénesis patológica: en el primer caso darían lugar a AC aisladas, de las que nos ocuparemos en este artículo, mientras que en el segundo se asociarían con otras malformaciones cardiacas.
CLASIFICACION
Hay varias clasificaciones1-3. Recientemente se ha propuesto una nueva que trata de unificar criterios diagnósticos y agrupa las AC en 7 categorías4 (tabla 1).
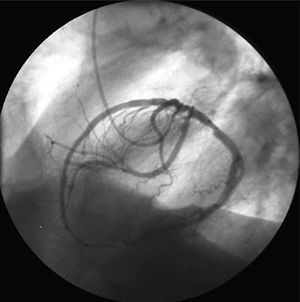
Desde foros internacionales se están haciendo llamadas para llevar a cabo registros que incluyan, al menos, el grupo de anomalías causantes de la mayor parte de los eventos clínicos (muerte súbita e isquemia miocárdica) que se atribuyen a las AC5-7 y que está constituido por las que tienen su origen en el seno de Valsalva contralateral. Se incluyen en este grupo las coronarias únicas («hiperdominancia» de la clasificación de Rigatelli et al4), dado que éstas tienen que irrigar el miocardio partiendo de un solo ostium coronario y establecer trayectos en ocasiones similares a los de las AC originadas en senos de Valsalva contralaterales (fig. 1).
Fig. 1. Coronariografía en proyección oblicua anterior izquierda en la que se objetiva una coronaria única derecha.
INCIDENCIA
Las distintas definiciones o clasificaciones y el análisis de series tanto angiográficas8,9 como necrópsicas10 y, en los últimos años, ecocardiográficas11 hacen que la incidencia publicada de las AC oscile entre el 0,1 y el 8,4%1,8,11, por lo que es difícil conocer con exactitud la magnitud del problema que representan. De todos modos, posiblemente presenten una incidencia muy similar a la de otras enfermedades más conocidas en nuestro medio, como la miocardiopatía hipertrófica (0,2%)12 o el síndrome de Wolf-Parkinson- White (0,1-0,3%)13.
La incidencia de las anomalías con origen en el seno contralateral y coronarias únicas en estudios coronariográficos varía entre el 0,28 y el 1,74%2,3,8,9,14-16. Vamos a centrar esta revisión en estas anomalías, dada su trascendencia clínica.
FORMAS DE PRESENTACION CLINICA
Inicialmente, estas anomalías se diagnosticaban durante las coronariografías realizadas en pacientes con enfermedad valvular o cardiopatía isquémica y fueron considerados hallazgos sin significación clínica. Posteriormente comenzaron a publicarse casos de muerte súbita en deportistas jóvenes en los que la única alteración patológica encontrada era una anomalía en el origen de las arterias coronarias8,17.
El espectro clínico de presentación es variable: desde pacientes asintomáticos hasta pacientes con angina, disnea, síncope, infarto agudo de miocardio, fallo cardiaco y muerte súbita1,2,5,8,17-20. En el momento actual, las AC se consideran la segunda causa de muerte súbita en deportistas de Estados Unidos21.
¿Quiere decir esto que todas las AC deben considerarse como de alto riesgo? Rotundamente no, pero desde un punto de vista estratégico deben considerarse como «potencialmente malignas» hasta que descartemos, con pruebas adicionales, una isquemia miocárdica provocada por la anomalía.
La preocupación fundamental estriba en conocer qué AC puede manifestarse con muerte súbita. Hoy día sabemos que las que siguen un trayecto interarterial (o intramural), aquellas en las que la coronaria anómala es la dominante y las que presentan clínica en pacientes de edad < 30 o 35 años son las que tienen una mayor incidencia de muerte súbita22-26.
Debido a esto, nuestra actuación ante una AC debe ser distinta según la edad del paciente. En personas jóvenes, < 35 años, nos «centraremos» en prevenir la muerte súbita, mientras que en menores de 35 años el objetivo fundamental será tratar la isquemia miocárdica (fig. 2).
Fig. 2. Distinta actuación según la edad del paciente.
Ocasionalmente, las AC, debido a su origen y trayecto anómalo, pueden dañarse durante intervenciones quirúrgicas de recambio valvular, pero también en procedimientos de cierre percutáneo de forámenes ovales, por lo que debería descartarse la presencia de AC antes de este tipo de intervenciones27-30.
FISIOPATOLOGIA DE LA ISQUEMIA EN LAS ANOMALIAS CORONARIAS
Hay varias teorías31 para explicar los mecanismos productores de la isquemia en las AC, pero ninguna está claramente demostrada. Una considera que la causa es la marcada angulación presentada por la arteria anómala tras su salida de la aorta. En contraste con una coronaria normal que tiene una salida perpendicular a la aorta, la coronaria anómala tiene que «doblarse» sobre sí misma para alcanzar, desde el seno de Valsalva contralateral, su territorio de distribución normal. Por ello, el ostium de la coronaria anómala estaría reducido de tamaño, hendido en forma de rendija, en comparación con un ostium circular normal, y podría comprimirse en caso de una gran expansión aórtica, como la observada en situaciones de ejercicio intenso32.
Otra teoría se refiere al trayecto inicial de la AC. Así, cuando el trayecto es interarterial, entre la aorta y la arteria pulmonar, el aumento de la presión en ambos vasos, que se produce durante el esfuerzo, produciría una compresión de la coronaria anómala33. Además, si el inicio del trayecto es intramural, puede agravarse la obstrucción, ya que la arteria coronaria puede deformarse dentro de la pared de la aorta en períodos de hipertensión arterial34.
Otros autores consideran que el mecanismo de la isquemia es la producción de un espasmo de la coronaria anómala, como resultado de un daño endotelial fruto del trayecto anómalo35 y, finalmente, para otros se produciría una intususcepción de la parte proximal de la AC en la pared aórtica31.
Por último, todos los mecanismos expuestos pueden producir isquemia aguda o crónica (pequeños eventos isquémicos) que provoquen fibrosis miocárdica que, a su vez, podría ser la causa de la generación de arritmias letales35.
¿COMO DIAGNOSTICAR UNA ANOMALIA CORONARIA?
Es necesario un elevado índice de sospecha y valorar su presencia en determinadas circunstancias. Como hemos mencionado previamente, la mayor parte de las AC se descubren accidentalmente en coronariografías realizadas a pacientes afectados de cardiopatía isquémica o enfermedad valvular en los que se realiza un estudio coronariográfico previo a la cirugía de recambio valvular.
El principal reto diagnóstico lo constituyen las personas jóvenes sin factores de riesgo coronarios ni enfermedad valvular asociada. Debemos sospechar una AC ante la presencia de síncopes al esfuerzo, disnea o dolor torácico indicativo de angina24,26,35. Evidentemente, la primera prueba diagnóstica que todos realizaríamos sería una ergometría convencional. Sin embargo, ésta no ha demostrado ser de gran utilidad en este tipo de pacientes, ya que suele ser negativa, lo que indica que la isquemia debida a las AC sólo se presenta ocasionalmente35,36.
Por tanto, dado que las pruebas «funcionales» no son de gran ayuda, hemos de decantarnos por una prueba de imagen que nos ayude a estudiar la anatomía coronaria. La prueba no invasiva inicialmente recomendada es la ecocardiografía transtorácica (ETT)7,26,37-40. En la mayoría de estos pacientes, la utilización de un simple ETT en la proyección paraesternal de eje corto en el plano de la raíz aórtica permite distinguir los 2 ostiums coronarios e incluso determinar el trayecto inicial seguido por la AC. Pellicia et al estudiaron ecocardiográficamente a 1.360 deportistas de élite, en los que visualizaron el ostio y la parte proximal del tronco de la coronaria izquierda en el 97% de los casos y el de la coronaria derecha, en el 80%41.
Recientemente, Frommelt et al34 realizaron ecocardiografías a todos los niños y adolescentes (rango, 3 meses a 20 años) remitidos a su hospital (1997-2002) con síntomas de isquemia miocárdica, sospecha de enfermedad cardiaca congénita o dolor musculoesquelético. A todos se les realizó una ETT convencional con la ayuda de un mapeo de flujo con el Doppler color para conocer la dirección del flujo. Identificaron a 10 pacientes en los que se observaba un origen anómalo de una arteria coronaria en el seno contralateral (6 pacientes con la coronaria izquierda [CI] originada en el seno de Valsalva derecho y 4 con la coronaria derecha [CD] originada en el seno de Valsalva izquierdo). Mediante la utlización de la ETT con técnicas de Doppler color identificaron un curso intramural en la pared arterial aórtica en 9 de ellos y un curso intramiocárdico en el paciente restante. Cuando el trayecto de una anomalía coronaria originada en el seno contralateral es intramural, la anomalía puede parecer que emerge de su ostium normal. Por eso, los autores aconsejan la utilización del Doppler color para identificar la dirección del flujo cuando se trata de descartar una anomalía.
Las mejoras que ha experimentado la imagen en las técnicas ecocardiográficas nos permiten seguir el origen y el trayecto iniciales de una anomalía coronaria en determinados grupos de pacientes. Se ha estudiado a niños, adolescentes y deportistas de élite, pero todavía no hay series grandes en población adulta normal. Por tanto, la identificación de los ostiums coronarios en pacientes jóvenes con esta sintomatología debería realizarse sistemáticamente en el examen ecocardiográfico transtorácico7,26.
En el grupo con mala ventana ecocardiográfica, o si persiste la duda diagnóstica y la clínica es indicativa, se podría realizar una ecocardiografía transesofágica (ETE)7,26,42,43, una tomografía computarizada (TC)26,44-46 con rayo de electrones (electron beam) o multicorte (fig. 3) o una cardiorresonancia magnética (CRM)26,47,48, que permitirán identificar el origen y el trayecto inicial de la AC (fig. 4).
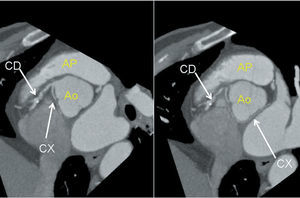
Fig. 3. Imagen de tomografía computarizada con multidetectores en la que se objetiva una arteria circunfleja (Cx) originada en la arteria coronaria derecha (CD), que sigue un trayecto retroaórtico hasta llegar a su lugar de distribución normal. Ao: aorta; AP: arteria pulmonar. Cortesía del Dr. Gabriel C. Fernández. Servicio de Radiología. Hospital Povisa. Vigo.
Fig. 4. Protocolo diagnóstico propuesto en < 35 años con sospecha de anomalía coronaria. CRM: cardiorresonancia magnética; EET: ecocardiografía transesofágica; ETT: ecocardiografía transtorácica; TC: tomografía computarizada.
¿Qué técnica debemos utilizar y en qué orden? Cada equipo médico, de acuerdo con las técnicas disponibles y su experiencia, debe responder a esta pregunta. Lo que debemos hacer es identificar la AC y su trayecto inicial con la técnica menos invasiva de la que dispongamos. Aunque el ETE se ha utilizado en el diagnóstico e identificación del trayecto inicial de algunas AC creemos que, debido a su carácter semiinvasivo, debería relegarse a un segundo término. Hoy día, debido a la cada vez mayor disponibilidad y a las excelentes imágenes tridimensionales que se pueden obtener, parece prudente decantarse por la TC con multidetectores (fig. 5) o por la CRM49,50. La coronariografía convencional estaría indicada si las otras pruebas no fueran diagnósticas.
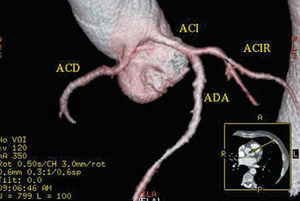
Fig. 5. Tomografía computarizada multicorte (16 cortes); reconstrucción tridimensional «renderizada» en la que se objetiva una arteria coronaria derecha (ACD) que se origina en el seno de Valsalva izquierdo. ACI: arteria coronaria izquierda; ACIR: arteria circunfleja; ADA: arteria descendente anterior. Cortesía del Dr. Joaquín Alonso. Servicio de Cardiología y Servicio de Diagnóstico por Imagen. Hospital de Fuenlabrada. Madrid.
En este sentido, la 36th Bethesda Conference51 para la selección de atletas de competición con anomalías cardiovasculares publicada en abril del 2005 recomienda: «las AC deben tenerse en cuenta en atletas con síncope de esfuerzo o arritmias ventriculares sintomáticas y deben ser investigadas con estudios apropiados, como la ecografía, la resonancia magnética cardiaca o la tomografía computarizada ultrarrápida; la coronariografía está indicada si otros estudios no son diagnósticos». En definitiva, no se decantan por uno u otro estudio diagnóstico.
En pacientes > 35 años que consulten por clínica indicativa de angina o síncopes de repetición, tras la prueba funcional (ergometría, ecografía de estrés, etc.) suele realizarse un cateter ismo ante la sospecha de enfermedad coronaria, debido a la mayor incidencia de aterosclerosis. En determinados centros con la tecnología disponible, en pacientes con clínica atípica también podría realizarse una TC con multidetectores o una CRM como primer cribado. Tanto en una como en otra situación, la AC sería un hallazgo (fig. 6).
Fig. 6. Protocolo diagnóstico propuesto en > 35 años con sospecha de anomalía coronaria. CRM: cardiorresonancia magnética; EET: ecocardiografía transesofágica; ETT: ecocardiografía transtorácica; TC: tomografía computarizada.
¿COMO IDENTIFICAR EL TRAYECTO INICIAL DE UNA ANOMALIA CORONARIA?
Es uno de los puntos más complejos del estudio de las AC y constituye un aspecto primordial en la identificación del riesgo.
Para empezar, hemos de tener en cuenta que el nombre y la naturaleza de una arteria coronaria se encuentran definidos por el territorio distal al que irrigan y no por su origen. Así, una arteria coronaria que nace del seno derecho de Valsalva y que se divide distribuyéndose por los territorios de la descendente anterior y la circunfleja no es una coronaria derecha, sino un tronco de la coronaria izquierda con origen en el seno contralateral. Cuando una arteria coronaria nace del seno contralateral, el nombre, la naturaleza e incluso la función permanecen invariables, y sólo su origen y su curso inicial son anómalos2.
Después de nacer del seno de Valsalva contralateral, una arteria coronaria anómala puede seguir, hasta su lugar de distribución normal, al menos 5 caminos diferentes2,52:
1. Retrocardiaco, por detrás de las válvulas mitral y tricúspide.
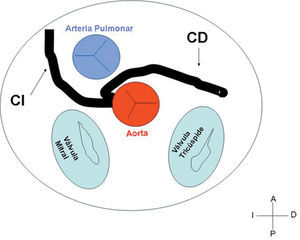
2. Retroaórtico, habitualmente seguido por la arteria circunfleja originada en el seno de Valsalva derecho o en la CD, junto a la pared posterior de la aorta, en el surco entre la aurícula y la aorta (seno transverso) (fig. 3).
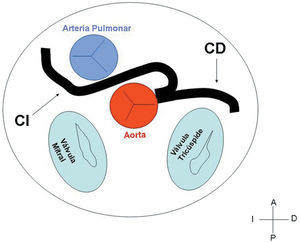
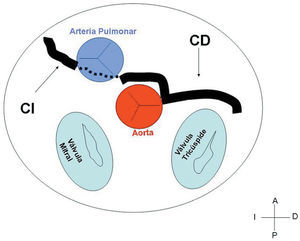
3. Preaórtico o interarterial (entre la aorta y la arteria pulmonar). Cuando la CD, la descendente anterior o el tronco de la CI anómalos cruzan el septo o el espacio aortopulmonar. Éste es el trayecto que con más frecuencia se ha relacionado con manifestaciones isquémicas y/o muerte súbita (figs. 7 y 8).
Fig. 7. Representación esquemática en la que se observa el trayecto interarterial y su relación con las estructuras vecinas de una coronaria derecha (CD) originada en el seno contralateral.
Fig. 8. Representación esquemática en la que se observa el trayecto interarterial y su relación con las estructuras vecinas de una coronaria izquierda (CI) originada en el seno contralateral.
4. Intraseptal, a través de la parte superior del septo intraventricular. En la mayor parte de los casos intramiocárdico y se reconoce angiográficamente por el estrechamiento sistólico, similar a un puente intramiocárdico, y porque suele dar una o 2 ramas perforantes septales en esta zona (fig. 9).
Fig. 9. Representación esquemática de una coronaria izquierda (CI) originada en el seno de Valsalva derecho que sigue un trayecto intraseptal.
5. Precardiaco o prepulmonar, caracterizado por su localización subepicárdica, en la pared anterior del tracto de salida del ventrículo derecho o infundíbulo. Este paso suele ser seguido por una CD, tronco de CI o descendente anterior anómalos.
Para algunos autores puede haber otros posibles caminos o incluso varios trayectos en un mismo paciente2.
¿Cómo identificar estos trayectos iniciales con la coronariografía? En un principio se señaló que la introducción de una guía en la arteria pulmonar seguida de una coronariografía en proyección lateral sería suficiente para identificar la relación de la anomalía con los grandes vasos. Sin embargo, esta técnica es limitada ya que, por ejemplo, en una visión lateral, tanto el trayecto septal como el interarterial aparecerían situados posteriores a la arteria pulmonar y anterior a la aorta, cuando en realidad el trayecto septal es caudal a ambos vasos53.
También se describieron distintos signos coronariográficos que tratan de reconocer la anomalía y su trayecto inicial incluso antes de su visualización. Así, Page et al54 proponen 2 signos que nos permiten reconocer un origen anómalo de la arteria coronaria circunfleja (Cx) y su trayecto inicial:
1. El signo del «miocardio no perfundido». Durante la opacificación selectiva de la coronaria izquierda se observa un área avascular en la zona posterolateral del ventrículo izquierdo que indica el origen anómalo de la Cx. Descartaríamos antes, mediante inyecciones de contraste en el seno coronario izquierdo, el origen por ostiums independientes de la descendente anterior y la Cx. Sin embargo, si hay dudas en la identificación de la Cx, es útil recordar que el origen de la Cx en el seno coronario derecho o en la coronaria derecha es más frecuente que la presencia de ostiums separados en el seno coronario izquierdo55.
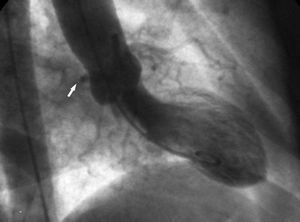
2. Signo «de la raíz aórtica». Durante la ventriculografía en la proyección oblicua anterior derecha se observa el contorno de la Cx anómala mientras sigue su trayecto posterior por detrás del seno coronario derecho (fig. 10).
Fig. 10. Ventriculografía en proyección oblicua anterior derecha en la que se observa el contorno de la circunfleja anómala (flecha) siguiendo un trayecto posterior por detrás del seno coronario derecho; es conocido como el signo de la raíz aórtica o de Page.
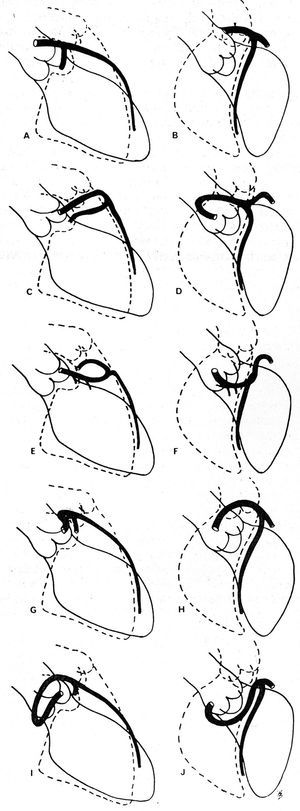
Ishikawa et al56 en 1985 y posteriormente Serota et al57 en 1990 propusieron una serie de criterios coronariográficos que tratan de definir la relación, durante su trayecto inicial, del vaso anómalo con la aorta y la arteria pulmonar (fig. 11). Así, según la orientación del «lazo» que forma la coronaria anómala con el resto del árbol coronario56 o añadiendo a lo anterior el concepto de dot o punto (visualización de la columna de contraste de la AC que por el giro que realiza adopta la morfología de un punto57), tratan de identificar los diferentes trayectos.
Fig. 11. Dibujos de coronariografías en proyección oblicua anterior derecha (A, C, E, G, I) y en oblicua anterior izquierda (B, D, F, H, J) de la descendente anterior y de la parte proximal de la circunfleja, con los distintos trayectos iniciales que puede llevar una coronaria izquierda que se origine en el seno de Valsalva derecho. A y B representan una coronaria izquierda normal; C y D muestran un «lazo» anterocraneal, que se describe en el trayecto anterior; E y F: «lazo» anterocaudal, trayecto septal; G y H: «lazo» posterocraneal, trayecto interarterial; I y J: «lazo» posterocaudal, trayecto retroaórtico. Tomada de Ishikawa et al56.
En muchos casos, la identificación del trayecto inicial de la AC puede ser difícil mediante la coronariografía, ya que ésta ofrece una visión bidimensional de una compleja estructura tridimensional como es el
árbol coronario. En manos de hemodinamistas experimentados en el diagnóstico de las AC, la coronariografía puede ser suficiente para una correcta identificación del trayecto. Sin embargo, la baja incidencia de las AC hace que la mayoría de los hemodinamistas tengan una experiencia limitada en su estudio, lo que hace que en una gran parte de los casos no se describan correctamente. En un reciente registro llevado a cabo en 13 hospitales de nuestro país, el trayecto inicial de las AC recogidas no fue identificado en la mayor parte de los casos16.
Por tanto, en muchas ocasiones, ante la presencia de una AC con origen en el seno contralateral, es necesario utilizar una técnica de imagen adicional para identificar el trayecto inicial. Como hemos mencionado previamente, tanto la ETT como la ETE pueden utilizarse para la identificación de este trayecto pero, dada la cada vez mayor disponibilidad en los hospitales de nuestro medio de técnicas que, de una manera no invasiva, nos dan una más correcta y exacta definición de la anatomía coronaria y de su relación con las estructuras adyacentes en pacientes que pueden ser candidatos quirúrgicos, nos decantamos por la CRM o la TC con multidetectores35,37,47,49.
¿QUÉ ACTITUD TERAPÉUTICA DEBE SEGUIRSE?
Constituye éste uno de los aspectos más controvertidos de esta afección, ya que no hay ninguna guía oficial establecida sobre esta materia.
Parece lógico que, una vez diagnosticada y descrita la AC, tratemos de demostrar si ésta provoca isquemia miocárdica. Si el paciente ha presentado un infarto de miocardio (sin causa aterosclerótica demostrable) o ha sido reanimado de una muerte súbita atribuible a la anomalía y tiene menos de 35 años, la revascularización es apoyada por la mayoría de los autores24,26,35. Una prueba de estrés con talio o una ecococardiografía de estrés (farmacológico o de ejercicio) que demuestren isquemia reversible en el territorio de la anomalía ayudarán en la toma de decisiones36.
¿Qué hacer en las personas jóvenes, asintomáticas, en las que se descubre accidentalmente una AC con criterios de riesgo y en las que no se demuestra isquemia mediante las pruebas de provocación? En primer lugar se debe adoptar un estilo de vida sedentario26,35. Corrado et al compararon la muerte súbita en jóvenes deportistas y no deportistas, y únicamente se asociaron con el esfuerzo las ocurridas por AC y por displasia arritmogénica de ventrículo derecho58. En cuanto a su tratamiento, la revascularización es discutida, pero una parte de los autores optan por ella, dado que la muerte súbita en estos pacientes es impredecible y puede ser la primera manifestación de la AC24,26,34,35. Algunos autores realizan seguimientos anuales de estos pacientes con ecografías de estrés o pruebas de estrés con talio, y actúan según resultados7,36. Una vez intervenidos, pueden hacer vida normal, sin excluir el deporte25,34,49.
En pacientes > 35 años habría que individualizar la decisión. El riesgo de muerte súbita es menor, pero puede ocasionar isquemia miocárdica sintomática, con lo que en ocasiones se opta por la revascularización24,26 (fig. 12).
Fig. 12. Protocolo terapéutico propuesto para las anomalías coronarias con origen en el seno de Valsalva contralateral con criterios de riesgo.
Algunos grupos están investigando la utilización de determinados protocolos diagnósticos (ecografía intracoronaria para describir el ostium coronario anómalo en reposo y con infusión de dobutamina o sobrecarga hídrica)59 o utilización de guías de presión intracoronarias para detectar isquemia60.
Como puede observarse, hasta que haya unas guías oficiales sobre esta materia, lo más razonable parece, primero, confirmar si la edad y la anatomía de la AC son de riesgo y, segundo, verificar que la isquemia coronaria (que ha presentado el paciente o que se ha demostrado) esté claramente provocada por la anomalía.
¿COMO DEBE SER LA REVASCULARIZACION?
Lógicamente, es necesario individualizar cada caso de acuerdo con el trayecto seguido, por lo que la revascularización puede ser tanto quirúrgica como percutánea.
La revascularización quirúrgica comprende el bypass aortocoronario, la reimplantación ostial o la técnica del unroofing, que libera el segmento intramural de la AC mediante una incisión en la pared común de la AC y la aorta, creando así un neoorificio más grande en el seno apropiado61,62. Hay una gran controversia en la revascularización quirúrgica de este tipo de pacientes, sobre todo cuando nos referimos a personas jóvenes. Ha sido muy criticada la implantación de bypass aortocoronarios7,63 debido a su «limitada» permeabilidad y a la presencia inevitable de flujo competitivo entre el puente y la AC, adoptándose con cada vez más frecuencia la técnica del unroofing, que sería más fisiológica62.
Respecto al intervencionismo percutáneo con implantación de stent en la zona de compresión entre los grandes vasos y en el ostio anómalo, se ha realizado en varios casos, en personas adultas, con éxito a corto plazo64.
Hasta el momento se ha preferido la revascularización quirúrgica para las personas jóvenes y se ha reservado la percutánea para los adultos26,62-64. Evidentemente, tanto en una como en otra es necesario realizar un seguimiento a largo plazo.
¿TIENE EL TRATAMIENTO MÉDICO ALGUNA OPCION?
La ausencia de series y estudios controlados hace que sea difícil contestar a esta pregunta. En algunos trabajos se publican seguimientos a 2 y 5 años en pacientes no operados o que rechazaron la cirugía, en los que se h a mantenido una actitud expectante o bien se ha iniciado tratamiento con bloqueadores beta y en los que no ha habido ninguna muerte súbita65-68. Sin embargo, algunos autores discuten la decisión de iniciar un tratamiento «de por vida» en niños o adolescentes7.
PRINCIPALES PROBLEMAS SIN RESOLVER
Se desconoce el auténtico riesgo de muerte súbita de cada anomalía5. Esto es debido a que el riesgo está calculado a partir de los estudios necrópsicos y, por tanto, no indican el riesgo real de que una persona muera por una AC, sino que realmente nos ofrece la posibilidad de que una persona que muere súbitamente tenga una AC7. Además, los riesgos calculados pueden estar sobrevalorados respecto a los de población general, ya que se obtienen de series de atletas de competición que, como es sabido, tienen el doble de riesgo de muerte súbita que una persona sedentaria69.
Sabemos que el riesgo de muerte súbita por una AC es mayor en personas jóvenes; de hecho, se recomienda una u otra actitud terapéutica dependiendo si la edad es < 30 o 35 años. Estas cifras se han obtenido de los pocos estudios realizados sobre la materia23,25 y, por tanto, deben considerarse como simplemente orientativas, por lo que la actitud terapéutica siempre debe ser individualizada.
Si se adopta la solución quirúrgica previamente referida, hay que tener en cuenta que no hay series que hayan estudiado la evolución de estos pacientes más allá de 2 años. A la incertidumbre sobre la permeabilidad del bypass hay que añadirle el posible daño a la válvula aórtica que el procedimiento del unroofing puede provocar. Así, se han descrito insuficiencias aórticas, incluso reemplazos valvulares tras este procedimiento7,70. No hay que olvidar que cada intervención quirúrgica cardiaca conlleva un riesgo de complicaciones neurológicas, que en personas jóvenes se ha estimado en torno al 2,3%71.
Por último, las guías para la selección de atletas de competición con anomalías cardiovasculares recomiendan la exclusión de los pacientes con AC de todos los deportes competitivos51. Otra vez vuelven a extrapolarse a la población normal los datos de una población de deportistas. El término «competitivo», en un adolescente, puede ser difícil de definir. Además, apartar a un adolescente o a un adulto joven de las clases de gimnasia o del deporte habitual que éste pueda hacer puede conllevar más daños que beneficios. Quizá se deba evitar el deporte extenuante, pero no el deporte a un nivel más bajo7.
CONCLUSION
El origen de las arterias coronarias en el seno de Valsalva contralateral constituye el grupo de AC principalmente relacionado con la isquemia miocárdica y, en particular, con la muerte súbita.
Debemos tener un elevado índice de sospecha de esta anomalía ante pacientes jóvenes con clínica de angina, disnea o síncope con el esfuerzo y, en estas ocasiones, indicar la realización de un ETT que trate de identificar los ostiums y el trayecto inicial de ambas coronarias.
Ante toda coronaria anómala debemos definir claramente el trayecto inicial seguido por ésta, apoyándonos para ello en técnicas de imagen como la ETT, la ETE o, preferentemente, la TC con multidetectores
o la CRM, según las características de nuestro hospital.
Es prioritaria la realización de registros nacionales e internacionales que permitan describir la incidencia de estas anomalías así como su morbimortalidad, pronóstico, tratamiento, posibles influencias genéticas o ambientales y, en definitiva, lograr el mayor conocimiento posible de esta enfermedad.
Es necesario realizar un seguimiento a largo plazo de los pacientes con AC intervenidos, sobre todo los jóvenes, pero la revascularización (quirúrgica o percutánea) puede ser una solución válida para los pacientes con este tipo de enfermedad.
AGRADECIMIENTOS
Al Dr. Joaquín Alonso y al Dr. Gabriel C. Fernández por su ayuda en la obtención de las imágenes de TCMC.
Correspondencia: Dr. R. Barriales-Villa.
Servicio de Cardiología. Complexo Hospitalario de Pontevedra.
Mourente-Montecelo, s/n. 36071 Pontevedra. España.
Correo electrónico: rbarrialesv@inicia.es