En investigación cardiovascular se ha empleado animales pequeños y grandes y de distintas especies como modelos. La elección de la especie que se use como modelo es una de las decisiones más importantes que se ha de tomar antes del inicio de una investigación biomédica. Una elección correcta de la técnica anestésica nos proporciona una mejora de las tasas de supervivencia, así como el mayor bienestar posible de los modelos animales empleados, lo que incrementa la aceptación ética y la eficiencia de estos modelos experimentales. Esta revisión analiza las características particulares de cada modelo animal empleado en investigación cardiovascular en cuanto a las técnicas analgésicas y anestésicas, así como las técnicas, los fármacos y su posología más adecuados a cada caso.
Palabras clave
Entendemos por modelo animal aquel que no solo nos permite investigar su biología o comportamiento y diferentes procesos patológicos inducidos o espontáneos, sino que, en uno o más aspectos, estos reflejan las mismas características que en humanos. La elección de la especie que emplear como modelo es una de las decisiones más importantes que hemos de tomar antes del inicio de una investigación biomédica.
En investigación cardiovascular se han empleado animales pequeños y grandes y de distintas especies como modelos. El uso de perros, ovejas y cerdos permite investigar la funcionalidad cardiaca y los cambios morfológicos y estructurales del corazón de manera mucho más exacta que con modelos animales basados en especies de menor tamaño, por lo que su empleo cada vez es mayor1.
Una elección correcta de la técnica anestésica proporciona una mejora de las tasas de supervivencia de los modelos animales empleados en experimentación, lo que incrementa la aceptación ética y la eficiencia de estos modelos experimentales. En definitiva, empleando el protocolo anestésico más adecuado, aseguramos el bienestar de los animales, reducimos la morbilidad, optimizamos el rendimiento y garantizamos la calidad de la investigación2.
Consideraciones FisiológicasUna de las responsabilidades más importantes previas al comienzo de un ensayo experimental es la evaluación física del modelo animal3 para optimizar el desarrollo de la anestesia y el procedimiento experimental en sí, con el mínimo riesgo para los pacientes y la recuperación más rápida y adecuada posible. Para evaluar la historia del animal que vamos a utilizar como modelo, debemos tener en cuenta especie, edad, estado general, aspecto externo, postura y nivel de actividad, constatando la ausencia de estados patológicos previos, ya sean respiratorios, cardiovasculares, gastrointestinales, hepáticos, renales o neurológicos.
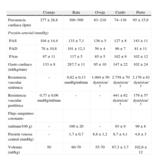
Resulta de vital importancia el conocimiento de las características de la especie elegida como modelo animal, sus parámetros fisiológicos normales y sus particularidades anestésicas, con el fin de elegir la técnica y el protocolo anestésico más adecuados para cada especie y para cada ensayo experimental concreto2–5 (tabla 1).
Parámetros cardiovasculares normales de los principales modelos animales3–5
| Conejo | Rata | Oveja | Cerdo | Perro | |
| Frecuencia cardiaca (lpm) | 277±28,8 | 300–500 | 63–210 | 74–116 | 95 ± 15,9 |
| Presión arterial (mmHg) | |||||
| PAS | 104±14,4 | 133±7,1 | 136±5 | 127±8 | 143±11 |
| PAD | 78±10,8 | 101±12,3 | 56±4 | 86±7 | 81±11 |
| PAm | 87±11 | 117±5 | 85±5 | 102±9 | 102±12 |
| Gasto cardiaco (ml/kg/min) | 133±8 | 287,7±11 | 95±10 | 147±22 | 102±24 |
| Resistencia vascular sistémica | – | 0,82±0,13mmHg/ml/min | 1.004±50dyn/s/cm–5 | 2.759±70dyn/s/cm–5 | 2.176±61dyn/s/cm–5 |
| Resistencia vascular periférica | 0,77±0,06mmHg/ml/min | – | – | 441±62dyn/s/cm–5 | 179±57dyn/s/cm–5 |
| Flujo sanguíneo coronario | |||||
| (ml/min/100 g) | – | 100±20 | – | 93±9 | 99±8 |
| Presión venosa central (mmHg) | – | 1,7±0,7 | 8,8±1,2 | 8,7±4,1 | 4,8±3 |
| Volemia (ml/kg) | 50 | 60-70 | 55-70 | 67,3±3,7 | 102,6±12 |
PAD: presión arterial diastólica; PAm: presión arterial media; PAS: presión arterial sistólica.
Para llevar a cabo un acto anestésico correcto, con las mínimas repercusiones para el paciente, es preciso un alto conocimiento farmacológico tanto de la farmacodinámica como de la farmacocinética de los fármacos comúnmente empleados en anestesia, con el fin de combinar y potenciar sus efectos beneficiosos y evitar los que puedan resultar perjudiciales6.
La elección de la técnica anestésica debe corresponderse con la gravedad de la intervención, ajustarse a la intensidad máxima esperada de dolor, adaptarse a las posibilidades de aplicación de cada especie, proporcionar una inmovilización adecuada a la duración de la intervención y, por supuesto, adecuarse a los objetivos del estudio. Por lo tanto, depende de distintos factores: especie, posibilidad de aplicación de anestésicos, dolor esperado, compatibilidad de los anestésicos con el objetivo del estudio, dotación técnica y personal del centro de investigación y tipo de ensayo (con o sin intervención quirúrgica, de corta o larga duración, con supervivencia o ensayo final)7,8. Además, resulta imprescindible conocer los efectos hemodinámicos de los distintos fármacos anestésicos en especies cardiovascularmente sensibles como la porcina o cuando vamos a realizar procedimientos cardiovasculares8 (tabla 2).
Efectos hemodinámicos de los principales agentes anestésicos8
| Fármaco | Frecuencia cardiaca | Gasto cardiaco | Contractilidad | Presión arterial | Presión aurícula derecha | Consumo miocárdico de O2 |
| Anticolinérgicos | ↑ | ↑ | ↑ | = o ↑ | ↓ | ↑ |
| Fenotiacinas | ↑ | ↑ | ↓ | ↓ | ↓ | = o ↑ |
| Butirofenonas | ↑ | = o ↑ | ↓ | Ligera↓ | ↓ | = o ↑ |
| Benzodiacepinas | = | = | = | = | = | ↓ |
| Agonistas α2 | ↓ | ↓ | = o ↓ | Inicial↑, luego↓ | ↑ | ↑ |
| Opiáceos | ↓ | ↓ | = o ↓ | = o ↓ | = | = |
| Barbitúricos | ↓ | ↓ | ↓ | ↓ | ↓ | = o ↑ |
| Propofol | = o ↑ | ↓ | ↓ | ↓ | ↓ | = o ↑ |
| Etomidato | = o ↑ | = o ↓ | = o ↓ | = o ↓ | = o ↓ | = o ↑ |
| Agentes disociativos | ↑ | ↑ | ↑ | ↑ | ↓ | ↑ |
| Agentes inhalados | ↓ | ↓ | ↓ | ↓ | ↓ | ↓ |
| Bloqueadores neuromusculares | ||||||
| Pancuronio | ↑ | ↑ | = | ↑ | = | ↑ |
| Atracurio | = o ↑ | = | = | Puede↓ | = | = |
| Vecuronio | = | = | = | = | = | = |
Causan depresión del sistema reticular activador ascendente y tienen acción antidopaminérgica en el sistema nervioso central (SNC) en los receptores D1 y D29. También inhiben el sistema nervioso simpático por inhibición de la liberación central y periférica de catecolaminas. Inducen un bloqueo de receptores alfa-1-adrenérgicos, lo que produce una marcada vasodilatación periférica y disminución de la resistencia vascular sistémica, lo que conlleva una disminución de la presión arterial.
Este bloqueo de receptores alfa-1-adrenérgicos y la disminución de la actividad central, ganglionar y periférica (suprarrenal) del sistema nervioso simpático, con una disminución de la liberación de catecolaminas, hacen que posean efectos antiarrítmicos9.
Butirofenonas: azaperona, droperidol, fluanisonaInducen una depresión del sistema reticular activador ascendente y una acción antidopaminérgica en el SNC9,10. También inhiben el sistema nervioso simpático por inhibición de la liberación de catecolaminas, tanto central como periférica. Inducen unos efectos similares a las fenotiacinas y, aunque tienen mayor potencia, la hipotensión que causan por bloqueo de receptores alfa-1-adrenérgicos es menor10.
Benzodiacepinas: diazepam, midazolam, zolazepamLas benzodiacepinas ejercen su efecto estimulando la liberación de ácido gammaaminobutírico (GABA) endógeno, un neurotransmisor inhibidor del SNC, con lo que aumenta la acción inhibidora de la glicina9.
Los efectos hemodinámicos de las benzodiacepinas se han estudiado extensamente tanto in vivo11 como in vitro12. Se ha visto que estos efectos son mínimos (ligera hipotensión) y similares en pacientes sanos y en pacientes con enfermedad cardiaca o en los clasificados como índice de la American Society of Anaesthesiologists (ASA) III y IV, lo que demuestra su alto margen de seguridad12, por lo que con frecuencia se ha utilizado las benzodiacepinas en premedicaciones anestésicas de pacientes críticos13. Por lo tanto, a dosis terapéuticas, las benzodiacepinas tienen mínimos efectos adversos en el sistema cardiovascular y un amplio margen de seguridad, lo que los hace extremadamente útiles en animales de alto riesgo y en cirugía cardiaca9,11,14.
Se ha observado, además, que las benzodiacepinas, a dosis clínicas, tienen efecto cardioprotector en isquemia miocárdica, ya que disminuyen tanto la adhesión postisquémica de neutrófilos como su función (quimiotaxis, fagocitosis y generación de radicales libres)15,16 y la entrada de calcio en cardiomiocitos, por su efecto inotrópico negativo16,17. Además, aumentan selectivamente la vasodilatación coronaria/flujo coronario (mediado por receptores A2A de adenosina), y pueden tener un potencial terapéutico al ser empleadas como «agente regulador de la adenosina», con la finalidad de mejorar las acciones cardioprotectoras de esta18 y disminuir los daños en distintos órganos inducidos por isquemia o hipoxia, particularmente en la fase perioperatoria18.
Agonistas alfa-2-adrenérgicos: xilacina, romifidina, medetomidina, dexmedetomidinaInducen una importante depresión del SNC y analgesia mediante estimulación de los receptores alfa-2-adrenérgicos presinápticos y postsinápticos, tanto en el SNC como periféricamente, en tracto gastrointestinal, útero, riñón y plaquetas; esto reduce la liberación de noradrenalina y disminuye la transmisión nociceptiva ascendente. Como consecuencia, se produce una disminución de la actividad simpática del SNC y las catecolaminas circulantes.
Inducen una depresión cardiovascular que puede llegar a ser intensa debido a su actividad parasimpática y estimuladora de los receptores adrenérgicos10. Los efectos cardiovasculares siguen un patrón bifásico14. La respuesta inmediata del sistema cardiovascular, tras su administración, es un incremento de la presión arterial causada por un aumento de la resistencia vascular sistémica, que causa una vasoconstricción periférica vía activación del sistema nervioso simpático. Este aumento de la presión arterial causa una reducción refleja de la frecuencia cardiaca mediada por los barorreceptores. Esta primera fase dura alrededor de 20 min, y después se produce una disminución de la presión arterial hasta valores normales o incluso inferiores, mientras que la bradicardia se mantiene por una inhibición simpática mediada por los receptores alfa-2-adrenérgicos presinápticos localizados en el SNC14. Esta bradicardia sinusal puede desencadenar un bloqueo auriculoventricular (BAV) de primer o segundo grado. Raramente producen BAV completos (de tercer grado) con latidos de escape.
Además causan una disminución del gasto cardiaco de etiología multifactorial: contractilidad miocárdica reducida, disminución de frecuencia cardiaca (30–50%) e incremento de la resistencia vascular sistémica17,19. En animales sanos este descenso del gasto cardiaco no se asocia a una disminución de la liberación tisular de oxígeno en cerebro, corazón, riñón e hígado, pero en animales con una reserva cardiovascular escasa, esta sí se afecta de forma importante, lo que constituye un riesgo anestésico elevado17. Aumenta la sensibilización miocárdica a la liberación de catecolaminas y pueden aparecer arritmias por estimulación de receptores alfa-1-adrenérgicos10.
Por lo tanto, como efectos adversos destacan: depresión respiratoria grave, bradiarritmias, hipotensión y disminución del gasto cardiaco y de la perfusión tisular9,10. Por lo tanto, inducen profundos cambios cardiovasculares y respiratorios, por lo que se debe evitarlos en animales de riesgo9 o en caso de procedimientos experimentales que impliquen un cierto compromiso cardiovascular.
Analgésicos opioidesLos opioides en infusión continua no afectan a la contractilidad miocárdica ni al flujo sanguíneo coronario, por lo que este método de administración es el que aporta la mayor estabilidad cardiovascular, por ello es el de elección para procedimientos cardiovasculares.
A dosis analgésicas, especialmente en el caso de los agonistas mu, se puede observar una disminución de la frecuencia cardiaca secundaria a un incremento del tono vagal, y esta bradicardia es sensible a la administración de anticolinérgicos20.
Normalmente, el efecto de los opioides en la presión arterial es mínimo20, aunque se debe tener en cuenta que, en animales anestesiados, la administración endovenosa de opiáceos rápida causa un descenso importante de la presión arterial que, en la morfina y la petidina, se produce como resultado de la vasodilatación originada por la liberación de histamina tras la desgranulación de mastocitos20.
Debido a que los opioides tienen pocos efectos cardiovasculares y no inducen depresión miocárdica, son especialmente seguros en pacientes con función ventricular deteriorada21. Además, se les atribuye propiedades cardioprotectoras desde que Schultz et al22 señalaron que el precondicionamiento isquémico, fenómeno que reduce el daño miocárdico, está mediado por receptores opioides. Además de la protección mediada por receptores opioides, también actúan en el receptor A1 de adenosina23,24 y los canales de KATP22,25,26. También se ha demostrado que el poscondicionamiento está mediado por receptores opioides endógenos, ya que los antagonistas selectivos de estos receptores anulan sus efectos27. Los opioides también actúan mediante la reducción de la adhesión y la migración de neutrófilos15,28.
Los opioides agonistas puros, como el fentanilo, tienen efectos antiarrítmicos, especialmente en arritmias asociadas a daño por isquemia-reperfusión, debido a la prolongación del potencial de acción cardiaco mediado por receptores opioides delta y kappa29.
Anestésicos inyectablesTiopentalSu principal efecto es una depresión del SNC por inhibición de distintos neurotransmisores sinápticos mediante su interacción con receptor del GABAA30. Produce una depresión cardiovascular dependiente de la dosis que incluye: hipotensión (causada por vasodilatación periférica), reducción del gasto cardiaco por depresión miocárdica directa y taquiarritmias (taquicardia ventricular, bigeminismo o extrasístoles ventriculares)30,31.
PropofolEs un derivado alquilfenólico que induce una disminución de la actividad cerebral32 mediante la activación del neurotransmisor inhibidor GABA, principal neurotransmisor inhibidor del SNC que hace que la unión de dicho neurotransmisor a sus receptores se produzca de manera más potente33.
El efecto hemodinámico más importante tras la administración de propofol es una disminución de la presión arterial por reducción del gasto cardiaco34 y la resistencia vascular sistémica30, efecto que puede ser grave en pacientes hipovolémicos o con baja reserva cardiaca. Esta hipotensión es más intensa en los primeros minutos tras la administración endovenosa, en especial si es rápida30. Según distintos autores, esta hipotensión no se debe a reducciones de la contractilidad miocárdica35, ya que el efecto del propofol en esta es insignificante a dosis clínicas, probablemente debido a un aumento de la sensibilidad de los miofilamentos al calcio36 mediado por la proteincinasa C, por lo que se considera un anestésico seguro para animales cardiópatas31.
En cuanto a la frecuencia cardiaca, la mayoría de los autores coinciden en que tiene pocos efectos en ella37, aunque puede aparecer bradicardia en administración conjunta con opioides o en pacientes con bradicardia preexistente30.
Se considera que la capacidad antioxidante y la atenuación de la peroxidación lipídica son los principales mecanismos cardioprotectores del propofol38,39. Además de reducir la liberación de radicales libres38,39, tiene efecto directo en la homeostasis miocárdica del calcio17,40, ya que atenúa la entrada de calcio a las células17 y disminuye la actividad de neutrófilos41. Se ha señalado también que el propofol induce cardioprotección por la inhibición de los poros de transición de permeabilidad mitocondrial42, como resultado de la disminución del estrés oxidativo, lo que disminuye la necrosis y la apoptosis celular miocárdica40. Además, protege el miocardio contra el daño por isquemia-reperfusión40,42 preservando el contenido de ATP miocárdico43.
Anestésicos disociativos: ketamina, tiletaminaSe emplean para inducir inmovilización y anestesia general. Inducen sus efectos mediante interrupción de las vías nerviosas encefálicas y estimulación del sistema de retículo activado, lo que causa estimulación selectiva del SNC por supresión farmacológica de las neuronas inhibitorias e induce una anestesia disociativa o catalepsia, en la que hay aumento del tono muscular, movimientos musculares esqueléticos reflejos y mantenimiento de los reflejos protectores31.
La ketamina tiene efectos cardiovasculares únicos entre los anestésicos; tiene un efecto simpaticomimético mediado en el SNC, inhibición de la absorción neuronal de catecolaminas en las terminaciones nerviosas simpáticas, vasodilatación directa del músculo liso vascular y efecto inotrópico en el miocardio44. Por lo tanto, genera una estimulación cardiovascular con incrementos de frecuencia cardiaca, presión arterial sistémica, presión arterial pulmonar, resistencia vascular sistémica, contractilidad y gasto cardiaco30,31. Este incremento de variables hemodinámicas se asocia a un incremento del trabajo y el consumo de oxígeno miocárdico30,44 que, en un corazón sano, no resulta perjudicial, ya que se incrementa el aporte de oxígeno mediante vasodilatación coronaria e incremento del gasto cardiaco, pero en alteraciones cardiacas como hipertrofia o isquemia, el corazón no es capaz de generar esta respuesta, por lo que en estos casos no se aconseja su uso31.
A pesar de estos efectos, su combinación con benzodiacepinas, y a bajas dosis, nos proporciona una buena inmovilización en animales de manejo difícil, con un amplio margen de seguridad31. Por lo tanto, la combinación ketamina+midazolam resulta ventajosa para analgesia y sedación de pacientes con inestabilidad hemodinámica. Esta combinación potencia la sedación y la amnesia y proporciona gran estabilidad cardiorrespiratoria45.
EtomidatoEl etomidato es un derivado imidazólico de acción ultracorta. Su efecto hipnótico se debe a su acción sobre receptores del GABA y su comienzo de acción es rápido tras su administración endovenosa, así como la recuperación30.
Tras administración endovenosa, hay un leve aumento de frecuencia cardiaca y un mínimo descenso de la presión arterial, mientras que el funcionamiento miocárdico no se afecta. Por lo tanto, como agente único, los efectos cardiovasculares son mínimos, tanto en animales sanos como en hipovolémicos, lo que hace de él el anestésico de elección en animales con cardiopatías30,31.
AlfaxalonaEs un esteroide neuroactivo derivado de la progesterona que induce hipnosis y excelente relajación muscular mediante el aumento del efecto inhibidor del GABA en los receptores GABAA.
Produce una excelente inducción anestésica y buena recuperación, con efectos cardiovasculares y respiratorios mínimos. Posee un amplio margen de seguridad y, a las dosis recomendadas, todos los parámetros cardiorrespiratorios retornan a valores basales a los 15 min de su administración30.
Anestésicos InhaladosTodos los anestésicos volátiles inducen alteraciones en el sistema cardiovascular de manera dependiente de la dosis; los mecanismos son diversos dependiendo del agente, pero a menudo incluyen una depresión miocárdica directa y una disminución de la actividad simpaticoadrenal46. Todos causan reducción del gasto cardiaco, y la magnitud de esa reducción depende del agente y de la dosis. Esta disminución se debe a la reducción del volumen de eyección como resultado de la disminución de la contractilidad miocárdica46. Además, se produce una disminución de la presión arterial (debido a una reducción del volumen sistólico y la resistencia vascular periférica) y la perfusión tisular31. Sus efectos en la frecuencia cardiaca son variables y dependen del agente empleado; sin embargo, como regla general, a dosis clínicas suele mantenerse constante dentro de valores fisiológicos en ausencia de otros factores modificadores46.
Se ha observado que el sevofluorano no induce taquicardia ni alteraciones en la perfusión miocárdica47. Produce una disminución de la presión arterial dependiente de la dosis que es mínima a concentraciones de 1 concentración alveolar mínima (CAM)48 y, según distintos autores, es menor que la inducida por isofluorano49,50.
Los anestésicos inhalados también poseen propiedades cardioprotectoras mediante la preservación del ATP51 y la reducción de la entrada de calcio en las células, con lo que se evita la sobrecarga citosólica y mitocondrial de calcio típica de isquemia y reperfusión. Esto tiene lugar por distintos mecanismos: inhibiendo la bomba Na+-Ca2+52 y la interacción con el intercambio Na+-H+53, la disminución de la formación de radicales libres durante la isquemia-reperfusión, activación o translocación de la proteincinasa C y otras proteincinasas54 y la apertura de canales de KATP51,54. Estos efectos cardioprotectores no son dependientes de la especie, ya que se han visto resultados similares en estudios realizados con perros55, cerdos56, conejos57 y ratas56.
Además, se ha demostrado que los anestésicos inhalados tienen actividad antiapoptótica mediante dos mecanismos: interfieren en la homeostasis cálcica intracelular bloqueando la entrada de calcio sarcolémica, inhibiendo la bomba de Na+-Ca2+ y disminuyendo el contenido de calcio en el retículo sarcoplásmico51 y disminuyen la muerte celular por apoptosis por inhibición betaadrenérgica58.
Por otra parte, previenen el daño por reperfusión, ya que inhiben la activación de neutrófilos y su adhesión al endotelio coronario, con lo que se evitan disfunciones miocárdicas y se preserva la funcionalidad cardiaca59. También disminuyen la adhesión plaquetaria a la pared vascular tras un episodio isquémico60.
Otro efecto de esta cardioprotección es la reducción de las arritmias cardiacas61, que se debe en parte a la habilidad de estos agentes para alterar la homeostasis cálcica del miocardio y, por lo tanto, la contracción-relajación de cardiomiocitos62.
El sevofluorano ha mostrado efectos beneficiosos contra las arritmias ventriculares debidas a isquemia-reperfusión63, disminuye la incidencia de fibrilación ventricular e incrementa las tasas de supervivencia en un modelo porcino de isquemia miocárdica aguda comparado con isofluorano50.
Consideraciones Anestésicas en Función del Modelo AnimalEspecie porcinaLa especie porcina se ha convertido en una de las más utilizadas en experimentación animal debido a su alta disponibilidad7 y sus similitudes anatómicas y fisiológicas con la especie humana64–66. Sin embargo, se debe tener en cuenta ciertas consideraciones o inconvenientes que determinan el protocolo y la técnica anestésica de elección: difícil manejo, vías venosas periféricas de pequeño tamaño2,7,67, posibilidad de hipertermia maligna, alta propensión al estrés y alta tasa de arritmias cardiacas68,69.
La intubación endotraqueal es recomendable para mantener el control de la vía aérea siempre que se aplique anestesia general. Esta maniobra en el cerdo es más difícil que en otras especies, debido a sus características anatómicas2,7,67: presencia de un divertículo laríngeo ventral, laringe y tráquea de pequeño tamaño (que hacen necesarios tubos endotraqueales de menor diámetro que los utilizados en un perro de peso similar) y laringe en forma de uve muy angulada, que obliga a rotar el tubo endotraqueal 180° una vez que ha llegado al suelo de la laringe para poder alcanzar la tráquea; además, la apertura de la cavidad oral es pequeña, y el acceso es más difícil que en otras especies. Se debe tener en cuenta que la manipulación reiterada de la laringe puede causar la aparición de hemorragia, edema laríngeo o laringospasmo2.
Además esta especie muestra alta variabilidad individual en la respuesta a los fármacos anestésicos, incluso en condiciones ambientales similares o idénticas, lo que destaca la importancia que tiene la comprensión de las respuestas fisiológicas y farmacológicas típicas de esta especie67. Son animales altamente sensibles a las manipulaciones y el estrés, debido a que poseen un sistema cardiovascular inestable y su capacidad termorreguladora está muy limitada, ya que su superficie corporal es pequeña respecto a su masa corporal2,7,67. Debido a ello, resulta imprescindible seleccionar y diseñar un buen protocolo anestésico en esta especie, y muy particularmente en ensayos experimentales cardiovasculares.
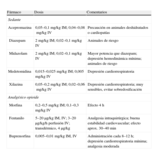
Las complicaciones más frecuentes asociadas con la inmovilización farmacológica y anestesia del cerdo son depresión respiratoria, apnea, hipertermia maligna, depresión cardiovascular y síndrome de estrés porcino67 (tabla 3).
| Fármaco | Dosis y vía | Comentarios |
| Sedante | ||
| Acepromacina | 1,1–2,2mg/kg IM, SC; 0,1–0,2 IV | Sedación menos potente que en otras especies; precaución en animales deshidratados o cardiopatías |
| Diazepam | 0,5–10mg/kg IM, SC; 0,4–2mg/kg bolo IV; 1mg/kg/h perfusión IV; 2–10mg/kg PO | Buena hipnosis y sedación; depresión hemodinámica mínima; alta seguridad |
| Midazolam | 0,1–0,5mg/kg IM, IV; 0,6–1,5mg/kg/h perfusión IV | Mayor potencia que diazepam; depresión hemodinámica mínima; alta seguridad |
| Azaperona | 2–8mg/kg IM | Alta eficacia, inmovilización 30 min; mínimos efectos cardiovasculares |
| Medetomidina | 20–40μg/kg IM, SC; 2μg/kg/h IV | Sedación menos potente que en otras especies; depresión cardiorrespiratoria; analgesia postoperatoria |
| Analgésico opioide | ||
| Morfina | 0,2–1mg/kg IM, SC; 0,05–0,1mg/kg IV | Efecto <4 h |
| Fentanilo | 2–20μg/kg IM, SC, IV; 5–10 (20)μg/kg/h perfusión IV | Analgesia intraquirúrgica; buena estabilidad cardiovascular; efecto en aproximadamente 40–60 min |
| Remifentanilo | 15–60μg/kg/h | Analgesia intraquirúrgica óptima; buena estabilidad cardiovascular |
| Buprenorfina | 0,01–0,05 (0,1)mg/kg IM, SC, IV; 0,5–10μg/kg/h perfusión IV | Administración cada 8–12h; depresión cardiorrespiratoria mínima; analgesia moderada |
| Anestésico | ||
| Ketamina | 11–33mg/kg IM, SC; 2–6mg/kg IV + 3–33mg/kg/h perfusión IV | Mala analgesia visceral; recomendada combinación con otros agentes para obtener relajación muscular y analgesia |
| Tiletamina/zolazepam | 2–8,8 (10)mg/kg IM, SC | Depresión cardiovascular e hipotermia; contraindicado en deterioro cardiovascular |
| Tiopental | 6,6–11 (25)mg/kg IV; 3–6 (30)mg/kg/h | Apnea tras administración en bolo; efecto acumulativo; depresión cardiovascular |
| Propofol | 4–13 (20)mg/kg IV; 0,8–1,6mg/kg bolo IV + 1420mg/kg/h perfusión IV | Hipotensión a altas dosis; a bajas dosis no altera gasto cardiaco ni flujo sanguíneo coronario; la perfusión proporciona una anestesia muy estable |
| Etomidato | 4–8 (0,5–2)mg/kg IV | Buena estabilidad cardiovascular |
| Alfaxalona | 0,7–0,9mg/kg IV | No registrado |
| Isofluorano | Concentración alveolar mínima, 1,2–2,04 | De elección para anestesia general en cerdo; efecto leve en flujo sanguíneo coronario y contractilidad miocárdica |
| Sevofluorano | Concentración alveolar mínima, 2,53 | De elección para anestesia general en cerdo; efecto leve en flujo sanguíneo coronario y contractilidad miocárdica; de elección en pacientes de riesgo |
Esta especie es una de las más estudiadas, lo que nos permite elegir una amplia gama de posibilidades anestésicas en la elección tanto de los fármacos como de la técnica, que dependerá principalmente del tipo de procedimiento experimental que vayamos a realizar. Por ejemplo, la raza Beagle, muy empleada en investigación, no presenta ninguna susceptibilidad especial a la medicación anestésica6,70.
Otra ventaja de esta especie es que su manejo es sencillo, lo que nos permite explorar y preparar al paciente con el mínimo estrés, lo que resulta de vital importancia, sobre todo en estudios cardiovasculares. Debemos tener en cuenta, sin embargo, que actualmente su empleo en estudios cardiovasculares, como en isquemia miocárdica, ha disminuido debido a que posee una importante red colateral coronaria que es capaz de proporcionar el 40% del flujo normal de perfusión cuando se induce una oclusión coronaria aguda64 (tabla 4).
| Fármaco | Dosis | Comentarios |
| Sedante | ||
| Acepromazina | 0,03–0,2mg/kg IM; 0,03–0,1mg/kg IV; 1,25–3mg/kg PO | Precaución en animales deshidratados o cardiopatías |
| Diazepam | 0,5mg/kg IV, rectal | Animales de riesgo; administración endovenosa lenta; no usar vía IM |
| Midazolam | 0,25–0,5mg/kg IM, IV; 0,35μg/kg/min perfusión IV | Mayor potencia que diazepam; depresión hemodinámica mínima; alta seguridad |
| Medetomidina | 10–20 (40)μg/kg IM, IV; 1–5μg/kg/h perfusión IV | Efecto cardiovascular bifásico; disminución gasto cardiaco; bloqueos AV; efecto hiperglucemiante |
| Dexmedetomidina | 5–10 (20)μg/kg IM, IV; 0,5–2μg/kg/h perfusión IV | Efecto cardiovascular bifásico; disminución gasto cardiaco; bloqueos AV; efecto hiperglucemiante |
| Analgésico opioide | ||
| Morfina | 0,3–1mg/kg IM, IV, SC; 0,1mg/kg epidural; 0,1–1mg/kg/h perfusión IV | Administración bolo endovenoso lento; efecto 4 h; epidural, intraarticular: 24 h; efecto emético |
| Fentanilo | 5–10μg/kg IM, IV; 5–40μg/kg/h perfusión IV; transdérmico: 4μg/kg; postoperatorio, 2–10μg/kg/h | Analgesia intraquirúrgica; buena estabilidad cardiovascular; efecto aprox. 30–40 min |
| Remifentanilo | 4–10μg/kg IV lento; 15–60μg/kg/h intraoperatorio; 4–10μg/kg/h postoperatorio | Efecto muy corto, solo perfusión IV; analgesia intraquirúrgica óptima; buena estabilidad cardiovascular; ventilación controlada obligatoria |
| Metadona | 0,1–0,5mg/kg IM, IV, SC | Efecto similar a morfina, no emético; dolor neuropático (antagonismo NMDA) |
| Buprenorfina | 0,01–0,02 mg/kg IM, IV, SC | Administración cada 8-12 h; depresión cardiorrespiratoria mínima; analgesia moderada |
| Anestésico | ||
| Ketamina | 5–10mg/kg IV; 10–20mg/kg IM; 0,05–0,09mg/kg/min | Mala analgesia visceral; recomendada combinación con otros agentes para obtener relajación muscular y analgesia; estimulación cardiovascular |
| Tiopental | 6-15 mg/kg IV (no más de 25 mg/kg) | Apnea tras administración bolo, efecto acumulativo, depresión cardiovascular (caída gasto cardiaco, incremento demanda miocárdica oxígeno); escaso margen de seguridad |
| Propofol | 2–6mg/kg IV; 0,2–0,4mg/kg/min perfusión | Hipotensión a altas dosis; a bajas dosis, no altera gasto cardiaco ni flujo sanguíneo coronario; perfusión IV proporciona una anestesia muy estable |
| Etomidato | 0,5–2mg/kg IV; 50–150μg/kg/min | Buena estabilidad cardiovascular; mioclonías, disminución respuesta adrenocortical; perfusión IV poco recomendada |
| Alfaxalona | 2–3mg/kg IV; 0,1–0,15mg/kg/min | Efectos cardiorrespiratorios leves; administración IV lenta (en 60 s) |
| Isofluorano | Concentración alveolar mínima, 1,3 | Efecto leve en flujo sanguíneo coronario y contractilidad miocárdica; de elección en pacientes de riesgo |
| Sevofluorano | Concentración alveolar mínima, 2,2 | Efecto leve en flujo sanguíneo coronario y contractilidad miocárdica; de elección en pacientes de riesgo |
AV: auriculoventricular; IM: intramuscular; IV: intravenoso; NMDA: ácido N-metil-D-aspártico; SC: subcutáneo.
Debido a las características de su sistema digestivo, la anestesia general conlleva ciertos riesgos, como el timpanismo abdominal y la regurgitación, que pueden causar obstrucción de vías respiratorias71,72. Para minimizar estos riesgos, se debe garantizar el correcto ayuno, la colocación adecuada del animal y la intubación endotraqueal inmediata a la inducción anestésica72. En los rumiantes sometidos a estrés suele generarse un importante shunt pulmonar (síndrome de Euler-Liljestrand) que motiva, durante los primeros 30–60 min tras la inducción anestésica, un descenso importante de la presión parcial de oxígeno arterial (PaO2)73; por ello, durante la fase preanestésica se debe preoxigenar con oxígeno al 100%.
Los problemas anestésicos más frecuentes en rumiantes son: regurgitación, timpanismo abdominal, oxigenación inadecuada, depresión respiratoria, apnea o neumonía por aspiración72.
La oveja presenta ciertas ventajas como modelo animal en estudios cardiovasculares: no desarrollan masa muscular en poco tiempo como sucede en el cerdo, tienen un carácter muy dócil, por lo que su manejo es sencillo, y una anatomía coronaria similar a la humana, con escasa circulación coronaria colateral74.
Sin embargo, también presentan ciertas limitaciones, ya que las lesiones producidas en el miocardio tienen un sistema de reparación tisular diferente del humano, pues se caracteriza por la formación de cicatrices colágenas75 (tabla 5).
Dosis recomendadas de agentes anestésicos en oveja7,9-11,39,86.
| Fármaco | Dosis | Comentarios |
| Sedante | ||
| Acepromazina | 0,05–0,1mg/kg IM; 0,04–0,08mg/kg IV | Precaución en animales deshidratados o cardiopatías |
| Diazepam | 2mg/kg IM; 0,02–0,1 mg/kg IV | Animales de riesgo |
| Midazolam | 2mg/kg IM; 0,02–0,1mg/kg IV | Mayor potencia que diazepam; depresión hemodinámica mínima; animales de riesgo |
| Medetomidina | 0,015–0,025mg/kg IM; 0,005mg/kg IV | Depresión cardiorrespiratoria |
| Xilazina | 0,05–0,2mg/kg IM; 0,02–0,06mg/kg IV | Depresión cardiorrespiratoria; muy sensibles, evitar sobredosificación |
| Analgésico opioide | ||
| Morfina | 0,2–0,5mg/kg IM; 0,1–0,3mg/kg IV | Efecto 4h |
| Fentanilo | 5–20μg/kg IM, IV; 3–20μg/kg/h perfusión IV; transdérmico, 4μg/kg | Analgesia intraquirúrgica; buena estabilidad cardiovascular; efecto aprox. 30–40min |
| Buprenorfina | 0,005–0,01mg/kg IM, IV | Administración cada 8–12h; depresión cardiorrespiratoria mínima; analgesia moderada |
AV: auriculoventricular; IM: intramuscular; IV: intravenoso; NMDA: ácido N-metil-D-aspártico; SC: subcutáneo.
El conejo es una especie de alto riesgo anestésico76,77, y es importante tener en cuenta ciertas particularidades fisiológicas y anatómicas en la elección del protocolo anestésico más adecuado. Sufren frecuentemente enfermedades subclínicas, tanto respiratorias (neumonía por Pasteurella multocida), como renales (Encephalitozoon cuniculi), que pueden causar complicaciones perianestésicas graves76,77. Son muy sensibles a la hipercapnia y tienen una cavidad torácica de pequeño tamaño que se puede comprimir fácilmente por dilatación de las vísceras abdominales o por un posicionamiento inadecuado durante el periodo anestésico; todo ello hace que sufran, como complicaciones anestésicas, insuficiencia respiratoria e incluso apnea, por lo que es recomendable realizar intubación endotraqueal siempre que se los someta a anestesia general77. La intubación endotraqueal es un procedimiento complicado debido a sus características anatómicas77. Se debe tener en cuenta que los intentos repetidos de intubación y el traumatismo laríngeo resultante a menudo causan inflamación, laringospasmo, obstrucción respiratoria o necrosis traqueal78. Tienen alta sensibilidad al estrés de manejo3,77, con gran liberación de catecolaminas, lo que induce taquiarritmias e incluso parada cardiaca76.
Para valorar la profundidad anestésica, se debe tener en cuenta los reflejos postural, palpebral, corneal, interdigital y auricular76,77,79, teniendo presente que exoftalmos y rotación de globo ocular con marcado prolapso de la membrana nictitante constituyen importantes signos de alarma, ya que indican una profundidad anestésica excesiva (tabla 6).
Dosis recomendadas de agentes anestésicos en conejo3,90,91,95
| Fármaco | Dosis | Comentarios |
| Sedante | ||
| Acepromazina | 0,1–0,5 (1)mg/kg IM | Sedación de moderada a leve, produce vasodilatación periférica; precaución en animales deshidratados o cardiopatías |
| Diazepam | 1–2 (5)mg/kg IM, IV | Sedación de moderada a profunda; vía IV, emplear solución emulsionada para evitar tromboflebitis |
| Midazolam | 2 (5)mg/kg IM, IV | Sedación de moderada a profunda |
| Medetomidina | 0,1–0,3 (0,5)mg/kg IM, SC | Sedación de ligera a profunda; vasoconstricción periférica (dificulta venoclisis); depresión cardiorrespiratoria (empleo exclusivamente en animales sanos) |
| Xilazina | 5mg/kg IM | Sedación de ligera a profunda; vasoconstricción periférica (dificulta venoclisis); depresión cardiorrespiratoria (empleo exclusivamente en animales sanos) |
| Analgésico opioide | ||
| Morfina | 0,5–2mg/kg | Efecto 4h |
| Fentanilo | 0,005–0,04mg/kg IV bolo | Analgesia intraquirúrgica, buena estabilidad cardiovascular; efecto aprox. 30–40 min |
| Buprenorfina | 0,01–0,05 (0,1)mg/kg IV, SC | Administración cada 8–12h; depresión cardiorrespiratoria mínima; analgesia moderada |
| Anestésico | ||
| Ketamina | 25–50mg/kg IM | Hipnosis de moderada a profunda y leve analgesia |
| Tiopental | 30mg/kg IV | Anestesia quirúrgica 5-10 min; tiempo de despertar, 10-15 min |
| Propofol | 10 (8–15)mg/kg IV; 0,5–1,5mg/kg/min | Anestesia ligera 5-10 min; apnea común a dosis altas; recuperación rápida y tranquila; tiempo de despertar, 10–15 min |
| Alfaxalona | 3mg/kg IV; 5–10mg/kg IM | No registrado |
| Isofluorano | Inducción, 2–5%; mantenimiento, 1,25–2,5% | Cuidado si se usa para inducción: apnea, acidosis, hipercapnia, bradicardia; malo como agente único; controlar presión arterial |
| Sevofluorano | Inducción, 5–6%; mantenimiento, 4–5% | Malo como agente único; controlar presión arterial |
AV: auriculoventricular; IM: intramuscular; IV: intravenoso; NMDA: ácido N-metil-D-aspártico; SC: subcutáneo.
Sufren frecuentemente enfermedades respiratorias subclínicas que pueden manifestarse por secreciones oculares o nasales y generar complicaciones perianestésicas importantes79,80. Los animales que presenten una secreción negra o rojiza en las comisuras oftálmicas mediales sufren un estado general deficiente o un gran estrés79, por lo que se debería excluirlos del ensayo experimental.
La monitorización de la profundidad anestésica se realiza evaluando el reflejo podal y de pellizco de la cola, ya que los oculares no son útiles como en otras especies porque el globo ocular se mantiene fijo y el reflejo palpebral puede continuar activo incluso en planos anestésicos quirúrgicos. Es importante señalar que la exoftalmia indica una excesiva profundidad anestésica80.
Las principales complicaciones anestésicas en roedores son: hipotermia, hipoglucemia, depresión respiratoria y cardiovascular, complicaciones que se agravan, en ocasiones, por una deficiente monitorización anestésica80,81 (tabla 7).
| Fármaco | Dosis | Comentarios |
| Sedante | ||
| Acepromazina | 1–2,5 (5)mg/kg IM, intraperitoneal, SC | Sedación, pero continúan activos |
| Diazepam | 2,5mg/kg IM, intraperitoneal, IV | Solo sedación |
| Midazolam | 2,5mg/kg IM, intraperitoneal, IV | Solo sedación |
| Medetomidina | 30–100μg/kg intraperitoneal, SC | Sedación y algo de analgesia, inmovilización a dosis altas |
| Xilazina | 1,5mg/kg intraperitoneal; 5mg/kg IM, SC | Sedación y algo de analgesia, inmovilización a dosis altas |
| Analgésico opioide | ||
| Morfina | 2,5mg/kg IM, SC | Cada 4h |
| Fentanilo | 0,01–0,3mg/kg SC | Duración efecto 2–4h |
| Buprenorfina | 0,01–0,05mg/kg IM, intraperitoneal, SC; 0,1–0,25mg/kg oral; 0,01–0,02mg/ml agua bebida | Cada 8–12h |
| Combinaciones anestésicas | ||
| Ketamina+medetomidina | 60–75mg/kg + 0,4–0,5mg/kg IM, intraperitoneal, SC | Anestesia quirúrgica, 20–180 min; poliuria, hipotermia |
| Ketamina+xilazina | 40–100mg/kg + 5–10mg/kg IM, intraperitoneal | Anestesia quirúrgica, 20–30 min; recuperaciones largas |
| Ketamina+diazepam | 40–80mg/kg + 5–10mg/kg intraperitoneal | Alta seguridad |
| Pentobarbital | 40–50mg/kg intraperitoneal | Breve duración anestesia; estrecho margen de seguridad |
| Isofluorano | Inducción, 2–4%; mantenimiento, 1,5–3% | Buena inducción y recuperación, poca excitación |
| Sevofluorano | Inducción, 6–8%; mantenimiento, 3–3,5% | Buena inducción y recuperación, poca excitación |
Ninguno.