La disfunción de la aurícula izquierda en la estenosis aórtica puede preceder a la dilatación y predecir la aparición de fibrilación auricular (FA). Para analizar esta hipótesis, se estudió la función auricular izquierda y se determinó su impacto en la incidencia de FA tras recambio valvular aórtico.
MétodosSe estudió mediante ecocardiografía con speckle-tracking a 149 pacientes (74±8,6 años; el 51% varones) con estenosis aórtica grave sin FA previa. La función auricular izquierda se evaluó con el pico de strain longitudinal auricular (PSLA), el pico de strain de la contracción auricular (PSCA) y el volumen de la aurícula izquierda en cada fase de la contracción auricular. En 114 pacientes se detectó la aparición de FA entre la cirugía y el alta hospitalaria.
ResultadosEn el análisis de regresión lineal múltiple, el PSLA y el PSCA tenían correlación inversa con la dilatación auricular, la hipertrofia ventricular izquierda y la función diastólica; 36 pacientes presentaron FA una media de 3 [intervalo intercuartílico, 1-4] días tras el recambio valvular aórtico. En la regresión de Cox, la incidencia de FA se asoció de manera independiente con ambos parámetros (HR=0,946; IC95%, 0,910-0,983; p=0,005; HR=0,932; IC95%, 0,883-0,984; p=0,011) incluso después de ajustar los resultados según las dimensiones de la aurícula izquierda. Tanto la reducción del PSLA como del PSCA se asociaron con la incidencia de FA en los pacientes con aurícula izquierda no dilatada (PSLA con las dimensiones de la aurícula izquierda, p=0,013).
ConclusionesEn la estenosis aórtica grave, la disfunción auricular predijo la incidencia de FA posoperatoria independientemente de la dilatación auricular, lo que indica que la ecocardiografía con speckle-tracking antes de la cirugía puede ser de ayuda en la estratificación del riesgo, particularmente en aquellos con aurícula izquierda no dilatada.
Palabras clave
La fibrilación auricular (FA) de nuevo comienzo es la complicación más frecuente tras la cirugía cardiaca y se da en un 15-45% de las intervenciones1. Su aparición se asocia con estancias hospitalarias más largas, aumento de la morbilidad y mortalidad a los 6 meses2,3.
La patogenia de la FA posoperatoria no se conoce por completo, pero está relacionada con una combinación de factores perioperatorios, como la inflamación del pericardio, el aumento del tono simpático y la sobrecarga de volumen y un sustrato anatómico y funcional vulnerable en la aurícula izquierda (AI)4–6.
En los pacientes con una estenosis aórtica grave, las alteraciones de la estructura y la función del ventrículo izquierdo de larga duración dan lugar a aumento de la presión en la AI, dilatación de la cavidad y deterioro de la función de la AI7,8. Este remodelado estructural y funcional de la AI puede aumentar el riesgo de arritmias auriculares, tanto antes como después de la intervención quirúrgica9–11.
La ecocardiografía con speckle tracking (STE) es un método viable, reproducible y fácil de realizar para evaluar la función de la AI y supera varias de las dificultades que tenían las técnicas anteriormente utilizadas, a la vez que aporta un valor pronóstico más potente12–15. El análisis de la STE puede usarse para medir el strain (deformación) longitudinal de la AI, que es el primer parámetro útil para el análisis funcional de la AI16. La STE permite determinar los volúmenes de la AI en las diversas fases, y ello puede usarse también para evaluar la función auricular8,12,17. El strain de la AI se relaciona con el grado de fibrosis de la pared auricular y puede predecir incluso el riesgo de FA de nuevo comienzo en los pacientes con estenosis aórtica5,6,18. Sin embargo, no se ha establecido aún el papel del análisis funcional de la AI en la evaluación del riesgo de los pacientes a los que se practica una sustitución de válvula aórtica (SVA).
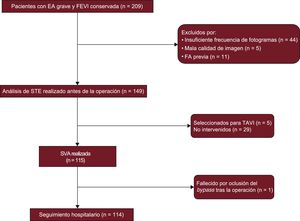
El objetivo de este estudio es caracterizar mediante STE la función de la AI de pacientes con estenosis aórtica grave y determinar su utilidad como predictor de FA de nuevo comienzo tras la SVA. En un análisis secundario, se evaluó si la disfunción de la AI predice la FA en los pacientes con una AI no dilatada.
MÉTODOSPoblación del estudioEl estudio EPICHEART (The influence of EPICardial adipose tissue in HEART diseases) es un estudio observacional/traslacional en el que se investigan los mecanismos que subyacen a la relación entre el tejido adiposo epicárdico y cardiopatías como la enfermedad coronaria, el remodelado cardiaco y la FA. Formaron la población del estudio pacientes con estenosis aórtica grave (área de la válvula aórtica < 1cm2 o < 0,6cm2/m2 mediante ecocardiografía transtorácica) remitidos al centro para SVA entre octubre de 2014 y septiembre de 2016. Los criterios de exclusión fueron: flutter o FA previos, coexistencia de insuficiencia aórtica moderada o grave o valvulopatía mitral, válvula aórtica bicúspide, dilatación del ventrículo izquierdo (índice de volumen telediastólico > 75 ml/m2) o fracción de eyección del ventrículo izquierdo < 55%, insuficiencia renal crónica en estadio 3-5, enfermedad pulmonar obstructiva crónica grave o moderada y cáncer activo. Se examinaron en total 209 ecocardiografías para elegir las que tenían suficiente calidad de imagen para permitir el análisis de la STE. Se excluyeron las que tenían insuficiente frecuencia de fotogramas (n = 44), mala calidad de imagen (n = 5) o un FA de nuevo comienzo antes de la intervención quirúrgica (n = 11). Finalmente, se incluyó a 149 pacientes en el análisis. En la figura 1 se presenta el diagrama de flujo del estudio. Todos los pacientes pasaron un examen preespecificado que incluía una evaluación antropométrica, clínica, ecocardiográfica y por tomografía coronaria y una angiografía coronaria invasiva. Se registraron las comorbilidades, incluidas las siguientes: clase funcional de la New York Heart Association, hipertensión, dislipemia, diabetes, obesidad (reflejada en el índice de masa corporal), tabaquismo, enfermedad pulmonar obstructiva crónica, ictus y enfermedad arterial periférica, así como la medicación utilizada. Todos los participantes dieron su consentimiento informado por escrito y el estudio fue aprobado por el comité de ética de los centros y por el comité nacional de protección de datos.
Análisis de la ecografía transtorácica estándar bidimensionalUn mismo operador experimentado realizó todas las exploraciones ecocardiográficas con un sistema ecográfico (iE33, Philips Medical Systems; Best, Países Bajos) provisto de un transductor S5-1, y las imágenes se digitalizaron para un ulterior análisis offline. Se midieron las dimensiones y los volúmenes de las cámaras cardiacas y la masa ventricular izquierda19. Se determinaron las velocidades de flujo de entrada mitral mediante Doppler pulsado en la proyección de 4 cámaras apical, con la muestra colocada en las puntas de las valvas mitrales; las velocidades se registraron en la fase final de la espiración. Se obtuvieron las velocidades de Doppler pulsado tisular al final de la espiración en la proyección de 4 cámaras apical, con la muestra colocada en la parte septal y lateral del anillo mitral: se determinaron las velocidades sistólica (S’), protodiastólica (E’) y telediastólica (A’). Para todos los parámetros se registró la media de 3 latidos cardiacos consecutivos. La función sistólica se evaluó determinando la fracción de eyección del ventrículo izquierdo mediante la regla de Simpson modificada utilizando proyecciones biplanares de 4 y 2 cámaras, y la velocidad tisular anular miocárdica sistólica (S’ septal, S’ lateral y S’ media).
Análisis de la ecocardiografía con speckle tracking de la función auricular izquierdaSe obtuvieron imágenes bidimensionales en escala de grises en la proyección tetracameral apical, a 50-100 fps20. El borde endocárdico de la AI se trazó manualmente y un observador que no conocía los datos clínicos realizó el análisis con el programa informático Velocity Vector Imaging (Syngo VVI 2.0, Siemens Medical Solutions USA Inc.), según un método descrito con anterioridad12,13. El programa divide la AI en 6 segmentos, y se verificó visualmente la calidad del trazado en todos ellos; se excluyó a los pacientes con trazado inadecuado en más de 2 segmentos. A continuación, el operador ajustó manualmente los segmentos con trazado inadecuado. Según lo descrito con anterioridad17, se obtuvieron los siguientes volúmenes fásicos de la AI a partir de las curvas de tiempo-volumen basadas en el desplazamiento de los píxeles endocárdicos de la AI: volumen máximo de la AI, volumen mínimo de la AI y volumen de la AI antes de la onda A. Se determinaron los índices de la función de la AI a partir de esos volúmenes mediante varias fórmulas validadas en estudios previos8,12. Se caracterizó la función de reservorio de la AI con la fracción de vaciado de la AI ([volumen máximo de la AI – volumen mínimo de la AI] / volumen máximo de la AI × 100), y el índice de expansión de la AI ([volumen máximo de la AI – volumen mínimo de la AI] / volumen mínimo de la AI × 100). Se determinó también la función de conducto de la AI por el volumen de vaciado pasivo de la AI (volumen máximo de la AI – volumen de la AI antes de la onda A), la fracción de vaciado pasivo de la AI ([volumen máximo de la AI – volumen de la AI ante de la onda A] / volumen máximo de la AI) y el volumen de conducto de la AI (volumen de eyección del ventrículo izquierdo – [volumen máximo de la AI – volumen mínimo de la AI]). Por último, se determinó la función de bomba de la AI por la fracción de vaciado activo de la AI ([volumen de la AI antes de la onda A – volumen mínimo de la AI] / volumen de la AI antes de la onda A) y el volumen de vaciado activo de la AI (volumen de la AI antes de la onda A – volumen mínimo de la AI).
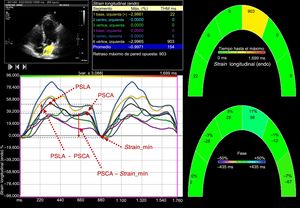
El strain miocárdico de la AI se determinó con el mismo programa informático mediante el trazado y la comparación de la posición relativa de las manchas (speckles) a lo largo de todo el ciclo cardiaco. Se presentaron las curvas de strain para cada uno de los 6 segmentos generadas automáticamente por el programa. El strain cero se estableció en el inicio del QRS. Empleando este punto de referencia, el patrón de strain de la AI consiste en una onda positiva que alcanza su máximo al final de la sístole ventricular, seguida de una disminución tras la apertura de la válvula mitral y, después de un periodo estable, una segunda disminución que corresponde a la contracción auricular. Con el promedio de las curvas de strain de todos los segmentos, se determinaron el pico de strain de la AI al final de la sístole ventricular (PSLA), que es una medida de la función de reservorio de la AI12, el pico de strain auricular antes de la contracción auricular (PSCA), que puede considerarse un indicador de la función de bomba de la AI12, y el strain mínimo, que se mide al final de la contracción auricular. A continuación se calcularon el strain de vaciado pasivo de la AI como PSLA – PSCA, que es una medida de la función de conducto de la AI, y el strain de vaciado activo de la AI como PSCA – strain mínimo20. En la figura 2 se muestra la determinación del strain de la AI en un paciente con estenosis aórtica grave.
Para evaluar la reproducibilidad de las determinaciones del PSLA, se seleccionó aleatoriamente a 10 pacientes y se llevó a cabo un análisis de Bland-Altman para evaluar la coincidencia intraobservador e interobservadores. Las medias ± 2 desviaciones estándar de la coincidencia intraobservador e interobservadores fueron del −0,03 ± 2,3% y el 0,17 ± 1,75%.
Fibrilación auricular de novoSe sometió a todos los pacientes a monitorización electrocardiográfica continua mediante telemetría desde el ingreso en el hospital hasta el alta. Con independencia del ritmo existente, se obtuvieron tiras de ritmo ordinarias cada 2 h en la unidad de cuidados intensivos cardiacos y cada 8 h en las unidades de telemetría. Si se producía alguna anomalía, se imprimían las tiras de ritmo y se adjuntaban a la historia clínica del paciente, y se obtenía un electrocardiograma de 12 derivaciones para confirmar las observaciones dudosas. Además, se realizaron sistemáticamente electrocardiogramas de 12 derivaciones preoperatorio, posoperatorio inmediato y el primer y el segundo día posoperatorios. Los eventos de FA o flutter auricular se identificaron mediante el examen de las tiras de ritmo de electrocardiograma, los electrocardiogramas de 12 derivaciones, las notas médicas y de enfermería en la historia clínica y las listas de medicación diaria.
Análisis estadísticoLas variables continuas se presentan como media ± desviación estándar de los datos con distribución normal o mediana (segundo cuartil [Q] 2) y los centiles 25 (Q1) y 75 (Q3) para los datos de distribución no normal. Las variables discretas se expresan mediante frecuencias y porcentajes. En primer lugar, se realizó una regresión lineal univariable para identificar las variables clínicas y ecocardiográficas correlacionadas con los parámetros de PSLA, PSCA, volumen máximo de la AI y volumen mínimo de la AI. A continuación, se introdujo en estas asociaciones un ajuste por el efecto de otras variables que pueden estar relacionadas simultáneamente con la estenosis aórtica y la función de la AI, como edad, sexo, hipertensión, diabetes mellitus, índice de masa corporal, índice de área de la válvula aórtica y uso de bloqueadores beta o antagonistas del sistema renina-angiotensina-aldosterona. Se realizó una regresión de riesgos proporcionales de Cox para evaluar la asociación del strain y los volúmenes de la AI con la incidencia de FA después de la SVA; se elaboraron modelos ajustados por la medicación preoperatoria con bloqueadores beta o estatinas, el tipo de intervención (SVA sola frente a SVA combinada con cirugía de bypass arterial coronario), número total de bypasses coronarios y tipo de prótesis (biológica frente a mecánica), ya que se sabe que estas variables influyen en el riesgo de FA tras la cirugía (modelo 1). También se introdujo un ajuste en la asociación entre strain de la AI y FA de novo respecto a las medidas del tamaño de la AI (modelos 2-6). Se utilizó un análisis de características operativas del receptor (ROC) para identificar los mejores valores de corte de PSLA, PSCA, volumen máximo de la AI, volumen mínimo de la AI y previo a la onda A en cuanto a la predicción de FA tras la SVA. Se estimaron las curvas de Kaplan-Meier para la incidencia acumulada de FA y se compararon en los distintos grupos de pacientes mediante test de log rank. Como análisis secundario, se realizó una regresión de Cox estratificada para analizar la asociación del PSLA y el PSCA con el riesgo de FA según los diferentes grupos de dimensiones de la AI: normal (diámetro de la AI ≤ 40 mm) y dilatada (> 40 mm) con una prueba de interacción. El análisis estadístico se realizó con el programa informático STATA (versión 13.1, StataCorp LP; Texas, Estados Unidos). Los valores de p son bilaterales y se consideró indicativos de significación estadística los valores < 0,05.
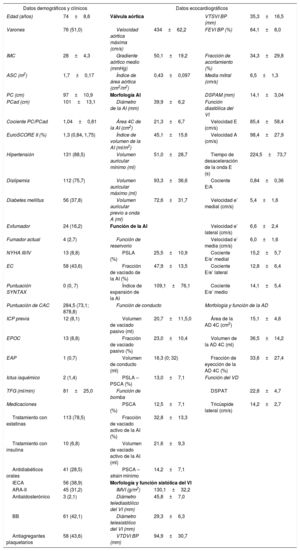
RESULTADOSCaracterísticas de los pacientesEn el estudio se incluyó a un total de 149 pacientes de edad avanzada (74 ± 8,6 años; un 51% de varones) con estenosis aórtica grave, fracción de eyección conservada (media de fracción de eyección del ventrículo izquierdo, 64 ± 8,0%) y una mediana de EuroSCORE II de 1,3 (Q1, 0,84; Q3, 1,75). La media del diámetro de la AI fue 39,9 ± 6,2mm, y 63 (55,3%) pacientes tenían dilatada la AI. En la tabla 1 se presentan las características generales de la población.
Características generales de los pacientes (n = 149)
| Datos demográficos y clínicos | Datos ecocardiográficos | ||||
|---|---|---|---|---|---|
| Edad (años) | 74±8,6 | Válvula aórtica | VTSVI BP (mm) | 35,3±16,5 | |
| Varones | 76 (51,0) | Velocidad aórtica máxima (cm/s) | 434±62,2 | FEVI BP (%) | 64,1±8,0 |
| IMC | 28±4,3 | Gradiente aórtico medio (mmHg) | 50,1±19,2 | Fracción de acortamiento (%) | 34,3±29,8 |
| ASC (m2) | 1,7±0,17 | Índice de área aórtica (cm2/m2) | 0,43±0,097 | Media mitral (cm/s) | 6,5±1,3 |
| PC (cm) | 97±10,9 | Morfología AI | DSPAM (mm) | 14,1±3,04 | |
| PCad (cm) | 101±13,1 | Diámetro de la AI (mm) | 39,9±6,2 | Función diastólica del VI | |
| Cociente PC/PCad | 1,04±0,81 | Área 4C de la AI (cm2) | 21,3±6,7 | Velocidad E (cm/s) | 85,4±58,4 |
| EuroSCORE II (%) | 1,3 (0,84, 1,75) | Índice de volumen de la AI (ml/m2) | 45,1±15,6 | Velocidad A (cm/s) | 98,4±27,9 |
| Hipertensión | 131 (88,5) | Volumen auricular mínimo (ml) | 51,0±28,7 | Tiempo de desaceleración de la onda E (s) | 224,5±73,7 |
| Dislipemia | 112 (75,7) | Volumen auricular máximo (ml) | 93,3±36,6 | Cociente E/A | 0,84±0,36 |
| Diabetes mellitus | 56 (37,8) | Volumen auricular previo a onda A (ml) | 72,6±31,7 | Velocidad e’ medial (cm/s) | 5,4±1,6 |
| Exfumador | 24 (16,2) | Función de la AI | Velocidad e’ lateral (cm/s) | 6,6±2,4 | |
| Fumador actual | 4 (2,7) | Función de reservorio | Velocidad e’ media (cm/s) | 6,0±1,6 | |
| NYHA III/IV | 13 (8,8) | PSLA (%) | 25,5±10,9 | Cociente E/e’ medial | 15,2±5,7 |
| EC | 58 (43,6) | Fracción de vaciado de la AI (%) | 47,9±13,5 | Cociente E/e’ lateral | 12,8±6,4 |
| Puntuación SYNTAX | 0 (0, 7) | Índice de expansión de la AI | 109,1±76,1 | Cociente E/e’ medio | 14,1±5,4 |
| Puntuación de CAC | 284,5 (73,1; 878,8) | Función de conducto | Morfología y función de la AD | ||
| ICP previa | 12 (8,1) | Volumen de vaciado pasivo (ml) | 20,7±11,5,0 | Área de la AD 4C (cm2) | 15,1±4,6 |
| EPOC | 13 (8,8) | Fracción de vaciado pasivo (%) | 23,0±10,4 | Volumen de la AD 4C (ml) | 36,5±14,2 |
| EAP | 1 (0,7) | Volumen de conducto (ml) | 16,3 (0; 32) | Fracción de eyección de la AD 4C (%) | 33,6±27,4 |
| Ictus isquémico | 2 (1,4) | PSLA – PSCA (%) | 13,0±7,1 | Función del VD | |
| TFG (ml/min) | 81±25,0 | Función de bomba | DSPAT | 22,8±4,7 | |
| Medicaciones | PSCA (%) | 12,5±7,1 | Tricúspide lateral (cm/s) | 14,2±2,7 | |
| Tratamiento con estatinas | 113 (78,5) | Fracción de vaciado activo de la AI (%) | 32,8±13,3 | ||
| Tratamiento con insulina | 10 (6,8) | Volumen de vaciado activo de la AI (ml) | 21,6±9,3 | ||
| Antidiabéticos orales | 41 (28,5) | PSCA – strain mínimo | 14,2±7,1 | ||
| IECA | 56 (38,9) | Morfología y función sistólica del VI | |||
| ARA-II | 45 (31,2) | IMVI (g/m2) | 130,1±32,2 | ||
| Antialdosterónico | 3 (2,1) | Diámetro telediastólico del VI (mm) | 45,8±7,0 | ||
| BB | 61 (42,1) | Diámetro telesistólico del VI (mm) | 29,3±6,3 | ||
| Antiagregantes plaquetarios | 58 (43,6) | VTDVI BP (mm) | 94,9±30,7 | ||
AD: aurícula derecha; AI: aurícula izquierda; ARA-II: antagonista del receptor de la angiotensina II; ASC: área de superficie corporal; BB: bloqueador beta; BP: biplanar; CAC: calcificación arterial coronaria; DSPAM: desplazamiento sistólico del plano del anillo mitral; DSPAT: desplazamiento sistólico del plano del anillo tricuspídeo; EAP: enfermedad arterial periférica; EC: enfermedad coronaria; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del VI; ICP: intervención coronaria percutánea; IECA: inhibidor de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; IMVI: índice de masa del VI; NYHA: New York Heart Association; PC: perímetro de cintura; PCad: perímetro de cadera; PSCA: pico de strain de la contracción auricular; PSLA: pico de strain longitudinal auricular; TFG: tasa de filtrado glomerular; VD: ventrículo derecho; VI: ventrículo izquierdo; VTDVI: volumen telediastólico del VI; VTSVI: volumen telesistólico del VI.
Los valores se presentan como media±desviación estándar o mediana (cuartil 1; cuartil 3) si la distribución es asimétrica.
Los valores medios de PSLA, PSCA, volúmenes máximo y mínimo de la AI, y volumen de la AI antes de la onda A fueron 25,5 ± 10,9%, 12,5 ± 7,1%, 93,3 ± 36,6ml, 51,0 ± 28,7ml y 72,6 ± 31,7ml respectivamente. En la regresión múltiple, tanto el PSLA como el PSCA mostraron correlación inversa con el índice de volumen de la AI, el índice de masa del ventrículo izquierdo y la dimensión telediastólica del ventrículo izquierdo, así como una peor función diastólica evaluada mediante la velocidad E’ medial y los cocientes mediales E/E’ (PSLA solamente) y E/A (PSCA solamente). En la figura 3 se muestran las correlaciones del PSLA y el PSCA con el índice de masa del ventrículo izquierdo, la media del cociente E/E’ y la fracción de eyección del ventrículo izquierdo. El aumento de los volúmenes de la AI se asoció con mayores cifras de índice de masa del ventrículo izquierdo y el cociente E/A ( y ). Ni el strain ni los volúmenes de la AI mostraron asociación con la función sistólica del ventrículo izquierdo. En la tabla 2 se muestran los coeficientes de regresión lineal univariable y múltiple para las correlaciones con el PSLA y el PSCA.
Correlaciones del PSLA y el PSCA con el índice de masa ventricular izquierda (A y D), el EE’ medio (B y E) y la fracción de eyección del ventrículo izquierdo (C y F). EE’: cociente E/e’; FEVI: fracción de eyección del ventrículo izquierdo; IMVI: índice de masa ventricular izquierda; PSCA: pico de strain de la contracción auricular; PSLA: pico de strain longitudinal auricular.
Análisis univariable y de regresión lineal múltiple de las variables asociadas con el pico de strain longitudinal auricular y el pico de strain de la contracción auricular
| PSLA | PSCA | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Univariable | Multivariable | Univariable | Multivariable | |||||||||||||
| Beta | IC95% inferior | IC95% superior | P | Beta | IC95% inferior | IC95% superior | P | Beta | IC95% inferior | IC95% superior | p | Beta | IC95% inferior | IC95% superior | P | |
| Edad | –0,43 | –0,627 | –0,234 | 0,0001 | –0,125 | –0,257 | 0,007 | 0,064 | ||||||||
| Varón | 2,855 | –0,706 | 0,418 | 0,115 | 0,24 | –2,051 | 2,031 | 0,836 | ||||||||
| IMC | –0,154 | –0,556 | 0,248 | 0,451 | –0,092 | –0,347 | 0,164 | 0,479 | ||||||||
| Hipertensión | –3,297 | –8,907 | 2,313 | 0,247 | –1,608 | –5,213 | 2,001 | 0,38 | ||||||||
| Dislipemia | –0,187 | –4,464 | 4,09 | 0,931 | 0,622 | –2,064 | 3,307 | 0,648 | ||||||||
| Diabetes mellitus | –0,842 | –0,457 | 2,886 | 0,656 | –1,008 | –3,379 | 1,364 | 0,402 | ||||||||
| Índice de área aórtica | 14,48 | –4,741 | 33,71 | 0,138 | 1,557 | –10,505 | 13,621 | 0,799 | ||||||||
| Índice de volumen de la AI | –0,247 | –0,356 | –0,139 | 0,0001 | –0,239 | –0,361 | –0,118 | 0,0001 | –0,19 | –0,256 | –0,124 | 0,0001 | –0,225 | –0,324 | –0,125 | 0,0001 |
| Índice de masa del VI | –0,079 | –0,132 | –0,024 | 0,005 | –0,071 | –0,128 | –0,0134 | 0,016 | –0,046 | –0,081 | –0,012 | 0,008 | –0,054 | –0,092 | –0,017 | 0,005 |
| Diámetro telediastólico del VI | –0,398 | –0,643 | –0,153 | 0,002 | –0,508 | –0,751 | –0,265 | 0,0001 | –0,195 | –0,352 | –0,038 | 0,015 | –0,026 | –0,423 | –0,092 | 0,003 |
| Volumen telesistólico del VI | –0,321 | –0,601 | –0,039 | 0,025 | –0,318 | –0,662 | 0,025 | 0,069 | –0,303 | –0,476 | –0,131 | 0,001 | –0,436 | –0,654 | –0,218 | 0,0001 |
| FEVI BP | 0,178 | –0,601 | 0,494 | 0,266 | 0,199 | –0,036 | 0,436 | 0,096 | 0,117 | –0,029 | 0,264 | 0,116 | 0,098 | –0,061 | 0,257 | 0,224 |
| Media mitral | 2,506 | –0,601 | 4,627 | 0,02 | 0,891 | –0,969 | 2,75 | 0,344 | 1,354 | 0,079 | 2,628 | 0,038 | 0,503 | –0,705 | 1,711 | 0,41 |
| Velocidad E | 0,008 | –0,601 | 0,042 | 0,653 | –0,039 | 0,115 | 0,037 | 0,314 | –0,001 | –0,022 | 0,02 | 0,902 | –0,07 | –0,117 | –0,023 | 0,004 |
| Velocidad A | 0,023 | –0,601 | 0,093 | 0,524 | 0,038 | –0,032 | 0,109 | 0,282 | 0,049 | 0,006 | 0,093 | 0,026 | 0,051 | 0,006 | 0,096 | 0,027 |
| Cociente E/A | –4,407 | –0,601 | 1,514 | 0,143 | –4,731 | –10,72 | 1,261 | 0,12 | –0,826 | –11,625 | –4,897 | 0,0001 | –0,807 | –11,6 | –4,534 | 0,0001 |
| Velocidad e’ medial | 1,926 | –0,601 | 3,405 | 0,011 | 1,615 | –0,002 | 3,233 | 0,05 | –0,061 | –0,976 | 0,855 | 0,897 | –0,667 | –1,66 | 0,326 | 0,185 |
| Cociente E/e’ medial | –0,662 | –0,601 | –0,228 | 0,003 | –0,513 | –0,972 | –0,053 | 0,029 | –0,313 | –0,575 | –0,051 | 0,02 | –0,257 | –0,533 | 0,019 | 0,068 |
| Cociente E/e’ medio | –0,581 | –0,601 | –0,097 | 0,019 | –0,341 | –0,827 | 0,145 | 0,167 | –0,219 | –0,514 | 0,075 | 0,142 | –0,138 | –0,444 | 0,1667 | 0,368 |
AI: aurícula izquierda; BP: biplanar; FEVI: fracción de eyección del VI; IC95%: intervalo de confianza del 95%; IMC: índice de masa corporal; PSCA: pico de strain de la contracción auricular; PSLA: pico de strain longitudinal auricular; VI: ventrículo izquierdo.
La estimación de beta corresponde a 1 unidad de variación del PSLA.
El modelo multivariable incluye edad, sexo, IMC, hipertensión, diabetes mellitus, uso de bloqueadores beta, inhibidores del sistema renina-angiotensina-aldosterona e índice de área de la válvula aórtica.
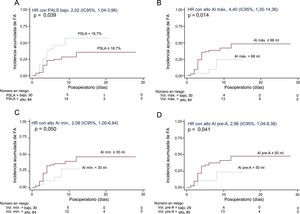
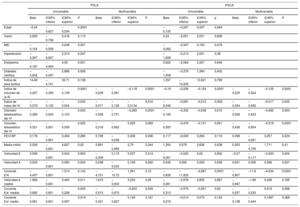
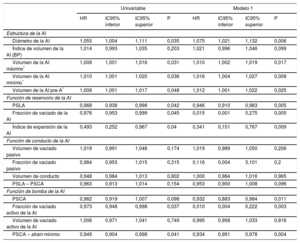
Se practicó SVA a 115 pacientes (en 25, la SVA se combinó con revascularización miocárdica) y se excluyó a 1 paciente porque falleció en el contexto de un infarto de miocardio extenso durante la operación. La mediana de estancia hospitalaria fue 7 (Q1, 5; Q3, 9) días y se produjo FA en 36 pacientes (incidencia acumulada del 36,7%; tasa de incidencia, 5,7 casos de FA cada 100 pacientes operados y día de hospitalización; intervalo de confianza del 95% [IC95%], 4,1-7,8). La FA se produjo una mediana de 3 (Q1, 2,5; Q3, 4) días después de la SVA. En el análisis de regresión de Cox multivariable, el aumento del diámetro de la AI se asoció con mayor incidencia de FA tras la SVA, junto con un deterioro de las funciones de la AI de reservorio (que se reflejaba en una reducción del PSLA, la fracción de vaciado de la AI y el índice de expansión de la AI) y de bomba (que correspondía a una reducción del PSCA, la fracción de vaciado activo de la AI y el strain de vaciado activo de la AI) (tabla 3, modelo 1). El análisis de regresión de Cox univariable para las demás variables asociadas con la incidencia de FA, ninguna de las cuales alcanzó significación estadística, se muestra en la . En el análisis ROC, los mejores valores de corte asociados con FA de novo tras la SVA fueron: PSLA < 18,7%, PSCA < 7,9%, volumen máximo de la AI ≥ 68ml, volumen mínimo de la AI ≥ 30ml y volumen de la AI antes de la onda A ≥ 50ml. En la figura 4 se muestran las curvas de Kaplan-Meier para la incidencia acumulada de FA según los grupos de PSLA, volúmenes máximo y mínimo de la AI y volumen de la AI antes de la onda A. En el análisis de regresión lineal múltiple, varias de las medidas de la función de reservorio y la función de bomba de la AI continuaron mostrando asociación significativa con la incidencia de FA (tabla 3), y estas asociaciones (concretamente con el PSLA y el PSCA) mantuvieron la significación estadística incluso después de introducir un ajuste adicional por el diámetro y los volúmenes de la AI (modelos 2 a 5) (tabla 4).
Análisis de regresión de Cox para la asociación de las dimensiones y la función de la aurícula izquierda con la incidencia de fibrilación auricular tras sustitución de válvula aórtica
| Univariable | Modelo 1 | |||||||
|---|---|---|---|---|---|---|---|---|
| HR | IC95% inferior | IC95% superior | P | HR | IC95% inferior | IC95% superior | P | |
| Estructura de la AI | ||||||||
| Diámetro de la AI | 1,055 | 1,004 | 1,111 | 0,035 | 1,075 | 1,021 | 1,132 | 0,006 |
| Índice de volumen de la AI (BP) | 1,014 | 0,993 | 1,035 | 0,203 | 1,021 | 0,996 | 1,046 | 0,099 |
| Volumen de la AI máximo* | 1,008 | 1,001 | 1,016 | 0,031 | 1,010 | 1,002 | 1,019 | 0,017 |
| Volumen de la AI mínimo* | 1,010 | 1,001 | 1,020 | 0,036 | 1,016 | 1,004 | 1,027 | 0,009 |
| Volumen de la AI pre-A* | 1,008 | 1,001 | 1,017 | 0,048 | 1,012 | 1,001 | 1,022 | 0,025 |
| Función de reservorio de la AI | ||||||||
| PSLA | 0,968 | 0,938 | 0,998 | 0,042 | 0,946 | 0,910 | 0,983 | 0,005 |
| Fracción de vaciado de la AI | 0,976 | 0,953 | 0,999 | 0,045 | 0,015 | 0,001 | 0,275 | 0,005 |
| Índice de expansión de la AI | 0,493 | 0,252 | 0,967 | 0,04 | 0,341 | 0,151 | 0,767 | 0,009 |
| Función de conducto de la AI | ||||||||
| Volumen de vaciado pasivo | 1,019 | 0,991 | 1,048 | 0,174 | 1,019 | 0,989 | 1,050 | 0,206 |
| Fracción de vaciado pasivo | 0,984 | 0,953 | 1,015 | 0,315 | 0,116 | 0,004 | 3,101 | 0,2 |
| Volumen de conducto | 0,948 | 0,984 | 1,013 | 0,802 | 1,000 | 0,984 | 1,016 | 0,965 |
| PSLA – PSCA | 0,963 | 0,913 | 1,014 | 0,154 | 0,953 | 0,900 | 1,008 | 0,096 |
| Función de bomba de la AI | ||||||||
| PSCA | 0,962 | 0,919 | 1,007 | 0,098 | 0,932 | 0,883 | 0,984 | 0,011 |
| Fracción de vaciado activo de la AI | 0,973 | 0,948 | 0,998 | 0,037 | 0,010 | 0,004 | 0,222 | 0,003 |
| Volumen de vaciado activo de la AI | 1,006 | 0,971 | 1,041 | 0,749 | 0,995 | 0,958 | 1,033 | 0,816 |
| PSCA – strain mínimo | 0,949 | 0,904 | 0,998 | 0,041 | 0,934 | 0,991 | 0,978 | 0,004 |
AI: aurícula izquierda; BP: biplanar; HR: hazard ratio; IC95%: intervalo de confianza del 95%; PSCA: pico de strain de la contracción auricular; PSLA: pico de strain longitudinal auricular; STE: ecocardiografía con speckle tracking.
El modelo 1 incluye medicación preoperatoria con bloqueadores beta o estatinas, tipo de intervención (sustitución de válvula aórtica sola frente a la combinada con cirugía de bypass arterial coronario), número total de bypasses coronarios y tipo de prótesis (biológica frente a mecánica).
Curvas de tiempo hasta el evento de FA tras la sustitución de la válvula aórtica, según los grupos de PALS (A), volumen máximo de la AI (B), volumen mínimo de la AI (C) y volumen de la AI previo a la onda A (D). AI: aurícula izquierda; FA: fibrilación auricular; HR: hazard ratio; IC95%: intervalo de confianza del 95%; PSCA: pico de strain de la contracción auricular; PSLA: pico de strain longitudinal auricular.
Asociación del strain longitudinal auricular máximo y el strain en contracción auricular máxima con la incidencia de fibrilación auricular tras la sustitución de válvula aórtica, con ajuste por tamaño de la aurícula izquierda
| PSLA | PSCA | |||||||
|---|---|---|---|---|---|---|---|---|
| HR | IC95% inferior | IC95% superior | p | HR | IC95% inferior | IC95% superior | p | |
| Modelo 2: diámetro de la AI | 0,955 | 0,917 | 0,994 | 0,025 | 0,942 | 0,894 | 1,001 | 0,058 |
| Modelo 3: índice de volumen de la AI | 0,947 | 0,906 | 0,989 | 0,015 | 0,936 | 0,880 | 0,994 | 0,033 |
| Modelo 4: volumen máximo de la AI | 0,952 | 0,915 | 0,992 | 0,018 | 0,941 | 0,890 | 0,996 | 0,038 |
| Modelo 5: volumen mínimo de la AI | 0,957 | 0,917 | 1,000 | 0,05 | 0,949 | 0,841 | 1,007 | 0,085 |
| Modelo 6: volumen de la AI pre-A | 0,953 | 0,913 | 0,993 | 0,024 | 0,940 | 0,889 | 0,995 | 0,034 |
AI: aurícula izquierda; HR: hazard ratio; IC95%: intervalo de confianza del 95%; PSCA: pico de strain de la contracción auricular; PSLA: pico de strain longitudinal auricular.
Los modelos 2, 3, 4, 5 y 6 incluyen las variables del modelo 1 + el diámetro de la AI, el índice de volumen de la AI, el volumen auricular máximo, el volumen auricular mínimo o el volumen auricular previo a la onda A respectivamente.
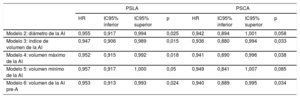
Como objetivo secundario, se determinó la asociación del PSLA y el PSCA con la incidencia de FA estratificada según los subgrupos definidos por el diámetro de la AI. En los pacientes con una AI no dilatada («normal»), los valores reducidos tanto del PSLA como del PSCA se asociaron con mayor riesgo de FA tras la SVA, mientras que no se observó asociación significativa entre la FA y el PSLA o el PSCA en los pacientes con AI dilatada. El valor predictivo del pico de strain longitudinal auricular respecto a la FA fue estadísticamente diferente entre los pacientes con AI dilatada y no dilatada (para la interacción del PSLA con la dimensión AI, p = 0,013) (tabla 5).
Asociación del pico de strain longitudinal auricular y el pico de strain de la contracción auricular con la incidencia de fibrilación auricular tras la sustitución de válvula aórtica según las dimensiones de la aurícula izquierda
| Univariable | Modelo 1 | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Número | HR | IC95% inferior | IC95% superior | P | HR | IC95% inferior | IC95% superior | P | |
| PSLA | 0,004 | ||||||||
| Diámetro de la AI ≤ 40 mm | 63 | 0,948 | 0,899 | 1,000 | 0,052 | 0,904 | 0,844 | 0,968 | 0,442 |
| Diámetro de la AI > 40 mm | 51 | 1,001 | 0,959 | 1,044 | 0,936 | 0,981 | 0,936 | 1,029 | 0,013* |
| PSCA | 0,005 | ||||||||
| Diámetro de la AI ≤ 40 mm | 63 | 0,932 | 0,861 | 1,010 | 0,087 | 0,879 | 0,804 | 0,963 | 0,853 |
| Diámetro de la AI > 40 mm | 51 | 1,016 | 0,949 | 1,088 | 0,644 | 1,001 | 0,929 | 1,092 | 0,884* |
AI: aurícula izquierda; HR: hazard ratio; IC95%: intervalo de confianza del 95%; PSCA: pico de strain de la contracción auricular; PSLA: pico de strain longitudinal auricular.
El modelo 1 incluye medicación preoperatoria con bloqueadores beta o estatinas, tipo de intervención (sustitución de válvula aórtica sola frente a combinada con cirugía de bypass arterial coronario), número total de bypasses coronarios y tipo de prótesis (biológica frente a mecánica).
Los principales resultados de este estudio son los siguientes: a) el deterioro de las funciones de reservorio y de bomba de la AI se asoció con hipertrofia ventricular izquierda, aumento de la presión de llenado del ventrículo izquierdo y dilatación de la AI; b) la FA después de la SVA puede predecirse de manera independiente con el strain y los volúmenes de la AI determinados mediante la STE; c) el strain de la AI puede predecir la aparición de FA incluso tras un ajuste por las dimensiones de la AI, y d) el deterioro del strain de la AI predijo el riesgo de FA de los pacientes con AI no dilatada.
Disfunción auricular izquierda en pacientes con estenosis aórticaLa función de la AI consta de 3 fases: reservorio, conducto y bomba. La función de reservorio corresponde a una fase de expansión durante la sístole del ventrículo izquierdo; la función de conducto es consecuencia del paso de sangre de la AI al ventrículo izquierdo durante la fase inicial de la diástole, y la función de bomba se produce en la parte final de la diástole y corresponde a la contracción de la AI13. La función de la AI puede evaluarse con diversos métodos, como los cambios fásicos en los volúmenes de la AI, el flujo transmitral determinado mediante Doppler pulsado y la medición de las velocidades miocárdicas por Doppler tisular. Sin embargo, estas técnicas de uso habitual tienen varias dificultades que limitan su utilidad clínica12,13. El análisis de STE ha surgido como un instrumento de uso fiable y reproducible para evaluar la función de la AI, que permite superar la mayor parte de las limitaciones de los índices convencionales y puede aportar información pronóstica adicional14,21. De hecho, la función de la AI puede considerarse un indicador de las presiones de llenado del ventrículo izquierdo y la disfunción diastólica, y se ha asociado con resultados clínicos como ictus, insuficiencia cardiaca y mortalidad cardiovascular en diferentes contextos clínicos22.
En la estenosis aórtica, el aumento de la poscarga causa una serie de cambios en la estructura y la función diastólica del ventrículo izquierdo que conducen a un aumento de las presiones de llenado de este y, por consiguiente, aumento de las presiones de la AI, dilatación de la AI y disfunción miocárdica7,8,23. En este estudio se ha puesto de manifiesto que el deterioro de las funciones de reservorio y de bomba de la AI, que se manifiestan en una reducción del PSLA y el PSCA respectivamente, está correlacionado con un aumento del índice de volumen de la AI y las dimensiones del ventrículo izquierdo y con una reducción de la función diastólica. Estas correlaciones se observaron con independencia de la edad, el índice del área de la válvula aórtica, las comorbilidades (como la diabetes mellitus o la hipertensión) y el uso de bloqueadores beta o estatinas.
Asociación de la dilatación de la aurícula izquierda con la fibrilación auricular de novoEn este estudio, el deterioro del strain de la AI predijo la incidencia de FA tras la SVA, lo cual concuerda con lo indicado por otros estudios previos más pequeños5,6,24. Cameli et al.6 apuntaron que un aumento agudo de la presión de llenado durante la cirugía e inmediatamente después puede desestabilizar en mayor medida la función miocárdica en una AI ya frágil y contribuir, por consiguiente, a la aparición de FA. En ese mismo estudio, el deterioro de la función preoperatoria de la AI fue el único factor que predijo la FA de nuevo comienzo tras la SVA, y su incidencia no estuvo relacionada con ningún evento perioperatorio, lo cual resalta el papel de una disfunción previa de la AI en la aparición de la FA.
Concretamente, se ha observado una asociación significativa de la FA con la reducción del PSLA y el PSCA, que corresponden a las funciones de reservorio y de bomba de la AI, pero no con los índices de la función de conducto de la AI. Anteriormente se había observado que los 3 componentes de la función auricular están reducidos en los pacientes con estenosis aórtica grave21,25. Por consiguiente, cabía prever que, de manera similar a lo ocurrido con las funciones de reservorio y de bomba, la función de conducto pudiera estar correlacionada también con la aparición de FA. Sin embargo, otros varios estudios que han abordado la relación entre la función de la AI y la FA de novo tras la SVA han mostrado resultados significativos para las funciones de reservorio y de bomba únicamente5,6,24,26. Además, la mayor parte de los ensayos clínicos se han centrado tan solo en las fases de reservorio y de bomba27, lo cual indica que el papel del deterioro de la función de conducto de la AI en la estenosis aórtica aún no se ha estudiado completamente. Tanto la función de reservorio como la de bomba dependen de propiedades intrínsecas de la AI, es decir, la rigidez y la contractilidad miocárdicas, mientras que la función de conducto depende principalmente de la relajación del ventrículo izquierdo28. Así pues, el deterioro de las funciones de reservorio y de bomba corresponde posiblemente a cambios reales de la mecánica de la AI que podrían favorecer la aparición de FA tras la SVA; en cambio, la contribución de un deterioro de la función de conducto en este contexto podría ser menos relevante.
Función auricular izquierda como predictor de fibrilación auricular independientemente de la dilatación auricularLa dilatación de la AI es un hallazgo frecuente en la estenosis aórtica8 y, como se ha mostrado, está directamente relacionada con el deterioro de la función de la AI25. La dilatación de la AI puede predecir también el riesgo de aparición de FA29, y actualmente forma parte del análisis ecocardiográfico estándar19. Sin embargo, la disfunción de la AI puede no ser totalmente paralela al aumento de tamaño de la AI y puede darse incluso antes de que la AI empiece a dilatarse, lo cual probablemente denote un desacoplamiento temporal entre la dilatación y la disfunción auriculares8,21,25. De hecho, aunque el strain y los volúmenes de la AI mostraron buena correlación en el presente estudio, las funciones de reservorio y de bomba de la AI fueron factores independientes predictivos de FA de novo, incluso tras introducir un ajuste por las dimensiones de la AI. En consecuencia, Galli et al.30 observaron que el deterioro de la función de reservorio de la AI, pero no el aumento de los volúmenes de la AI, era predictor independiente de eventos adversos cardiovasculares mayores en los pacientes con estenosis aórtica. Estas discrepancias entre anatomía y función respaldan el concepto de que el strain de la AI puede ser un marcador temprano de disfunción de la AI y deterioro clínico que aporte un valor pronóstico adicional al de las dimensiones de la AI. Los resultados resaltan un posible nuevo papel del análisis del strain de la AI en los pacientes con estenosis aórtica grave, en especial aquellos con AI no dilatada, cuya función podría ser mejor que una evaluación del riesgo de FA tras la SVA basada únicamente en el tamaño. Las guías de la Sociedad Europea de Cardiología, tanto sobre FA como sobre valvulopatías, proponen la aplicación de estrategias profilácticas destinadas a mantener el ritmo sinusal, como el empleo de bloqueadores beta y amiodarona, en la supervisión perioperatoria de los pacientes con estenosis aórtica e insuficiencia mitral; sin embargo, no se hacen recomendaciones específicas1,31. En este artículo se propone que el análisis funcional de la AI en la evaluación preoperatoria de los pacientes con estenosis aórtica podría permitir la identificación de los pacientes con mayor riesgo de FA, en especial los indetectables mediante la evaluación ecocardiográfica estándar y, por consiguiente, podría ser útil a los médicos para individualizar las estrategias profilácticas en función del riesgo específico de cada paciente. No obstante, los resultados deberán validarse en estudios controlados y aleatorizados o en estudios observacionales multicéntricos.
Puntos fuertes y limitacionesHasta donde se sabe, este es el estudio más amplio en el que se haya investigado la asociación entre la función de la AI evaluada mediante STE y la aparición de FA después de la SVA. Se seleccionó una muestra homogénea de pacientes con estenosis aórtica grave aplicando estrictos criterios de inclusión y exclusión, lo cual aporta notables validez interna y reproducibilidad dentro de esta población.
Por lo que respecta a las limitaciones del estudio, aunque se excluyó a los pacientes con una FA previa, no se puede descartar por completo la existencia de eventos de FA paroxística no documentados, dado el carácter paroxístico y a menudo asintomático de este trastorno, en especial en los pacientes ancianos. Además, a pesar de un origen más frecuente en la AI, la FA podría haberse desencadenado también por alteraciones en el tamaño y la función de la aurícula derecha, posiblemente a causa de una enfermedad pulmonar concomitante6. Sin embargo, puesto que se excluyó a los pacientes con hipertensión pulmonar moderada o grave y la FA no se asoció con dilatación de la aurícula derecha o con la función del ventrículo derecho, creemos que la contribución de las anomalías de la aurícula derecha no fue importante.
CONCLUSIONESEn la estenosis aórtica grave, el deterioro de las funciones de reservorio y de bomba de la AI predijo la aparición de FA de novo tras la SVA independientemente de la dilatación de la AI. Estos resultados refuerzan la evidencia previa que respalda el concepto de que el análisis de STE puede ser un útil biomarcador por imagen pronóstico de varios resultados cardiovasculares, en especial en la evaluación preoperatoria de pacientes con estenosis aórtica sintomática grave.
FINANCIACIÓNJ. Mancio cuenta con el apoyo de la Fundação Portuguesa para a Ciência e Tecnologia (SFRH/BD/104369/2014) y la Sociedade Portuguesa de Cardiologia (Bolsa de investigação João Porto).
CONFLICTO DE INTERESESNo se declara ninguno.
- –
En estudios previos se ha propuesto el uso del análisis por STE de la función de la AI para predecir el riesgo de FA de nuevo comienzo tras la cirugía cardiaca. Sin embargo, los datos disponibles sobre pacientes sometidos a SVA son todavía escasos y no se ha establecido aún el papel de la evaluación funcional de la AI en este contexto.
- –
En la estenosis aórtica grave, el deterioro de la función de la AI evaluada mediante el strain de la AI predijo la aparición de FA después de la SVA independientemente de la dilatación de la AI. Estos resultados respaldan el papel del análisis del strain de la AI como útil biomarcador por imagen. En el futuro, es posible que el análisis del strain pueda usarse para seleccionar a los pacientes que podrían obtener un efecto beneficioso con los tratamientos profilácticos que permiten reducir la carga de FA posoperatoria.
Los autores agradecen la contribución vital de los profesionales de los departamentos de Cardiología y Cirugía Cardiotorácica del Centro Hospitalar Vila Nova de Gaia e Espinho.