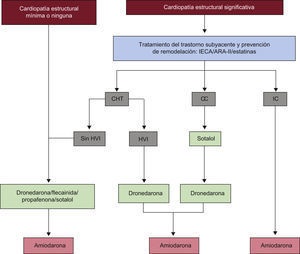
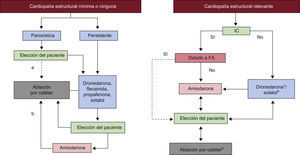
Las guías resumen y evalúan todas las pruebas disponibles en el momento de la redacción sobre una cuestión en especial con el objetivo de ayudar a los médicos a escoger las mejores estrategias de manejo para cada paciente con determinada enfermedad, teniendo en cuenta el impacto en los resultados y el balance riesgo-beneficio de un diagnóstico o un medio terapéutico determinados. Las guías no sustituyen a los libros de texto y cubren los temas principales de la Sociedad Europea de Cardiología (ESC). Las implicaciones legales de las guías médicas se han presentado previamente.
Tanto la ESC como otras sociedades y organizaciones han publicado varias guías en los últimos años. Debido al impacto en la práctica clínica, se han establecido criterios de calidad para el desarrollo de las guías para tomar decisiones que sean transparentes para el usuario. Las recomendaciones para crear y publicar las guías de la ESC están disponibles en la página web de la ESC (http://www.escardio.org/guidelinessurveys/esc-guidelines/about/Pages/rules-writing.aspx).
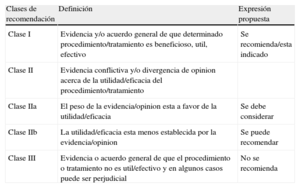
En resumen, se selecciona a expertos en el campo que llevan a cabo una revisión exhaustiva de las pruebas publicadas para el manejo o la prevención de un trastorno específico. Se realiza una evaluación crítica de los procedimientos diagnósticos y terapéuticos, incluida la valoración del balance riesgo-beneficio. Cuando se ha dispuesto de datos, se incluye también una estimación de resultados sanitarios para sociedades más grandes. Se valora el nivel de evidencia y el grado de recomendación de una opción terapéutica particular de acuerdo con escalas predefinidas, tal como se indica en las tablas 1 y 2.
Clases de recomendación
| Clases de recomendación | Definición | Expresión propuesta |
| Clase I | Evidencia y/o acuerdo general de que determinado procedimiento/tratamiento es beneficioso, util, efectivo | Se recomienda/esta indicado |
| Clase II | Evidencia conflictiva y/o divergencia de opinion acerca de la utilidad/eficacia del procedimiento/tratamiento | |
| Clase IIa | El peso de la evidencia/opinion esta a favor de la utilidad/eficacia | Se debe considerar |
| Clase IIb | La utilidad/eficacia esta menos establecida por la evidencia/opinion | Se puede recomendar |
| Clase III | Evidencia o acuerdo general de que el procedimiento o tratamiento no es util/efectivo y en algunos casos puede ser perjudicial | No se recomienda |
Niveles de evidencia
| Nivel de evidencia A | Datos procedentes de multiples ensayos clinicos aleatorizados o metaanalisis |
| Nivel de evidencia B | Datos procedentes de un unico ensayo aleatorizado y controlado o de estudios no aleatorizados a gran escal |
| Nivel de evidencia C | Consenso de opinion de expertos y/o estudios a pequena escala, estudios retrospectivos, registros |
Los expertos del Grupo de Trabajo han declarado por escrito cualquier posible relación que se pueda considerar conflicto de intereses real o potencial. Estas declaraciones escritas se conservan en los archivos de la European Heart House, la sede central de la ESC. Durante el periodo de redacción, cualquier modificación en las relaciones que se pueda considerar conflicto de intereses debe ser notificada a la ESC. La ESC financió en su totalidad el informe del Grupo de Trabajo, sin ninguna participación de fabricantes de fármacos, dispositivos o equipo quirúrgico.
El Comité de la ESC de Guías de Práctica Clínica (CGPC) supervisa y coordina la elaboración de las nuevas guías redactadas por los Grupos de Trabajo, grupos de expertos o paneles de consenso. El Comité también es responsable del proceso de aprobación de estas guías. Una vez se termina el documento y se aprueba por todos los expertos del Grupo de Trabajo, se envía a especialistas externos para su revisión. El CGPC revisa y da aprobación final al documento y después lo publica.
Después de su publicación, es primordial que se produzca la difusión del mensaje. Para ello, resulta de ayuda la publicación de versiones de bolsillo o versiones que se pueda descargar a PDA. Sin embargo, algunos sondeos han demostrado que los usuarios a los que van dirigidas estas guías a menudo no conocen su existencia o simplemente no las ponen en práctica. Por lo tanto, los programas de implementación de las nuevas guías son un importante componente de la difusión de conocimientos. La ESC organiza congresos dirigidos a sus sociedades nacionales miembro e importantes líderes de opinión de toda Europa. Los congresos de implementación también pueden tener lugar en cada país después de que las sociedades miembro de la ESC hayan aprobado las guías y las hayan traducido al idioma de cada país. Los programas de implementación son necesarios porque se ha demostrado que el resultado de la enfermedad puede beneficiarse de la aplicación minuciosa de las recomendaciones clínicas.
De este modo, la tarea de redactar guías cubre no sólo la integración de la investigación más reciente, sino también la creación de herramientas educativas y programas de aplicación para las recomendaciones. El lazo entre la investigación clínica, la redacción de las guías y su aplicación en la práctica clínica únicamente puede completarse si las encuestas y los registros se realizan para verificar que la práctica diaria de la vida real va acorde con lo que se recomienda en estas guías. Encuestas y registros también permitirán evaluar el impacto de la aplicación de las guían en los resultados del paciente. Las guías y recomendaciones deben ayudar a los médicos a tomar decisiones es su práctica diaria; no obstante, la decisión final sobre el cuidado de un paciente individual debe tomarla el médico encargado de su cuidado.
INTRODUCCIÓNLa estimación actual de la prevalencia de la fibrilación auricular (FA) en el mundo desarrollado es de aproximadamente un 1,5-2% de la población general, y la media de edad del paciente que sufre este trastorno ha ido aumentando paulatinamente, de tal forma que actualmente la media se sitúa entre 75 y 85 años. La arritmia se asocia a un riesgo 5 veces mayor de accidente cerebrovascular (ACV), una incidencia 3 veces mayor de insuficiencia cardiaca (IC) congestiva y mayor mortalidad. La hospitalización de pacientes con FA también es muy común. Este tipo de arritmia es todo un desafío cardiovascular en la sociedad moderna, y se cree que sus aspectos médicos, sociales y económicos empeorarán durante las próximas décadas. Afortunadamente, durante los últimos años se ha diseñado una serie de tratamientos que pueden ofrecer soluciones a este problema.
En 2010, cuando las «Guías de la ESC sobre el manejo de la fibrilación auricular» se publicaron por primera vez1, ya se sabía que sería necesaria una actualización en 2012, puesto que, por ejemplo, se avanzó la aprobación de varios fármacos nuevos por las autoridades reguladoras europeas, como vernakalant y dabigatrán. Además, se esperaban informes procedentes de importantes ensayos clínicos de nuevos anticoagulantes orales (NACO), como los estudios AVERROES2, ROCKET-FA3 y ARISTOTLE4, que allanasen todavía más el camino a posibles aprobaciones reguladoras. Lo que no se esperaba necesariamente era el abandono temprano del estudio PALLAS sobre dronedarona5 o los informes de hepatoxicidad de dicho fármaco.
La American College of Cardiology Foundation (ACCF), la American Heart Association (AHA) y la Heart Rhythm Society (HRS) han publicado conjuntamente dos actualizaciones importantes, una sobre la dronedarona y la ablación auricular izquierda6 y otra centrada en dabigatrán7. A principios de 2012, el American College of Chest Physicians (ACCP) publicó su novena versión del tratamiento antitrombótico contra la fibrilación auricular8, y los redactores de las guías de la Canadian Cardiovascular Society han publicado una actualización detallada de sus guías sobre FA9. Asimismo, el National Institute for Health and Clinical Excellence del Reino Unido (NICE) y la ACCF, la AHA y la HRS tienen la intención de reescribir por completo sus guías sobre FA en un futuro próximo.
La investigación de los resultados clínicos de la FA sigue a buen ritmo. Asimismo, se ha obtenido considerablemente más experiencia clínica en el terreno de la anticoagulación, el cierre de la orejuela, el uso de fármacos antiarrítmicos para la cardioversión y el control del ritmo cardiaco y la ablación auricular izquierda10. Estas cinco áreas constituyen la mayor parte de las revisiones de nuestras recomendaciones.
Detección de la fibrilación auricularDiagnosticar la FA antes de que aparezcan las primeras complicaciones es una prioridad reconocida para prevenir los ACV11. Los datos recientes obtenidos de pacientes con dispositivos implantados12 y mediante electrocardiogramas (ECG) Holter en estudios epidemiológicos13 refuerzan el supuesto de que incluso los episodios cortos de FA «silente» conllevan mayor riesgo de ACV. Por lo tanto, para la detección precoz de la FA, recomendamos realizar un oportuno cribado de FA mediante palpación del pulso, seguido de un registro de ECG en pacientes > 65 años para verificar el diagnóstico14,15.
Punto clave- •
Es importante realizar el oportuno cribado mediante palpación del pulso, seguido de un ECG en los pacientes de edad ≥ 65 años con pulso irregular para detectar la FA antes del primer ACV.
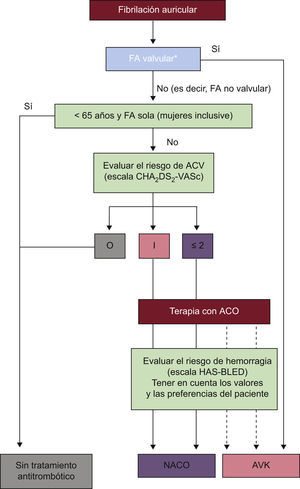
Es habitual dividir la FA en casos que se describen como «valvular» o «no valvular». No existe una definición uniforme o satisfactoria de estos términos. En esta guía, el término FA no valvular se utiliza para dar a entender que la FA está relacionada con enfermedad valvular reumática (predominantemente la estenosis mitral) o con prótesis de valvula aortica.
Desde la publicación de las Guías de la ESC de 2010, pruebas adicionales han reforzado el uso del abordaje basado en factores de riesgo para la estratificación del riesgo de ACV propuesto en esa guía, prestando más atención a identificar a los pacientes de «riesgo verdaderamente bajo» que no necesitan ningún tratamiento antitrombótico y más pruebas sobre el uso de NACO (véase a continuación) como alternativas al tratamiento con un antagonista de la vitamina K (AVK) a dosis ajustada (p. ej., warfarina, cociente internacional normalizado [INR] 2,0-3,0)16.
El riesgo de ACV es un proceso continuo y el valor predictivo de clasificar artificialmente a los pacientes con FA en estratos de riesgo leve, moderado y alto apenas tiene valor predictivo sólo para identificar la categoría de «alto riesgo» de los pacientes que más tarde pueden sufrir un ACV17. Hasta hace poco, el único anticoagulante oral (ACO) disponible era de la clase de los AVK (p. ej., warfarina) y, a pesar de sus limitaciones, muchos médicos continuaban recetando el tratamiento con AVK en porcentajes muy similares, independientemente de la clasificación en estratos de riesgo leve, moderado y alto; si no se utilizaba AVK, a menudo se prescribía ácido acetilsalicílico (AAS)18,19 en su lugar.
La evidencia sobre la prevencion eficaz de ACV con AAS en la FA son debiles, con potencial danonio20–22, puesto que los datos indican que el riesgo de hemorragias graves o hemorragias intracraneales (HIC) con AAS no es significativamente distinto que con los ACO, especialmente para los ancianos2,23–25. Dada la disponibilidad de los NACO, el uso de la terapia antiplaquetaria (como la terapia combinada con AAS-clopidogrel o, menos eficaz, AAS en monoterapia) para prevenir los ACV en la FA deberia limitarse a unos pocos pacientes que se niegan a tomar ninguna forma de ACO. La terapia combinada AAS-clopidogrel tiene una eficacia adicional, en comparacion con AAS en monoterapia, pero un riesgo adicional de hemorragia grave26. Asi, AAS en monoterapia deberia limitarse a pacientes que se niegan a tomar un ACO y no pueden tolerar la terapia combinada de AAS-clopidogrel, por ejemplo, debido al riesgo de hemorragia excesiva. No hay evidencias del descenso de la mortalidad cardiovascular o total con AAS (o farmacos antiplaquetarios) en la poblacion con FA. Incluso en las poblaciones sin FA, la profilaxis con AAS en personas sin antecedentes de enfermedad cardiovascular no resulta en descensos de la mortalidad cardiovascular o por cancer, y los beneficios en los infartos de miocardio no fatal se ven aun mas contrarrestados por episodios hemorragicos clinicamente importantes27.
Así pues, estas guías recomiendan enérgicamente un cambio de práctica y prestar más atención a identificar a los pacientes de «riesgo verdaderamente bajo» con FA (es decir, edad < 65 y FA sola, que no necesitan ningún tratamiento antitrombótico), en lugar de intentar centrarse en identificar a los pacientes de «alto riesgo». Para conseguir esto en vez de excluir, es necesario incluir más factores de riesgo comunes del ACV como parte de cualquier evaluación integral del riesgo de ACV. De hecho, se recomienda que los pacientes con FA con uno o más factores de riesgo de ACV reciban una terapia eficaz de prevención de ACV, que esencialmente consiste en ACO, ya sea terapia con AVK bien controlada (INR 2-3, con largo tiempo en ventana terapéutica (TTR), p. ej., ≥ 70%)28 o con uno de los NACO.
Mientras que la escala CHADS2 (insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75, diabetes mellitus, ACV [doble]) es simple29, ahora la mayoría concuerda en que no incluye muchos factores de riesgo comunes del ACV y se han destacado sus limitaciones30,31. La escala CHADS2 también se basa en factores de riesgo identificados en bases de datos de pacientes no tratados con AVK en ensayos históricos sobre la prevención de ACV en FA llevados a cabo hace dos décadas. En esos ensayos, se incluyó a menos del 10% de los pacientes que participaron y muchos factores de riesgo de ACV se definieron de manera incoherente o no se registraron sistemáticamente17. Por ejemplo, la enfermedad vascular (no incluida en la escala CHADS2) es un factor independiente de riesgo de ACV en la FA y mejora significativamente la capacidad predictiva de la escala CHADS232–34. El riesgo de ACV también aumenta a partir de los 65 años, y es aún mayor a los 75 años o más32,35,36.
Muchos pacientes clasificados de ≪bajo riesgo≫ con la escala CHADS2 (puntuacion = 0) tienen tasas de ACV > 1,5%/ano29,36, y una puntuacion 0 en la escala CHADS2 no identifica de manera fiable a los pacientes que padecen FA y son de ≪riesgo verdaderamente bajo≫37,38.
Las Guías de la ESC sobre FA de 20101 restan importancia al uso de estratos de riesgo bajo, moderado y alto artificiales y recomiendan un abordaje basado en el factor de riesgo que defina factores de riesgo «importantes» y «clínicamente relevantes no importantes», que se puede expresar con el acrónimo CHA2DS2-VASc (insuficiencia cardiaca congestiva/disfunción ventricular izquierda, hipertensión, edad ≥ 75 [doble], diabetes mellitus, ACV [doble]-enfermedad vascular, edad 65-74 y categoría de sexo [mujer])39.
Dado que las guías deberían aplicarse a la mayoría de los pacientes con FA durante la mayor parte del tiempo y en la mayoría de las situaciones de la práctica clínica diaria, la Guía de la ESC sobre el abordaje de la evaluación del riesgo de ACV cubre a la mayoría de los pacientes con FA atendidos y tiene en cuenta los factores de riesgo de ACV comunes en estos pacientes. El tratamiento antitrombótico no se recomienda para pacientes con FA (independientemente del sexo) de edad < 65 años y FA sola (es decir, de «riesgo verdaderamente bajo»), ya que estos tienen tasas de eventos absolutos muy bajas.
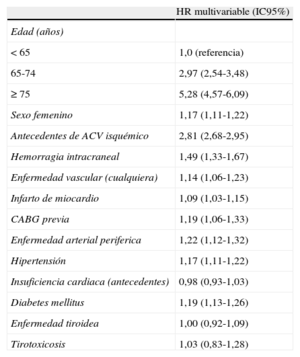
La escala CHA2DS2-VASc incluye los factores de riesgo de ACV mas comunes en la practica clinica diaria39–41. Al contrario que los datos mas antiguos, conflictivos e insuficientes, la enfermedad tiroidea (o hipertiroidismo) no se considera factor independiente de riesgo de ACV en analisis multivariable (tabla 3)25. Contar con antecedentes de ≪cualquier tipo de IC≫ per se no se define sistematicamente como factor de riesgo25–40, y la C del CHA2DS2-VASc hace referencia a la disfuncion sistolica de moderada a grave documentada (es decir, IC con fraccion de eyeccion baja [IC-FEB])42,43 o pacientes con IC descompensada reciente que requieren hospitalizacion, independientemente de la fraccion de eyeccion (es decir, tanto IC-FEB como IC con fraccion de eyeccion conservada [IC-FEC])43. El sexo femenino aumenta independientemente el riesgo de ACV en general (tabla 3)40,44,45, a menos que el criterio de ≪edad < 65 y FA sola≫ se cumpla con claridad, en cuyo caso el sexo femenino no aumenta independientemente el riesgo del ACV33,44. Ademas, las tasas de ACV en estos pacientes (edad < 65 y FA sola) son tan bajas en ambos sexos que no se recomienda el tratamiento antitrombotico. De este modo, las mujeres, siendo unicamente el sexo el factor de riesgo (puntuacion CHA2DS2-VASc de apenas 1) no necesitarian anticoagulacion si cumplen claramente el criterio ≪edad < 65 y FA sola≫, como se ha confirmado en estudios recientes33,44.
Factores de riesgo de ACV isquemico/AIT/embolia sistemica en pacientes con FA: el estudio Swedish Cohort Atrial Fibrillation (adaptado de Friberg et al25)
| HR multivariable (IC95%) | |
| Edad (años) | |
| < 65 | 1,0 (referencia) |
| 65-74 | 2,97 (2,54-3,48) |
| ≥ 75 | 5,28 (4,57-6,09) |
| Sexo femenino | 1,17 (1,11-1,22) |
| Antecedentes de ACV isquémico | 2,81 (2,68-2,95) |
| Hemorragia intracraneal | 1,49 (1,33-1,67) |
| Enfermedad vascular (cualquiera) | 1,14 (1,06-1,23) |
| Infarto de miocardio | 1,09 (1,03-1,15) |
| CABG previa | 1,19 (1,06-1,33) |
| Enfermedad arterial periferica | 1,22 (1,12-1,32) |
| Hipertensión | 1,17 (1,11-1,22) |
| Insuficiencia cardiaca (antecedentes) | 0,98 (0,93-1,03) |
| Diabetes mellitus | 1,19 (1,13-1,26) |
| Enfermedad tiroidea | 1,00 (0,92-1,09) |
| Tirotoxicosis | 1,03 (0,83-1,28) |
ACV: accidente cerebrovascular; AIT: accidente isquemico transitorio; CABG: cirugia de revascularizacion coronaria; FA: fibrilacion auricular; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
Mientras que los AIT en si son un objetivo poco robusto, confirmar el diagnostico implicaria un riesgo similar al de ACV o embolia sistemica. Analisis multivariable basado en 90.490 pacientes sin tratamiento anticoagulante durante el seguimiento.
Desde entonces, la escala CHA2DS2-VASc se ha validado en multiples cohortes17; la evidencia acumulada demuestra que CHA2DS2VASc es mejor a la hora de identificar a pacientes de ≪riesgo verdaderamente bajo≫ con FA37,38,46,47 y es igual de buena, y posiblemente mejor, que escalas como la CHADS2 para identificar a pacientes que sufren ACV y tromboembolias25,36,48. Entre los pacientes con puntuacion 0 en CHADS2, las tasas de eventos al cabo de 1 ano pueden variar entre el 0,84% (CHA2DS2-VASc = 0), el 1,75% (CHA2DS2-VASc = 1), el 2,69% (CHA2DS2-VASc = 2) y el 3,2% (CHA2DS2-VASc = 3)38. Tambien, la escala CHA2DS2-VASc refina la evaluacion del riesgo de ACV en pacientes con FA de ≪bajo riesgo≫ tras la ablacion49.
Los pacientes con FA e insuficiencia renal grave tienen alto riesgo de padecer ACV, pero tambien tienen mayor riesgo de fallecer o sufrir eventos coronarios y hemorragia grave. No se ha estudiado adecuadamente a estos pacientes, se los ha excluido de los ensayos clinicos, y evaluar su riesgo es complejo50. Tambien se ha advertido que la funcion renal puede no permanecer estatica, especialmente en pacientes ancianos con FA y multiples comorbilidades y tratamientos farmacologicos concomitantes.
Para tomar la decision de la tromboprofilaxis, primero es necesario evaluar el riesgo de ACV frente al riesgo de hemorragia grave, especialmente HIC, que es la complicacion mas temida del tratamiento anticoagulante y confiere un alto riesgo de muerte y discapacidad51. Hasta hace poco, las herramientas para evaluar el riesgo de hemorragia se basaban en formulas complejas con ciertos factores de riesgo ponderados de distintas maneras o derivados de cohortes de pacientes anticoagulados, en lugar de pacientes con FA especificamente52. De las escalas de riesgo hemorragico disponibles, solo tres proceden de poblaciones con FA y estan validadas: el estudio HEMORR2HAGES53, el estudio HAS-BLED54 y el estudio ATRIA55.
Las Guias de la ESC sobre FA de 20101, las Guias de la Canadian Cardiovascular Society (actualizadas recientemente)9,56 y el documento de consenso sobre hemorragia en la FA, elaborado por la European Heart Rhythm Association (EHRA) y el Grupo de Trabajo de la ESC sobre Trombosis52, recomendaban el uso de la escala de evaluacion del riesgo de hemorragia HAS-BLED, mas simple, en lugar de la escala HEMORR2HAGES, mas complicada, o la ATRIA, menos practica. La escala HAS-BLED cuenta con un valor predictivo mejor que la escala ATRIA y, lo que es mas importante, destaca los factores de riesgo que se puede tratar activamente para reducir el riesgo de hemorragia57,58. La escala HAS-BLED se ha validado en varias cohortes independientes25,54,59–61 y se correlaciona bien con el riesgo de HIC. Es digno de mencion que la tasa de HIC (y hemorragia grave) entre los pacientes tratados con AAS, a igual puntuacion HAS-BLED, era similar a la de quienes tomaban warfarina25.
Por lo tanto, se recomienda una evaluacion formal del riesgo hemorragico para todos los pacientes con FA, y para los pacientes con puntuacion HAS-BLED ≥ 3, se recomienda precaucion y revisiones regulares, asi como esfuerzos para corregir los factores de riesgo hemorragico reversibles. La escala HAS-BLED per se no deberia utilizarse para excluir a los pacientes del tratamiento con ACO, pero permite a los facultativos realizar una evaluacion respaldada del riesgo de hemorragia (en lugar de confiar en conjeturas) y, lo que es mas importante, les hace pensar en los factores de riesgo hemorragico corregibles: por ejemplo, presion arterial incontrolada, uso concomitante de AAS/antiinflamatorios no esteroideos (AINE), INR ≪labil≫, etc. Recientemente se ha revisado el uso de las escalas CHA2DS2-VASc y HAS-BLED para ayudar en la toma de decisiones practicas para la tromboprofilaxis en la FA no valvular62.
En el analisis de Olesen et al21 sobre los beneficios clinicos netos sopesando el ACV isquemico frente a la HIC, los pacientes con puntuacion HAS-BLED alta tuvieron un beneficio clinico neto incluso mayor con warfarina, dado que las personas en mayor riesgo tendrian con warfarina una reduccion absoluta del riesgo de ACV mucho mayor, que sobrepasaria el pequeno aumento absoluto de hemorragias graves. Friberg et al63 describieron observaciones similares en una base de datos mucho mayor, donde el beneficio clinico neto ajustado favorecio la anticoagulacion en casi todos los pacientes con FA, a excepcion de los pacientes con muy bajo riesgo de ACV isquemico, con CHA2DS2-VASc = 0 y un riesgo hemorragico de moderado a grave. En dos extensas bases de datos independientes21,63, la escala CHA2DS2-VASc fue capaz de identificar a los pacientes que tenian algun perjuicio con el tratamiento anticoagulante con warfarina. Curiosamente, la escala CHADS2 discrimino menos a los pacientes de ≪riesgo verdaderamente bajo≫, pues parece que todos los pacientes con FA, independientemente de la puntuacion CHADS2, se beneficiaban con los anticoagulantes63.
Las pruebas adicionales resaltan que la prevencion de ACV con AVK es eficaz cuando el TTR medio individual es bueno (p. ej., > 70%)28,64–67. Por lo tanto, cuando se utiliza AVK, es necesario esforzarse en mejorar la calidad del control del INR para conseguir TTR mas largos.
NUEVOS ANTICOAGULANTES ORALESLos NACO para la prevención de ACV en la FA se dividen en dos clases: inhibidores directos de la trombina por vía oral (p. ej., dabigatrán) e inhibidores directos del factor Xa por vía oral (p. ej., rivaroxabán, apixabán, etc.)68. En contraposición a los AVK, que bloquean la formación de múltiples factores activos de la coagulación dependientes de vitamina K (factores II, VII, IX y X), estos fármacos bloquean la actividad de un único paso en la coagulación. El edoxabán es otro inhibidor del factor Xa por vía oral que tiene en curso un ensayo de fase III a gran escala que probablemente se publicará en 201369.
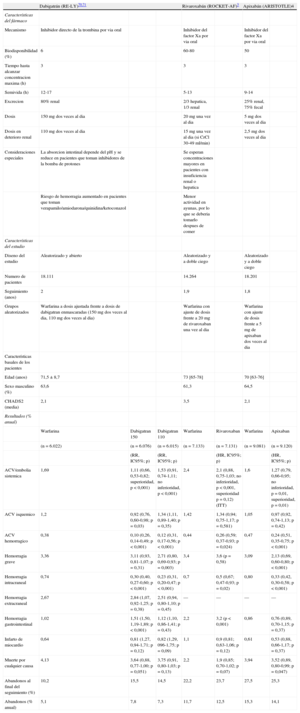
Dabigatrán etexilatoEl ensayo RE-LY fue un ensayo en fase III prospectivo, aleatorizado y abierto en el que se comparo enmascaradamente dos dosis de dabigatran etexilato (110mg dos veces al dia [D110] o 150mg dos veces al dia [D150]) con una dosis ajustada de warfarina sin enmascaramiento para conseguir un INR 2-3 (tabla 4)70,71. Para el punto final primario de eficacia de ACV y embolia sistemica, el D150 fue superior a la warfarina, sin diferencia significativa en el punto final primario de seguridad de hemorragia grave. El D110 no fue inferior a la warfarina, con un 20% de hemorragias graves menos. Las tasas de ACV hemorragico y HIC fueron inferiores con ambas dosis de dabigatran, pero la hemorragia gastrointestinal aumento significativamente con el D150. Se registro un aumento numerico no significativo (del 28%) en infartos de miocardio (IM) con ambas dosis de dabigatran71,72. Con el D150, hubo una reduccion significativa en ACV isquemico, un descenso limite en la mortalidad por cualquier causa (p = 0,051) y un descenso significativo en la mortalidad vascular (p = 0,04). Las tasas de abandono fueron mas elevadas con el D150 (20,7%) y el D110 (21,2%), en comparacion con el 16,6% registrado con warfarina a los 2 anos. Un analisis post-hoc ha registrado una significativa interaccion con la edad, de modo que con el D110 los pacientes mayores de 75 anos tenian tasas de hemorragia grave similares que con warfarina, con tendencia hacia mas hemorragia con D150; no obstante, las HIC fueron menos con ambas dosis de dabigatran. La eficacia y la seguridad de dabigatran concordaron en todos los estratos de riesgo CHADS273. La exposicion previa a los AVK no influye en los beneficios de ambas dosis de dabigatran en comparacion con warfarina74.
Resumen de los ensayos clinicos sobre los nuevos anticoagulantes frente a warfarina para la prevencion de ACV en la FA no valvular
| Dabigatrán (RE-LY)70,71 | Rivaroxabán (ROCKET-AF)3 | Apixabán (ARISTOTLE)4 | |||||
| Características del fármaco | |||||||
| Mecanismo | Inhibidor directo de la trombina por via oral | Inhibidor del factor Xa por via oral | Inhibidor del factor Xa por via oral | ||||
| Biodisponibilidad (%) | 6 | 60-80 | 50 | ||||
| Tiempo hasta alcanzar concentracion maxima (h) | 3 | 3 | 3 | ||||
| Semivida (h) | 12-17 | 5-13 | 9-14 | ||||
| Excrecion | 80% renal | 2/3 hepatica, 1/3 renal | 25% renal, 75% fecal | ||||
| Dosis | 150 mg dos veces al dia | 20 mg una vez al dia | 5 mg dos veces al dia | ||||
| Dosis en deterioro renal | 110 mg dos veces al dia | 15 mg una vez al dia (si CrCl 30-49 ml/min) | 2,5 mg dos veces al dia | ||||
| Consideraciones especiales | La absorcion intestinal depende del pH y se reduce en pacientes que toman inhibidores de la bomba de protones | Se esperan concentraciones mayores en pacientes con insuficiencia renal o hepatica | |||||
| Riesgo de hemorragia aumentado en pacientes que toman verapamilo/amiodarona/quinidina/ketoconazol | Menor actividad en ayunas, por lo que se deberia tomarlo despues de comer | ||||||
| Características del estudio | |||||||
| Diseno del estudio | Aleatorizado y abierto | Aleatorizado y a doble ciego | Aleatorizado y a doble ciego | ||||
| Numero de pacientes | 18.111 | 14.264 | 18.201 | ||||
| Seguimiento (anos) | 2 | 1,9 | 1,8 | ||||
| Grupos aleatorizados | Warfarina a dosis ajustada frente a dosis de dabigatran enmascaradas (150 mg dos veces al dia, 110 mg dos veces al dia) | Warfarina con ajuste de dosis frente a 20 mg de rivaroxaban una vez al dia | Warfarina con ajuste de dosis frente a 5 mg de apixaban dos veces al dia | ||||
| Características basales de los pacientes | |||||||
| Edad (anos) | 71,5 ± 8,7 | 73 [65-78] | 70 [63-76] | ||||
| Sexo masculino (%) | 63,6 | 61,3 | 64,5 | ||||
| CHADS2 (media) | 2,1 | 3,5 | 2,1 | ||||
| Resultados (% anual) | |||||||
| Warfarina | Dabigatran 150 | Dabigatran 110 | Warfarina | Rivaroxaban | Warfarina | Apixaban | |
| (n = 6.022) | (n = 6.076) | (n = 6.015) | (n = 7.133) | (n = 7.131) | (n = 9.081) | (n = 9.120) | |
| (RR, IC95%; p) | (RR, IC95%; p) | (HR, IC95%; p) | (HR, IC95%; p) | ||||
| ACV/embolia sistemica | 1,69 | 1,11 (0,66, 0,53-0,82; superioridad, p < 0,001) | 1,53 (0,91, 0,74-1,11; no inferioridad, p < 0,001) | 2,4 | 2,1 (0,88, 0,75-1,03; no inferioridad, p < 0,001, superioridad p = 0,12) (ITT) | 1,6 | 1,27 (0,79, 0,66-0,95; no inferioridad, p = 0,01, superioridad, p = 0,01) |
| ACV isquemico | 1,2 | 0,92 (0,76, 0,60-0,98; p = 0,03) | 1,34 (1,11, 0,89-1,40; p = 0,35) | 1,42 | 1,34 (0,94; 0,75-1,17; p = 0,581) | 1,05 | 0,97 (0,92, 0,74-1,13; p = 0,42) |
| ACV hemorragico | 0,38 | 0,10 (0,26, 0,14-0,49; p < 0,001) | 0,12 (0,31, 0,17-0,56; p < 0,001) | 0,44 | 0,26 (0,59; 0,37-0,93; p = 0,024) | 0,47 | 0,24 (0,51, 0,35-0,75; p < 0,001) |
| Hemorragia grave | 3,36 | 3,11 (0,93, 0,81-1,07; p = 0,31) | 2,71 (0,80, 0,69-0,93; p = 0,003) | 3,4 | 3,6 (p = 0,58) | 3,09 | 2,13 (0,69, 0,60-0,80; p < 0,001) |
| Hemorragia intracraneal | 0,74 | 0,30 (0,40, 0,27-0,60; p < 0,001) | 0,23 (0,31, 0,20-0,47; p < 0,001) | 0,7 | 0,5 (0,67; 0,47-0,93; p = 0,02) | 0,80 | 0,33 (0,42, 0,30-0,58; p < 0,001) |
| Hemorragia extracraneal | 2,67 | 2,84 (1,07, 0,92-1,25; p = 0,38) | 2,51 (0,94, 0,80-1,10; p = 0,45) | — | — | — | — |
| Hemorragia gastrointestinal | 1,02 | 1,51 (1,50, 1,19-1,89; p < 0,001) | 1,12 (1,10, 0,86-1,41; p = 0,43) | 2,2 | 3,2 (p < 0,001) | 0,86 | 0,76 (0,89, 0,70-1,15; p = 0,37) |
| Infarto de miocardio | 0,64 | 0,81 (1,27, 0,94-1,71; p = 0,12) | 0,82 (1,29, 096-1,75; p = 0,09) | 1,1 | 0,9 (0,81; 0,63-1,06; p = 0,12) | 0,61 | 0,53 (0,88, 0,66-1,17; p = 0,37) |
| Muerte por cualquier causa | 4,13 | 3,64 (0,88, 0,77-1,00; p = 0,051) | 3,75 (0,91, 0,80-1,03; p = 0,13) | 2,2 | 1,9 (0,85; 0,70-1,02; p = 0,07) | 3,94 | 3,52 (0,89, 0,80-0,99; p = 0,047) |
| Abandonos al final del seguimiento (%) | 10,2 | 15,5 | 14,5 | 22,2 | 23,7 | 27,5 | 25,3 |
| Abandonos (% anual) | 5,1 | 7,8 | 7,3 | 11,7 | 12,5 | 15,3 | 14,1 |
ACV: accidente cerebrovascular; AIT: accidente isquemico transitorio; AVK: antagonista de la vitamina K; CHADS2: insuficiencia cardiaca congestiva, hipertension, edad ≥ 75, diabetes mellitus, ACV/AIT (doble); CrCl: aclaramiento de creatinina; FA: fibrilacion auricular; HR: hazard ratio; IC95%: intervalo de confianza del 95%; ITT: intencion de tratar; RR: riesgo relativo.
Salvo otra indicacion, los datos expresan media ± desviacion estandar o mediana [intervalo intercuartilico].
La preocupacion generada por el pequeno aumento de IM con dabigatran motivo un analisis detallado en el que no hubo exceso de nuevas hospitalizaciones por anginas entre los pacientes tratados con dabigatran, con una mortalidad vascular y un beneficio clinico neto favorables a dabigatran72. Un metaanalisis de siete estudios de dabigatran frente a wararina (FA, tromboembolia venosa, etc.) con mas de 30.000 pacientes demostro un aumento significativo del 33% en IM, pero un descenso del 11% en la mortalidad por cualquier causa75. No obstante, esto podria reflejar un mejor efecto protector de la warfarina contra el IM76.
Segun los resultados del ensayo RE-LY, el dabigatran etexilato ha sido aprobado por la Food and Drug Administration (FDA) y la Agencia Europea del Medicamento (EMEA), asi como en muchos paises del mundo para prevenir el ACV y las embolias sistemicas. La indicacion de la EMEA es para pacientes con FA no valvular con al menos un factor de riesgo, concretamente: antecedentes de ACV, accidente isquemico transitorio (AIT) o embolia sistemica, FEVI < 40%, IC sintomatica y edad ≥ 75, o ≥ 65 anos con uno de los trastornos siguientes: diabetes mellitus, coronariopatia o hipertension. La FDA ha aprobado la dosis de 150mg dos veces al dia, y la dosis de 75mg dos veces al dia contra el deterioro renal grave, mientras que la EMEA ha aprobado tanto la dosis de 110mg dos veces al dia como la de 150mg dos veces al dia.
RivaroxabánEl ensayo aleatorizado y a doble ciego ROCKET-FA3 distribuyo aleatoriamente a 14.264 pacientes de alto riesgo con FA entre tratamiento con 20mg de rivaroxaban una vez al dia (15mg al dia para los pacientes con aclaramiento de creatinina [CrCl] estimado de 30-49ml/min) o warfarina (tabla 4). La poblacion tenia un riesgo considerablemente mayor de sufrir un ACV que en otros estudios sobre NACO en FA, y el TTR medio fue del 55% (mediana, 58%), menor que en otros ensayos aleatorizados. El rivaroxaban no fue inferior a la warfarina en el objetivo primario de ACV y embolia sistemica, y el analisis del tratamiento por protocolo consiguio superioridad estadistica (reduccion del riesgo relativo [RRR] del 21%; p = 0,015), pero utilizando el mas convencional analisis por intencion de tratar, el rivaroxaban no fue superior (p = 0,12). No hubo reduccion en las tasas de mortalidad o ACV isquemico, sino significativamente menos ACV hemorragico y HIC. El objetivo primario de seguridad era el compuesto de hemorragia grave y hemorragia no grave clinicamente relevante, que no fue significativamente distinto entre el rivaroxaban y la warfarina, pero con rivaroxaban hubo un descenso significativo en hemorragias mortales y un aumento en las hemorragias gastrointestinales y las que requirieron transfusion. El abandono temprano del tratamiento fue mas comun con rivaroxaban (23,9%) que con warfarina (22,4%).
Tanto la FDA como la EMEA han aprobado el rivaroxaban para la prevencion de ACV en la FA no valvular, igual que en otros paises de todo el mundo.
ApixabánEl ensayo AVERROES2 aleatorizo a 5.599 pacientes con FA —que no eran candidatos adecuados para AVK o se negaban a tomarlos— a un tratamiento a doble ciego y de doble simulacion con apixaban (5mg dos veces al dia con un ajuste de la dosis a 2,5mg dos veces al dia en pacientes de edad ≥ 80 anos, peso ≤ 60kg o creatinina serica ≥ 1,5mg/dl [133 mmol/l]) o AAS (81-324mg/dia, con un 91% tomando ≤ 162mg/dia). Tras un seguimiento medio de 1,1 anos, el ensayo se interrumpio prematuramente debido a un descenso significativo del 55% en el objetivo primario de ACV o embolia sistemica con apixaban en comparacion con AAS, sin diferencia significativa en las tasas de hemorragia grave o HIC entre apixaban y AAS. El apixaban se tolero ligeramente mejor y a los 2 anos la tasa de abandono permanente de los tratamientos del estudio se situo en el 20,5% anual en el grupo de AAS, frente al 17,9% anual en el grupo de apixaban (p = 0,03).
El ensayo ARISTOTLE4 fue un ensayo aleatorizado, a doble ciego y de doble simulacion en fase III, que comparo apixaban (5mg dos veces al dia con ajuste de la dosis a 2,5mg dos veces al dia en pacientes de edad ≥ 80 anos, peso ≤ 60kg o con creatinina serica ≥ 1,5mg/dl [133 mmol/l]) con el tratamiento con warfarina a dosis ajustada, cuyo objetivo consistia en conseguir un INR 2-3 en 18.201 pacientes con FA no valvular (tabla 4). Hubo un descenso significativo en el resultado de eficacia primaria de ACV o embolia sistemica del 21% con apixaban en comparacion con warfarina, con un descenso del 31% en hemorragias graves y un descenso significativo del 11% en mortalidad por cualquier causa (pero no en mortalidad cardiovascular). Las tasas de ACV hemorragico y HIC, pero no la de ACV isquemico, fueron significativamente mas bajas con apixaban que con warfarina. Las hemorragias gastrointestinales fueron similares en los grupos de tratamiento. El apixaban se tolero mejor que la warfarina, con ligeramente menos abandonos prematuros (el 25,3 frente al 27,5%). El apixaban todavia no ha conseguido la aprobacion de la EMEA y la FDA. Se incluye en esta guia porque podria aprobarse justo despues de su publicacion.
Consideraciones prácticasaTodos los NACO probados hasta ahora en ensayos clinicos han mostrado no inferioridad en comparacion con los AVK, con mas seguridad, pues siempre limitan el numero de HIC. Sobre esta base, esta guia ahora los recomienda sobre los AVK para la gran mayoria de los pacientes con FA no valvular utilizados tal y como se los ha estudiado en los ensayos clinicos realizados hasta ahora. Puesto que todavia se tiene poca experiencia con estos agentes, se recomienda encarecidamente cumplir estrictamente las indicaciones aprobadas y una cuidadosa vigilancia poscomercializacion.
A falta de ensayos comparativos directos, es inadecuado llegar a conclusiones definitivas sobre que NACO es el mejor, dada la heterogeneidad de los ensayos77. Los analisis comparativos indirectos no indican profundas divergencias entre NACO en los objetivos de eficacia, pero parece que hay menos hemorragias graves con 110mg de dabigatran dos veces al dia y apixaban77. Las caracteristicas del paciente, la tolerabilidad del farmaco y el coste pueden ser consideraciones importantes28. Se han publicado algunos datos de la relacion coste-eficacia de dabigatran en varios ambitos de atencion sanitaria, y parece ser que el dabigatran es rentable para la mayoria de los pacientes78–81, excepto en aquellos con INR muy bien controlado. Ademas, sigue habiendo dudas sobre la aplicabilidad de los datos de los NACO a pacientes muy ancianos, con multiples comorbilidades, polimedicados y con problemas de cumplimiento, etc., que suelen estar atendidos por medicos de atencion primaria. Ninguno de los nuevos ACO cuenta con un antidoto especifico; dabigatran y apixaban tienen regimenes de una dosis doble al dia, y son evidentes algunas interacciones farmacologicas. Se excluyo de estos ensayos a los pacientes con deterioro renal grave y, dabigatran en concreto tiene altas tasas de aclaramiento renal.
El beneficio clinico neto de los AVK, equilibrar los ACV isquemicos y las HIC en pacientes con FA no valvular, se ha inspirado en las tasas de ACV y hemorragias del estudio de cohorte nacional danes sobre dabigatran, rivaroxaban y apixaban, con base en los resultados de ensayos clinicos recientes sobre estos NACO82. Para CHA2DS2-VASc = 1, apixaban y ambas dosis de dabigatran (110mg dos veces al dia y 150mg dos veces al dia) arrojaron un beneficio clinico neto positivo, mientras que en los pacientes con CHA2DS2-VASc ≥ 2 los tres NACO fueron superiores a warfarina, con un beneficio clinico neto positivo independientemente del riesgo de hemorragia.
Al cambiar de un AVK a un NACO, se deberia permitir que el INR descendiese a aproximadamente 2,0 (hay diferencias transatlanticas y especificas de los NACO detalladas en los resumenes de las caracteristicas del producto y los prospectos, pero el principio es juzgar el efecto decreciente de la warfarina frente al efecto cada vez mas anticoagulante de los NACO) antes de iniciar el NACO, pues producen la rapida aparicion del efecto anticoagulante. Al cambiar de un NACO a un AVK, se deberia iniciar el tratamiento con el AVK tras un periodo que depende de la funcion renal; por ejemplo, con dabigatran se hace necesario el solapamiento con el AVK durante 2-3 dias, puesto que los AVK tardan unos dias en conseguir la anticoagulacion terapeutica.
La adherencia al tratamiento es crucial, especialmente porque estos farmacos tienen una semivida relativamente corta, y los pacientes se quedarian sin ninguna proteccion anticoagulante si se saltasen mas de una dosis. Todos estos farmacos son de excrecion renal en cierto grado, especialmente el dabigatran. Por lo tanto, la evaluacion de la funcion renal (mediante CrCl) es obligatoria con todo NACO, pero especialmente para los pacientes que toman dabigatran. De hecho, se deberia supervisar la funcion renal de los pacientes con funcion normal o (CrCl ≥ 80ml/min) o deterioro leve (CrCl 50-79ml/min), y tal vez dos o tres veces al ano la de los pacientes con deterioro renal moderado (CrCl 30-49ml/min). El dabigatran tambien puede causar dispepsia, que tal vez mejore si el farmaco se toma con alimentos o utilizando un inhibidor de la bomba de protones.
Los NACO no necesitan ajuste de la dosis sobre la base de una prueba de coagulacion especifica (a diferencia del INR para los AVK). Existen pruebas de coagulacion no especificas que se puede utilizar para comprobar si hay efecto de anticoagulacion (en lugar de una intensidad de anticoagulacion concreta)28,83. No se debe utilizarlas para ajustar la dosis. Para dabigatran, el tiempo de coagulacion de la ecarina y el tiempo de coagulacion de la trombina son pruebas utiles, y reflejan directamente la inhibicion de la trombina84; no obstante, tambien se puede utilizar un tiempo de tromboplastina parcial activado (TTPa) — especialmente en caso de urgencias—, aunque la correlacion no es lineal, especialmente en las concentraciones mas elevadas84,85. El rivaroxaban prolonga el tiempo de protrombina (TP), lo que podria utilizarse como una estimacion aproximada del efecto de anticoagulacion86. La prueba anti-Xa ofrece una estimacion mas precisa del efecto anticoagulante de los inhibidores orales del factor Xa86,87.
Estos nuevos farmacos no tienen antidotos especificos y el manejo de las hemorragias es mas que nada paliativo, ya que estos farmacos tienen una semivida relativamente corta (5-17h)85,88. Un pequeno estudio sugirio la normalizacion de la prueba de coagulacion con concentrado de complejo de protrombina no activado (Cofactw, Sanquin Blood Supply; Amsterdam, Paises Bajos) administrado a pacientes sanos y relativamente jovenes que tomaban rivaroxaban, pero no se observo ningun efecto con el dabigatran89. Otro estudio hallo que FEIBAR en dosis bajas (Baxter AG; Viena, Austria) revirtio la actividad anticoagulante de rivaroxaban y dabigatran90. No obstante, la ausencia de normalizacion de las pruebas de coagulacion no necesariamente se correlaciona con la ausencia de efecto antihemorragico, tal y como se ha demostrado en modelos animales84.
El manejo perioperatorio es otra consideracion importante88,91. Como la accion de dabigatran etexilato se inicia y termina rapidamente, no se necesita ningun tratamiento puente con heparina de bajo peso molecular (HBPM) en la mayoria de las intervenciones, aunque esto depende de equilibrar el riesgo de ACV/tromboembolias y el hemorragico (para lo que se ha demostrado util la escala HAS-BLED)92. Tras la cirugia, se puede volver a empezar el tratamiento con NACO tan pronto se haya conseguido una hemostasia eficaz. El efecto de los NACO sera evidente a las pocas horas de administrar la primera dosis.
Los datos disponibles indican que la cardioversion voluntaria puede realizarse de manera segura con dabigatran93, con el requisito de administrar 3 semanas de anticoagulacion terapeutica previa a la cardioversion, realizar la cardioversion y continuar la anticoagulacion durante un minimo de 4 semanas tras la cardioversion. Las tasas de eventos no fueron diferentes entre la cardioversion guiada por ecocardiograma transesofagico (ETT) y la convencional; no obstante, la adherencia al farmaco es crucial para el periodo de anticoagulacion pericardioversion, ya que, a diferencia del INR para los AVK, no hay un medio facil de evaluar la anticoagulacion terapeutica. En los pacientes con factores de riesgo de ACV o de alto riesgo de recurrencia, se deberia continuar el ACO a largo plazo, con un AVK o un NACO. Todavia no hay datos disponibles sobre la cardioversion con rivaroxaban o apixaban.
Actualmente no hay datos controlados sobre el perfil riesgos/beneficios de la ablacion por cateter con NACO ininterrumpidamente. La ablacion de un paciente que esta tomando NACO ininterrumpidamente, en teoria, conlleva un pequeno riesgo, dada la ausencia de un agente para la reversion en caso de que surja la complicacion de una hemorragia grave. Los datos procedentes de pequenas series de casos indican que el manejo adecuado tras la ablacion con dabigatran se asocia con bajo riesgo de complicaciones embolicas o hemorragicas94, aunque una breve interrupcion de dabigatran se asocia con mas complicaciones tromboembolicas y hemorragicas95.
Los pacientes que toman NACO podrian presentarse con un sindrome coronario agudo (SCA) y/o someterse a una intervencion coronaria percutanea (ICP). El uso concomitante de tratamiento antiplaquetario con NACO aumenta significativamente el riesgo de hemorragia96, como sucede al combinar cualquier ACO con la terapia antiplaquetaria. En los pacientes con FA en riesgo de sufrir un ACV, e independientemente de la escala HAS-BLED, el ACO sigue proporcionando beneficio (menos mortalidad y eventos cardiacos adversos mayores), pero con mas hemorragias97. A falta de datos solidos, en los pacientes con FA con un SCA o ICP/colocacion de un stent, se deberia seguir las recomendaciones basadas en consensos de expertos sobre el manejo de este tipo de pacientes, tal y como se describe en las Guias de la ESC de 2010 o en el actual documento de consenso europeo o norteamericano98–100. Por lo tanto, es necesario un periodo de terapia triple (ACO mas AAS mas clopidogrel), seguido de una combinacion de ACO mas un unico farmaco antiplaquetario, y tras 1 ano el manejo para los pacientes estables puede consistir en ACO en monoterapia, que puede ser dosis ajustada de un AVK o probablemente un NACO. Cabe resenar que el unico ensayo en que no se contraindico el uso de clopidogrel fue el RE-LY, por lo que los datos sobre la terapia triple con un NACO (administrado en dosis para la prevencion de ACV en pacientes con FA) son escasos.
Un paciente que toma dabigatran puede presentarse con un SCA y, dado el pequeno aumento numerico de episodios de IM con dabigatran, aunque no significativo en comparacion con warfarina71,72, el facultativo involucrado puede considerar el uso de un AVK o un NACO alternativo (p. ej., rivaroxaban o apixaban). No hay muchas pruebas que lo respalden, puesto que los efectos relativos de dabigatran frente a warfarina en los episodios isquemicos miocardicos fueron parejos entre los pacientes con y sin antecedente basal de IM o coronariopatia. A pesar de que la dosis baja de rivaroxaban (2,5 o 5mg dos veces al dia) se ha utilizado con ciertos beneficios en el SCA101, no hay datos sobre SCA en cuanto a la dosis de rivaroxaban utilizada para la anticoagulacion en la FA (20mg una vez al dia). El apixaban, utilizado en el contexto del SCA en dosis de prevencion de ACV (5mg dos veces al dia) en combinacion con AAS mas clopidogrel, no se asocio a reduccion de la tasa de eventos cardiovasculares, sino a un exceso de hemorragias graves102. Los pacientes con FA y enfermedad vascular estable (es decir, sin episodios agudos o revascularizacion > 12 meses, tengan enfermedad arterial periferica o coronaria) pueden ser tratados con ACO en monoterapia, ya sea AVK con ajuste de dosis o, probablemente, un NACO. Con estos pacientes estables, no hay necesidad de AAS concomitante, que puede aumentar el riesgo de hemorragias graves, como la HIC.
Recomendaciones para la prevención de tromboembolias en la fibrilación auricular no valvular
| Recomendaciones | Clasea | Nivelb | Refc | |
| Recomendaciones para la prevención de tromboembolias en la FA no valvular: general | ||||
| Se recomienda tratamiento antitrombotico para prevenir tromboembolias para todos los pacientes con FA, excepto aquellos (tanto varones como mujeres) en riesgo bajo (edad < 65 anos y FA sola) o con contraindicaciones | I | A | 21,63,104–106 | |
| La eleccion del tratamiento antitrombotico debe basarse en los riesgos absolutos de ACV/tromboembolia y hemorragico y en el beneficio clinico neto para el paciente concreto | I | A | 21,63,105 | |
| La escala CHA2DS2-VASc se recomienda como medio para evaluar el riesgo de ACV en la FA no valvular | I | A | 25,36,39 | |
| Para los pacientes con CHA2DS2-VASc = 0 (es decir, edad < 65 anos con FA sola), riesgo bajo y ningun factor de riesgo, no se recomienda ningun tratamiento antitrombotico | I | B | 21,36,82 | |
| Para los pacientes con CHA2DS2-VASc ≥ 2, a menos que este contraindicado, se recomienda el tratamiento anticoagulante con: | ||||
| • AVK con ajuste de dosis (INR 2-3) o | ||||
| • Un inhibidor directo de la trombina (dabigatran) o | ||||
| • Un inhibidor oral del factor Xa (p. ej., rivaroxaban, apixaban)d | I | A | 3,4,70,82 | |
| Para los pacientes con CHA2DS2-VASc = 1, basandose en una evaluacion del riesgo de complicaciones hemorragicas y las preferencias del paciente, se debe considerar el tratamiento anticoagulante con: | ||||
| • AVK con ajuste de dosis (INR 2-3) o | ||||
| • Un inhibidor directo de la trombina (dabigatran) o | ||||
| • Un inhibidor oral del factor Xa (p. ej., rivaroxaban, apixaban)d | IIa | A | 33,44 | |
| Las mujeres de edad < 65 y con FA sola (pero con CHA2DS2-VASc = 1 en virtud de su sexo) tienen riesgo bajo y no se debe considerar el tratamiento antitrombotico | IIa | B | 33,44 | |
| Si el paciente se niega a tomar cualquier tipo de ACO (ya sea AVK o NACO), se debe considerar tratamiento antiplaquetario mediante terapia combinada con 75-100 mg de AAS mas 75 mg/dia de clopidogrel (con lo que hay bajo riesgo hemorragico) o, menos eficazmente, AAS 75-325 mg/dia | IIa | B | 21,26,51,109 | |
| Recomendaciones para la prevención de tromboembolias en la FA no valvular: NACO | ||||
| Cuando un paciente con FA para el que se recomiendan ACO no puede utilizar un AVK con ajuste de dosis (INR 2-3) debido a problemas para mantener la anticoagulacion terapeutica, efectos secundarios con los AVK o imposibilidad de acudir a la monitorizacion y el control del INR, se recomienda un NACO: | ||||
| • Un inhibidor directo de la trombina (dabigatran) o | ||||
| • Un inhibidor oral del factor Xa (p. ej., rivaroxaban, apixaban)d | I | B | 2,28,65,107 | |
| En los casos en que se recomienda ACO, en lugar de un AVK con ajuste de dosis (INR 2-3) para la mayoria de los pacientes con FA no valvular, segun su beneficio clinico neto, se debe considerar un NACO: | ||||
| • Un inhibidor directo de la trombina (dabigatran) o | ||||
| • Un inhibidor oral del factor Xa (p. ej., rivaroxaban, apixaban)d | IIa | A | 3,4,70,82 | |
| Para los casos en que se prescribe dabigatran, se debe considerar una dosis de 150 mg dos veces al dia para la mayoria de los pacientes en lugar de 110 mg dos veces al dia, y se recomienda la segunda en caso de: | ||||
| • Ancianos de edad ≥ 80 anos | ||||
| • Uso concomitante de farmacos con interacciones (p. ej., verapamilo) | ||||
| • Riesgo hemorragico elevado (HAS-BLED ≥ 3) | ||||
| • Deterioro renal moderado (CrCl 30-49 ml/min) | IIa | B | 85,96 | |
| En el caso del rivaroxaban, se debe considerar una dosis de 20 mg una vez al dia para la mayoria de los pacientes en lugar de 15 mg una vez al dia, y se recomienda la segunda en caso de: | ||||
| • Riesgo hemorragico elevado (HAS-BLED ≥ 3) | ||||
| • Deterioro renal moderado (CrCl 30-49 ml/min) | IIa | C | 3,108 | |
| Se recomienda una evaluacion basal, y regularmente despues, de la funcion renal (mediante CrCl) en pacientes que esten iniciando tratamiento con algun NACO; debe realizarse anualmente, pero con mayor frecuencia en pacientes con deterioro renal moderado, cuyo CrCl se debe evaluar dos o tres veces al ano | IIa | B | 85 | |
| Los NACO (dabigatran, rivaroxaban y apixaban) no estan recomendados para pacientes con deterioro renal grave (CrCl < 30 ml/min) | III | A | 3,24,70 | |
| Recomendaciones para la prevención de tromboembolias en la FA no valvular: hemorragia | ||||
| Se recomienda evaluar el riesgo hemorragico al prescribir tratamiento antitrombotico (ya sea con AVK, NACO, AAS/clopidogrel o AAS solo) | I | A | 25,54,59,60 | |
| Se debe considerar la escala HAS-BLED como una estimacion para evaluar el riesgo hemorragico, de modo que una puntuacion ≥ 3 indica ≪alto riesgo≫ y hace necesaria cierta precaucion y revisiones regulares tras iniciar el tratamiento antitrombotico, ya sea con ACO o terapia antiplaquetaria (nivel de evidencia A); se debe abordar los factores de riesgo hemorragico corregibles (p. ej., presion arterial no controlada, INR labil si el paciente recibe tratamiento con un AVK, farmacos concomitantes [AAS, AINE, etc.], alcohol, etc.) (nivel de evidencia B); se debe utilizar la escala HAS-BLED para identificar los factores de riesgo hemorragico modificables que haya que tratar, pero no se debe utilizar por si sola para excluir a los pacientes del tratamiento con ACO (nivel de evidencia B) | IIa | A | B | 25,54,60 |
| El riesgo de hemorragia grave con terapia antiplaquetaria (con terapia combinada de AAS y clopidogrel y, especialmente en ancianos, tambien con AAS en monoterapia) se debe considerar similar al riesgo con ACO | IIa | B | 18,21,23,24,26,35 | |
| Recomendaciones para la prevención de tromboembolias en la FA no valvular: pericardioversión | ||||
| Para los pacientes con FA ≥ 48 h o cuando se desconoce la duracion de la FA, se recomienda el tratamiento con ACO (p. ej., AVK con INR 2-3 o dabigatran) durante al menos 3 semanas antes y al menos 4 semanas despues de la cardioversion, independientemente del metodo (electrico o con farmacos orales/i.v.) | I | B | 93 | |
| Para los pacientes con factores de riesgo de recurrencia de ACV o FA, el tratamiento con ACO, ya sea con AVK con ajuste de dosis (INR 2-3) o un NACO, se deberia continuar de por vida independientemente del mantenimiento aparente del ritmo sinusal tras la cardioversion | I | B | 110 | |
AAS: acido acetilsalicilico; ACO: anticoagulante oral; ACV: accidente cerebrovascular; AINE: antiinflamatorios no esteroideos; AVK: antagonistas de la vitamina K; CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertension, edad ≥ 75 anos (doble), diabetes mellitus, ACV (doble), enfermedad vascular, edad 65-74 anos, categoria de sexo (femenino); CrCl: aclaramiento de creatinina; FA: fibrilacion auricular; HAS-BLED: hipertension, funcion renal/hepatica anomala (1 punto cada una), ACV, antecedentes o predisposicion hemorragica, INR labil en caso de tomar warfarina, edad avanzada (es decir, > 65 anos), farmacos (AAS, AINE, etc.), drogas/alcohol concomitantemente (1 punto cada una); i.v.: intravenoso; INR: cociente internacional normalizado; NACO: nuevo anticoagulante oral.
Los pacientes que toman NACO tambien pueden presentarse con un ACV isquemico grave. Si el TTPa se prolonga en un paciente que toma dabigatran (o el TP en el caso del rivaroxaban), deberia asumirse que ese paciente esta anticoagulado y no se le deberia administrar tromboliticos103. Dado que dabigatran 150mg dos veces al dia resulto en un descenso significativo tanto de los ACV isquemicos como de los hemorragicos, en caso de que se produjera un ACV isquemico grave mientras el paciente esta tomando rivaroxaban o apixaban (ninguno de los cuales redujo significativamente los ACV isquemicos respecto a warfarina en sus ensayos respectivos), el facultativo puede considerar en su lugar el uso de 150mg de dabigatran dos veces al dia. Los algoritmos que ilustran la eleccion del tratamiento antitrombotico y el manejo de la hemorragia en pacientes con FA que toman NACO se muestran en las figuras 1 y 2. Aunque se puede preferir los NACO, sobre la base de los datos de ensayos clinicos, los facultativos deberian ser conscientes de que la experiencia clinica con estos agentes sigue siendo escasa y que es necesario tener cuidado, vigilancia y mas informacion sobre su eficacia en la practica clinica.
Eleccion del anticoagulante. Se deberia considerar terapia antiplaquetaria con AAS mas clopidogrel o, menos eficaz, AAS en monoterapia para pacientes que se niegan a tomar ningun tipo de ACO o que no toleren los anticoagulantes por razones no relacionadas con la hemorragia. Si hay contraindicaciones para ACO o la terapia antiplaquetaria, se podria considerar oclusion, cierre o escision de la orejuela izquierda. CHA2DS2-VASc: verde, 0; azul, 1; rojo, ≥ 2. Linea continua, mejor opcion; linea discontinua, opcion alternativa. AAS: acido acetilsalicilico; ACO: anticoagulante oral; ACV: accidente cerebrovascular; AVK: antagonista de la vitamina K; FA: fibrilacion auricular; NACO: nuevos anticoagulantes orales.
*Incluye enfermedad valvular reumatica y protesis valvulares.
Manejo de la hemorragia en pacientes que toman nuevos anticoagulantes orales. NACO: nuevos anticoagulantes orales; CCP: concentrado de complejo de protrombina; rFVIIa: factor VII recombinante activado. TP: tiempo de protrombina; TTPa: tiempo de tromboplastina parcial activado.
*Con dabigatran.
- •
La eficacia en prevencion de ACV con AAS es debil, con potencial danino, puesto que el riesgo de hemorragia grave (y HIC) con AAS no es significativamente distinto que con los ACO, especialmente para los ancianos.
- •
El uso de tratamiento antiplaquetario (como el combinado de AAS-clopidogrel o, menos eficaz, AAS en monoterapia para pacientes que no toleren la combinacion AAS-clopidogrel) para la prevencion de ACV en la FA deberia limitarse a unos pocos pacientes con FA que se niegan a tomar ninguna forma de ACO.
- •
La escala CHA2DS2-VASc es mejor para identificar a los pacientes de «riesgo verdaderamente bajo» con FA e igual de buena, y osiblemente mejor, que escalas como la CHADS2 para identificar a pacientes que sufriran ACV y tromboembolias.
- •
La escala HAS-BLED permite a los facultativos realizar una evaluacion informada del riesgo de hemorragia y, lo que es mas importante, les hace pensar en los factores de riesgo hemorragico corregibles. Se recomienda cautela y revisiones regulares para los pacientes con una puntuacion HAS-BLED ≥ 3, asi como esforzarse en corregir los factores de riesgo hemorragico potencialmente reversibles. No se deberia utilizar sin mas una puntuacion HAS-BLED elevada para excluir a los pacientes del tratamiento con ACO.
- •
Los NACO ofrecen mas eficacia, seguridad y comodidad que la anticoagulacion con AVK. De modo que para los casos en que se recomienda anticoagulacion, para la mayoria de los pacientes con FA se deberia considerar uno de los NACO, ya sea un inhibidor directo de la trombina (dabigatran) o un inhibidor del factor Xa por via oral (p. ej., rivaroxaban, apixaban), en lugar de AVK con ajuste de dosis (INR 2-3).
- •
No hay pruebas suficientes para recomendar un NACO u otro, aunque algunas caracteristicas del paciente, la adherencia y la tolerancia al tratamiento y el coste pueden ser consideraciones importantes a la hora de elegir el agente.
Se considera a la orejuela izquierda (OI) el principal (aunque no el unico) sitio de formacion de trombos que inducen ACV isquemico en pacientes que sufren FA. La ETT detecta la mayoria de los trombos en la OI y se describen tasas de ACV bajas entre los pacientes a los se ha extirpado quirurgicamente la OI (aunque estos pacientes tambien fueron revertidos a ritmo sinusal mediante varias tecnicas quirurgicas)111,112. De hecho, la escision quirurgica o grapado de la OI se realiza mucho como un procedimiento concomitante durante la cirugia a corazon abierto. Mas recientemente, se han desarrollado tecnicas epicardicas minimamente invasivas y tecnicas transeptales intervencionistas para la oclusion del orificio de la OI para reducir el riesgo de ACV113–115. Estos dispositivos/procedimientos pueden ofrecer una alternativa a los ACO para pacientes con FA y alto riesgo de ACV pero con contraindicaciones al tratamiento cronico con ACO y, si se puede demostrar de manera concluyente la eficacia del cierre de la OI, potencialmente para reemplazar el tratamiento a largo plazo con ACO.
Resultados del cierre de la orejuela izquierdaA pesar de que se ha aplicado a nivel clinico durante decadas, no existen pruebas concluyentes de que la oclusion o escision quirurgica la OI reduzca el riesgo de ACV en pacientes con FA, debido a la falta de ensayos a gran escala y controlados con un seguimiento sistematico113. Ademas, hay datos que apuntan a que no todos los ACV en pacientes con FA son cardioembolicos o debidos a la FA, y la OI probablemente no sea la unica region auricular izquierda en que pueden originarse los trombos. Esto indica que puede ser necesario dar tratamiento antitrombotico a los pacientes con FA incluso despues de la escision o cierre de la OI116.
Los datos procedentes de estudios retrospectivos u observacionales llevados a cabo en distintas poblaciones de pacientes han mostrado resultados contradictorios de oclusion o escision quirurgica de la OI117. Ademas, no se dispone de datos concluyentes sobre la mejor técnica quirúrgica para realizar el cierre de la OI. Los riesgos de la escisión quirúrgica de la OI incluyen hemorragia grave y oclusión de la OI incompleta, con riesgo residual de ACV117.
En estudios observacionales no aleatorizados con un numero de pacientes relativamente pequeno, se ha demostrado la factibilidad de la oclusion percutanea de la OI. Actualmente, dos dispositivos autoexpandibles, el WATCHMAN (Boston Scientific; Natick, Massachusetts, Estados Unidos) y el Amplatzer Cardiac Plug (St. Jude Medical; St. Paul, Minnesota, Estados Unidos), que se colocan transeptalmente en la OI, estan disponibles para uso clinico en Europa, mientras que su evaluacion en ensayos controlados sigue en curso.
El ensayo PROTECT AF (WATCHMAN LAA system for embolic PROTECTion in patients with Atrial Fibrillation PT prothrombin time) distribuyo aleatoriamente a 707 pacientes elegibles al cierre percutaneo la OI utilizando el dispositivo WATCHMAN o ACO (INR 2-3; controles, n = 244)115. A los pacientes aleatorizados a oclusion de la OI se los trato con ACO durante 45 dias tras el procedimiento, seguido de doble inhibicion plaquetaria durante 6 meses y AAS en monoterapia como tratamiento cronico. La tasa de efectos de eficacia primarios (objetivo compuesto de ACV, muerte cardiovascular y embolia sistemica) en el grupo de oclusion de la OI no fue inferior que en el de pacientes tratados con ACO. Hubo alta tasa de efectos secundarios en el grupo de intervencion, principalmente debido a las complicaciones perioperatorias. Muchos de los efectos secundarios en el grupo de intervencion tuvieron lugar en las primeras etapas del ensayo, lo que senala la curva de aprendizaje del operador. El registro de acceso continuo a PROTECT FA (CAP) controla los resultados de los pacientes una vez concluida la inscripción, y muestra un «efecto curva de aprendizaje», con menores tasas de complicaciones tras la finalizacion del ensayo118. Un segundo ensayo aleatorizado, PREVAIL, actualmente esta inscribiendo a pacientes.
En un estudio de viabilidad y seguridad, la oclusion de la OI con el Amplatzer Cardiac Plug se intento en 137 de 143 pacientes, y se realizo con exito en 132 (96%)114. Del total, 10 (7,0%) manifestaron complicaciones graves. Actualmente se esta llevando a cabo un estudio prospectivo aleatorizado con el dispositivo (Ensayo Amplatzer Cardiac Plug).
A pesar de que el concepto de cierre de la OI parezca razonable, las pruebas de eficacia y seguridad aun no son suficientes para recomendar estos abordajes a ningun paciente, salvo los que tienen contraindicados los ACO a largo plazo. No obstante, a falta de datos clinicos controlados, esta recomendacion se basa unicamente en consenso de expertos. Ademas, se necesitan estudios aleatorizados, dotados de herramientas adecuadas, realizados en pacientes con alto riesgo de ACV y con seguimiento a largo plazo que comparen los cierres intervencionistas/percutaneos/quirurgicos de la OI con el tratamiento con ACO, incluidos los NACO, para realizar la adecuada evaluacion de estas tecnicas. La necesidad de tratamiento con AAS de por vida tras el implante de dispositivos de cierre de la OI y el significativo riesgo hemorragico con AAS2 pueden inclinar las preferencias por la oclusion intervencionista de la OI. Hoy por hoy el cierre intervencionista de la OI no esta indicado como mera alternativa al tratamiento con ACO para reducir el riesgo de ACV.
Recomendaciones para el cierre/oclusión/escisión de la OI
| Recomendaciones | Clasea | Nivelb | Refc |
| Se puede considerar el cierre de la OI por intervencion percutanea para pacientes con alto riesgo de ACV y contraindicaciones para la anticoagulacion oral a largo plazo | IIb | B | 115,118 |
| Se puede considerar la escision quirurgica de la OI para pacientes sometidos a cirugia a corazon abierto | IIb | C |
ACV: accidente cerebrovascular; OI: orejuela izquierda.
- •
La oclusion/cierre percutaneo intervencionista de la OI tiene una funcion en los pacientes con riesgo tromboembolico a los que no se puede tratador a largo plazo con ninguna forma de ACO.
Desde que se publicaron las guías de la ESC de 2010, se ha aprobado un nuevo agente antiarrítmico administrado por vía intravenosa, el vernakalant, para la cardioversión farmacológica de la FA de hasta 7 días, o hasta 3 días para pacientes tras cirugía cardiaca. Esta actualización únicamente incluye las recomendaciones modificadas desde 2010.
El vernakalant actúa preferentemente en la aurícula bloqueando varios canales iónicos, lo que resulta en la prolongación de la capacidad de refracción auricular y una ralentización de la conducción auricular dependiente de la frecuencia, si bien tiene poca repercusión en las corrientes implicadas en la repolarización ventricular. El vernakalant tiene un inicio de acción rápido y una semivida de eliminación media de 3-5h.
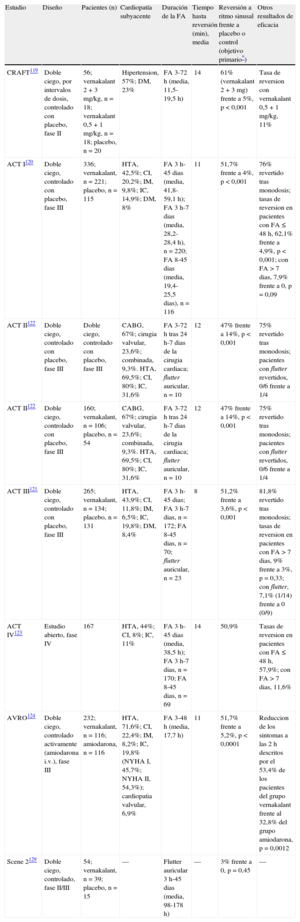
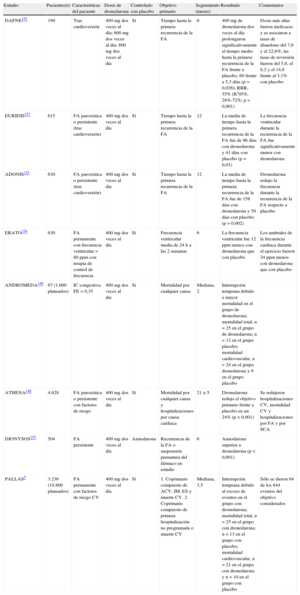
Evidencias clínicas del vernakalantLa eficacia del vernakalant se investigó en un estudio de determinación de la dosis, tres estudios clínicos de tamaño medio en fase III aleatorizados y controlados con placebo, una ensayo clínico aleatorizado con amiodarona como comparador activo y un estudio abierto en fase IV (tabla 5)119–124. En estudios en fases III y IV, el vernakalant se administró en infusión de 3mg/kg en 10min, y si la FA persistía tras 15min, se administraba una segunda dosis en infusión de 2mg/kg. Los pacientes inscritos en los estudios de vernakalant eran principalmente varones (68%), con una media de edad de 63 años, aunque aproximadamente la mitad de los pacientes tenían más de 65 años.
Resumen de los estudios clinicos sobre vernakalant en fibrilacion/flutter auricular
| Estudio | Diseño | Pacientes (n) | Cardiopatía subyacente | Duración de la FA | Tiempo hasta reversión (min), media | Reversión a ritmo sinusal frente a placebo o control (objetivo primario*) | Otros resultados de eficacia |
| CRAFT119 | Doble ciego, por intervalos de dosis, controlado con placebo, fase II | 56; vernakalant 2 + 3 mg/kg, n = 18; vernakalant 0,5 + 1 mg/kg, n = 18; placebo, n = 20 | Hipertension, 57%; DM, 23% | FA 3-72 h (media, 11,5-19,5 h) | 14 | 61% (vernakalant 2 + 3 mg) frente a 5%, p < 0,001 | Tasa de reversion con vernakalant 0,5 + 1 mg/kg, 11% |
| ACT I120 | Doble ciego, controlado con placebo, fase III | 336; vernakalant, n = 221; placebo, n = 115 | HTA, 42,5%; CI, 20,2%; IM, 9,8%; IC, 14,9%; DM, 8% | FA 3 h-45 dias (media, 41,8-59,1 h); FA 3 h-7 dias (media, 28,2-28,4 h), n = 220; FA 8-45 dias (media, 19,4-25,5 dias), n = 116 | 11 | 51,7% frente a 4%, p < 0,001 | 76% revertido tras monodosis; tasas de reversion en pacientes con FA ≤ 48 h, 62,1% frente a 4,9%, p < 0,001; con FA > 7 dias, 7,9% frente a 0, p = 0,09 |
| ACT II122 | Doble ciego, controlado con placebo, fase III | Doble ciego, controlado con placebo, fase III | CABG, 67%; cirugia valvular, 23,6%; combinada, 9,3%. HTA, 69,5%; CI, 80%; IC, 31,6% | FA 3-72 h tras 24 h-7 dias de la cirugia cardiaca; flutter auricular, n = 10 | 12 | 47% frente a 14%, p < 0,001 | 75% revertido tras monodosis; pacientes con flutter revertidos, 0/6 frente a 1/4 |
| ACT II122 | Doble ciego, controlado con placebo, fase III | 160; vernakalant, n = 106; placebo, n = 54 | CABG, 67%; cirugia valvular, 23,6%; combinada, 9,3%. HTA, 69,5%; CI, 80%; IC, 31,6% | FA 3-72 h tras 24 h-7 dias de la cirugia cardiaca; flutter auricular, n = 10 | 12 | 47% frente a 14%, p < 0,001 | 75% revertido tras monodosis; pacientes con flutter revertidos, 0/6 frente a 1/4 |
| ACT III121 | Doble ciego, controlado con placebo, fase III | 265; vernakalant, n = 134; placebo, n = 131 | HTA, 43,9%; CI, 11,8%; IM, 6,5%; IC, 19,8%; DM, 8,4% | FA 3 h-45 dias; FA 3 h-7 dias, n = 172; FA 8-45 dias, n = 70; flutter auricular, n = 23 | 8 | 51,2% frente a 3,6%, p < 0,001 | 81,8% revertido tras monodosis; tasas de reversion en pacientes con FA > 7 dias, 9% frente a 3%, p = 0,33; con flutter, 7,1% (1/14) frente a 0 (0/9) |
| ACT IV123 | Estudio abierto, fase IV | 167 | HTA, 44%; CI, 8%; IC, 11% | FA 3 h-45 dias (media, 38,5 h); FA 3 h-7 dias, n = 170; FA 8-45 dias, n = 69 | 14 | 50,9% | Tasas de reversion en pacientes con FA ≤ 48 h, 57,9%; con FA > 7 dias, 11,6% |
| AVRO124 | Doble ciego, controlado activamente (amiodarona i.v.), fase III | 232; vernakalant, n = 116; amiodarona, n = 116 | HTA, 71,6%; CI, 22,4%; IM, 8,2%; IC, 19,8% (NYHA I, 45,7%; NYHA II, 54,3%); cardiopatia valvular, 6,9% | FA 3-48 h (media, 17,7 h) | 11 | 51,7% frente a 5,2%, p < 0,0001 | Reduccion de los sintomas a las 2 h descritos por el 53,4% de los pacientes del grupo vernakalant frente al 32,8% del grupo amiodarona, p = 0,0012 |
| Scene 2129 | Doble ciego, controlado, fase II/III | 54; vernakalant, n = 39; placebo, n = 15 | — | Flutter auricular 3 h-45 dias (media, 98-178 h) | — | 3% frente a 0, p = 0,45 | — |
ACT: Ensayo de reversion de la arritmia auricular; AVRO: estudio prospectivo, aleatorizado, a doble ciego y controlado activamente sobre superioridad del vernakalant frente a la amiodarona contra el inicio precoz de la fibrilacion auricular; CI: cardiopatia isquemica; CRAFT: ensayo aleatorizado y controlado sobre la fibrilacion auricular; DM: diabetes mellitus; FA: fibrilacion auricular; HTA: hipertension arterial; IC: insuficiencia cardiaca; IM: infarto de miocardio; NYHA: New York Heart Association.
En el estudio CRAFT de determinacion de la dosis, se utilizaron dos dosis de vernakalant: bolo de 0,5 mg/kg en 10 min seguido de un bolo de 1 mg/kg o un bolo de 2 mg/kg en 10 min, seguido de un bolo de 3 mg/kg si habia FA 30 min despues de la primera infusion. En los posteriores estudios ACT I-IV, AVRO y Scene, se administro una infusion de 3 mg/kg en 10 min seguida de un bolo de 2 mg/kg si la FA no desaparecia a los 15 min tras la primera infusion.
No se describieron torsades de pointes a las 24 h de tratamiento; se describieron 3 casos (no relacionados con el farmaco) de torsades de pointes a las 32 h y a los 16 y 17 dias, respectivamente, tras la infusion de vernakalant.
Otro ensayo (ACT V) se concluyo prematuramente tras una muerte relacionda con la infusion de vernakalant. No hay detalles disponibles.
El objetivo primario de los estudios ACT I-IV y Scene 2 era la proporcion de pacientes con FA de 3 h-7 dias de duracion o flutter auricular, respectivamente, que pasaron a ritmo sinusal a los 90 min de iniciarse el farmaco; el objetvo primario del estudio CRAFT era la proporcion de pacientes con FA de 3-72 h de duracion que pasaron a ritmo sinusal durante la infusion o a los 30 min tras la ultima infusion; el objetivo primario del estudio AVRO era el porcentaje de pacientes con FA de 3-48 h de duracion que pasaron a ritmo sinusal a los 90 min de iniciarse el farmaco.
En los ensayos ACT, el vernakalant fue significativamente más eficaz que el placebo en revertir la FA de hasta 7 días (el 51,7 y el 51,2% en comparación con el 4 y el 3,6% respectivamente)120,121. El tiempo medio hasta la reversión fue de 8-11min, y en la mayoría de los pacientes (75-82%) se observó tras la primera dosis125.
En comparación directa, el vernakalant fue significativamente superior a la amiodarona intravenosa en la restauración del ritmo sinusal a los 90min (el 51,7 frente al 5,2%; p < 0,0001) y a las 4h tras la infusión (el 54,4 frente al 22,6%; p < 0,0001)124. Un metaanálisis de la eficacia del vernakalant demostró que los pacientes tenían 8,4 veces más probabilidades de revertir a ritmo sinusal a los 90min tras la infusión de vernakalant que con placebo o amiodarona [intervalo de confianza del 95%, (IC95%), 4,4-16,3], sin riesgo excesivo de sufrir efectos secundarios graves (hazard ratio [HR] = 0,91; IC95%, 0,6-1,36)126. En otro metaanálisis, el vernakalant se comparó favorablemente con agentes antiarrítmicos más antiguos para la cardioversión rápida (a las 2h)127.
El vernakalant retuvo su eficacia en subgrupos de pacientes con enfermedades cardiovasculares asociadas, como cardiopatía isquémica e hipertensión. En concreto, de 274 pacientes con cardiopatía isquémica (el 41% con antecedentes de IM) incluidos en todos los estudios, la eficacia sustraída a placebo del vernakalant fue del 45,7%, en comparación con el 47,3% de aquellos sin cardiopatía isquémica, sin exceso de efectos secundarios como hipotensión, bradicardia y arritmias ventriculares128. No obstante, hubo tendencia a escaso beneficio en pacientes con IC125. Más del 95% de los pacientes que pasaron a ritmo sinusal tras recibir una inyección de vernakalant se mantuvieron en ritmo sinusal a las 24h. En los ensayos conjuntos ACT I y III, un 76% de los pacientes del grupo vernakalant recibieron tratamiento concomitante con bloqueadores beta, antagonistas del calcio o digoxina para controlar la frecuencia, y el 24% recibía tratamiento farmacológico antiarrítmico. No hubo diferencias en los efectos secundarios.
El vernakalant cardiovirtió al 47% de los pacientes con FA postoperatoria incluidos en el ACT II tras ser sometidos a cirugía cardiaca, en comparación con el 14% del grupo placebo que pasó a ritmo sinusal espontáneamente, con un tiempo medio hasta la reversión de 12 min122. El vernakalant fue ineficaz revirtiendo la FA de más de 7 días de duración o aleteo (flutter) auricular típico121,123,129. La conversión de la FA a flutter auricular se observó en un 8,6-12,7% de los pacientes tratados con vernakalant, de los que un tercio pasó después a ritmo sinusal120,121.
Seguridad del vernakalantLos efectos secundarios más comunes del vernakalant fueron alteraciones del gusto (∼30%), estornudos (16%), parestesias (10%) y náuseas (9%), que generalmente se resolvían a los 5-15 min125. Se describen tasas similares de efectos secundarios graves con vernakalant y placebo (el 4,1 frente al 3,9%). Apareció hipotensión transitoria en aproximadamente un 5-7% de los pacientes tratados con vernakalant, pero la presión arterial regresaba al nivel basal tras aproximadamente 15-20min. La hipotensión durante las primeras 2h fue más común entre los pacientes con IC (16,1%), y causó el abandono del tratamiento del 2,9%130. La bradicardia fue más común con vernakalant que con placebo, pero rara vez llevó a suspender el fármaco (0,5%). No hubo exceso de episodios de arritmia ventricular en comparación con placebo (el 5,3 frente al 6,3% a las 2h y el 12,5 frente al 16,5% a las 24h de iniciarse el tratamiento) y sin torsade de pointes secundaria al fármaco120,121,125. No obstante, entre los pacientes con IC, las arritmias ventriculares no sostenidas (por lo general tripletes ventriculares y salvas) ocurrieron más a menudo con el tratamiento (el 7,3 frente al 1,6% con placebo). El intervalo QTc generalmente se prolongó 20-25ms y el complejo QRS aumentó aproximadamente 8ms tras la infusión de vernakalant.
Este farmaco esta contraindicado en pacientes con hipotension (presion arterial sistolica < 100mmHg), menos de 30 dias tras SCA, IC en clase NYHA I-II, estenosis aortica grave y prolongacion del intervalo QT (sin corregir, > 440ms), y deberia utilizarse con cautela en pacientes con IC NYHA I-II debido al mayor riesgo de hipotension. Actualmente, se deberia evitar el vernakalant en pacientes con FEVI baja (≤ 35%) debido a la escasa experiencia.
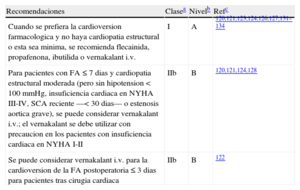
Recomendaciones para la cardioversión farmacológica de la FA de reciente aparición
| Recomendaciones | Clasea | Nivelb | Refc |
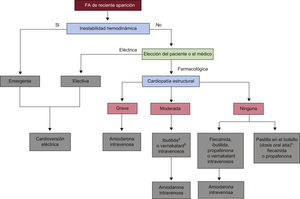
| Cuando se prefiera la cardioversion farmacologica y no haya cardiopatia estructural o esta sea minima, se recomienda flecainida, propafenona, ibutilida o vernakalant i.v. | I | A | 120,121,123,124,126,127,131–134 |
| Para pacientes con FA ≤ 7 dias y cardiopatia estructural moderada (pero sin hipotension < 100 mmHg, insuficiencia cardiaca en NYHA III-IV, SCA reciente —< 30 dias— o estenosis aortica grave), se puede considerar vernakalant i.v.; el vernakalant se debe utilizar con precaucion en los pacientes con insuficiencia cardiaca en NYHA I-II | IIb | B | 120,121,124,128 |
| Se puede considerar vernakalant i.v. para la cardioversion de la FA postoperatoria ≤ 3 dias para pacientes tras cirugia cardiaca | IIb | B | 122 |
FA: fibrilacion auricular; NYHA: New York Heart Association; SCA: sindrome coronario agudo.
La integracion de vernakalant en el esquema general para la cardioversion farmacologica y electrica se muestra en la figura 3.
Indicaciones para la cardioversion electrica y farmacologica y eleccion de farmacos antiarritmicos para la cardioversion farmacologica de pacientes con FA de reciente aparicion. FA: fibrilacion auricular.
a No se debe administrar ibutilida si hay hipertrofia ventricular izquierda significativa (≥ 1,4 cm).
b No se debe administrar vernakalant en caso de estenosis aortica, sindrome coronario agudo, hipotension o insuficiencia cardiaca moderada o grave. Precaucion en caso de insuficiencia cardiaca leve.
c Tecnica de ≪pastilla en el bolsillo≫: evaluacion preliminar en un entorno medicamente seguro y utilizado despues ambulatoriamente por el paciente.
- •
El vernakalant es eficaz en la cardioversion de pacientes con FA ≤ 7 dias o ≤ 3 dias tras cirugia cardiaca y ofrece un rapido efecto antiarritmico, pues en aproximadamente un 50% de los pacientes se observa la reversion a los 90min de iniciarse el tratamiento, con una media de tiempo hasta la reversion de 8-14min.
- •
El vernakalant se administra en infusion de 3mg/kg en 10min, y si la FA persiste tras 15min, se puede administrar una segunda infusion de 2mg/kg.
- •
El vernakalant cuenta con un perfil de seguridad satisfactorio para pacientes con una cardiopatia de minima a moderada, incluida la cardiopatia isquemica, pero se debe utilizar con cautela en pacientes hemodinamicamente estables con IC en NYHA I-II, debido al mayor riesgo de hipotension y arritmias ventriculares no sostenidas en este tipo de pacientes.
- •
El vernakalant esta contraindicado para pacientes con hipotension < 100mmHg (< 30 dias), SCA reciente, IC en NYHA I-II, estenosis aortica grave y prolongacion del intervalo QT (QT sin corregir > 440ms).
En los ultimos anos, se ha descrito una serie de ensayos que investigan mas alla del tratamiento convencional para la prevencion de la FA, lo que se conoce como ‘tratamiento upstream’135,136. Ninguno de los recientes ensayos controlados con placebo a doble ciego sobre antagonistas del receptor de la angiotensina II (ARA-II) y la mayoria de los ensayos con acidos grasos poliinsaturados no han podido mostrar resultados convincentes136–140. Ahora hay muy pocas razones para considerar el uso de tal tratamiento para la prevencion de la FA recurrente en pacientes con cardiopatia subyacente leve o nula. Puede estar justificado prescribir concomitantemente un ARA-II o un inhibidor de la enzima de conversion de la angiotensina (IECA) y un farmaco antiarritmico para aumentar la probabilidad de mantener el ritmo sinusal tras la cardioversion136.
Principios del tratamiento con antiarrítmicos oralesSe puede considerar el tratamiento con antiarritmicos orales para tratar la FA (paroxistica y persistente) recurrente. Varios metaanalisis y revisiones sistematicas han confirmado la eficacia antiarritmica a la vez que aumentan los signos de alarma por efectos secundarios y mortalidad141–144. Por esta razon, es importante enfatizar que el tratamiento con antiarritmicos se deberia ofrecer solo para controlar los sintomas resistentes debidos a la FA recurrente y deberia prevalecer el principio de que la seguridad es lo primero. En este aspecto, el hallazgo de que se puede reducir o retrasar los episodios de FA persistente con tratamiento antiarritmico a corto plazo (4 semanas tras la cardioversion) puede permitir tratamientos de menor duracion.
Por lo general, el tratamiento de la FA con antiarritmicos se ha administrado como tratamiento a largo plazo. Un ensayo publicado recientemente, el Flec-SL145, distribuyo aleatoriamente a 635 pacientes (media de edad, 64 anos; el 64% varones; el 97% con FEVI conservada; el 6% con coronariopatia; diametro auricular izquierdo medio, 47mm) a a) ningun tratamiento farmacologico antiarritmico (81 pacientes); b) tratamiento farmacologico antiarritmico a largo plazo (263 pacientes), o c) tratamiento farmacologico antiarritmico a corto plazo limitado a 4 semanas tras la cardioversion (261 pacientes). El ensayo probo la hipotesis de que el tratamiento a corto plazo no era inferior al tratamiento a largo plazo. Se siguio a los pacientes durante 6 meses mediante grabacion telemetrica del ECG diaria por el resultado primario de FA persistente o muerte. El ensayo demostro que el tratamiento a corto plazo produce una accion antiarritmica ligeramente inferior, pero aun asi eficaz, estimada en un 80% del efecto del tratamiento a largo plazo 6 meses tras la cardioversion. Un ensayo anterior habia comparado el tratamiento episodico con amiodarona frente al tratamiento continuo para evaluar el objetivo primario compuesto que contenia variables de eficacia y seguridad. En ese ensayo, la amiodarona episodica no fue tan eficaz como la amiodarona continua146. Segun ese ensayo y por la farmacocinetica de la amiodarona, especialmente su larga semivida, no parece ser adecuada para el tratamiento farmacologico antiarritmico a corto plazo147. En conjunto, la informacion disponible indica que el tratamiento con antiarritmicos a corto plazo tras la cardioversion no deberia ser el tipo de tratamiento por defecto ni se deberia considerar la amiodarona, pero puede ser util en pacientes en alto riesgo de efectos secundarios inducidos por el farmaco o con recurrencias de FA infrecuentes.
Actualización sobre la dronedaronaLa dronedarona es un derivado del benzofurano, estructuralmente relacionado con la amiodarona, recientemente aprobada para el tratamiento de la FA paroxistica o persistente. La dronedarona es un ≪bloqueador multicanal≫ que inhibe los canales del sodio y el potasio, muestra actividad antiadrenergica no competitiva y tiene propiedad antagonista del calcio. Este farmaco es mas eficaz que el placebo para mantener el ritmo sinusal, pero inferior a la amiodarona en ese aspecto (tabla 6). En el estudio ATHENA148, un amplio estudio de resultados sobre pacientes con riesgo moderado de eventos cardiovasculares y FA paroxistica o persistente, la dronedarona se asocio con una reducción significativa de eventos cardiovasculares, incluido el objetivo primario combinado de hospitalizaciones cardiovasculares no programadas y muerte por cualquier causa. Otros analisis demostraron un descenso significativo en la mortalidad arritmica, la mortalidad cardiovascular (incluida la mortalidad arritmica) y los ACV (tabla 6).
Resumen de los estudios clínicos sobre dronedarona en la fibrilación auricular
| Estudio | Pacientes(n) | Características del paciente | Dosis de dronedarona | Controlado con placebo | Objetivo primario | Seguimiento (meses) | Resultado | Comentarios |
| DAFNE152 | 199 | Tras cardioversión | 400 mg dos veces al día; 600 mg dos veces al día; 800 mg dos veces al día | Sí | Tiempo hasta la primera recurrencia de la FA | 6 | 400 mg de dronedarona dos veces al día prolongaron significativamente el tiempo medio hasta la primera recurrencia de la FA frente a placebo: 60 frente a 5,3 días (p = 0,026); RRR, 55% (IC95%, 28%-72%; p = 0,001) | Dosis más altas fueron ineficaces y se asociaron a tasas de abandono del 7,6 y el 22,6%; las tasas de reversión fueron del 5,8, el 8,2 y el 14,8 frente al 3,1% con placebo |
| EURIDIS153 | 615 | FA paroxística o persistente (tras cardioversión) | 400 mg dos veces al día | Sí | Tiempo hasta la primera recurrencia de la FA | 12 | La media de tiempo hasta la primera recurrencia de la FA fue de 96 días con dronedarona y 41 días con placebo (p = 0,01) | La frecuencia ventricular durante la recurrencia de la FA fue significativamente menor con dronedarona |
| ADONIS153 | 630 | FA paroxística o persistente (tras cardioversión) | 400 mg dos veces al día | Sí | Tiempo hasta la primera recurrencia de la FA | 12 | La media de tiempo hasta la primera recurrencia de la FA fue de 158 días con dronedarona y 59 días con placebo (p = 0,002) | Dronedarona redujo la frecuencia durante la recurrencia de la FA respecto a placebo |
| ERATO154 | 630 | FA permanente con frecuencia ventricular > 80 ppm con terapia de control de frecuencia | 400 mg dos veces al día | Sí | Frecuencia ventricular media de 24 h a las 2 semanas | 6 | La frecuencia ventricular fue 12 ppm menos con dronedarona que con placebo | Los umbrales de la frecuencia cardiaca durante el ejercicio fueron 24 ppm menos con dronedarona que con placebo |
| ANDROMEDA149 | 67 (1.000 planeados) | IC congestiva; FE < 0,35 | 400 mg dos veces al día | Sí | Mortalidad por cualquier causa | Mediana, 2 | Interrupción temprana debido a mayor mortalidad en el grupo de dronedarona; mortalidad total, n = 25 en el grupo de dronedarona; n = 12 en el grupo placebo; mortalidad cardiovascular, n = 24 en el grupo dronedarona y 9 en el grupo placebo | |
| ATHENA148 | 4.628 | FA paroxística o persistente con factores de riesgo | 400 mg dos veces al día | Sí | Mortalidad por cualquier causa y hospitalizaciones por causa cardiaca | 21 ± 5 | Dronedarona redujo el objetivo primario frente a placebo en un 24% (p < 0,001) | Se redujeron hospitalizaciones CV, mortalidad CV y hospitalizaciones por FA y por SCA |
| DIONYSOS155 | 504 | FA persistente | 400 mg dos veces al día | Amiodarona | Recurrencia de la FA o suspensión prematura del fármaco en estudio | 6 | Amiodarona superior a dronedarona (p < 0,001) | |
| PALLAS5 | 3.236 (10.800 planeados) | FA permanente con factores de riesgo CV | 400 mg dos veces al día | Sí | 1. Coprimario compuesto de ACV, IM, ES y muerte CV. 2. Coprimario compuesto de primera hospitalización no programada o muerte CV | Mediana, 3,5 | Interrupción temprana debido al exceso de eventos en el grupo con dronedarona; mortalidad total, n = 25 en el grupo con dronedarona; n = 13 en el grupo con placebo; mortalidad cardiovascular, n = 21 en el grupo con dronedarona y n = 10 en el grupo con placebo | Sólo se dieron 64 de los 844 eventos del objetivo considerados |
ADONIS: estudio estadounidense, australiano y africano con dronedarona contra la fibrilación o flutter auricular para el mantenimiento del ritmo sinusal; ANDROMEDA: ensayo antiarrítmico con dronedarona contra la insuficiencia cardiaca congestiva de moderada a grave que evalúa el descenso de morbilidad; ATHENA: estudio controlado con placebo, a doble ciego y de brazos paralelos para evaluar la eficacia de 400 mg de dronedarona dos veces al día para prevenir hospitalización cardiovascular o muerte por cualquier causa en pacientes con fibrilación/flutter auricular; CV: cardiovascular; DAFNE: estudio sobre la fibrilación auricular con dronedarona tras cardioversión eléctrica; DIONYSOS: ensayo a doble ciego y aleatorizado para evaluar la eficacia y la seguridad de dronedarona (400 mg dos veces al día) frente a amiodarona (600 mg una vez al día durante 28 días, después 200 mg una vez) durante al menos 6 meses para mantener el ritmo sinusal en pacientes con fibrilación auricular; ERATO: eficacia y seguridad de la dronedarona para control de la frecuencia ventricular durante la fibrilación auricular; ES: embolia sistémica; EURIDIS: ensayo europeo en pacientes con fibrilación o flutter auricular que reciben dronedarona para mantener el ritmo sinusal; FA: fibrilación auricular; FE: fracción de eyección; IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%; IM: infarto de miocardio; RRR: reducción del riesgo relativo; SCA: síndrome coronario agudo.
Tambien se observo un descenso, similar pero inesperado, de la tasa de eventos del objetivo en una pequena poblacion de pacientes que se mantuvieron con FA durante todo el ensayo. Por lo tanto, se llevo a cabo un ensayo aleatorizado a gran escala para comparar dronedarona con placebo en pacientes con FA permanente. Recientemente se han comunicado los resultados del estudio PALLAS5, en el que se aleatorizo a los pacientes con FA permanente (definida para la inclusion en el ensayo como > 6 meses) y factores de riesgo cardiovascular a 400mg de dronedarona dos veces al dia o placebo en identico regimen añadido al mejor tratamiento medico (tabla 6).
El ensayo planeaba incluir a 10.800 pacientes, pero el comite de control de datos lo detuvo prematuramente tras la inclusion de 3.236 pacientes, debido a un aumento de eventos cardiovasculares, incluida la muerte de causa cardiovascular, en el grupo que recibia dronedarona respecto al grupo control. El primer resultado del estudio coprimario (compuesto de ACV, IM, embolia sistemica y muerte cardiovascular) se observo en 43 pacientes que recibian dronedarona y 19 que recibian placebo (HR = 2,29; IC95%, 1,34-3,94; p = 0,002]. El objetivo secundario del estudio coprimario (primera hospitalizacion cardiovascular no programada o muerte) se produjo en 127 pacientes que recibian dronedarona y 67 pacientes que recibian placebo (HR = 1,95; IC95%, 1,45-2,62; p < 0,001). Hubo 21 muertes por causas cardiovasculares en el grupo dronedarona y 10 en el grupo placebo (HR = 2,11; IC95%, 1,00-4,49; p = 0,046), incluida la muerte subita probablemente debida a arritmia de 13 y 4 pacientes respectivamente (HR = 3,26; IC95%, 1,06-10,00; p = 0,03). Sufrieron ACV 23 pacientes del grupo que a dronedarona y 10 del grupo a placebo (HR = 2,32; IC95%, 1,11-4,88; p = 0,02). Requirieron hospitalizacion por IC 43 pacientes a dronedarona y 24 a placebo (HR = 1,81; IC95%, 1,10-2,99; p = 0,02).
Las razones de que los resultados del estudio PALLAS difirieran tanto de los del ATHENA no estan completamente claras. Los pacientes que participaron en el estudio PALLAS tenian mayor carga de enfermedad cardiovascular y obviamente tenian FA permanente. No hay ensayos de otros fármacos antiarritmicos contra la FA permanente, por lo que no se puede comparar los resultados del PALLAS con otros estudios. Desde un punto de vista metodologico, el estudio PALLAS solo ha recogido 64 de los 844 objetivos primarios que el estudio tenia planeados antes su conclusion. Ademas, la mortalidad en el grupo del estudio PALLAS que recibia placebo fue menor que la del grupo del estudio ATHENA que recibia dronedarona a pesar de la mayor carga de enfermedad cardiovascular en el primero.
Como consecuencia del estudio PALLAS, no se deberia tratar con dronedarona a los pacientes con FA permanente, especialmente aquellos con una carga de enfermedad cardiovascular significativa. El farmaco puede utilizarse en pacientes con FA paroxistica o persistente tras la cardioversion. La Ficha Técnica Europea de las Caracteristicas del Producto revisado sobre el farmaco aconseja que el tratamiento con dronedarona sea supervisado por un ≪especialista≫, es decir, personal hospitalario o de consulta que este familiarizado con el uso de farmacos antiarritmicos, y es obvio que no deberia iniciarlo un medico general o de familia. El control posterior tambien debe incluir informacion del especialista apropiado. Actualmente las autoridades reguladoras europeas han aprobado el uso de dronedarona para el mantenimiento del ritmo sinusal tras la cardioversion. La cardioversion puede ser espontanea o inducida y el paciente puede estar tomando dronedarona o no en el momento de la cardioversion. Una recurrencia de la FA que persiste requiere que el medico y el paciente decidan si buscar o no el ritmo sinusal (p. ej., mediante cardioversion electrica), en cuyo caso se puede mantener el tratamiento con dronedarona o dejar al paciente con FA, que pasaria a ser de naturaleza ≪permanente≫, en cuyo caso se debe suspender el tratamiento con dronedarona.
En la actualizacion mas reciente de la EMEA sobre dronedarona, el farmaco estaba contraindicado para pacientes con trastornos hemodinamicos inestables, IC previa o en curso o disfuncion ventricular izquierda. Para los pacientes en clase funcional NYHA III-IV, el estudio ANDROMEDA aportó evidencia de que el tratamiento con dronedarona puede resultar danino para estos pacientes149. Por otra parte, no hay evidencia cientifica clara de efectos daninos del farmaco para pacientes con IC en NYHA I-II o con IC-FEC. El analisis de subgrupo del estudio PALLAS no mostro signos claros de que el grado de IC (clase funcional NYHA) o el grado de disfuncion sistolica ventricular izquierda (FEVI) fuesen relevantes para ningun objetivo del estudio, incluidos hospitalizaciones y eventos de IC. Por otro lado, el estudio PALLAS incluyo a un elevado porcentaje de pacientes con IC previa y varios grados de descompensacion cardiaca, excepto para la clase NYHA IV. Los episodios de IC en el estudio PALLAS fueron mas comunes entre los pacientes con coronariopatia subyacente, pero la validez estadistica de este analisis de subgrupo es incierta. El uso de la dronedarona como agente antiarritmico en pacientes con FA recurrente e IC menos grave (clase NYHA I-II) es inadecuado a menos que no haya una alternativa oportuna.
El estudio PALLAS mostro que la dronedarona se asocia con aumento de muertes subitas entre los pacientes en tratamiento concomitante con digoxina; por lo tanto, se desaconseja el uso combinado de estos dos farmacos. No se ha documentado proarritmia con el uso de dronedarona en ningun ensayo, y hay pocos o ningun informe sobre torsade de pointes o taquicardia ventricular en el informe de efectos secundarios tras la aprobacion. Por lo tanto, parece innecesario eliminar esta opcion para el tratamiento de la hipertension con hipertrofia ventricular izquierda, en el que se cree que el riesgo de los farmacos antiarritmicos esta relacionado con la torsade de pointes.
Recomendaciones para los agentes antiarrítmicos orales
| Recomendaciones | Clasea | Nivelb | Refc |
| Se recomienda dronedarona para pacientes con FA recurrente como agente antiarritmico moderadamente eficaz para el mantenimiento del ritmo sinusal | I | A | 142,144,153 |
| Se puede considerar el tratamiento antiarritmico a corto plazo (4 semanas) tras la cardioversion para determinados pacientes como aquellos en riesgo de complicaciones relacionadas con el tratamiento | IIb | B | 145 |
| La dronedarona no esta recomendada para pacientes con FA permanente | III | B | 5 |
FA: fibrilacion auricular.
En algunos casos, la dronedarona se ha asociado con hepatotoxicidad grave. Por lo tanto, se aconseja realizar pruebas para controlar la funcion hepatica de los pacientes que reciben tratamiento con dronedarona a largo plazo. Puesto que la dronedarona es un inhibidor de la glucoproteina P, aumenta las concentraciones plasmaticas de dabigatran; por lo tanto, se debe evitar el uso concomitante de los dos farmacos.
Las actuales opciones de farmacos antiarritmicos relacionados con la fisiopatologia subyacente se muestran en la figura 4.
Eleccion del farmaco antiarritmico segun la enfermedad subyacente. Los agentes antiarritmicos aparecen por orden alfabetico en cada cuadro de tratamiento. ARA-II: antagonistas del receptor de la angiotensina II; CC: cardiopatia coronaria; CHT: cardiopatia hipertensiva; HVI: hipertrofia ventricular izquierda; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversion de la angiotensina; NYHA: New York Heart angiotensina.
- •
El tratamiento para controlar el ritmo cardiaco, ya sea con antiarritmicos o con ablacion por cateter, esta indicado para aliviar los sintomas asociados con la FA.
- •
No se debe utilizar farmacos antiarritmicos para controlar la frecuencia cardiaca de pacientes con FA permanente, a menos que fallen los agentes adecuados del control de la frecuencia cardiaca.
- •
Para pacientes seleccionados, limitar el tratamiento farmacologico antiarritmico a 4 semanas tras la cardioversion puede ayudar a mejorar la seguridad.
- •
En un paciente determinado, la eleccion de un farmaco antiarritmico debe estar condicionada por la seguridad aparente del farmaco. Esto es mas importante que la eficacia aparente.
- •
La dronedarona es adecuada para mantener el ritmo sinusal de pacientes con FA paroxistica o persistente.
- •
No se debe administrar dronedarona a pacientes con IC moderada o grave y se debe evitar en pacientes con IC menos grave si hay una alternativa adecuada.
Desde la publicacion de las Guias de la ESC sobre FA en 2010, se han publicado varios conjuntos de datos. El ensayo aleatorizado MANTRA-PAF156 comparo en 294 pacientes la ablacion de la FA por cateter con el tratamiento con antiarritmicos como intervencion de primera linea para control del ritmo. Tras 24 meses de seguimiento, significativamente mas pacientes del grupo de ablacion no presentaban ningun tipo de FA ni FA sintomatica. La calidad de vida era significativamente mejor en el grupo de ablacion a los 12 y los 24 meses. No obstante, la carga de FA total no fue significativamente diferente entre ambos grupos. Se ha difundido informacion similar de los resultados del ensayo RAAFT II158.
Estos datos respaldan la recomendacion de 2012 de que es razonable recomendar la ablacion por cateter como tratamiento de primera linea para el control del ritmo cardiaco de la FA en pacientes seleccionados, es decir, aquellos con FA paroxistica que prefieren un tratamiento intervencionista con bajo perfil de riesgo de complicaciones relacionadas con el procedimiento158. Sin bien es cierto que por lo general con datos no aleatorizados de un unico centro, otros informes tambien corroboran que la ablacion por cateter es mas eficaz que el tratamiento con antiarritmicos para mantener el ritmo sinusal de los pacientes con FA, en su mayoria pacientes sin cardiopatia estructural marcada, con puntuacion CHA2DS2-VASc baja y FA paroxistica. Todos estos datos respaldan lo comunicado en las guias de que la ablacion de la FA por cateter es mas eficaz que el tratamiento con antiarritmicos para mantener el ritmo sinusal.
El ensayo FAST comparo los resultados de la ablacion por cateter y la ablacion quirurgica en una poblacion de pacientes relativamente pequena y con un diseno aleatorizado. El resultado del ritmo fue mejor tras la ablacion quirurgica. No obstante, la tasa de complicaciones tras la ablacion quirurgica fue significativamente mayor que con la ablacion por cateter159. Otro ensayo reciente160 ha destacado que los abordajes quirurgicos para la ablacion de la FA presentan dificultades tecnicas, especialmente en lo que respecta a las lineas transmurales.
Mientras que la ablacion por cateter es mas eficaz que el tratamiento con antiarritmicos para mantener el ritmo sinusal, el numero de recurrencias de FA durante el seguimiento a largo plazo parece ser significativo. Varios informes recientes demuestran que las recurrencias tardias de la FA son comunes, incluso cuando los pacientes aptos con FA ≪sola≫ o ≪casi sola≫ se someten a ablacion por cateter en centros con experiencia161–163. El mas importante factor predictivo de esta recurrencia tardia parece ser la recurrencia temprana de la FA tras el procedimiento de ablacion164–167, lo que indica que la persistencia de la recurrencia temprana es mucho mas frecuente que la verdadera recurrencia tardia. No obstante, una baja tasa de recurrencias, que puede deberse a la progresion del dano auricular, se sigue sumando a importantes tasas de recurrencia a largo plazo168. Practicamente todos los estudios sobre ablacion de la FA por cateter dependen del aislamiento de la vena pulmonar como diana del procedimiento. Actualmente se esta estudiando si se necesita el aislamiento completo de las venas pulmonares para conseguir el efecto terapeutico.
Aunque sea eficaz, la ablacion de la FA por cateter conlleva un importante riesgo de de complicaciones graves169. Esto se refleja en la reciente publicacion del estudio piloto sobre la ablacion de la FA en el EURObservational Research Programme170. En esta encuesta, que describe el resultado de mas de 1.000 procedimientos de ablacion llevados a cabo en centros de alto volumen por toda Europa, la tasa de complicaciones agudas graves fue del 0,6% de ACV, el 1,3% de taponamientos, el 1,3% de complicaciones vasculares perifericas y aproximadamente el 2% de pericarditis. Se han descrito similares tasas de complicaciones en un importante centro de ablacion de Estados Unidos y, ya disponible en la publicacion de las Guias de la ESC de 2010, la Worldwide AF Survey171,172. Esta informacion proviene de registros voluntarios y tiene la tendencia inherente a influir en los centros con experiencia; la verdadera tasa de complicaciones puede ser mayor. En un muy reciente analisis de una base de datos medica con 4.156 pacientes sometidos a su ablacion inicial entre 2005 y 2008, la tasa de complicaciones fue del 5% y la de hospitalizacion por cualquier causa durante el primer ano tras la ablacion por cateter fue del 38,5%173. Ademas, varios informes indican que los procedimientos de ablacion por cateter pueden inducir infartos cerebrales silentes, detectables mediante imagenes de resonancia magnetica cerebral174–176.
Segun varios estudios, la incidencia de infarto cerebral silente varia significativamente entre las distintas tecnologias de ablacion, aproximadamente entre el 4 y el 35%174,175,177. No se entiende por completo las razones de estas diferencias, pero parece que aumentan con el uso de tecnicas de ablacion especificas. Aunque el significado clinico del infarto cerebral silente no esta claro, hay que considerar detenidamente estos riesgos al elegir una tecnica o herramienta de ablacion. Hay una necesidad clara y no satisfecha de desarrollar tecnologias mas seguras para la ablacion de la FA174,177. Datos monocentricos indican que los pacientes varones con bajo riesgo de ACV (CHA2DS2-VASc 0-1) tienen menos probabilidad de sufrir tales complicaciones que los pacientes de mas edad, las mujeres y los pacientes con mayor riesgo de ACV171.
Pasaran algunos anos antes de que los extensos estudios de resultado sobre la terapia de control del ritmo cardiaco basada en la ablacion publiquen los resultados primarios178,179. Hasta entonces, es necesario sopesar cuidadosamente el riesgo asociado con la ablacion de la FA frente al beneficio en los sintomas del sujeto.
Ablación por catéter en pacientes con insuficiencia cardiacaLa FA con IC-FEB concomitante sigue siendo un reto cuando se necesita tratamiento para controlar el ritmo cardiaco. Las recomendaciones revisadas del tratamiento con antiarritmicos dejan la amiodarona como el unico agente antiarritmico disponible en este ambito (fig. 4). Muchos pacientes pueden volverse asintomaticos o ligeramente sintomaticos (EHRA I-II) con esta terapia, especialmente cuando la IC y la frecuencia cardiaca estan bien controladas. En los pacientes que sufren recurrencias de FA sintomaticas con el tratamiento con amiodarona, la ablacion por cateter sigue siendo la unica opcion para el tratamiento escalonado del control del ritmo cardiaco. Los principios fundamentales del tratamiento del control del ritmo cardiaco se aplican tambien a este grupo de pacientes, especificamente que el tratamiento de control del ritmo esta indicado para mejorar los sintomas relacionados con la FA (puntuacion EHRA II-IV) y que se debe mantener el tratamiento con ACO, puesto que es probable que la arritmia se produzca. Hay que resaltar que la probabilidad de mantener el ritmo sinusal tras la ablacion por cateter es menor y que los riesgos relacionados con el procedimiento pueden ser mas altos en los pacientes con IC. Ademas, la evaluacion correcta de los sintomas relacionados con la FA puede ser mas dificil con el solapamiento de los sintomas de la IC, lo que resalta la necesidad de una decision individualizada y fundamentada para la ablacion por cateter en pacientes con IC. En pacientes con IC seleccionados y en tratamiento en centros con mucha experiencia, la ablacion por cateter de la FA puede proporcionar mejoria de la funcion ventricular izquierda. Estas recomendaciones se resumen en la figura 5.
Farmacos antiarritmicos y ablacion auricular izquierda para el control del ritmo cardiaco en la fibrilacion auricular. FA: fibrilacion auricular; IC: insuficiencia cardiaca.
a Suele ser adecuado el aislamiento venoso pulmonar.
b Podria ser necesaria una ablacion auricular izquierda mas extensa.
c Precaucion en cardiopatia coronaria.
d No recomendada en hipertrofia ventricular izquierda. Insuficiencia cardiaca por FA: taquicardiomiopatia.
Hay consenso en que los ACO son utiles en la prevencion de complicaciones tromboembolicas en los procedimientos de ablacion180. Esto se aplica tanto a los pacientes que tienen indicacion para el tratamiento con ACO de larga duracion como a los pacientes sin factores de riesgo de ACV, lo que resalta que, de algun modo, la ablacion aumenta el riesgo de ACV en el momento del procedimiento.
Desde las Guias sobre la FA de 2010, ha habido varios informes que indican que la ablacion de la FA por cateter puede realizarse con menos complicaciones si se continua el tratamiento con ACO (por lo general AVK con INR 2-3)181–184, entre ellos un informe sobre el resultado del taponamiento cardiaco inducido por la ablacion en pacientes con y sin anticoagulacion continua durante el procedimiento185. Estos informes concluyen que el tratamiento continuo con ACO es seguro durante los procedimientos de ablacion, en linea con las recomendaciones previas sobre procedimientos de revascularizacion coronaria95–98. La continuacion del tratamiento con ACO tambien se recomienda en la reciente declaracion de consenso de la HRS/EHRA/APHRS sobre la ablacion de la FA, como alternativa a un tratamiento puente con heparina, para pacientes tratados mediante anticoagulacion con AVK antes de la ablacion por cateter186. La experiencia con los NACO es escasa. Los informes iniciales, pese a utilizar protocolos no estandarizados para el uso de NACO periablacion, senalan que el riesgo de ACV puede aumentar ligeramente, lo que va en contra del sentido comun a la luz de los efectos de los NACO para la prevencion de ACV en la FA en general95. Mientras se desconoce el riesgo relativo exacto de anticoagular ininterrumpidamente con NACO periablacion, se conoce el riesgo de eventos hemorragicos al cambiar de anticoagulantes o administrarlos como terapia puente52,186. Para los pacientes a los que se retira los ACO antes del procedimiento de ablacion, parece ser razonable iniciar la anticoagulacion con NACO poco despues del procedimiento de ablacion. Este abordaje tambien debe evitar cualquier puente con heparina.
Por lo tanto, para los pacientes anticoagulados con AVK, actualmente recomendamos la ablacion de la FA por cateter con anticoagulacion continua. El tratamiento anticoagulante debe mantenerse en la parte baja del intervalo terapeutico (como INR 2-2,5) durante la ablacion. Tal regimen puede ayudar a reducir los ACV perioperatorios e incluso los infartos cerebrales silentes. Como ya se hizo en las guias de 20101, se recomienda continuar a largo plazo con los ACO tras la ablacion en todos los pacientes con CHA2DS2-VASc ≥ 2, independientemente del exito aparente de la intervencion.
La seguridad es lo primeroHay muchas tecnologias en evolucion que pueden ayudar a reducir el riesgo de complicaciones perioperatorias durante la ablacion de la FA174,187. Como ya se ha mencionado, mejorar la seguridad de la ablacion por cateter debe ser un objetivo primario en el ulterior desarrollo de este tratamiento178. No obstante, las consideraciones fisiopatologicas indican que el tratamiento de control del ritmo puede realizarse mejor justo despues del diagnostico inicial, puesto que ese periodo puede ofrecer una ≪ventana de oportunidad≫ para el tratamiento eficaz del control del ritmo178,187,188. Este concepto claramente requiere de pruebas en ensayos controlados.
Recomendaciones para la ablación auricular izquierda
| Recomendaciones | Clasea | Nivelb | Refc |
| La ablacion por cateter de la FA paroxistica sintomatica de pacientes con recurrencias sintomaticas de la FA en tratamiento farmacologico antiarritmico (amiodarona, dronedarona, flecainida, propafenona, sotalol) que preferirian un tratamiento de control del ritmo cardiaco mas intenso esta recomendada si la realiza un electrofisiologo con la formacion adecuada y en un centro con experiencia | I | A | 192,193 |
| La ablacion por cateter de la FA deberia tratar el aislamiento de las venas pulmonares | IIa | A | 170,172,192,194 |
| Se debe considerar la ablacion de la FA por cateter como tratamiento de primera linea para determinados pacientes con FA paroxistica sintomatica y alternativo al tratamiento con farmacos antiarritmicos, teniendo en cuenta las preferencias del paciente, los beneficios y los riesgos | IIa | B | 156–158 |
| Cuando se programe ablacion de la FA por cateter, se debe considerar mantener la anticoagulacion oral con un AVK durante el procedimiento, manteniendo un INR proximo a 2,0 | IIa | B | 170,181–184 |
| Cuando la FA recurra en las primeras 6 semanas tras la ablacion por cateter, se debe considerar monitorizacion del ritmo cardiaco | IIa | B | 195 |
FA: fibrilacion auricular; INR: cociente internacional normalizado.
En las guias de la ESC de 2010, la ablacion de la FA paroxistica sintomatica por cateter tras el fracaso del tratamiento con antiarritmicos se clasifico como de clase IIa con nivel de recomendacion A. Considerando los resultados de los estudios aleatorizados sobre la ablacion de la FA por cateter frente a tratamiento con antiarritmicos y la reciente publicacion de ensayos aleatorizados y no aleatorizados156,158,189,190, es razonable elevar la categoria de esta recomendacion a clase I, siempre que operadores especializados realicen la ablacion. Esto esta en linea con la actualizacion detallada de 2011 de la ACCF/AHA y HRS y la declaracion de consenso de expertos de 2012 sobre la ablacion por cateter y quirurgica redactada conjuntamente con la EHRA6,186. Para los pacientes con FA paroxistica muy sintomatica y bajo perfil de riesgo para ello, se deberia considerar de entrada la ablacion por cateter156,190,191.
Estas recomendaciones estan circunscritas a: a) investigadores/centros muy especializados; b) seleccion adecuada de los pacientes; c) evaluacion detallada de las alternativas de tratamiento, y d) las preferencias del paciente. Para los pacientes con FA persistente y refractaria a los farmacos y FA persistente y constante, no hay cambios en las recomendaciones. Actualmente no hay pruebas para recomendar la ablacion de la FA por cateter en pacientes asintomaticos.
Puntos clave- •
La ablacion por cateter esta recomendada como alternativa al tratamiento con antiarritmicos para pacientes con FA paroxistica recurrente y sintomatica en tratamiento con antiarritmicos, siempre que lleve a cabo el procedimiento un operador especializado.
- •
Se puede considerar la continuacion del tratamiento oral con AVK durante el procedimiento de ablacion, pero faltan datos solidos sobre los NACO.
- •
Para pacientes seleccionados con FA paroxistica y sin cardiopatia estructural, es razonable la ablacion auricular izquierda como tratamiento de primera linea.
Este documento es una actualizacion de las guias de la ESC de 2010 sobre el manejo de la FA. No pretende ser una nueva guia exhaustiva y hay muchas otras areas en que podria ser util hacer pequenas revisiones de las Guias de 2010, que deberan esperar a otra actualizacion o una guia nueva. En los casos pertinentes, se han actualizado organigramas y tablas. Esta actualizacion detallada se publicara de forma independiente y no se incorporara en su totalidad a las guias originales en una unica publicacion. Se publicara una guia de bolsillo con todas las recomendaciones, organigramas y tablas totalmente integrados.
REFERENCIAS NO CITADAS