La fibrilación auricular (FA) es la arritmia cardiaca más frecuente y con una prevalencia creciente en nuestro medio1. Se trata de una de las principales causas de accidente cerebrovascular, insuficiencia cardiaca, morbilidad cardiaca y muerte súbita. Si bien su tratamiento suele ser farmacológico, se han desarrollado técnicas de ablación tanto percutáneas como quirúrgicas.
Se presenta el caso de una paciente tratada con ablación de la FA mediante radiofrecuencia, con desenlace fatal. Mujer de 61 años diagnosticada de enfermedad de Fabry con daño renal (proteinuria), ocular (córnea verticilata) y cardiaco (FA persistente, hipertrofia del ventrículo izquierdo asimétrica, disfunción del ventrículo izquierdo progresiva hasta el 40% en su última determinación y trastornos de la conducción auriculoventricular que requirieron implante de marcapasos bicameral). Estaba en tratamiento de reemplazo enzimático con agalsidasa alfa bisemanal, candesartán, bisoprolol, furosemida, espironolactona y apixabán. La paciente sufría episodios recurrentes de FA con mala tolerancia hemodinámica, que se trataron con cardioversión eléctrica en varias ocasiones, pero con recaídas precoces, y se intentó mantener el ritmo sinusal con amiodarona, pero apareció hepatitis tóxica en relación con esta, lo que llevó a su retirada definitiva. Dados los síntomas de la paciente, se planteó una estrategia de control del ritmo mediante ablación percutánea por radiofrecuencia, para lo cual se utilizó un catéter irrigado con sensor de fuerza de contacto TactiCath Quartz 75 (St. Jude Medical), y se procedió al aislamiento eléctrico de las venas pulmonares; al tratarse de FA persistente con varias recidivas, además de la cardiopatía estructural asociada, con gran dilatación auricular izquierda, se realizaron líneas de ablación en la pared posterior de la aurícula izquierda y el istmo mitral y ablación de electrogramas auriculares complejos fragmentados. Se realizaron aplicaciones de duración < 15 s, con una fuerza de contacto < 10g y potencia ≤ 25W, con el objetivo de aumentar la seguridad del procedimiento.
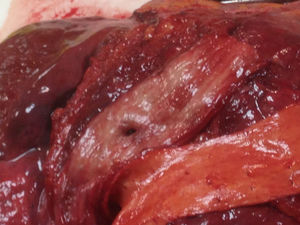
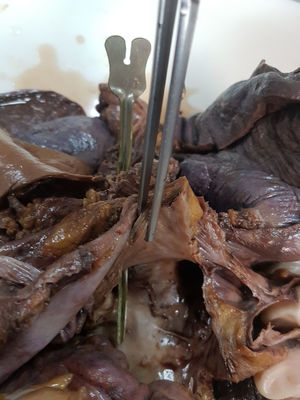
A los 18 días del procedimiento, ingresó por nuevo episodio de insuficiencia cardiaca, con recidiva de la FA. Durante su ingreso, sufrió repentinamente hemiparesia y parálisis facial, por lo que se realizó tomografía computarizada craneal ante la posibilidad de hematoma intracraneal, con resultado normal. Súbitamente presentó hematemesis franca con inestabilidad hemodinámica, que obligó a estabilización y realización de endoscopia digestiva alta emergente para descartar hemorragia digestiva relacionada con la anticoagulación oral, que mostró restos de coágulo en el fundus gástrico y, durante la retirada del endoscopio, se observó en tercio medio del esófago una imagen similar a un divertículo, pulsátil. Inmediatamente y coincidiendo con la insuflación de aire, la paciente sufrió fibrilación ventricular refractaria a las maniobras de reanimación cardiopulmonar avanzada y falleció. Ante la alta sospecha de fístula auriculoesofágica secundaria a la ablación de FA, se le practicó una autopsia clínica que confirmó el diagnóstico (figura 1 y figura 2), además de proporcionar datos macroscópicos compatibles con daño cardiaco por enfermedad de Fabry.
En nuestra paciente, la fisiopatología que presumiblemente subyacía a la clínica neurológica se debió a la embolia de material aéreo o contenido alimenticio desde el esófago a la aurícula izquierda, y su depósito en el tejido cerebral a través de la circulación sistémica; la hemorragia digestiva se explica por el paso de sangre desde la aurícula izquierda a una cámara de baja presión como es el esófago, y la fibrilación ventricular por el paso de contenido aéreo insuflado en la endoscopia digestiva alta desde el esófago al ventrículo izquierdo.
El aislamiento eléctrico de las venas pulmonares en la FA es una técnica terapéutica efectiva y muy extendida, que utiliza energía de radiofrecuencia o crioterapia para aislar eléctricamente el tejido auricular que se implica en la generación y el sostenimiento de la arritmia2. Puede asociar líneas de ablación en la pared de la aurícula izquierda en caso de cardiopatía estructural, como es nuestro caso.
La guía de práctica clínica3 recomienda este procedimiento con clase I en la FA paroxística sintomática que fracasa tras tratamiento antiarrítmico y recibe una indicación de clase IIa en algunos casos de FA persistente sintomática tras ensayo antiarrítmico fallido.
Si bien se trata de un procedimiento bastante seguro, es una técnica no exenta de complicaciones. Se estima una mortalidad algo inferior a 2/1.000 procedimientos3. En España, se indicaron 2.953 procedimientos durante 2016, con una tasa de complicaciones aceptable en relación con la técnica (3,9%), sin ninguna muerte descrita4. Las complicaciones, aunque poco frecuentes, son potencialmente letales, entre las que destacen el taponamiento cardiaco, el ictus o la fístula auriculoesofágica. Un equipo experimentado, junto con una adecuada selección de los pacientes, reduce significativamente la incidencia de estas complicaciones5. Además, recientemente se ha relacionado la escala CHA2DS2-VASc con el riesgo de complicaciones periprocedimiento4.
La fistula auriculoesofágica es una complicación poco frecuente (< 1/1.000 pacientes)2, que puede aparecer entre los 3 días y las 5 semanas posteriores a la ablación. Debe sospecharse precozmente ante la aparición de fiebre, dolor torácico, disfagia, hemorragia digestiva, clínica neurológica o sepsis. Su mortalidad sin tratamiento quirúrgico ronda el 100% y se reduce al 32% mediante la cirugía precoz6.