El diagnóstico y el tratamiento de la valvulopatía mitral y tricuspídea han sufrido unos cambios extraordinarios en los últimos años. La irrupción de las intervenciones percutáneas y la generalización de las nuevas técnicas de imagen han modificado las recomendaciones para el diagnóstico y el tratamiento de estas afecciones. La ingente cantidad de publicaciones y estudios en este campo obliga a una continua actualización de nuestros protocolos. La publicación de la guía de la Sociedad Europea de Cardiología de 2021 sobre el tratamiento de las valvulopatías no cubre algunos aspectos novedosos de estos tratamientos y, además, el número de intervenciones realizadas en los países de nuestro entorno es muy variable, lo que exige una adecuación de las recomendaciones al contexto local. Además, es indispensable un resumen de toda esta información para que se pueda generalizar su uso. Por estos motivos, se considera necesario el posicionamiento común de la Asociación de Cardiología Intervencionista, la Asociación de Imagen Cardiaca, la Asociación de Cardiología Clínica y la Sección de Valvulopatías y Patología Aórtica de la Sociedad Española de Cardiología para el diagnóstico y el tratamiento de la valvulopatía mitral y tricuspídea.
Palabras clave
A continuación, se presenta el posicionamiento común de la Asociación de Cardiología Intervencionista, la Asociación de Imagen Cardiaca, la Sección de Valvulopatías y Patología Aórtica y la Asociación de Cardiología Clínica de la Sociedad Española de Cardiología para el diagnóstico y el tratamiento de la valvulopatía mitral y tricuspídea.
VALVULOPATÍA MITRALLa insuficiencia mitral (IM) es la segunda valvulopatía más frecuente en Europa y la más prevalente en el mundo1,2. Se puede clasificar en IM primaria, por lesión de uno o más de los componentes del aparato valvular, e IM funcional o secundaria, en la que los velos son estructuralmente normales y la insuficiencia se produce por alteraciones en el cierre y la tensión de los velos debido a alteraciones en la geometría ventricular o auricular3,4.
Los pacientes con IM primaria pueden permanecer asintomáticos durante años, puesto que la sobrecarga de volumen en el ventrículo izquierdo (VI) conduce a mecanismos compensadores como su dilatación. Sin embargo, si no se interviene a tiempo, la sobrecarga de volumen crónica lleva a un incremento del estrés parietal, fenómenos de remodelado y fibrosis miocárdica y, finalmente, disfunción ventricular3.
El pronóstico de los pacientes con IM grave depende de diferentes variables, entre las cuales destacan la presencia de síntomas, una fracción eyección del VI (FEVI) <60% y un diámetro telesistólico del VI> 40mm5. Múltiples estudios muestran la necesidad de actuar en pacientes asintomáticos con función sistólica del VI conservada para evitar un peor pronóstico5,6. Además, algunos autores consideran que los puntos de corte establecidos en la actualidad representan ya un estadio descompensado del VI y, por lo tanto, la intervención debería realizarse antes7,8.
En el caso de la IM secundaria, la insuficiencia valvular puede ocurrir por disfunción del VI o tras un infarto de miocardio que afecte al músculo papilar posterior, o también por dilatación anular secundaria a dilatación auricular grave, habitualmente en el contexto de fibrilación auricular o insuficiencia cardiaca (IC) con FEVI conservada4.
El abordaje debe incluir siempre tratamientos dirigidos al remodelado inverso del VI, tanto farmacológicos como con terapia de resincronización cardiaca y revascularización en los casos indicados9,10.
Sin embargo, en los pacientes con IM secundaria, cualquier grado de insuficiencia tiene un impacto pronóstico negativo, mayor incidencia de IC y muerte11,12, por lo que en ciertos casos las intervenciones sobre la válvula mitral pueden ser de utilidad9,10.
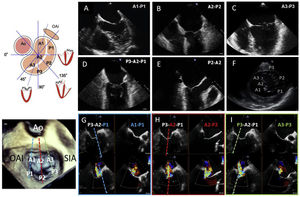
DIAGNÓSTICOEl complejo valvular mitral está compuesto por el anillo, los velos, el aparato subvalvular (cuerdas tendinosas y músculos papilares) y el VI. El anillo mitral es una estructura tridimensional en silla de montar con morfología oval (diámetros anteroposterior e intercomisural). Los velos anterior y posterior tienen similar superficie y se unen en las comisuras anterolateral y posteromedial, entre las que discurre la línea de coaptación. El velo posterior está dividido por 2 pequeñas indentaciones y, de acuerdo con la clasificación de Carpentier, divide los velos en 3 festones por contraposición, de lateral a medial: A1-P1, A2-P2 y A3-P3 (figura 1).
Valoración de la válvula mitral mediante ETE. Para obtener una valoración sistemática en ETE-2D es preciso la visualización en diferentes planos (A-F; medioesofágico 0° variando profundidad, bicomisural, tracto de salida y eje corto transgástrico). La ETE-3D permite una valoración integral en «vista del cirujano; o bien una visión en 2D-ortogonal de cada pareja de festones (X-plane. G: A1-P1, azul; H: A2-P2, rojo; I: A3-P3, verde). Este último método de visualización es muy útil en la monitorización de procedimientos percutáneos. Ao: aorta; ETE: ecografía transesofágica; OAI: orejuela de la aurícula izquierda; SIA: septo interauricular.
En pacientes con IM, la ecocardiografía transtorácica es la técnica de imagen de primera línea y la ecocardiografía transesofágica (ETE) se reserva para los casos con diagnóstico no concluyente, que requieran mayor detalle o para planificación de una reparación valvular. La ETE tridimensional (3D) aporta información adicional en pacientes con lesiones complejas y durante la monitorización de procedimientos percutáneos. La valoración del grado de gravedad de la IM es un aspecto complejo. La IM depende de las condiciones hemodinámicas y ningún parámetro por sí solo permite un estudio concluyente. Se recomienda la valoración conjunta de parámetros cualitativos, semicuantitativos y cuantitativos, integrados de forma escalonada, para diferenciar el grado de IM12 (tabla 1).
Valoración de la insuficiencia mitral
| Leve (1 o 1+) | Leve-moderada (2 o 2+) | Moderada-grave (3 o 3+) | Grave (4 o 4+) | |
|---|---|---|---|---|
| Parámetros cuantitativos | ||||
| Morfología valvular | Normal o velos ligeramente anormales o abombamiento (tenting) ligero | Velos moderadamente anormales o tenting moderado | Velos moderadamente anormales o tenting moderado | Flail o amplio defecto coaptación o tenting grave |
| Jet de regurgitación por Doppler colora | Pequeño, central (< 4cm2 o <20% AI) | Intermedio (4-6cm2 o 20-30% AI) | Intermedio (6-8cm2 o 30-40% AI) | Jet central amplio (> 8cm2 o> 50% AI) o jet excéntrico con efecto Coandă |
| Convergencia de flujob, señal de Doppler continuo | No o pequeño o parabólico | Denso, parcial o parabólico | Denso, parcial o parabólico | Holosistólico, denso, triangular |
| Parámetros semicuantitativos | ||||
| Vena contracta (mm)c | <3 | 3-5 | 5- <7 | ≥ 7 (≥ 8 biplano)d |
| Flujo en venas pulmonarese | Dominancia sistólicaf | Normal, aplanamiento sistólico | Aplanamiento sistólico | Flujo sistólico mínimo, ausente o inversog |
| Flujo de entrada mitral | Onda A dominantef | Variable | Onda E> 1,2 m/se | Onda E> 1,2 m/sh |
| ITV mitral/ITV aórticoe | <1 | Intermedio | > 1,2h | > 1,2h |
| Parámetros cuantitativosi,j,k | ||||
| ORE (mm2)c | <20 | 20-29 | 30-39 | ≥ 40 |
| Volumen regurgitante (ml)l | <30 | 30-44 | 45-59 | ≥ 60 |
| Fracción regurgitante (%) | <30 | 30-39 | 40-49 | ≥ 50 |
| Parámetros basados en cardio-RMm | ||||
| Fracción regurgitante (%) | <30 | 30-39 | 40-49 | ≥ 50 |
| Parámetros estructurales | ||||
| Tamaño del VI y la AIn | Normal | Normal-dilatado | Dilatado | Dilatado |
| Presión arterial pulmonarn | Normal | Normal-elevada | Normal-elevada | Elevada |
AI: aurícula izquierda; cardio-RM: cardiorresonancia magnética; DTDVI: diámetro telediastólico del VI; ETT: ecocardiograma transtorácico; IM: insuficiencia mitral; ITV: integral velocidad-tiempo; IVTDVI: índice de volumen telediastólico del VI; ORE: orificio regurgitante efectivo; VC: vena contracta; VI: ventrículo izquierdo.
El área de flujo color se considera un método de detección de IM. No se recomienda su graduación basada solo en este parámetro.
La VC y el ORE-PISA son los métodos cuantitativos recomendados cuando es posible aplicarlos. La VC puede obtenerse en caso de chorro excéntrico y en presencia de múltiples chorros, si bien los valores no son aditivos. El PISA puede utilizarse para jets centrales o excéntricos. La medición de la VC 3D-color puede ayudar a determinar la morfología del orificio regurgitante.
La presencia de flujo sistólico inverso en las venas pulmonares y la relación de ITV mitral/aórtico alterada son los parámetros más específicos de IM grave.
La medida de PISA por ETT-2D en pacientes con IM secundaria puede subestimar el tamaño del verdadero ORE.
Los grados de gravedad de la IM clasifican la regurgitación como leve, moderada o grave y subclasifican el grupo moderado en «leve-moderada» y «moderada-grave». En la IM secundaria, un ORE ≥ 30mm2 o un volumen regurgitante ≥ 45ml pueden definir la IM grave y se ha asociado con eventos clínicos y necesidad de intervención.
Pueden observarse discrepancias entre los valores de ORE, volumen regurgitante y fracción regurgitante en situaciones de bajo o alto flujo.
El volumen regurgitante mitral puede ser menor en condiciones de bajo flujo, pero corresponde a una mayor fracción regurgitante.
A pesar de una moderada correlación entre diferentes técnicas de imagen, la graduación de la IM por cardio-RM es posible, y el método indirecto (comparación entre volumen latido del VI y flujo anterógado aórtico) es el más reproducible. El uso de ecocardiografía 3D y cardio-RM permite una valoración más precisa y reproducible de las cavidades izquierdas, si bien la indicación de intervención continúa basándose en las medidas por ETT-2D.
Excepto por otras causas, el tamaño del VI y la AI y la presión pulmonar son normales en pacientes con IM leve. En la IM grave aguda, la presión pulmonar suele estar elevada y el tamaño del VI, normal. En la IM grave crónica, clásicamente el VI está dilatado. Se aceptan valores de corte para la dilatación no significativa de las cavidades izquierdas: DTDVI <56mm, iVTDVI <82ml/m2, DTSVI <40mm, iVTSVI <30ml/m2, diámetro de la AI <39mm y volumen de la AI <36ml/m2.
La tomografía computarizada cardiaca (cardio-TC) es una técnica esencial en la planificación del reemplazo percutáneo de la válvula mitral, ya sea de prótesis o de una anuloplastia quirúrgica previa disfuncionante (valve-in-valve y valve-in-ring), en anillo mitral calcificado (valve-in-MAC) o en anatomía valvular nativa. La cardio-TC permite seleccionar el tamaño protésico, analizar en detalle la zona de despliegue y evaluar el área del neotracto de salida del VI (neo-TSVI) mediante el implante virtual de la válvula mitral13. Un área de neo-TSVI <1,7cm2 predice la aparición de obstrucción del TSVI y contraindica el reemplazo percutáneo de la válvula mitral14.
TRATAMIENTOEl abordaje terapéutico de la IM depende de su mecanismo5,15.
Insuficiencia mitral primariaTratamiento médico de la insuficiencia primaria agudaSe debe utilizar nitratos y diuréticos para disminuir las presiones de llenado. El nitroprusiato de sodio disminuye la poscarga y la fracción regurgitante. Si el paciente presenta inestabilidad hemodinámica, se debe emplear agentes inotrópicos y dispositivos de asistencia ventricular.
Tratamiento quirúrgico o intervencionista en insuficiencia mitral primaria aguda graveEn esta condición, y tras instaurar el tratamiento de soporte que permita estabilizar al paciente, se debe evaluar la posibilidad de tratamiento intervencionista de la valvulopatía. La cirugía urgente ha sido la estrategia clásica de tratamiento, la mayoría de las veces para una sustitución valvular, si bien es cierto que es un procedimiento asociado con elevada morbimortalidad16. En los últimos años se ha explorado asimismo la posibilidad de reparación percutánea en este contexto, y se han obtenido buenos resultados en pacientes tanto estables como en shock cardiogénico17,18.
Tratamiento médico de la insuficiencia mitral primaria crónicaNo hay evidencia para respaldar el uso preventivo de vasodilatadores si la función sistólica del VI está conservada. El tratamiento de pacientes con IC es el recomendado por la vigente guía europea sobre IC15.
Tratamiento quirúrgico e intervencionista de la insuficiencia mitral primaria crónica graveLa guía actual recomienda la cirugía para los pacientes sintomáticos con bajo riesgo quirúrgico (reparación valvular recomendada), los asintomáticos con función ventricular izquierda disminuida (DTS ≥ 40mm o FEVI ≤ 60%) o con función del VI conservada si sufren fibrilación auricular o tienen un volumen telesistólico indexado de la aurícula izquierda ≥ 60ml/m2 o un diámetro ≥ 55mm o hipertensión pulmonar sistólica (PAPs> 50mmHg). Si el riesgo quirúrgico es alto, actualmente es indispensable valorar si es posible el tratamiento percutáneo borde a borde, que se discute en el siguiente apartado.
Insuficiencia mitral secundariaTratamiento médicoEl tratamiento farmacológico con bloqueadores beta, antagonistas del receptor de mineralcorticoides, inhibidores de la enzima de conversión de la angiotensina (IECA) o antagonistas del receptor de la angiotensina II (ARA-II) y, en su caso, sacubitrilo-valsartán e inhibidores del cotransportador 1 de sodio y glucosa (iSLGT-1), junto con la terapia de resincronización cardiaca (en pacientes con QRS ancho) y la revascularización coronaria (en pacientes con IC de origen isquémico) constituyen la base del abordaje terapéutico de los pacientes con IC y FEVI reducida.
Tratamiento quirúrgico/intervencionista de la insuficiencia mitral grave secundariaTras tratamiento médico óptimo y con síntomas persistentes:
- •
En caso de enfermedad coronaria subsidiaria de cirugía o si se precisa otra cirugía cardiaca, el reemplazo valvular será quirúrgico.
- •
Si el paciente presenta criterios adecuados para tratamiento borde a borde mitral, se realizará dicho procedimiento; en caso contrario, se valorarán otros procedimientos percutáneos valvulares o se lo evaluará para un dispositivo de asistencia ventricular o trasplante cardiaco (véase el siguiente apartado).
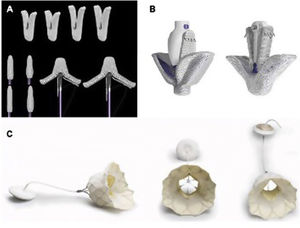
Las técnicas transcatéter de reparación han aumentado exponencialmente en los últimos años, y sus excelentes resultados han obligado a replantear las indicaciones de intervención sobre la insuficiencia mitral. Estos procedimientos han intentado emular técnicas quirúrgicas de reparación mitral como la anuloplastia, el aumento de coaptación de los velos y la inserción de neocuerdas. Asimismo, ya es posible también reemplazar la válvula por catéter. En el momento actual destacan los dispositivos de reparación borde a borde (MitraClip, Abbott Vascular, Estados Unidos, y PASCAL, Edwards Lifesciences, Estados Unidos) y el sistema de reemplazo Tendyne (Abbott Vascular), que han alcanzado su uso clínico habitual19,20 (figura 2).
Selección de candidatosLos principales grupos de pacientes candidatos a tratamiento percutáneo se recogen en la tabla 2, de acuerdo con el consenso de las sociedades de intervencionismo española, italiana y portuguesa21.
Pacientes candidatos a tratamiento percutáneo de la insuficiencia mitral
| Candidatos apropiados |
| IM secundaria grave sintomática + FEVI <50% + sin injerto planeado, fundamentalmente si cumplen criterios COAPT* |
| IM grave sintomática (IM primaria o IM secundaria) + injertos previos con AMI permeable |
| IM primaria sintomática y alto riesgo quirúrgico o inoperable o candidato quirúrgico no apropiado |
| Considerar en |
| IM secundaria auricular en candidato quirúrgico no apropiado |
| Anuloplastias fallidas |
| IM grave sintomática tras infarto de miocardio en candidato quirúrgico no apropiado |
| Puente a trasplante cardiaco o asistencia ventricular en pacientes con IM secundaria grave y clase funcional avanzada (concepto MitraBridge) |
| Movimiento sistólico anterior mitral en pacientes con miocardiopatía hipertrófica no candidatos a miomectomía |
AMI: arteria mamaria izquierda; FEVI: fracción de eyección del ventrículo izquierdo; IM: insuficiencia mitral.
El primer ensayo realizado, el EVEREST II, mostró que el MitraClip de primera generación era menos eficaz pero más seguro que la cirugía estándar en una población fundamentalmente de IM primaria22. Las nuevas generaciones de los dispositivos de reparación han mejorado ostensiblemente y con la cuarta generación, la tasa de pacientes con IM primaria 0-1 a los 30 días es> 90%23.
En cuanto a la IM secundaria, en 2018 se publicaron los resultados de los estudios MITRA-FR24 y COAPT25, ambos estudios aleatorizados a tratamiento médico frente a procedimiento percutáneo borde-a-borde con MitraClip, pero con resultados opuestos. Mientras que en el estudio francés (MITRA-FR) no se observó mejoría en el grupo de intervención, el ensayo COAPT demostró en su grupo de intervención una disminución significativa del número de hospitalizaciones y una reducción relativa de la mortalidad del 38% a los 2 años de seguimiento. Los resultados contrapuestos pueden explicarse por una serie de diferencias entre ambos, entre las que destacan la magnitud de la IM, los volúmenes ventriculares, el tratamiento médico óptimo y la selección clínica de los candidatos (evitando factores de muy mal pronóstico).
Con base en estos estudios, se debe evitar a los pacientes en estadios muy avanzados (mayor dilatación ventricular con muy mala función), con IM secundaria no grave y sin tratamiento óptimo. Los pacientes deben estar en fases más precoces, con un importante grado de IM (orificio regurgitante efectivo> 30mm2) y tratamiento médico optimizado y que el dispositivo ofrezca un buen resultado, por lo que la selección anatómica y la experiencia del equipo implantador deben ser altas (tabla 3). En cualquier caso, los subanálisis del ensayo COAPT muestran que el tratamiento intervencionista mejoró el pronóstico en prácticamente todos los subgrupos, e incluso en los pacientes cuyo fenotipo era más parecido a MITRA-FR corregir la IM se asoció con una mejoría significativa de la clase funcional y la calidad de vida26.
Criterios de inclusión COAPT
| Criterios de inclusión (todos presentes) |
| 1. IM grave sintomática |
| 2. Tratamiento óptimo |
| 3. NYHA II, III o IV ambulatorio |
| 4. Ingreso por insuficiencia cardiaca en los últimos 12 meses o BNP ≥ 300 pg/ml o NT-proBNP ≥ 1.500 pg/ml |
| 5. Se ha determinado que la cirugía mitral no es una opción |
| 6. FEVI 20-50% |
| 7. DTS ≤ 70 mm |
| 8. Jet principal central y el equipo implantador debe considerar altas probabilidades de éxito |
| 9. CK-MB obtenida 14 días antes debe estar por debajo del valor superior de la normalidad del laboratorio |
| 10. Acceso transeptal factible |
| 11. Edad> 18 años |
| 12. Consentimiento informado y conformidad con completar el protocolo del estudio |
| Criterios de exclusión (todos ausentes) |
| 1. Enfermedad coronaria no tratada que requiera revascularización |
| 2. CABG, ICP o TAVI en los 30 días previos |
| 3. Enfermedad valvular aórtica o tricuspídea que requiera intervención |
| 4. EPOC que requiera oxígeno domiciliario |
CABG: cirugía de revascularización aortocoronaria; CK-MB: creatincinasa MB; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; ICP: intervención coronaria percutánea; NYHA: clase funcional de la New York Heart Association; TAVI: implante percutáneo de válvula aórtica.
La evidencia del ensayo COAPT ha sido definitiva y las guías tanto estadounidenses como europeas abogan por que la reparación percutánea sea la primera alternativa que considerar en los casos de IM secundaria que precisen tratamiento intervencionista5,27.
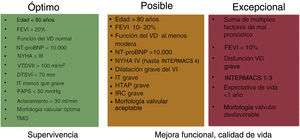
En un intento de reunir toda esta evidencia, hemos decidido crear 3 niveles de recomendación para poder guiar la selección de candidatos (figura 3).
Niveles de recomendación para la selección de pacientes para reparación borde-a-borde. En el nivel verde se situarían los pacientes con las características asociadas con una mejoría de los eventos clínicos, a los que se debería proponer el procedimiento prácticamente siempre (pacientes tipo COAPT, en los que se espera aumento de supervivencia). En el nivel ámbar estarían los pacientes que presentan alguna característica de mal pronóstico, por lo que cabe esperar un beneficio menor, aunque no quiere decir que no lo haya; de hecho, pueden producirse mejoras de la calidad de vida y la clase funcional, lo cual puede constituir un argumento muy poderoso para indicar el tratamiento. Por último, en el nivel rojo estarían los pacientes para quienes es más que probable que la reparación mitral sea estéril. DTSVI: diámetro telediastólico del ventrículo izquierdo; FEVI: fracción de eyección del ventrículo izquierdo; HTAP: hipertensión arterial pulmonar; IRC: insuficiencia renal crónica; IT: insuficiencia tricuspídea; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: clase funcional de la New York Heart Association; PAPS: presión sistólica arterial pulmonar; TMO: tratamiento médico óptimo; VD: ventrículo derecho; VTDVII: volumen telediastólico de ventrículo izquierdo indexado.
Además, recientemente se ha desarrollado una escala de riesgo, MitraScore, que permite identificar a los candidatos con peor pronóstico y peor capacidad de recuperación y que podría ser útil también como herramienta complementaria a la hora de seleccionar a los pacientes28.
Hay que mencionar también a los pacientes con IC avanzada, en la que el tratamiento mitral se utiliza como medio para que lleguen en mejor condición a otros tratamientos avanzados como el trasplante o la asistencia ventricular (estrategia MitraBridge)29.
Otro punto que merece mención es el de los pacientes con IM aguda tras un infarto de miocardio. Se han descrito series con buenos resultados con reparación mitral percutánea, fundamentalmente cuando la anatomía es favorable, e incluso un estudio indica que puede haber un beneficio pronóstico cuando se compara con la cirugía18,30.
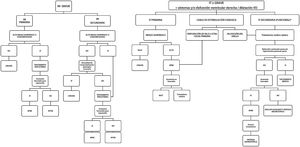
Como resumen, en la figura 4 se muestra el algoritmo de tratamiento de la IM tanto primaria como secundaria.
Figura central. Esquema de tratamiento de la IM y de la IT. IM: insuficiencia mitral; IT: insuficiencia tricuspídea; RPVT: reemplazo percutáneo de la válvula tricúspide; RPBB: reparación percutánea borde a borde; RPVM: reemplazo percutáneo de la válvula mitral.
*En pacientes con IT grave secundaria sometidos a intervención quirúrgica del lado izquierdo, se debe actuar sobre la válvula tricúspide.
En cuanto a la selección de pacientes para reemplazo percutáneo de la válvula mitral, en la tabla 4 se resumen los criterios de selección frente a reparación. Cuando la selección es adecuada, los resultados obtenidos con la prótesis Tendyne (Abbott Vascular) son positivos31,32.
Factores que favorecen el reemplazo percutáneo de la válvula mitral frente a la reparación percutánea
| Anatomía mitral que indica imposibilidad de reducir la IM a grado 0-1 con la reparación borde a borde |
| Alta probabilidad de estenosis mitral con técnica borde a borde |
| Calcificación anular mitral grave |
| FEVI> 30% |
| Estabilidad hemodinámica |
FEVI: fracción de eyección del ventrículo izquierdo; IM: insuficiencia mitral.
La insuficiencia tricuspídea (IT) moderada o grave se identifica hasta en el 4% de los pacientes mayores de 75 años33. Por lo tanto, es una entidad con una gran prevalencia directamente proporcional a la edad34.
La IT crónica conduce a una sobrecarga de volumen del ventrículo derecho (VD), que produce su remodelado y contribuye al empeoramiento progresivo de la IT34. Este proceso, que además se retroalimenta, lleva implícitos un deterioro de la supervivencia y síntomas de congestión, cualesquiera sean la presión pulmonar y la función sistólica del VI35–37.
La IT se ha considerado tradicionalmente una entidad benigna en probable relación con un desarrollo tardío de síntomas secundarios a disfunción o dilatación significativa del VD o hipertensión pulmonar. La cirugía en estas fases de la enfermedad supone un elevado riesgo: se ha descrito una mortalidad hospitalaria que oscila entre el 10 y el 35% en pacientes con cirugía cardiaca previa sometidos a cirugía valvular tricúspide38, atribuida al planteamiento tardío de la intervención valvular.
El desarrollo de técnicas percutáneas para el tratamiento de las valvulopatías aórtica y mitral ha conllevado un crecimiento exponencial en el estudio y el interés en la IT, al plantearse también la opción de un potencial abordaje percutáneo de esta afección, tradicionalmente considerada benigna y, en consecuencia, infratratada.
Todas estas novedades llevarán a un enfoque o algoritmo diagnóstico y terapéutico, que se tratan a continuación, centrados principalmente en la selección del momento y la estrategia más apropiados para la intervención del paciente con IT grave, subrayando la relevancia de no esperar a que el paciente evolucione hacia fases avanzadas de la enfermedad.
DIAGNÓSTICOLa ecocardiografía sigue siendo la técnica de imagen de primera elección en el diagnóstico y el seguimiento de la IT. La válvula tricúspide está formada por los velos, el anillo, el aparato subvalvular (cuerdas tendinosas y músculos papilares) y el VD. El diagnóstico de la IT exige la descripción de su etiología, su mecanismo y su gravedad, así como la anatomía de las cavidades derechas y la estimación de las presiones pulmonares12,39.
Si la ETE no permite identificar el tipo anatómico de la tricúspide, puede utilizarse la resonancia magnética cardiaca (cardio-RM) como alternativa diagnóstica. La TC permite una mejor valoración del anillo tricuspídeo y su grado de calcificación, datos fundamentales en la valoración previa procedimientos de intervención percutánea. En todos los casos es importante valorar el tamaño y la función del VD inicialmente con ecocardiograma transtorácico 2D y 3D, pero la cardio-RM es el patrón de referencia para la valoración12,40–42. En la tabla 5 se resume la actual clasificación del mecanismo de IT y se describe su etiología en cada grupo12,41,43.
Mecanismos y etiología de la insuficiencia tricuspídea
| Anatomía de velos | Patológica | Normal | Normal | Normal | Patológica |
|---|---|---|---|---|---|
| Etiología | Carpentier ICongénitaEndocarditisCarpentier IITraumáticaPosbiopsiaDegeneración mixoideCarpentier IIIARadioterapiaReumáticaCarcinoideTumor | Carpentier I:Dilatación anular secundaria a dilatación de la AI (fibrilación o flutter auricular, ICc, edad) | Carpentier IIIB:Dilatación anular secundaria a dilatación del VD (valvulopatía izquierda, HTP, infarto del VD, miocardiopatía del VD) | Carpentier IIIB:Dispositivo de estimulación (MP, DAI, TRC) | Carpentier I:Dispositivo de estimulación (MP, DAI, TRC) |
| Fisiopatología | Alteración estructural que genera déficit de coaptación de los velos por exceso de movimiento o por restricción de este | Dilatación anular secundaria a crecimiento y disfunción de la AD con VD que suele ser normal | Dilatación anular secundaria a crecimiento y disfunción del VD con tethering de los velos | Desplazamiento o interferencia con los velos del cable | Adherencia, perforación, laceración de los velos o rotura del aparato subvalvular por el cable |
| Diagnóstico por imagen | Anomalías anatómicas y de movilidad de los velos y el aparato subvalvular | Dilatación anularMovilidad normal de los velosCrecimiento y disfunción de la ADEl VD suele ser normal | Tethering de los velosMovilidad de los velos restringida en sístoleDilatación del anillo, el VD y la AD y posible disfunción del VD y la AD | Alteración de la movilidad de los velosPuede tener alteraciones estructurales de los velosSuele haber dilatación del anillo, el VD y la AD | Adherencia, perforación, laceración de los velos o rotura del aparato subvalvular por el cable |
AD: aurícula derecha; ICc: insuficiencia cardiaca con función sistólica conservada; DAI: desfibrilador automático implantable; HTP: hipertensión pulmonar; MP: marcapasos; TRC: terapia de resincronización cardiaca; VD: ventrículo derecho.
Elaborada con datos de Hahn et al.41.
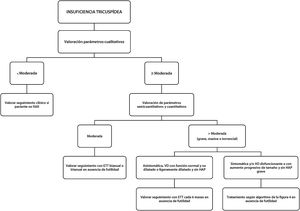
La estimación de la gravedad de la IT exige una valoración multiparamétrica que incluye parámetros cualitativos, semicuantitativos y cuantitativos. En 2017 se incrementaron los grados de IT añadiendo a la clasificación clásica los grados masivo y torrencial44, de los que se ha demostrado una mejor valoración pronóstica en relación con muerte o necesidad de ingreso por IC. La actual clasificación de la IT se muestra en la tabla 6. La figura 5 indica cómo evaluar y seguir a un paciente con IT en la práctica clínica diaria12,39,41,44.
Valoración de la gravedad de la insuficiencia tricuspídea
| Grado | ||||||
|---|---|---|---|---|---|---|
| Variable | Ligero | Moderado | Grave | Masivo | Torrencial | Papel en la cuantificación |
| Cualitativa | ||||||
| Anatomía de la válvula | N/aN | N/aN | N/aN | N/aN | N/aN | Los parámetros cualitativos diferencian la IT grave o grado mayor que el resto |
| Jet por Doppler color | Pequeño central | Moderado central | Importante central o excéntrico | Importante central o excéntrico | Importante central o excéntrico | |
| Registro Doppler continuo del chorro regurgitante | Parabólico | Parabólico o triangular | Triangular pico precoz | Triangular pico precoz | Triangular pico precoz | |
| Semicuantitativa | ||||||
| Vena contracta | <3 mm | 3-6,9 mm | 7-13 mm | 14-20 mm | ≥ 21 mm | Diferencia grave o mayor que el resto |
| Radio de PISA | ≤ 5 mm | 6-9 mm | > 9 mm | |||
| Flujo en venas hepáticas | Dominancia sistólica | «Embotamiento sistólico» | Flujo sistólico inverso | Flujo sistólico inverso | Flujo sistólico inverso | Fundamental para definir grave o superior |
| Llenado tricuspídeo | E dominante ≥ 1 m/s | E dominante ≥ 1 m/s | E dominante ≥ 1 m/s | |||
| Vena contracta 3D u ORE cuantitativo | 75-94mm2 | 95-114mm2 | ≥ 115mm2 | |||
| Cuantitativa | ||||||
| ORE (PISA) | <20mm2 | 20-39mm2 | 40-59mm2 | 60-79mm2 | ≥ 80mm2 | El mejor parámetro |
| Volumen regurgitante | <30 ml | 30-44 ml | ≥ 45ml | ≥ | ≥ | |
| Fracción regurgitante | ≤ 15% | 16-49% | ≥ 50% | ≥ | ≥ | |
| Parámetros estructurales | ||||||
| Dilatación de cavidades | +/– | + | ++ (según etiología) | +++ (según etiología) | +++ (según etiología) | |
| Vena cava inferior | <2 cm | 2,1-2,5 cm | > 2,5 cm | > 2,5 cm | ||
IT: insuficiencia tricuspídea; ORE: orificio regurgitante efectivo.
La imagen multimodal es imprescindible para una adecuada valoración de la IT, especialmente en el contexto de la aproximación terapéutica percutánea. La cardio-RM es el patrón de referencia para la valoración de cavidades derechas, por lo que es imprescindible para evaluar la repercusión de la IT en estas estructuras. La función del VD puede condicionar la viabilidad de las diferentes opciones terapéuticas. La cuantificación del calcio y la valoración de estructuras extracardiacas abordables mediante intervención percutánea precisa la cardio-TC. En la tabla 7 se muestran la fortaleza de las diferentes técnicas de imagen multimodal en la valoración de la IT y su indicación en relación con los procedimientos de intervención percutánea. Las limitaciones anatómicas para las diferentes formas de abordaje percutáneo se resumen en la tabla 812,39,41,44,45.
Papel de las técnicas de imagen en la valoración previa a la intervención
| Fortalezas | Limitaciones | Uso en intervencionismo | |
|---|---|---|---|
| ETT (2D y 3D) | Anatomía valvularMecanismo, etiología y grado de la ITValoración del VD, la AD y las cavidades izquierdasValoración hemodinámica pulmonarBuena resolución temporal y espacialNo irradia | VentanaRequiere experienciaTransportable | Valoración previa y guía de la técnica borde a bordeValoración previa a la anuloplastia percutáneaValoración previa al implante percutáneo de prótesis |
| ETE (2D y 3D) | Anatomía valvularMecanismo, etiología y grado de la ITValoración del VD, la AD y las cavidades izquierdasValoración hemodinámica pulmonarGuía de los procedimientosBuena resolución temporal y espacialNo irradiaPosprocesados automáticos del 3D | VentanaContraindicaciones para ETESedación o anestesiaRequiere experienciaTransportable | Valoración previa y guía de la técnica borde a bordeValoración previa y guía para el implante percutáneo de anillosValoración previa y guía para el implante percutáneo de válvulas |
| Cardio-TC | Tamaño, morfología y calcificación anularIdentificación de estructuras adyacentes y su estado (también coronariografía)Identificación de proyecciones ideales de fluoroscopiaValoración de estructuras extracardiacas (cavas)Valoración vascular extracardiacaExcelente resolución espacial | RadiaciónDisponibilidadPrecisa contraste yodadoPoca resolución temporalNo transportableNo es posible con arritmias o frecuencias cardiacas altasArtefacta el calcio y los dispositivos metálicos | Valoración previa a técnicas de anuloplastia e implante percutáneo de prótesis tricuspídeaValoración previa al implante de prótesis extracardiacas |
| Cardio-RM | Valoración del grado de ITCuantificación de la morfología y la función del VD (patrón de referencia)Caracterización tisular (con o sin gadolinio)Buena resolución temporal y espacialValoración de cavasProporciona información hemodinámicaNo irradia | DisponibilidadUso de gadolinio opcionalResolución espacial menor que con ecografía y TCResolución temporal menor que con ecografíaNo es posible con arritmias o frecuencias cardiacas altasNo visualiza el calcioIncompatible con determinados dispositivosSubestima velocidades máximasNo transportable | Valoración de cavidades derechas previas a la intervención |
| Fluoroscopia | Anatomía coronaria | Radiación | Guía para intervención apoyada en ETE |
| Estudio hemodinámico derecho | Patrón de referencia para la valoración de presiones en circuito derecho, reversibilidad y respuesta de estas a sobrecargas de volumen | Requiere experienciaRadiación | Imprescindible antes de la toma de decisiones para intervención percutánea |
2D: bidimensional; 3D: tridimensional; cardio-TC: tomografía computarizada cardiaca; cardio-RM: cardiorresonancia magnética; ETE: ecocardiografía transesofágica; ETT: ecocardiografía transtorácica; IT: insuficiencia tricuspídea; VD: ventrículo derecho.
Características anatómicas para seleccionar la idoneidad de cada dispositivo
| Técnica | Ideal | Posible | Desfavorable |
|---|---|---|---|
| Reparación borde a borde | Gap septolateral <7 mmChorro central con opción de grasping anteroseptalVelos ≥ 7mm con prolapso o IT secundaria con movilidad de velos normalVálvula trivalvaSin cables de dispositivos | Gap septolateral 7-8,5 mmChorro central en válvula con más de 3 comisuras con posibles zonas de graspingFlail o prolapso <10 mmAltura de tethering <9mm con reducción de movilidad de los velosCables de dispositivo pero sin daño valvular | Gap> 8,5 mmEngrosamiento grave o longitud <7mm o perforación de los velosFlaps o tethering mayores que lo posibleAfección importante del aparato subvalvularChorro no central, excéntrico o múltiples chorros con enfermedad torrencial (VC <14 mm)Cable de dispositivo con daño valvularHipertensión pulmonar grave |
| Anuloplastia | IT secundaria a dilatación anularAltura <0,76cm, área de tethering <1,63cm2 o volumen 3D <2,3 mlIT centralExistencia de suficiente zona anatómica de liberación | Portador de dispositivo sin lesión de velosTethering con altura 0,76-1cm, área 1,63-2,5cm2 o volumen 3D 2,3-3,5ml | Excesiva dilatación anularAltura de tethering> 1cm, área> 2,5cm2 y volumen 3D> 3,5 mlProximidad de coronaria derecha al anillo tricúspidePortador de dispositivo con lesión de velosHipertensión pulmonar grave |
| Prótesis tricuspídea percutánea | Portador de bioprótesis o anuloplastia tricuspídeaPortador de dispositivo sin lesión de velosVelos acortados o engrosados | Portador de dispositivo con lesión de velos | Excesiva dilatación anularDificultad anatómica para la liberación del dispositivoDisfunción grave del VDHipertensión pulmonar grave |
| Prótesis heterotópica | Tamaño de cavas adecuado | Distancia entre la AD y el origen de las venas hepáticas <10 mmHipertensión pulmonar graveDisfunción grave del VD |
AD: aurícula derecha; IT: insuficiencia tricuspídea; VC: vena contracta; VD: ventrículo derecho.
Como ya se ha comentado, la IT es un predictor independiente de mal pronóstico en todos los contextos clínicos en los que se presenta35. El reciente desarrollo de las técnicas percutáneas de reparación ofrece una alternativa efectiva y con bajo riesgo de complicaciones que podría aplicarse al tratamiento de la IT en casos seleccionados.
CirugíaEn pacientes con IT secundaria, la cirugía aislada sobre la válvula tricúspide en ausencia de indicación quirúrgica para las válvulas mitral o aórtica resulta controvertida y rara vez se lleva a cabo debido al perfil de riesgo de estos pacientes y el elevado riesgo de complicaciones posoperatorias46,47. Las técnicas transcatéter están cobrando una especial importancia en esta situación. Además, en el caso de la IT secundaria en pacientes que van a ser operados de IM, la intervención temprana sobre la válvula tricúspide muestra una menor necesidad de intervención durante el seguimiento, pero a costa de una elevada incidencia de implante de marcapasos en pacientes a los que se implanta un anillo rígido (el 14,1 frente al 2,5%)48.
Para la IT primaria, la cirugía cardiaca es hoy por hoy la técnica de elección para su corrección. Se favorece la reparación, siempre que sea posible, y en el caso de que se requiera la sustitución valvular adquiere fuerza la utilización de bioprótesis, con las que se evitaría la anticoagulación oral y se posibilitaría una futura intervención valve-in-valve en caso de disfunción protésica.
Tratamiento médicoEl tratamiento médico o conservador tiene un reducido número de opciones, dirigidas a tratar los mecanismos que producen esta IT funcional. Los diuréticos son la base del tratamiento para evitar la sobrecarga de volumen del VD y tratar los signos de IC derecha. Los antagonistas de la aldosterona también pueden ser útiles en caso de congestión hepática. Están contraindicados los vasodilatadores pulmonares para la IT secundaria a hipertensión pulmonar en pacientes con valvulopatía izquierda corregida, por asociarse con un peor pronóstico49. En casos de IT secundaria a dilatación del anillo atribuible a fibrilación auricular, una estrategia de control del ritmo puede ser útil, aunque su efectividad no está claramente establecida.
Es importante recalcar que en pacientes candidatos a actitud invasiva, el tratamiento médico no debe utilizarse como argumento para retrasar una eventual intervención. Diferir el tratamiento invasivo a las fases finales de la enfermedad disminuye la probabilidad de que se recuperen las funciones del VD, renal y hepática aunque se logre disminuir la congestión venosa central y del VD.
Intervención percutánea de la válvula tricúspideLas técnicas transcatéter permiten reparar la válvula tricúspide emulando técnicas quirúrgicas, pero evitando la toracotomía y la circulación extracorpórea, que resultan especialmente deletéreas en los pacientes con disfunción del VD.
Reparación borde-a-bordeLos dispositivos de reparación borde-a-borde son los más utilizados en la actualidad. La ventaja principal de esta técnica es que permite abordar desde etiologías funcionales a IT debidas a presencia de dispositivos (marcapasos). La mayor limitación viene dada por la ventana ecocardiográfica, sobre todo en los pacientes operados de válvula mitral.
La experiencia inicial con el dispositivo MitraClip dio lugar a una modificación de la vaina de liberación y el catéter guía del dispositivo que posibilitaba un mejor encaramiento a la válvula tricúspide y consigue una mayor coaxialidad con los velos, denominado TriClip (Abbott, Estados Unidos). El TriClip se evaluó en el estudio prospectivo TRILUMINATE, que incluyó a 85 pacientes, el 63% con IT masiva o torrencial. Se consiguió a los 12 meses una reducción significativa de la IT (moderada o menos) en el 71% de los pacientes. Estos hallazgos se acompañaron de una mejoría de la clase funcional (NYHA I-II, el 83 frente al 31% basal), reducción de reingresos por IC (0,8 eventos/paciente/año frente a 1,30 inicial), mejora de las pruebas de calidad de vida (incremento de 10 puntos del KCCQ en el 65% de los pacientes) y reducción de los diámetros ventriculares/auriculares del VD y la tasa de complicaciones mayores al año50. La mortalidad al año fue del 7,1% (el 4,8% cardiovascular). En la actualidad se está evaluando esta misma técnica en el estudio prospectivo bRIGHT (NCT04483089) donde se incluye la posibilidad de utilizar los 4 tamaños de dispositivos actualmente disponibles (NT, XT, NTW y XTW), y también está en marcha el ensayo fundamental Triluminate (NCT03904147), en el que se compara TriClip con el tratamiento médico.
El dispositivo PASCAL se ha evaluado con versión P10 en una serie de 34 pacientes, el 78% IT masiva o torrencial, y se observó una reducción de la IT a menor que moderada en el 52% y una reducción de al menos 1 grado en el 85% de los casos51. En proceso de evaluación está la versión ACE del dispositivo (con abrazaceras —clasps— más estrechas y sin espaciador), con la que se espera una mayor tasa de reducción de la IT.
AnuloplastiaEl dispositivo de anuloplastia directa Cardioband (Edwards Lifesciences) emula un anillo quirúrgico flexible que se implanta mediante una banda ajustable que se ancla con un sistema de tornillos52. Permite tratar a pacientes con defectos de coaptación amplios, difíciles de abordar con la técnica borde-a-borde, pero tiene la limitación anatómica de anillos amplios o con proximidad de la coronaria derecha al anillo. Otra ventaja de este dispositivo es que no limita ninguna otra técnica de reparación o sustitución valvular.
En el estudio TRI-REPAIR se incluyó a 30 pacientes, en los que se consiguió una reducción significativa de la IT a menos que moderada en el 72% a los 2 años pese a partir una IT masiva o torrencial en el 76%53.
Sustitución valvular percutáneaLa experiencia inicial con el acceso transauricular demostró una elevada morbimortalidad, por lo que el paso a dispositivos que posibilitan un implante transfemoral parece ineludible.
En este sentido, la válvula EVOQUE (Edwards Lifesciences) se ha utilizado como tratamiento compasivo en 25 pacientes; el implante se pudo realizar con éxito en 23 de ellos, con una IT residual mínima o ligera en el 100% de los pacientes. El 8% requirió el implante de un marcapasos definitivo54.
La sustitución valvular permite ampliar el abanico terapéutico del abordaje percutáneo de la IT e incluir a los pacientes con defectos complejos y anillos más amplios. Pero ello no debe llevar a tratar a pacientes con enfermedad evolucionada, a los que el tratamiento proporciona poco beneficio clínico.
Prótesis heterotópicasLas prótesis heterotópicas de cavas TricValve (Products+Features, Alemania)55 y TRICENTO (MEDIRA, Alemania)56 permiten mitigar los síntomas de la IT sin abordar directamente su causa. Por ello deberían utilizarse principalmente en situaciones en las que los tratamientos de reparación se han descartado o han fracasado.
Algoritmo de abordaje de la insuficiencia tricuspídeaEl elevado riesgo que acarrea la IT debería hacer que el tratamiento de referencia para estos pacientes pase de ser puramente médico a incorporar las opciones de corrección invasiva57. En los pocos casos de pacientes jóvenes sin comorbilidades significativas, la cirugía seguirá siendo una opción viable, mientras que las técnicas de reparación percutánea emergen como una mejor opción para la mayoría (figura 4). Resulta necesaria la búsqueda activa de pacientes con IT en los grupos susceptibles de sufrirla: operados de válvula mitral, con fibrilación auricular o portadores de dispositivos de estimulación cardiaca.
Un aspecto pendiente de resolver es el momento óptimo de intervención, para el que la evidencia es menos robusta que en valvulopatía mitral o aórtica. Este grupo aboga por una consideración precoz de las opciones de reparación percutánea debido a: a) mejora la probabilidad de recuperación funcional de los órganos afectados, dado que la aparición de síntomas suele indicar enfermedad terminal, y b) el buen perfil de seguridad de las técnicas de reparación percutánea.
CONCLUSIONESEl presente documento resume el posicionamiento común de la Asociación de Cardiología Intervencionista, la Asociación de Imagen Cardiaca, la Sección de Valvulopatías y Patología Aórtica y la Asociación de Cardiología Clínica de la Sociedad Española de Cardiología para el diagnóstico y el tratamiento de la valvulopatía mitral y tricuspídea.
FINANCIACIÓNNo hay financiación.
CONTRIBUCIÓN DE LOS AUTORESTodos los autores han participado por igual en la elaboración de este documento.
CONFLICTO DE INTERESESR. Estévez-Loureiro es proctor de Abbott Vascular, Edwards Lifesciences, Boston Scientific y Products and Features. D. Arzamendi es proctor de Abbott Vascular, Edwards Lifesciences y Boston Scientific. I. Cruz González es proctor de Abbott Vascular, Boston Scientific y Products and Features, y consultor de Edwards Lifesciences.
Asociación de Cardiología Intervencionista de la SEC: I. Cruz González, presidente; R. Estevez Loureiro y D. Arzamendi.
Asociación de Imagen Cardiaca de la SEC: L. Borreguero, presidente. A. Martínez-Monzonis, presidenta electa; M. Barreiro.
Sección de Valvulopatías y Patología Aórtica de la SEC: I. Vilacosta, presidente; C. Olmos Blanco y J.C. Gómez Polo.
Asociación de Cardiología Clínica de la SEC: J.M. Gámez, presidente; A. Aguilera y L.M. Rincón.