Los stents farmacoactivos (SF) tuvieron un éxito inicial considerable1. Sin embargo, no pasó mucho tiempo antes de que surgieran preocupaciones sobre la inflamación y el retraso de la cicatrización causados por los polímeros farmacoactivos2 y el riesgo de trombosis tardía del stent3,4. Se han elaborado varias estrategias para mejorar la seguridad de los SF sin comprometer su eficacia en la prevención de la reestenosis. Entre ellas, se encuentran más polímeros permanentes más biocompatibles5, polímeros biodegradables6 y tecnología sin polímeros7. Sin embargo, los stents metálicos no farmacoactivos no han perdido su reputación como dispositivos más seguros y los esfuerzos se han centrado en la fabricación de recubrimientos especiales pasivos8 o bioactivos9 que mejoren tanto la seguridad como la eficacia de los stents metálicos sin recubrimiento. En este contexto, varios tipos de material del puntal o strut (desde el acero inoxidable hasta el cobalto-cromo), grosor del strut (hasta 81μm), arquitectura del stent (actualmente un diseño helicoidal) y tecnología de recubrimiento (recubrimiento con óxido de nitruro de titanio por deposición química de titanio en fase de vapor mejorada por plasma en una mezcla de gas preespecificada de nitrógeno y oxígeno) han llevado a la creación del stent Titan-2 (Hexacath, Francia)10 y, en última instancia, a la del stent OPTIMAX (Hexacath, Francia)11.
No hay duda de que los ensayos clínicos de distribución aleatoria, con suficiente potencia y seguimiento a largo plazo son la mejor manera de evaluar las ventajas relativas de las tecnologías que incorpora el stent en pacientes con coronariopatía. Sin embargo, se necesitan recursos considerables y un largo intervalo de tiempo antes que se conozcan las verdaderas ventajas. Por tanto, los parámetros indirectos que pueden evaluarse en un tamaño de muestra factible de pacientes durante un periodo más corto pueden ser de gran ayuda si son capaces de predecir eventos trombóticos posteriores. En este sentido, la tomografía de coherencia óptica (OCT) intravascular con su excelente resolución espacial es una valiosa tecnología de estudio. Se encontró que los struts del stent no recubiertos o con mala aposición, así como la neoateroesclerosis, subyacían a la trombosis del stent en un grado que dependía del momento de su aparición (subaguda, tardía y muy tardía)12.
En un artículo reciente publicado en Revista Española de Cardiología, Sia et al.13 comunican los resultados del OPTIMAX-OCT, un estudio de distribución aleatoria en que se comparó el uso del stent bioactivo (SBA) OPTIMAX, con el del SYNERGY (Boston Scientific Corporation, EE. UU.), un stent liberador de everolimus (SLE) con polímero biodegradable, en pacientes que presentaban síndrome coronario agudo (SCA) y lesiones de novo en una arteria coronaria nativa. El objetivo principal del estudio fue el porcentaje de struts no recubiertos por paciente y el objetivo coprincipal fue el porcentaje de struts con mala aposición por paciente, que se evaluaron con el uso de un solo estudio de OCT en 2 cohortes separadas correspondientes a 2 momentos: cohorte A (52 pacientes) a los 30 días y cohorte B (30 pacientes) a los 6 meses. Al parecer, se trata de un estudio autónomo, independiente del ensayo TIDES-ACS11.
Se observaron diferencias considerables tanto a los 30 días como a los 6 meses. A los 30 días, la proporción de stents no recubiertos por strut fue del 4,3% en el grupo de SBA frente al 27,5% en el grupo de SLE; la proporción de struts con mala aposición por strut fue del 1,2% en el grupo de BSA y del 3,2% en el grupo de SLE. Las diferencias se mantuvieron a los 6 meses con el 0,8% de struts no recubiertos y el 0,1% de struts con mala aposición en el grupo de SBA frente al 14,5% de struts no recubiertos y el 1,1% de struts con mala aposición en el grupo de SLE. La OCT identificó pequeños trombos intrastent en 2 pacientes con SBA y en 7 pacientes con SLE a los 30 días, pero en ninguno a los 6 meses. Además, el espesor de la hiperplasia neointimal en el strut fue mayor en el grupo de SBA (0,25mm) que en el grupo de SLE (0,09mm).
Las ventajas del presente trabajo son: a) utiliza un diseño de estudio de distribución aleatoria; b) utiliza un método de diagnóstico sensible como la OCT para evaluar los criterios de valoración del estudio; y c) incluía a pacientes con SCA. Los hallazgos previos sugieren que los indicadores de OCT de retraso en la cicatrización están más presentes en pacientes con SCA que en aquellos con síndromes coronarios crónicos14. Por tanto, las conclusiones del presente estudio son relevantes para un subconjunto de pacientes en los que las diferencias en las características del stent podrían ser más trascendentales que en otros contextos clínicos. d) La selección del momento de evaluación a los 6 meses en una de las cohortes es razonable si se tiene en cuenta la cinética de absorción del polímero del SLE15. e) Compara 2 tecnologías de stent que están específicamente diseñadas para abordar el retraso en la cicatrización evitando la presencia de polímeros permanentes.
Sin embargo, el estudio también tiene algunas limitaciones: a) faltan pruebas sólidas que respalden el papel pronóstico de los struts sin recubrir o con mala aposición tardía16 y todavía existe la necesidad de estudios prospectivos diseñados específicamente con un número suficientemente grande de pacientes; b) el número de pacientes es limitado; c) falta una evaluación de OCT al final de la intervención inicial. La mala aposición del strut identificada a los 30 días y a los 6 meses podría haber sido residual (ya presente en la OCT aguda) o adquirida a lo largo del tiempo. La mala aposición adquirida tardíamente se considera un marcador de inflamación crónica y deterioro de la cicatrización, y tiene un impacto
más negativo, aunque esto aún no se ha confirmado en estudios clínicos17; d) falta caracterización cualitativa de la neoíntima a los 6 meses en el presente estudio. Esto podría haber sido más importante para el grupo de SBA, que tenía hiperplasia neointimal más abundante. A las características del tejido neointimal también se les atribuye un papel pronóstico18.
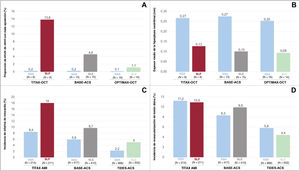
En resumen, el presente estudio de OCT mostró una mayor formación de neoíntima, por un lado, y menos struts no recubiertos y con mala aposición, por otro lado, con SBA que con un SF convencional de nueva generación. Nada espectacular hasta ahora. Con un sistema que no es SF, como el SBA, no es sorprendente este conjunto de hallazgos. Sin embargo, la relevancia de los presentes hallazgos se evalúa mejor si se sitúa en el contexto de la OCT y la evidencia clínica disponible de los estudios de distribución aleatoria sobre SBA (ya sea Titan-2 u OPTIMAX). Hay 3 comparaciones aleatorizadas entre SBA y SF, para las cuales se dispone tanto de la OCT como de los resultados clínicos (figura 1). En un subgrupo de 18 pacientes del ensayo TITAX AMI, la OCT se realizó, de media, ∼4 años después de la aleatorización. La proporción de stents no recubiertos a la altura del strut fue del 0,4% en el grupo de SBA y del 10,8% en el grupo de stents liberadores de paclitaxel (SLP). En consecuencia, la proporción de struts con mala aposición fue menor en el grupo de SBA (el 0,2 frente al 13,8% en el grupo de SLP). El espesor de la hiperplasia neointimal fue de 0,27mm en el grupo de SBA y de 0,13mm en el grupo de SLP19. El ensayo TITAX AMI completo, que incluía a 425 pacientes con infarto agudo de miocardio, mostró resultados a 5 años favorables a SBA en relación con muerte cardiaca (pero no en relación con muerte por cualquier causa), infarto de miocardio recurrente y trombosis definitiva del stent en comparación con SLP, sin diferencia en la revascularización de la lesión diana10. En un subgrupo de 28 pacientes del ensayo BASE-ACS (Comparison of Bio-Active Stent to the Everolimus-Eluting Stent in Acute Coronary Syndrome), la OCT se realizó, de media, ∼10 meses después de la aleatorización. Las proporciones de struts no recubiertos y con mala aposición fueron del 0,6 y el 0,2%, respectivamente, en el grupo de SBA y del 10,8 y el 4,6%, respectivamente, en el grupo de SLE con polímeros permanentes. El espesor de la hiperplasia neointimal fue de 0,27mm en el grupo de SBA y de 0,10mm en el grupo de SLE20. El ensayo BASE-ACS completo, que incluyó a 827 pacientes con SCA, mostró resultados a 5 años que favorecían el SBA por lo que respecta a infarto de miocardio no mortal, mientras que todos los demás resultados fueron comparables entre SBA y SLE, como la revascularización de la lesión diana21. Los resultados del presente estudio de OCT13 también deben tenerse en cuenta en relación con el gran ensayo clínico TIDES-ACS, que asignó aleatoriamente a 1.491 pacientes a SBA o SLE11. A los 18 meses de seguimiento, los resultados favorecieron al SBA por lo que respecta a trombosis del stent e infarto de miocardio sin diferencias considerables en la revascularización de la lesión diana11. Sin embargo, conviene ser prudente al interpretar los resultados mencionados porque las diferencias a favor del SBA se observaron en resultados que no representaban el objetivo principal de los ensayos y carecían de la potencia estadística requerida. A pesar de todas las limitaciones mencionadas anteriormente, un denominador común de los ensayos clínicos es que el SBA, un stent metálico no farmacoactivo y con un recubrimiento único, podría reducir el número de eventos trombóticos si se utilizara en pacientes con SCA sin compromiso clínicamente relevante en el riesgo de reintervención. Los estudios de OCT correspondientes sugieren indirectamente que con el SBA una mejor cicatrización vascular podría subyacer al potencial de beneficio clínico con esta prótesis. La figura muestra un resumen de los resultados de estos estudios, con las medidas de seguridad en los paneles de la izquierda y las medidas de eficacia en los paneles de la derecha. Se necesitan estudios clínicos y de OCT combinados para establecer si los estudios aislados de OCT a corto y medio plazo son suficientes para predecir el rendimiento a largo plazo de las tecnologías de stent coronario y obviar la necesidad de ensayos clínicos grandes con seguimiento a largo plazo.
Hallazgos de la tomografía de coherencia óptica y resultados clínicos en estudios de distribución aleatoria sobre stents bioactivos recubiertos con óxido de nitruro de titanio frente a stents farmacoactivos. A: struts de stent con mala aposición. B: espesor de la hiperplasia neointimal. C: infarto de miocardio. D: revascularización de la lesión diana. Los datos de la tomografía de coherencia óptica se obtuvieron después de ∼4 años en TITAX-OCT19, ∼10 meses en BASE-ACS20 y 6 meses en OPTIMAX-OCT13. Los resultados clínicos se evaluaron a los 5 años en TITAX AMI10 y BASE-ACS21, y a los 18 meses en TIDES-ACS11. Los datos de la OCT se muestran a la altura del strut. SBA, stent bioactivo recubierto con óxido de nitruro de titanio; SLE, stent liberador de everolimus; SLP, stent liberador de paclitaxel.
No se ha recibido financiación específica.
CONFLICTO DE INTERESESNinguno.