La definición de la disfunción cardiaca relacionada con el tratamiento oncológico (DC-TO) ha cambiado en los últimos años. Actualmente, la DC-TO se clasifica en leve cuando hay una elevación de troponina o un cambio> 15% en el strain longitudinal global (SLG) respecto su valor basal con fracción de eyección del ventrículo izquierdo (FEVI) ≥ 50%; moderada cuando la FEVI cae 10 puntos y se sitúa entre el 40 y el 49%, y grave cuando la FEVI se reduce por debajo del 40%1. En la recién publicada guía de Cardio-Oncología2, en casos de DC-TO leve se recomienda iniciar bloqueadores beta e inhibidores de la enzima de conversión de la angiotensina (IECA) para evitar la progresión a DC-TO moderada o grave, con una clase de recomendación IIa y nivel de evidencia B2.
En el presente estudio se determinó la incidencia de DC-TO en una cohorte de pacientes con cáncer de mama HER2 positivo precoz (CM-HER2p). Asimismo se analizó el valor de la troponina I ultrasensible (TnI-us) y del SGL predictivo de la aparición de DC-TO moderada o grave y su potencial utilidad para iniciar un tratamiento cardioprotector.
Entre mayo de 2018 y mayo de 2021, se incluyó a 95 pacientes con CM-HER2p consecutivos en un centro de tercer nivel. Los criterios de exclusión fueron una FEVI basal <50%, la presencia de una cardiopatía que pudiera condicionar un deterioro de la FEVI en el seguimiento y haber recibido quimioterapia previamente. Se realizó seguimiento clínico y ecocardiográfico basal y cada 3 meses hasta finalizar el tratamiento. Se analizó la FEVI por el método de Simpson biplanar y se proporcionó el valor promedio del SGL regional obtenido a través del análisis de 2, 3 y 4 cámaras. Se realizaron determinaciones de TnI-us en cada ciclo de tratamiento; se consideró positiva al superar el umbral de referencia del laboratorio (> 40 ng/l). En caso de DC-TO, se realizó una cardiorresonancia magnética (CRM). Los valores de T1 y T2 nativos se obtuvieron del valor promedio de los 16 segmentos en eje corto en las secuencias de mapeo en T1 y T2 y el volumen extracelular se calculó a partir de las secuencias de mapeo en T1 antes y después del contraste. Por protocolo, se inició tratamiento con IECA o bloqueadores beta solo en casos de DC-TO moderada-grave.
En la tabla 1 se muestran las características basales de las pacientes. El 48,4% recibió tratamiento secuencial con antraciclinas y terapia anti-HER2 y el 51,6%, terapia anti-HER2 sin antraciclinas. Con un seguimiento medio de 13,6 meses, no se presentó DC-TO sintomática. Sin embargo, la incidencia de DC-TO asintomática fue del 60%: leve en 53 pacientes (55,8%), moderada en 3 (3,2%) y grave en 1 (1,1%). La media de tiempo hasta el diagnóstico de la DC-TO fue de 162,1 días. Por otra parte, 3 pacientes presentaron progresión de la enfermedad oncológica y hubo 1 muerte de causa no cardiovascular. En el análisis bivariado, los factores de riesgo cardiovascular y el uso del doble bloqueo anti-HER2 con pertuzumab no se asociaron con el desarrollo de DC-TO. En el modelo multivariado, ajustado por edad, hipertensión, dislipemia, diabetes y uso de pertuzumab, el único factor asociado con DC-TO fue el uso de antraciclinas (odds ratio=7,78; intervalo de confianza del 95%, 2,55-27,08; p <0,001).
Características diferenciales de los pacientes con CM-HER2p en función del desarrollo de DC-TO y del tratamiento oncológico recibido
| Muestra total (n=95) | Pacientes con tratamiento a base de antraciclinas (n=46) | Pacientes en tratamiento sin antraciclinas (n=49) | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Sin DC-TO, n=38 | Con DC-TO, n=57 | p | Sin DC-TO, n=7 | Con DC-TO, n=39 | p | Sin DC-TO, n=31 | Con DC-TO, n=18 | p | |
| Características basales | |||||||||
| Edad (años) | 55,2±14,1 | 51,6±11 | 0,28 | 51,5±11,7 | 49,5±11,1 | 0,92 | 56±14,6 | 56,1±9,7 | 0,87 |
| Tabaquismo | 11 (29) | 15 (26,3) | 0,87 | 3 (42,9) | 13 (33,3) | 0,75 | 8 (25,8) | 2 (11,1) | 0,38 |
| IMC | 25,5±5,5 | 25,7±5 | 0,58 | 27,1±6,5 | 24,8±3,6 | 0,38 | 25,2±5,3 | 27,7±6,7 | 0,18 |
| Hipertensión | 11 (29) | 7 (12,3) | 0,05 | 2 (28,6) | 3 (7,7) | 0,15 | 9 (29) | 4 (22,2) | 0,75 |
| Diabetes mellitus | 5 (13,2) | 4 (7) | 0,48 | 2 (28,6) | 1 (2,6) | 0,06 | 3 (9,7) | 3 (16,7) | 0,66 |
| Dislipemia | 9 (23,7) | 10 (17,5) | 0,61 | 2 (28,6) | 5 (12,8) | 0,57 | 7 (22,6) | 5 (27,8) | 0,74 |
| Tratamiento basal | |||||||||
| IECA o ARA-II | 2 (5,3) | 2 (3,5) | 1 | 0 | 1 (2,6) | 1 | 2 (6,5) | 1 (5,6) | 1 |
| Bloqueador beta | 1 (2,6) | 1 (1,8) | 1 | 0 | 1 (2,6) | 1 | 1 (3,2) | 0 | 1 |
| Estatinas (n; %) | 1 (2,6) | 2 (3,5) | 1 | 0 | 0 | 1 | 1 (3,2) | 2 (11,1) | 0,71 |
| Datos ecocardiográficos basales | |||||||||
| Diámetro telediastólico del VI | 42,3±4,8 | 42,9±4,6 | 0,52 | 42,3±3,7 | 42,1±4,9 | 0,98 | 42,3±5 | 44,6±3,5 | 0,11 |
| Diámetro telesistólico del VI | 28,3±3,8 | 27,7±3,8 | 0,34 | 29,1±3,9 | 27,4±3,9 | 0,29 | 28,1±3,9 | 28,4±3,7 | 0,91 |
| Aurícula izquierda (cm2) | 16,3±3,6 | 16,5±3,3 | 0,82 | 16,9±2,8 | 15,9±3,2 | 0,34 | 15,8±3,9 | 17,7±3,1 | 0,18 |
| TAPSE (mm) | 21,2±3,5 | 21,9±3,4 | 0,39 | 22,3±2,7 | 22±3,4 | 0,62 | 21±3,7 | 21,6±3,4 | 0,52 |
| SLG medio basal | –21,4±2,2 | –22,1±2,4 | 0,21 | –21,2±1,1 | –22±2,3 | 0,36 | –21,5±2,4 | –22,3±2,6 | 0,02 |
| E/e’ basal | 7±2,6 | 7±1,8 | 0,78 | 7±1,9 | 7,1±1,7 | 0,85 | 7±2,7 | 6,9±2,1 | 0,98 |
| E/e’> 15 | 1 (2,6) | 2 (3,5) | 1 | 0 | 0 | 1 (3,2) | 2 (11,1) | 0,55 | |
| FEVI basal (%) | 61,4±3,3 | 62,1±4 | 0,47 | 58,7±1,4 | 62,2±3,6 | 0,02 | 62±3,2 | 61,9±4,8 | 0,61 |
| Biomarcadores basales | |||||||||
| Troponina I ultrasensible (ng/l) | 3,4±0,8 | 4,8±3,8 | 0,16 | 3±0 | 5±4,3 | 0,10 | 3,5±0,9 | 4,2±2 | 0,54 |
| Variables oncológicas | |||||||||
| Estadio tumoral | 0,34 | 0,24 | 0,31 | ||||||
| I | 10 (26,3) | 5 (8,8) | 0 | 2 (5,1) | 10 (9,7) | 3 (16,7) | |||
| II A | 16 (42,1) | 30 (52,6) | 2 (28,6) | 21 (53,8) | 14 (29) | 9 (50) | |||
| II B | 8 (21,1) | 13 (22,8) | 1 (14,3) | 9 (23,1) | 7 (12,9) | 4 (22,2) | |||
| III A | 1 (2,6) | 4 (7) | 1 (14,3) | 3 (7,7) | 0 | 1 (5,6) | |||
| III B | 1 (2,6) | 2 (3,5) | 1 (14,3) | 2 (5,1) | 0 | 0 | |||
| III C | 2 (5,3) | 3 (5,3) | 2 (28,6) | 2 (5,1) | 0 | 1 (5,6) | |||
| Tratamiento quimioterápico | |||||||||
| Antraciclinas | 7 (18,4) | 39 (68,4) | <0,001 | 7 (100) | 39 (100) | 1 | 0 | 0 | |
| Doxorubicina | 4 (10,5) | 19 (33,3) | 0,02 | 4 (57,1) | 19 (48,7) | 1 | |||
| Doxorubicina liposomal | 1 (2,6) | 2 (3,5) | 1 | 1 (14,3) | 2 (5,1) | 0,39 | |||
| Adriamicina | 2 (5,3) | 20 (35,1) | 0,001 | 2 (28,6) | 20 (51,3) | 0,42 | |||
| Ciclofosfamida | 7 (18,4) | 39 (68,4) | <0,001 | 7 (100) | 39 (100) | 1 | 0 | 0 | |
| Taxanos | |||||||||
| Docetaxel | 14 (36,8) | 14 (24,6) | 0,25 | 0 | 3 (7,7) | 1 | 14 (45,2) | 11 (61,1) | 0,36 |
| Paclitaxel | 24 (63,2) | 44 (77,2) | 0,16 | 7 (100) | 37 (94,9) | 1 | 17 (54,8) | 7 (38,9) | 0,37 |
| Carboplatino | 14 (36,8) | 11 (19,3) | 0,1 | 0 | 0 | 14 (45,2) | 11 (61,1) | 0,38 | |
| Pertuzumab | 26 (68,4) | 51 (89,5) | 0,01 | 7 (100) | 37 (94,9) | 1 | 19 (61,3) | 14 (77,8) | 0,35 |
| Radioterapia | |||||||||
| Dosis media cardiaca | 1,94±1,8 | 1,97±1,8 | 0,91 | 1,55±1 | 1,98±1,7 | 0,68 | 2±1,9 | 1,9±2 | 0,76 |
| Seguimiento: biomarcadores y ecocardiograma | |||||||||
| Elevación de troponina I ultrasensible | 0 | 37 (37,6) | 0 | 35 (89,7) | 0 | 2 (11,1) | |||
| Pico de troponina I ultrasensible | 10,2±10,7 | 123,8±179,1 | <0,001 | 27,3±14,7 | 139,9±132,7 | 0,001 | 6,5±4,5 | 84,6±261,7 | 0,17 |
| Cambio> 15% del SLG | 0 | 36 (63,2) | 0 | 20 (51,3) | 0 | 16 (88,9) | |||
| Peor SLG | –20±2 | –18,7±2,1 | 0,002 | –20,2±1,5 | –19±1,9 | 0,08 | –20±2,1 | –18±2,5 | 0,01 |
| FEVI <50% | 0 | 4 (7) | 0 | 1 (2,6) | 0 | 3 (16,7) | |||
| Peor FEVI (%) | 59,5±2,9 | 57,1±5,5 | 0,02 | 58,1±3,3 | 57,6±3,6 | 0,76 | 59,7±2,8 | 55,9±8,2 | 0,18 |
ARA-II: antagonistas del receptor de la angiotensina II; DC-TO: disfunción cardiaca relacionada con tratamiento oncológico; FEVI: fracción de eyección del ventrículo izquierdo; IECA: inhibidores de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; SLG: strain longitudinal global; TAPSE: desplazamiento sistólico del anillo tricuspídeo; VI: ventrículo izquierdo.
Los valores expresan n (%) o media±desviación estándar.
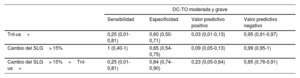
En total, 37 pacientes (38,9%) presentaron elevación de TnI-us y 36 (37,9%), un cambio> 15% en el SLG; 16 pacientes tenían ambas alteraciones al mismo tiempo. Sin embargo, solo 4 pacientes (4,2%) contrajeron una DC-TO moderada-grave. En la tabla 1 se muestra la distribución de la alteración de la TnI, el SLG y la FEVI en función de si habían recibido antraciclinas o no. Los valores de sensibilidad, especificidad, valor predictivo positivo (VPP) y valor predictivo negativo (VPN) de la TnI-us y del cambio> 15% en el SLG para predecir la aparición de DC-TO moderada-grave se muestran en la tabla 2. Aunque la sensibilidad, la especificidad y el VPP de la TnI-us y el SLG fueron pobres, el VPN resultó del 95,1% y el 99% respectivamente. En cambio, de las 4 pacientes con DC-TO moderada-grave, solo 1 presentó elevación de TnI-us, y aunque todas presentaron también un cambio> 15% en el SLG, este no se documentó hasta el diagnóstico de la DC-TO moderada-grave.
Sensibilidad, especificidad y valores predictivos positivo y negativo de la TnI-us y el SLG para el desarrollo de DC-TO moderada-grave
| DC-TO moderada y grave | ||||
|---|---|---|---|---|
| Sensibilidad | Especificidad | Valor predictivo positivo | Valor predictivo negativo | |
| TnI-us+ | 0,25 (0,01-0,81) | 0,60 (0,50-0,71) | 0,03 (0,01-0,13) | 0,95 (0,91-0,97) |
| Cambio del SLG> 15% | 1 (0,40-1) | 0,65 (0,54-0,75) | 0,09 (0,05-0,13) | 0,99 (0,95-1) |
| Cambio del SLG> 15%+TnI-us+ | 0,25 (0,01-0,81) | 0,84 (0,74-0,90) | 0,23 (0,05-0,64) | 0,85 (0,76-0,91) |
DC-TO: disfunción cardiaca relacionada con tratamiento oncológico; SGL: strain longitudinal global; TnI-us: troponina I ultrasensible.
De acuerdo con los resultados del registro Cardiotox3, nuestra cohorte de CM-HER2p también observó una elevada incidencia de DC-TO leve por aumento de la TnI-us y alteración del SLG, mientras que la incidencia de DC-TO moderada-grave fue baja (4,2%). Al igual que en otras series4, el valor añadido de la TnI-us y el SLG radicó principalmente en su elevado VPN para predecir DC-TO moderada-grave, mientras que los valores de sensibilidad, especificidad y VPP fueron discretos. Aunque consideramos que la presencia de DC-TO leve justifica un seguimiento cardiológico estrecho5, en nuestra serie ninguno de los 53 pacientes con DC-TO leve escaló a DC-TO moderada-grave en el seguimiento a pesar de que no iniciaran tratamiento con IECA o bloqueadores beta. Por otro lado, de los 4 pacientes con DC-TO moderada-grave, solamente 1 había tenido antes una DC-TO leve, por lo que 3 de ellos no habrían tenido indicación de dicho tratamiento. Por último, el 38,2% de las CRM realizadas a pacientes con DC-TO leve fueron estrictamente normales, y no se documentó alteración en los parámetros del mapeo en T1 o T2 ni en el volumen extracelular. Aunque estos resultados están limitados por el escaso tamaño muestral, indicarían que probablemente el riesgo de evolución a DC-TO moderada-grave en estos pacientes con CRM normal es bajo, incluso sin tratamiento cardioprotector. En este sentido, la CRM podría ser de utilidad como marcador adicional en la decisión de iniciar o no el tratamiento cardioprotector para los pacientes con DC-TO leve.
FINANCIACIÓNEl estudio recibió financiación a través de una beca la Sociedad Española de Cardiología en 2017 y de un proyecto FIS del ISC-III en 2017 PI17/510.
CONTRIBUCIÓN DE LOS AUTORESG. Oristrell e I. Ferreira-González han contribuido a la redacción del artículo y el análisis estadístico. M. Arumí y S. Escrivá-de-Romaní han contribuido en la inclusión de pacientes en el estudio. F. Valente y G. Burcet han contribuido en la realización de ecocardiogramas y CRM a las pacientes incluidas en el estudio.
CONFLICTO DE INTERESESLos autores declaran que no presentan ningún conflicto de intereses en relación con este trabajo.