La interrupción muy precoz (entre 1 y 3 meses) del tratamiento antiagregante plaquetario doble (TAPD), ha aparecido recientemente en el intervencionismo percutáneo con la nueva generación de stents liberadores de fármacos. El objetivo del presente metanálisis fue evaluar el impacto pronóstico de los diferentes regímenes de doble terapia antiagregante corta o muy corta, comparada con la clásica durante 12 meses en pacientes tratados con intervencionismo coronario percutáneo con un stent liberador de fármacos (SLF) de nueva generación.
MétodosSe buscaron ensayos clínicos aleatorizados en la literatura y en las principales sesiones científicas. El objetivo primario de eficacia fue la mortalidad y el objetivo primario de seguridad fueron las hemorragias mayores. Un análisis pre-especificado se realizó de acuerdo con el antiagregante elegido a largo plazo.
ResultadosSe incluyeron 5 ensayos clínicos aleatorizados con un total de 30.621 pacientes; entre los cuales, un 49,97% fueron aleatorizados a una TAPD muy corta (1-3 meses), seguidos de ácido acetilsalicílico o P2Y12I en monoterapia. Una TAPD más corta redujo significativamente el ratio de hemorragias mayores (2 frente a 3,1%, OR=0,62; IC95%, 0,46-0,84; p=0,002; phet=0,02), aunque no se observó un impacto significativo en la mortalidad (1,3 frente a 2%, OR=0,97; IC95%, 0,73-1,29; p=0,84; phet=0,18). La reducción de eventos como las hemorragias fue incluso más significativa en los ensayos aleatorizados en los que los pacientes estaban libres de eventos en el momento de la suspensión de la DAT. La aparición de infarto agudo de miocardio y la trombosis del stent fue similar en ambas estrategias (TAPD muy corta frente a TAPD clásica de 12 meses).
ConclusionesBasándonos en el actual metanálisis, un periodo muy breve (1-3 meses) de TAPD se asocia con una reducción significativa de hemorragia mayor en comparación con la terapia clásica de 12 meses, sin incremento de eventos isquémicos mayores y con una supervivencia similar.
Palabras clave
Como consecuencia de las mejoras introducidas en la tecnología de los stents, se ha producido una disminución progresiva de las trombosis en el stent1,2. Además, la reducción de las recidivas de eventos isquémicos que se ha producido con la aplicación de medidas farmacológicas de prevención más agresivas, incluidos los fármacos hipolipemiantes y las medicaciones antihipertensivas3–6, ha justificado la revaluación del papel del tratamiento antiagregante plaquetario doble (TAPD) para los pacientes sometidfos a intervención coronaria percutánea (ICP) con los stents farmacoactivos (SFA) modernos.
En las guías se ha recomendado una reducción progresiva de la duración óptima del TAPD7,8, y hoy se indica un TAPD de 6 meses para la enfermedad coronaria crónica, mientras que se mantiene la duración estándar de 12 meses en las situaciones agudas. Sin embargo, el envejecimiento de la población y el aumento de la proporción de pacientes con alto riesgo de eventos hemorrágicos han estimulado la investigación de una reducción aún mayor en la duración del TAPD (1-3 meses), en especial para los subgrupos concretos de pacientes con un perfil de riesgo isquémico bajo9,10.
Dado que se ha descrito que el ácido acetilsalicílico es el principal factor determinante de las complicaciones hemorrágicas gastrointestinales11, varios estudios12–14 han abordado la opción de suspender la administración de ácido acetilsalicílico después de un periodo de TAPD muy breve, para continuar luego con un inhibidor del P2Y12 (iP2Y12) en monoterapia. De hecho, los resultados tranquilizadores del ensayo WOEST12 han tenido la limitación de haber incluido a una población seleccionada con alto riesgo de eventos hemorrágicos que requerían anticoagulación, además del clopidogrel, en la que se trató a un 30% de los pacientes con stents metálicos. Sin embargo, la introducción de antiagregantes plaquetarios más potentes como el ticagrelor, que puede producir por sí solo una inhibición plaquetaria suficiente, ha conducido a la reciente realización de ensayos para evaluar una estrategia de suspensión temprana del ácido acetilsalicílico y toma de ticagrelor a largo plazo14.
En consecuencia, el objetivo del presente metanálisis es evaluar el impacto pronóstico de diferentes pautas de TAPD de muy corta duración en comparación con un tratamiento estándar de 12 meses en pacientes sometidos a ICP para implante de SFA modernos.
MÉTODOSElegibilidad y estrategia de búsquedaSe examinó la literatura médica mediante búsquedas formales en bases de datos electrónicas (MEDLINE, Cochrane y EMBASE) para identificar estudios clínicos y resúmenes, presentaciones orales o presentaciones de expertos mediante diapositivas en reuniones científicas, entre enero de 2008 y octubre de 2019. Se utilizaron los siguientes términos de búsqueda: “dual antiplatelet therapy”, “duration”, “clopidogrel”, “prasugrel”, “ticagrelor”, “drug-eluting stent” y “randomized”.
No se aplicaron limitaciones de idioma. Los criterios de inclusión fueron: a) estudios de comparación de duraciones del TAPD muy cortas (< 6 meses) frente a la estrategia estándar de 12 meses; b) tratamiento invasivo de los pacientes con ICP; c) uso de SFA de nueva generación en más del 90% de los pacientes, y d) disponibilidad de datos completos sobre las características clínicas y los resultados. Los criterios de exclusión fueron: a) datos de seguimiento en menos del 90% de los pacientes; b) uso de SFA de una generación antigua (Cypher, Taxus, Endeavor), y c) estudios en curso o imposibilidad para la obtención de los datos. La selección final de los ensayos incluidos se realizó mediante un examen de selección del artículo completo en cada una de las referencias potencialmente elegibles, mediante evaluaciones independientes del cumplimiento de los criterios de inclusión y exclusión y del riesgo de sesgo realizadas por 2 investigadores, y la inclusión final en el metanálisis de los estudios aptos para ello.
Extracción de los datos y evaluación de la validezExtrajeron los datos 2 investigadores de manera independiente (M. Verdoia, G. De Luca). En caso de que los datos fueran incompletos o no estuvieran claros, se contactó con los autores. Las discrepancias se resolvieron por consenso. Los datos se trataron según el principio de tratar. Cuando se presentaba este dato, se prefirió la definición de hemorragia mayor del Bleeding Academic Research Consortium (BARC)15.
Parámetros de valoraciónEl objetivo principal de eficacia fue la mortalidad total a los 12 meses de seguimiento. El objetivo principal de seguridad fue la tasa de complicaciones hemorrágicas mayores (según la definición del protocolo).
Los objetivos secundarios fueron: a) infarto de miocardio recurrente, y b) trombosis del stent (TS) (definitiva o probable según la definición del Academic Research Consortium [ARC]).
Análisis de los datosEl análisis estadístico se llevó a cabo con los programas informáticos Review Manager 5.3 (libre), SPSS 23.0 y Comprehensive Meta-Analysis (CMA, IBM Statistics). Como estadísticas de resumen, se utilizaron los valores de odds ratio (OR) junto con los intervalos de confianza del 95% (IC95%). Se calculó la OR agrupada mediante un modelo de efectos aleatorios (Mantel-Haenszel). Se utilizó la prueba de Breslow-Day para examinar la evidencia estadística de heterogeneidad entre los estudios (p <0,1). Los mismos 2 investigadores evaluaron la calidad de los estudios según una puntuación descrita con anterioridad y cuyos criterios se detallan en la 3. El riesgo de sesgo en los diversos estudios se calculó con el programa CMA. Concretamente, se examinó el posible sesgo de publicación mediante un diagrama de embudo, en el que se representó gráficamente el tamaño de la muestra en relación con el valor de OR (para el objetivo principal). Además, se aplicó también el instrumento de riesgo de sesgo Cochrane para los ensayos aleatorizados, con objeto de evaluar el riesgo de sesgo generando una tabla de clasificación para cada estudio según los diferentes tipos de sesgo. Se llevó a cabo un análisis de metarregresión según la proporción de pacientes con síndrome coronario agudo incluidos en los estudios.
Se realizó un análisis de sensibilidad en función del tiempo transcurrido hasta la aleatorización (en el momento de la ICP o al suspender el TAPD). El estudio se llevó a cabo cumpliendo la guía Preferred Reporting Items for Systematic reviews and Meta-Analyses (PRISMA)16.
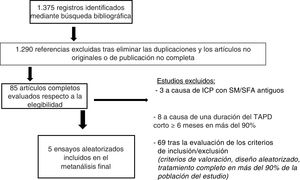
RESULTADOSEstudios elegiblesEn las 1.375 referencias obtenidas, se identificaron inicialmente 16 ensayos13–15,17–29. Se excluyeron 3 de estos ensayos porque permitían el tratamiento con stents metálicos o SFA antiguos19–21 y 8 porque el periodo de TAPD más corto era de 6 meses22–29. Finalmente se incluyeron 5 ensayos clínicos aleatorizados con un total de 30.621 pacientes13–15,17,18 (figura 1). En 3 de los ensayos14,17,18 se evaluaron los efectos beneficiosos de una pauta de TAPD más corta, de 3 meses (5.801 pacientes aleatorizados a 3 meses y 5.807 a 12 meses), mientras que en 2 ensayos13,15 la duración del tratamiento se redujo aún más, a 1 mes.
Los antiagregantes plaquetarios utilizados para la pauta de TAPD fueron el ácido acetilsalicílico y el clopidogrel (75 mg/día) o el ticagrelor (90mg 2 veces al día), y en 3 ensayos se permitió el uso de prasugrel (10 mg/día)15,17,18. El tratamiento antiagregante plaquetario de mantenimiento utilizado desde la suspensión del TAPD hasta los 12 meses fue ácido acetilsalicílico en 1 estudio17, ticagrelor en 213,14 y algún iP2Y12 en 2 ensayos clínicos aleatorizados15,18.
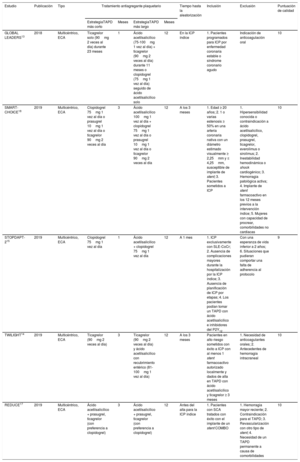
En la tabla 1 se presentan las características de los ensayos clínicos incluidos. La duración del seguimiento osciló entre 1 año (en 3 ensayos) y 2 años13,14, aunque en todos se tuvieron en cuenta los datos obtenidos a los 12 meses.
Características de los estudios aleatorizados incluidos
| Estudio | Publicación | Tipo | Tratamiento antiagregante plaquetario | Tiempo hasta la aleatorización | Inclusión | Exclusión | Puntuación de calidad | |||
|---|---|---|---|---|---|---|---|---|---|---|
| EstrategiaTAPD más corto | Meses | EstrategiaTAPD más largo | Meses | |||||||
| GLOBAL LEADERS13 | 2018 | Multicéntrico, ECA | Ticagrelor solo (90mg 2 veces al día) durante 23 meses | 1 | Ácido acetilsalicílico (75-100mg 1 vez al día) + ticagrelor (90mg 2 veces al día) durante 11 meses o clopidogrel (75mg 1 vez al día) seguido de ácido acetilsalicílico solo | 12 | En la ICP índice | 1. Pacientes programados para ICP por enfermedad coronaria estable o síndrome coronario agudo | Indicación de anticoagulación oral | 10 |
| SMART-CHOICE18 | 2019 | Multicéntrico, ECA | Clopidogrel 75mg 1 vez al día o prasugrel 10mg 1 vez al día o ticagrelor 90mg 2 veces al día | 3 | Ácido acetilsalicílico 100mg 1 vez al día + clopidogrel 75mg 1 vez al día o prasugrel 10mg 1 vez al día o ticagrelor 90mg 2 veces al día | 12 | A los 3 meses | 1. Edad ≥ 20 años; 2. 1 o varias estenosis ≥ 50% en una arteria coronaria nativa con un diámetro estimado visualmente ≥ 2,25mm y ≤ 4,25mm, susceptible de implante de stent; 3. Pacientes sometidos a ICP | 1. Hipersensibilidad conocida o contraindicación a ácido acetilsalicílico, clopidogrel, prasugrel, ticagrelor, everolimus o sirolimus; 2. Inestabilidad hemodinámica o shock cardiogénico; 3. Hemorragia patológica activa; 4. Implante de stent farmacoactivo en los 12 meses previos a la intervención índice; 5. Mujeres con capacidad de procrear, comorbilidades no cardiacas | 10 |
| STOPDAPT-215 | 2019 | Multicéntrico, ECA | Clopidogrel 75mg 1 vez al día | 1 | Ácido acetilsalicílico + clopidogrel 75mg 1 vez al día | 12 | A 1 mes | 1. ICP exclusivamente con SLE-CoCr; 2. Ausencia de complicaciones mayores durante la hospitalización por la ICP índice; 3. Ausencia de planificación de ICP por etapas; 4. Los pacientes podían tomar un TAPD con ácido acetilsalicílico e inhibidores del P2Y12 | Con una esperanza de vida inferior a 2 años; 6. Situaciones que pudieran comportar una falta de adherencia al protocolo | 9 |
| TWILIGHT14 | 2019 | Multicéntrico, ECA | Ticagrelor (90mg 2 veces al día) | 3 | Ticagrelor (90mg 2 veces al día) y ácido acetilsalicílico con recubrimiento entérico (81-100mg 1 vez al día) | 12 | A los 3 meses | Pacientes en alto riesgo sometidos con éxito a ICP con al menos 1 stent farmacoactivo autorizado localmente y dados de alta en TAPD con ácido acetilsalicílico y ticagrelor ≥ 3 meses | 1. Necesidad de anticoagulantes orales; 2. Antecedentes de hemorragia intracraneal | 10 |
| REDUCE17 | 2019 | Multicéntrico, ECA | Ácido acetilsalicílico + prasugrel, ticagrelor (con preferencia a clopidogrel) | 3 | Ácido acetilsalicílico + prasugrel, ticagrelor (con preferencia a clopidogrel) | 12 | Antes del alta para la ICP índice | 1. Pacientes con SCA tratados con éxito con el implante de un stent COMBO | 1. Hemorragia mayor reciente; 2. Contraindicación para el TAPD; 3. Revascularización con otro tipo de stent; 4. Necesidad de un TAPD permanente a causa de comorbilidades | 10 |
ECA: ensayo clínico aleatorizado; ICP: intervención coronaria percutánea; SCA: síndrome coronario agudo; SLE-CoCr: stent de cromo-cobalto liberador de everolimus; TAPD: tratamiento antiagregante plaquetario doble.
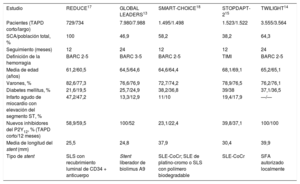
En la tabla 2 se muestran las características de los pacientes incluidos. La media de edad fue 64,7±2,7 años, el 77,4% de los pacientes eran varones, el 32,3% tenía diabetes y el 61,5%, síndrome coronario agudo (el 100% en 1 ensayo17). Se utilizaron SFA de nueva generación en la mayor parte de los pacientes (el 100% en 4 ensayos clínicos aleatorizados y el 97,8% en 1 estudio14).
Características clínicas de los pacientes en los estudios incluidos
| Estudio | REDUCE17 | GLOBAL LEADERS13 | SMART-CHOICE18 | STOPDAPT-215 | TWILIGHT14 |
|---|---|---|---|---|---|
| Pacientes (TAPD corto/largo) | 729/734 | 7.980/7.988 | 1.495/1.498 | 1.523/1.522 | 3.555/3.564 |
| SCA/población total, % | 100 | 46,9 | 58,2 | 38,2 | 64,3 |
| Seguimiento (meses) | 12 | 24 | 12 | 12 | 24 |
| Definición de la hemorragia | BARC 2-5 | BARC 3-5 | BARC 2-5 | TIMI | BARC 2-5 |
| Media de edad (años) | 61,2/60,5 | 64,5/64,6 | 64,6/64,4 | 68,1/69,1 | 65,2/65,1 |
| Varones, % | 82,6/77,3 | 76,6/76,9 | 72,7/74,2 | 78,9/76,5 | 76,2/76,1 |
| Diabetes mellitus, % | 21,6/19,5 | 25,7/24,9 | 38,2/36,8 | 39/38 | 37,1/36,5 |
| Infarto agudo de miocardio con elevación del segmento ST, % | 47,2/47,2 | 13,3/12,9 | 11/10 | 19,4/17,9 | —/— |
| Nuevos inhibidores del P2Y12, % (TAPD corto/12 meses) | 58,9/59,5 | 100/52 | 23,1/22,4 | 39,8/37,1 | 100/100 |
| Media de longitud del stent (mm) | 25,5 | 24,8 | 37,9 | 30,4 | 39,9 |
| Tipo de stent | SLS con recubrimiento luminal de CD34 + anticuerpo | Stent liberador de biolimus A9 | SLE-CoCr; SLE de platino-cromo o SLS con polímero biodegradable | SLE-CoCr | SFA autorizado localmente |
SCA: síndrome coronario agudo; SFA: stent farmacoactivo; SLE-CoCr: stent de cromo-cobalto liberador de everolimus; SLS: stent farmacoactivo liberador de sirolimus; TAPD: tratamiento antiagregante plaquetario doble.
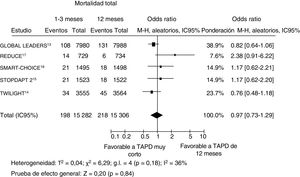
Se dispuso de datos de mortalidad de 30.552 pacientes (el 99,8% de la población total). Un total de 416 pacientes (1,4%) habían fallecido durante el periodo de seguimiento, y no se observó ninguna diferencia significativa de mortalidad con una duración del TAPD más corta en comparación con la más larga (el 1,3% [198/1.282] frente al 2% [218/15.306]; OR = 0,97; IC95%, 0,73-1,29; p = 0,84; phet=0,18) (figura 2). Se obtuvieron resultados similares al limitar el análisis a los ensayos en cuya aleatorización se incluyó a pacientes que no habían sufrido ningún evento en el momento de suspenderse el TAPD (OR = 0,94; IC95%, 0,68-1,29, p=0,70; phet=0,40). En el análisis de metarregresión, el impacto de la duración del TAPD en los resultados no se vio influido por el porcentaje de pacientes con una forma de presentación aguda (r=0,01; IC95%, −0,008 a 0,02; p=0,26). En la evaluación del posible sesgo de publicación, se observó una distribución simétrica de la magnitud media del efecto en el examen visual del gráfico de embudo generado para el riesgo de mortalidad.
Efecto en la mortalidad de un tratamiento antiagregante plaquetario doble más corto en comparación con un tratamiento más largo, con sus odds ratio e IC95%. El tamaño de los símbolos de datos (cuadrados) es aproximadamente proporcional a la ponderación estadística asignada a cada ensayo. IC95%: intervalo de confianza del 95%; M-H: Mantel-Haenszel; TAPD: tratamiento antiagregante plaquetario doble.
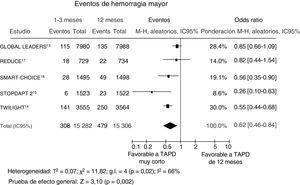
Se dispuso de datos sobre los eventos de hemorragia mayor de 30.552 pacientes (99,8%). En 3 ensayos se utilizó la definición del BARC (2-5)13,17,18, mientras que en 1 ensayo clínico aleatorizado se utilizó la definición del BARC (3-5) y en otro15, la definición del TIMI (Thrombolysis in Myocardial Infarction). Se documentó un evento de hemorragia mayor en 787 pacientes (2,6%).
Tal como se muestra en la figura 3, una menor duración del TAPD redujo significativamente la tasa de eventos de hemorragia mayor (el 2% [308/15.282] frente al 3,1% [479/15.306]; OR = 0,62; IC95%, 0,46-0,84; p=0,002; phet=0,02). La reducción de los eventos hemorrágicos fue aún más significativa en los ensayos en cuya aleatorización se incluyó a pacientes sin eventos en el momento de suspenderse el TAPD (OR = 0,52; IC95%, 0,40-0,68; p <0,0001; phet=0,27). En el análisis de metarregresión, el aumento del riesgo de eventos hemorrágicos con el TAPD muy corto no se vio influido por el porcentaje de pacientes agudos (r=0,007; IC95%, −0,01 a 0,026; p=0,48). En la evaluación del posible sesgo de publicación, se observó una distribución simétrica de la magnitud media del efecto en el examen visual del gráfico de embudo generado para el riesgo de eventos de hemorragia mayor.
Efecto en los eventos de hemorragia mayor de un tratamiento antiagregante plaquetario doble más corto en comparación con un tratamiento más largo, con sus odds ratio e IC95%. El tamaño de los símbolos de datos (cuadrados) es aproximadamente proporcional a la ponderación estadística asignada a cada ensayo. IC95%: intervalo de confianza del 95%; M-H: Mantel-Haenszel; TAPD: tratamiento antiagregante plaquetario doble.
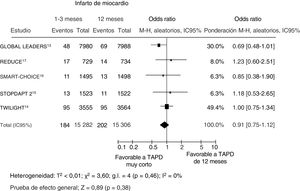
Se dispuso de datos sobre las recidivas de infarto de miocardio de 3.552 pacientes (99,8%), de los que 386 (1,3%) presentaron un evento. No se observaron diferencias en el riesgo de infarto de miocardio no mortal entre las estrategias de TAPD más corto o más largo (figura 4). En el análisis de metarregresión, el impacto de la duración del TAPD en el infarto de miocardio no se vio influido por el porcentaje de pacientes con una forma de presentación aguda (r=0,009; IC95%, −0,005 a 0,022; p=0,21).
Efecto en el infarto de miocardio de un tratamiento antiagregante plaquetario doble más corto en comparación con un tratamiento más largo, con sus odds ratio e IC95%. El tamaño de los símbolos de datos (cuadrados) es aproximadamente proporcional a la ponderación estadística asignada a cada ensayo. IC95%: intervalo de confianza del 95%; M-H: Mantel-Haenszel; TAPD: tratamiento antiagregante plaquetario doble.
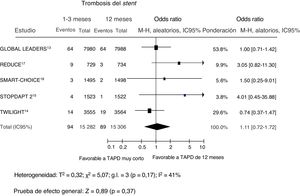
Se dispuso de datos sobre la TS definitiva/probable en 14.620 pacientes (44,7%); en 1 estudio13 se evaluó tan solo la TS definitiva y, además, no se dispuso de datos a los 12 meses. Sufrieron eventos de este tipo 55 pacientes (0,4%), y las tasas fueron comparables entre los pacientes con duraciones del TAPD más corta o más larga (figura 5). En el análisis de metarregresión, el riesgo de TS con un TAPD de menor duración no se vio influido por el porcentaje de pacientes agudos (r=0,006; IC95%, −0,004 a 0,005; p=0,81).
Efecto en la trombosis del stent (definitiva/probable) de un tratamiento antiagregante plaquetario doble más corto en comparación con un tratamiento más largo, con sus odds ratio e IC95%. El tamaño de los símbolos de datos (cuadrados) es aproximadamente proporcional a la ponderación estadística asignada a cada ensayo. IC95%: intervalo de confianza del 95%; M-H: Mantel-Haenszel; TAPD: tratamiento antiagregante plaquetario doble.
El presente metanálisis es el primer estudio en el que se aborda el impacto pronóstico de una duración muy corta (1-3 meses) del TAPD en comparación con la duración tradicional de 12 meses en pacientes sometidos a revascularización coronaria percutánea con SFA modernos.
En los últimos años, el desarrollo tecnológico de los SFA ha llevado a una reducción progresiva de las complicaciones trombóticas, y ello conlleva la posibilidad de una pauta de TAPD más breve después de la ICP, si bien el escaso número de ensayos clínicos y la heterogeneidad de estos impiden que se modifique la recomendación de 12 meses de TAPD, que sigue basándose en los resultados del ensayo CURE, ya antiguo19,30–33.
En consecuencia, recientemente se ha revaluado el papel del TAPD, con un desplazamiento progresivo de un tratamiento antitrombótico «protector» para el stent implantado a una estrategia de prevención para el paciente destinada a reducir la frecuencia de nuevos eventos isquémicos. La atención ha pasado a centrarse más en la evaluación de los perfiles de riesgo de los pacientes, y ello a menudo ha requerido llegar a un equilibrio entre las complicaciones trombóticas y las hemorrágicas, en especial como resultado del aumento de la complejidad y de la edad más avanzada de la población a la que actualmente se practican las ICP34,35. De hecho, varios estudios y registros36–39 han relacionado la anemia y las complicaciones hemorrágicas con una suspensión más temprana del TAPD que lleva a un aumento del riesgo de eventos isquémicos y una reducción de la supervivencia.
La vigente guía sobre revascularización miocárdica recomienda un TAPD de 6 meses como compromiso óptimo entre la trombosis y los eventos hemorrágicos8, aunque dejan un margen para la aplicación de estrategias de TAPD más «individualizadas», ya sean más cortas, en el caso de un perfil de riesgo hemorrágico alto y riesgo trombótico bajo, o más largas para los pacientes con una enfermedad coronaria más avanzada o una forma de presentación aguda.
No obstante, los ensayos clínicos aleatorizados recientes han demostrado la no inferioridad del TAPD de 6 meses respecto a los 12 meses tradicionales, incluso en el síndrome coronario agudo, y ello puede ampliar aún más las indicaciones para una suspensión temprana del TAPD. Concretamente, el ensayo REDUCE17, centrado específicamente en pacientes con síndrome coronario agudo, documentó a los 2 años de seguimiento la no inferioridad de un TAPD de 3 meses frente al de 1 año en un total de 1.496 pacientes tratados con un SFA de nueva generación (COMBO), de los que casi el 50% tenía infarto de miocardio con elevación del segmento ST y casi el 60% estaba en tratamiento con los iP2Y12 orales más potentes.
La introducción de fármacos antitrombóticos orales como el ticagrelor y el prasugrel ha aportado nuevas opciones para el tratamiento farmacológico de los pacientes sometidos a ICP40,41. Sin embargo, la máxima ventaja pronóstica con esos fármacos es la que se ha demostrado en asociación con el ácido acetilsalicílico. En el contexto del síndrome coronario agudo, estudios recientes13,14 indican que para pacientes electivos se puede considerar también el ticagrelor como tratamiento antiagregante plaquetario único (TAPU), que proporciona el beneficio de un antiagregante plaquetario más potente en las fases iniciales tras el implante del stent sin exponer al paciente a un riesgo de complicaciones hemorrágicas prolongado.
El ensayo GLOBAL LEADERS13 comparó un TAPD de 1 mes seguido de ticagrelor durante 23 meses con el TAPD estándar de 12 meses en 15.968 pacientes, y demostró que el ticagrelor utilizado solo era comparable al TAPD estándar por lo que respecta al objetivo principal de mortalidad e infarto de miocardio.
En el posterior ensayo TWILIGHT14 se incluyó a pacientes tratados con ICP que tenían un riesgo alto de complicaciones isquémicas y hemorrágicas. Al cabo de 3 meses, el TAPU con ticagrelor se asoció con una reducción significativa en el objetivo principal de seguridad, en comparación con el TAPD de 12 meses (el 3,6 frente al 7,6%; p <0,01), sin que hubiera diferencias en el objetivo isquémico secundario (el 4,3 frente al 4,5%).
Actualmente hay varias opciones de TAPD para los pacientes sometidos a ICP, como diversas combinaciones y duraciones del tratamiento, pero se respaldan en ensayos aleatorizados con SFA dedicados y en subgrupos de pacientes seleccionados. Sin embargo, la heterogeneidad de la población incluida y de la estrategia de TAPD han impedido hasta ahora la generalización de nuestros resultados y la inclusión de estas observaciones en la práctica clínica ordinaria.
El presente metanálisis tiene como objetivo determinar si los beneficios clínicos de un TAPD muy corto en pacientes sometidos a ICP con los nuevos SFA pueden asimilarse a un efecto de «clase» para todas las diferentes estrategias de TAPD en general o, por el contrario, deben tenerse en cuenta tan solo en contextos específicos. Se demuestra que la suspensión temprana del segundo fármaco antiagregante plaquetario en los primeros 1-3 meses tras la aleatorización se asocia con una reducción significativa de las complicaciones hemorrágicas sin que aumente el riesgo de eventos trombóticos, con un efecto nulo en la mortalidad.
El beneficio máximo por lo que respecta a la aparición de eventos hemorrágicos se observó en los estudios que incluyeron a los pacientes en el momento de suspenderse el TAPD, y en los que, por consiguiente, se evaluaron tan solo los beneficios del TAPU al tiempo que se excluía a los pacientes que sufrieron un evento durante la primera fase de TAPD obligatorio. Sin embargo, un subanálisis previo del ensayo PLATO40 puso de manifiesto que los eventos hemorrágicos relacionados con injertos de bypass arterial no coronarios se produjeron durante los primeros 30 días siguientes a la aleatorización, lo cual indicaba también la importancia de una estratificación correcta del perfil de riesgo de los pacientes, teniendo en cuenta tanto las características clínicas como las angiográficas, incluso antes de la ICP, con objeto de asignar a los pacientes la mejor estrategia para la revascularización coronaria y el tratamiento antitrombótico.
Aunque un TAPD muy corto parece seguro y eficaz para la mayoría de los pacientes tratados con los SFA modernos, un enfoque más individualizado sigue estando justificado y serán necesarios nuevos ensayos clínicos para aportar más luz sobre qué criterios aplicar para la optimización del TAPD.
LimitacionesEste metanálisis tiene ciertas limitaciones. La más importante es la relativa a la síntesis de datos de ensayos clínicos que incluyen tanto a pacientes con un síndrome coronario crónico como a pacientes con un síndrome coronario agudo, y con perfiles de riesgo isquémico y hemorrágico diferentes. Sin embargo, no se observó una heterogeneidad significativa en nuestros objetivos principales de eficacia y seguridad, y además este amplio espectro de pacientes podría constituir también un punto fuerte de nuestro metanálisis al revelar la viabilidad de un TAPD muy corto en una población amplia, a gran escala, como ocurre en la práctica clínica real.
Por otra parte, las definiciones del objetivo primario combinado eran diferentes entre los distintos estudios (y en determinados ensayos se incluyeron la TS, el ictus y los eventos hemorrágicos mayores), por lo que se ha preferido evaluar la mortalidad como objetivo principal de nuestro análisis y cada uno de los componentes del riesgo isquémico (infarto de miocardio). Sin embargo, a la vista de los resultados negativos de nuestro análisis y de las conclusiones similares obtenidas en estudios anteriores42–44, no se prevé que los resultados fueran distintos si se evaluara la tasa de MACE total.
El uso de stents diferentes es otra limitación importante. Los stents se limitaron a las tecnologías de SFA más recientes, que producen una reendotelización más rápida y menos riesgo de trombosis42. Además, se incluyeron diferentes estrategias de antiagregación plaquetaria, puesto que el ácido acetilsalicílico se suspendió en la mayoría de los ensayos, mientras que el tratamiento a largo plazo consistió en ticagrelor o clopidogrel. Asimismo, no se pudo evaluar los estudios que mantuvieron el TAPD durante 1 o 3 meses por separado, debido al bajo número de ensayos incluidos. No obstante, nuestros resultados no difieren de las conclusiones previas de ensayos y metanálisis realizados con un TAPD de 6 frente a 12 meses43, si bien hasta el momento no hay ningún estudio que haya comparado una estrategia de 1 a 3 meses con la de 6 meses. Además, un TAPD de 30 días ha resultado suficiente para prevenir los eventos trombóticos con los SFA más modernos44.
Por último, la estrategia de aleatorización tardía utilizada en algunos ensayos, limitando la inclusión a los pacientes que no habían sufrido ningún evento al final de la duración mínima prevista del TAPD, puede haber excluido a los pacientes con alto riesgo que podrían haber obtenido un beneficio superior con un TAPD más corto o más prolongado, como son los de edad avanzada, los que tienen una forma de presentación con un infarto agudo de miocardio con elevación del segmento ST y los que tienen diabetes o insuficiencia renal o necesitan anticoagulación oral.
CONCLUSIONESSegún el presente metanálisis, la suspensión del TAPD tras un periodo corto (1-3 meses) se asocia con una reducción significativa de las hemorragias mayores en comparación con el tratamiento estándar de 12 meses sin que haya un aumento de los eventos isquémicos mayores y con una supervivencia comparable. Se puede considerar con seguridad un TAPD muy corto para los pacientes sometidos a ICP con los SFA modernos, en especial si están en alto riesgo de complicaciones hemorrágicas. Serán necesarios nuevos ensayos aleatorizados para definir la mejor estrategia de antiagregación plaquetaria a largo plazo.
- –
La vigente guía de revascularización miocárdica recomienda un TAPD de 6 meses como un compromiso óptimo entre los eventos trombóticos y los hemorrágicos.
- –
Ensayos aleatorizados recientes muestran la viabilidad de las estrategias de TAPD extremadamente cortas (< 6 meses) y la interrupción temprana del ácido acetilsalicílico.
- –
Se ha realizado un metanálisis de 5 ensayos clínicos aleatorizados con más de 30.000 pacientes sometidos a ICP con SFA modernos.
- –
Se demuestra que la suspensión temprana del segundo fármaco antiagregante plaquetario en los primeros 1-3 meses tras la aleatorización se asocia con una reducción significativa de las complicaciones hemorrágicas sin que aumente el riesgo de eventos trombóticos, con un efecto nulo en la mortalidad.
- –
Serán necesarios nuevos ensayos clínicos para aportar más luz sobre qué criterios aplicar para la optimización del TAPD.
Los autores declaran no tener conflictos de intereses.