En diciembre de 2019 se describió por primera vez en China un nuevo síndrome de dificultad respiratoria aguda grave, y poco después se identificó un nuevo coronavirus como causa de lo que en la actualidad se denomina enfermedad por coronavirus de 2019 (COVID-19)1,2. En breve tiempo, esta pandemia ha puesto a prueba las capacidades de los sistemas de asistencia sanitaria de todo el mundo y ha llevado a la aplicación de diversas medidas de confinamiento destinadas a detener la propagación del virus. En este contexto, es esencial organizar la asistencia sanitaria de tal manera que proporcione atención médica para esa nueva enfermedad al tiempo que se mantiene un seguimiento clínico apropiado de los demás pacientes.
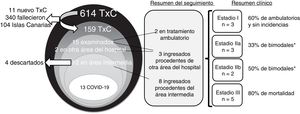
Se presenta nuestra experiencia en la asistencia de pacientes receptores de trasplante cardiaco (TxC) durante la pandemia en Madrid (España). Nuestro programa ha llevado a cabo 614 intervenciones de TxC en los últimos 30 años, en pacientes de un área geográfica amplia (incluidas las Islas Canarias) con un seguimiento regular tanto en nuestro hospital (como centro de referencia) como en sus centros locales. Toda la información se obtuvo a partir de nuestros registros médicos (figura 1).
Durante un periodo de 2 meses (28 de febrero a 28 de abril de 2020), se investigó la posible presencia de síntomas de COVID-19 en todos los pacientes receptores de un TxC. Todos ellos recibieron información acerca del confinamiento y las medidas de protección (uso de mascarillas e higiene de manos) y sobre el procedimiento que se debía seguir en caso de sospecharse COVID-19. Se programó un seguimiento telefónico para los pacientes en alto riesgo (p. ej., los pacientes con disfunción tardía del injerto) y se aplazaron las visitas de los pacientes estables. Se mantuvieron las visitas de los pacientes con un TxC más reciente (los primeros 3 meses siguientes al trasplante) en un circuito de protección para la asistencia ambulatoria en nuestro hospital. En nuestro centro se estableció un área sin coronavirus, denominada área intermedia (AI), para evaluar a los pacientes con alto riesgo (receptores de trasplante de órgano sólido, pacientes con un dispositivo de asistencia ventricular y pacientes oncológicos) que requerían una evaluación por sospecha de COVID-19. Esta AI consistía en habitaciones individuales que permitían la valoración de los pacientes, incluidas la realización de radiografías de tórax y la obtención de muestras de la vía respiratoria alta para la detección del ARN del coronavirus mediante pruebas de reacción en cadena de la polimerasa (PCR), así como muestras de sangre. La disponibilidad del AI era permanente, de modo que se eliminó la necesidad de que estos pacientes acudieran al servicio de urgencias. Todo el personal del AI recibió una formación intensiva en cuanto a los procedimientos de aislamiento de los pacientes, manejo del equipo de protección individual y esterilización sistemática. En la figura 1 se muestra el estadio clínico al realizar la evaluación según una clasificación propuesta recientemente3. El estadio I (leve) es la fase sintomática inicial, el estadio II (moderado) presenta una afección pulmonar sin (IIa) o con (IIb) hipoxia a causa de la inflamación pulmonar local y el estadio III (grave) es un síndrome de respuesta inflamatoria sistémica.
Se dio seguimiento telefónico a 159 pacientes con TxC; 2 pacientes ingresaron en otro centro (y requirieron una consulta telefónica). Se identificó a 15 pacientes con TxC que presentaron un cuadro clínico compatible con COVID-19, y se programaron para ellos llamadas telefónicas 2 veces por semana. De estos 15 pacientes, 2 fueron objeto de seguimiento telefónico en su domicilio habitual y para 13 fue necesaria una evaluación completa en el hospital (12 casos en el AI y 1 en otro centro). De los 12 pacientes con TxC evaluados en el AI, se envió a 4 a su domicilio de forma segura tras haber descartado la COVID-19. En ninguno de ellos se desarrolló la infección en los 30 días siguientes. Los otros 8 pacientes tuvieron resultados positivos y requirieron hospitalización para vigilancia y tratamiento.
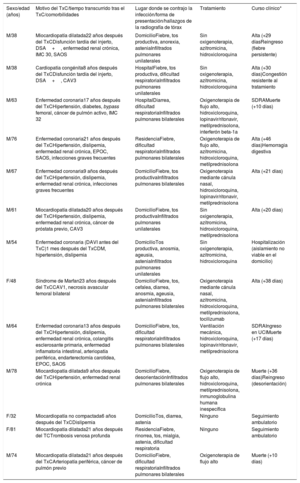
Se diagnosticó COVID-19 a 13 de los 159 pacientes evaluados (8,2%; intervalo de confianza del 95%, 4%-12%). Sus características clínicas se describen en la tabla 1. En una publicación anterior se describe a 4 de estos pacientes4. Es de destacar que un 15% de los pacientes había sufrido leucocitopenia en los 3-6 meses previos, tal como se ha descrito con anterioridad5; 9 (69%) de ellos recibían un tratamiento inmunosupresor triple con tacrolimus (n=7) o ciclosporina (n=6); ninguno estaba en tratamiento con un inhibidor de mTOR; 12 pacientes presentaron un resultado de la PCR positivo para el SARS-CoV-2; el diagnóstico de los demás fue clínico. Hubo que repetir la prueba de PCR de 4 pacientes (31%) tras obtenerse un resultado negativo a pesar de un alto grado de sospecha clínica (de 1 paciente se analizaron 2 muestras nasofaríngeas y 2 muestras de esputo antes de obtener un resultado positivo). Se observó un leve aumento de troponina en 6 pacientes, con valores 3 veces mayores que el valor umbral, pero sin relación con eventos clínicos. Dos pacientes presentaron durante el seguimiento una leucocitopenia grave, que requirió administrar factor estimulador de colonias de granulocitos.
Características de los pacientes con un TxC afectados por la COVID-19
| Sexo/edad (años) | Motivo del TxC/tiempo transcurrido tras el TxC/comorbilidades | Lugar donde se contrajo la infección/forma de presentación/hallazgos de la radiografía de tórax | Tratamiento | Curso clínico* |
|---|---|---|---|---|
| M/38 | Miocardiopatía dilatada22 años después del TxCDisfunción tardía del injerto, DSA+, enfermedad renal crónica, IMC 30, SAOS | DomicilioFiebre, tos productiva, anorexia, asteniaInfiltrados pulmonares unilaterales | Sin oxigenoterapia, azitromicina, hidroxicloroquina | Alta (+29 díasReingreso (fiebre persistente) |
| M/38 | Cardiopatía congénita8 años después del TxCDisfunción tardía del injerto, DSA+, CAV3 | HospitalFiebre, tos productiva, dificultad respiratoriaInfiltrados pulmonares unilaterales | Sin oxigenoterapia, azitromicina, hidroxicloroquina | Alta (+30 días)Congestión resistente al tratamiento |
| M/63 | Enfermedad coronaria17 años después del TxCHipertensión, diabetes, bypass femoral, cáncer de pulmón activo, IMC 32 | HospitalDiarrea, dificultad respiratoriaInfiltrados pulmonares bilaterales | Oxigenoterapia de flujo alto, hidroxicloroquina, lopinavir/ritonavir, metilprednisolona, interferón beta-1a | SDRAMuerte (+10 días) |
| M/76 | Enfermedad coronaria21 años después del TxCHipertensión, dislipemia, enfermedad renal crónica, EPOC, SAOS, infecciones graves frecuentes | ResidenciaFiebre, dificultad respiratoriaInfiltrados pulmonares bilaterales | Oxigenoterapia de flujo alto, azitromicina, hidroxicloroquina, metilprednisolona | Alta (+46 días)Hemorragia digestiva |
| M/67 | Enfermedad coronaria9 años después del TxCHipertensión, dislipemia, enfermedad renal crónica, infecciones graves frecuentes | DomicilioFiebre, tos productivaInfiltrados pulmonares bilaterales | Oxigenoterapia mediante cánula nasal, hidroxicloroquina, lopinavir/ritonavir, metilprednisolona | Alta (+21 días) |
| M/61 | Miocardiopatía dilatada20 años después del TxCHipertensión, dislipemia, enfermedad renal crónica, cáncer de próstata previo, CAV3 | DomicilioFiebre, tos productivaInfiltrados pulmonares unilaterales | Sin oxigenoterapia, azitromicina, hidroxicloroquina, metilprednisolona | Alta (+20 días) |
| M/54 | Enfermedad coronaria (DAVI antes del TxC)1 mes después del TxCDM, hipertensión, dislipemia | DomicilioTos productiva, anosmia, ageusia, asteniaInfiltrados pulmonares unilaterales | Sin oxigenoterapia, azitromicina, hidroxicloroquina | Hospitalización (aislamiento no viable en el domicilio) |
| F/48 | Síndrome de Marfan23 años después del TxCCAV1, necrosis avascular femoral bilateral | DomicilioFiebre, tos, cefalea, diarrea, anosmia, ageusia, asteniaInfiltrados pulmonares bilaterales | Oxigenoterapia mediante cánula nasal, azitromicina, hidroxicloroquina, metilprednisolona, tocilizumab | Alta (+38 días) |
| M/64 | Enfermedad coronaria13 años después del TxCHipertensión, dislipemia, enfermedad renal crónica, colangitis esclerosante primaria, enfermedad inflamatoria intestinal, arteriopatía periférica, endarterectomía carotídea, EPOC, SAOS | DomicilioFiebre, tos, dificultad respiratoriaInfiltrados pulmonares bilaterales | Ventilación mecánica, hidroxicloroquina, lopinavir/ritonavir, metilprednisolona | SDRAIngreso en UCIMuerte (+17 días) |
| M/78 | Miocardiopatía dilatada9 años después del TxCHipertensión, enfermedad renal crónica | DomicilioFiebre, desorientaciónInfiltrados pulmonares bilaterales | Oxigenoterapia de flujo alto, hidroxicloroquina, metilprednisolona, inmunoglobulina humana inespecífica | Muerte (+36 días)Reingreso (desorientación) |
| F/32 | Miocardiopatía no compactada6 años después del TxCDislipemia | DomicilioTos, diarrea, astenia | Ninguno | Seguimiento ambulatorio |
| F/81 | Miocardiopatía dilatada21 años después del TCTrombosis venosa profunda | ResidenciaFiebre, rinorrea, tos, mialgia, astenia, dificultad respiratoria | Ninguno | Seguimiento ambulatorio |
| M/74 | Miocardiopatía dilatada21 años después del TxCArteriopatía periférica, cáncer de pulmón previo | DomicilioFiebre, dificultad respiratoriaInfiltrados pulmonares bilaterales | Oxigenoterapia de flujo alto | Muerte (+10 días) |
CAV: vasculopatía de injerto coronario; DAVI: dispositivo de asistencia del ventrículo izquierdo; DM: diabetes mellitus; DSA: anticuerpos específicos de donante; EPOC: enfermedad pulmonar obstructiva crónica; F: sexo femenino; IMC: índice de masa corporal; M: sexo masculino; SAOS: síndrome de apnea obstructiva del sueño; SDRA: síndrome de dificultad respiratoria aguda; TxC: trasplante cardiaco.
El tratamiento de la COVID-19 se basó en el protocolo de nuestro centro, que se revisó diariamente. Se suspendieron los inhibidores de la calcineurina a 6 pacientes (los 5 pacientes en estadio III, y 1 paciente al prescribírsele lopinavir/ritonavir).
Los 3 pacientes en estadio I evolucionaron sin incidencias; 3 pacientes tuvieron una evolución bimodal, con reaparición de los síntomas y marcadores inflamatorios elevados antes de alcanzar una mejoría definitiva; 4 pacientes (31%) fallecieron, todos ellos con enfermedad en estadio III en el momento del diagnóstico3. Las causas de muerte fueron: insuficiencia respiratoria (2 pacientes), infección bacteriana (1 paciente) y shock hemorrágico debido a un hematoma retroperitoneal atribuible a la heparina de bajo peso molecular (1 paciente).
La incidencia de la COVID-19 en nuestra población con TxC fue del 8%, a pesar de la indicación de medidas intensivas de protección para esta población en alto riesgo. Esta incidencia es superior a la descrita en el área de Madrid (el 0,9% de la población general con resultado de PCR positivo para el SARS-CoV-2 confirmado6).
Según los resultados del presente estudio, puede establecerse un seguimiento seguro de los pacientes con TxC durante la pandemia de COVID-19. La puesta en marcha de un AI es útil para evaluar a los individuos con una sospecha de COVID-19 al tiempo que se reduce al mínimo el riesgo de infección que conlleva la visita al hospital.
La tasa de mortalidad fue alta, aunque ello puede explicarse por la elevada comorbilidad de los pacientes y la gravedad de la forma de presentación clínica.
Se debe tener presente que el elevado porcentaje de resultados falsos negativos de las pruebas de PCR en la población con TxC puede dificultar el diagnóstico de los casos atípicos o leves.
FINANCIACIÓNEste estudio fue financiado por el Centro de Investigación en Red de Enfermedades Cardiovasculares (CIBERCV), Instituto de Salud Carlos III, Ministerio de Economía y Competitividad de España. Este trabajo contó con el apoyo del Instituto de Salud Carlos III, Ministerio de Ciencia e Innovación de España (COV20/00181), con cofinanciación del Fondo Europeo de Desarrollo Regional, A way to achieve Europe.
Damos las gracias a Javier de Juan Bagudá y a Jorge Nuche por la revisión crítica de este artículo.