En el presente estudio, se investigó el rendimiento diagnóstico de la resonancia magnética cardiovascular (RMC) en una gran cohorte de pacientes ingresados con infarto de miocardio (IM) con enfermedad arterial coronaria no obstructiva (MINOCA) en función del momento de derivación a RMC.
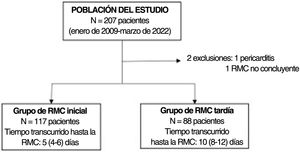
MétodosSe evaluó retrospectivamente a pacientes consecutivos remitidos a RMC desde enero de 2009 hasta febrero de 2022 con un diagnóstico de MINOCA. Se adquirió y analizó imágenes de cine, potenciadas en T2, y con realce temprano y tardío de gadolinio. Se evaluó la frecuencia del diagnóstico subyacente, y la asociación entre el momento de la RMC y la frecuencia relativa de cada diagnóstico.
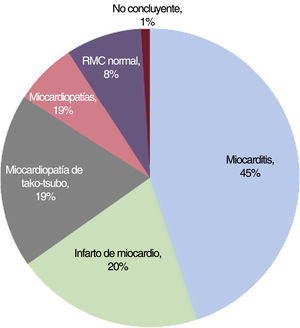
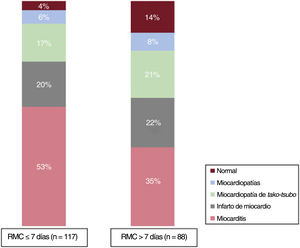
ResultadosSe incluyó a un total de 207 pacientes (mediana de edad 50 años, el 60% varones). El diagnóstico final tras la RMC se alcanzó en el 91% de los pacientes (miocarditis en el 45%, IM en el 20%, miocardiopatía de tako-tsubo en el 19% y otras miocardiopatías en el 7%). La realización de la RMC dentro de los 7 días posteriores al ingreso con MINOCA (mediana: 5 días; 117 pacientes) permitió un mayor rendimiento diagnóstico en comparación con la RMC llevada a cabo más tarde (mediana: 10 días; 88 pacientes) (el 96 frente al 86%; p=0,02). Aunque la miocarditis fue el diagnóstico más frecuente en ambos grupos según el momento de realización de la RMC, su frecuencia fue mayor entre los pacientes con una RMC llevada a cabo dentro de los primeros 7 días (el 53 frente al 35%; p=0,02). La frecuencia de otros diagnósticos subyacentes no se vio influenciada por el momento de la RMC.
ConclusionesLa RMC condujo al diagnóstico subyacente de MINOCA en el 91% de los pacientes y su rendimiento diagnóstico aumentó al 96% cuando se realizó dentro de los 7 días posteriores al ingreso. La miocarditis fue el diagnóstico más frecuente.
Palabras clave
Se ha observado infarto de miocardio (IM) con enfermedad coronaria no obstructiva (MINOCA) en el 5-6% de los pacientes con un cuadro clínico de IM agudo1. La vigente guía de práctica clínica de la Sociedad Europea de Cardiología (ESC) determina MINOCA cuando hay criterios de IM agudo sin estenosis coronaria ≥ 50% y sin otro diagnóstico específico para el cuadro clínico2. El diagnóstico de MINOCA es complicado y mayormente se basa en la exclusión de otros diagnósticos, como la estenosis coronaria obstructiva, la miocarditis o la miocardiopatía de tako-tsubo. La obtención de imágenes de resonancia magnética cardiaca (RMC) desempeña un papel importante en el diagnóstico diferencial de los pacientes con MINOCA, puesto que esta técnica de diagnóstico por la imagen proporciona información sobre las características del tejido miocárdico y permite diferenciar entre miocarditis, miocardiopatía de tako-tsubo e IM una vez se haya demostrado mediante angiografía coronaria que las arterias coronarias no están obstruidas. Según varios estudios, la RMC proporciona un diagnóstico definitivo en un 64-86% de los casos3–9. La variabilidad de este rendimiento diagnóstico se debe a las diferencias en la distribución de varios mecanismos fisiopatológicos en la serie y a las diferencias en el momento de realización de la RMC y el tipo de técnica utilizada. Aunque la última guía de la ESC recomienda realizar la RMC lo antes posible tras el cuadro clínico inicial de los pacientes con MINOCA2, solo en unos pocos estudios se ha explorado la importancia del momento de la RMC para optimizar la precisión diagnóstica. Las pruebas disponibles indican que la realización temprana de una RMC (antes de 14 días desde el cuadro clínico inicial) lleva a un mayor rendimiento diagnóstico frente a la RMC más tardía5-8. En el presente estudio, se evaluó el rendimiento diagnóstico de la RMC en una cohorte grande de pacientes con MINOCA y se tuvo en cuenta el momento de adquisición de las imágenes de RMC.
MÉTODOSPoblación del estudioEste estudio observacional longitudinal incluyó a pacientes consecutivos de 18 años o más con un diagnóstico provisional de MINOCA, según la definición de la ESC2, a los que se hizo una RMC en el Hospital Universitario Germans Trias i Pujol (Badalona, España). El periodo de inclusión se situó entre enero de 2009 y marzo de 2022, y se identificó a los pacientes retrospectivamente a partir de la base de datos institucional de RMC. Se excluyó a los pacientes con insuficiencia cardiaca como síntoma clínico principal o con un electrocardiograma sin ritmo sinusal en el momento del ingreso. Otros criterios de exclusión relacionados con la RMC fueron los pacientes con marcapasos condicionales para resonancia o desfibriladores automáticos implantables, claustrofobia o insuficiencia renal grave (tasa de filtrado glomerular estimada < 30ml/min/1,73 m2).
Se consideró que había lesión miocárdica cuando la concentración de troponina I era ≥ 0,5 ng/ml y la de troponina I de alta sensibilidad (hsTnI), ≥ 30 pg/ml. Para establecer el IM10 se requirieron evaluaciones seriadas de cualquier aumento o reducción de la concentración característica de estos biomarcadores. Durante el periodo de inclusión, cambió la prueba utilizada para analizar las concentraciones de troponina. Por consiguiente, se informa de la proporción máxima de troponina calculada como el valor máximo de troponina en el momento del ingreso dividido por el límite superior del valor normal para la prueba de troponina utilizada. Se consideró que no había obstrucción de las arterias coronarias cuando la estenosis era <50% en cualquier arteria coronaria epicárdica1, tanto en la angiografía coronaria invasiva como en la angiografía coronaria por tomografía computarizada.
El estudio se realizó de acuerdo con la Declaración de Helsinki y fue revisado y aprobado por el Comité Institucional de Revisión o Junta de Revisión Institucional (código de ética: PI-22-048 y PI-19-257). Debido al análisis retrospectivo de los datos clínicos, el comité de ética local prescindió de la necesidad de consentimiento informado por escrito.
Datos clínicosLos datos relacionados con el paciente, como los demográficos, los factores de riesgo cardiovascular y las enfermedades concomitantes iniciales, así como el electrocardiograma y los biomarcadores durante el ingreso, se obtuvieron de los partes médicos. Se definió obesidad con un índice de masa corporal ≥ 3011. Se definió dislipemia con colesterol total >250mg/dl o colesterol unido a lipoproteínas de baja densidad >130mg/dl12 y diabetes, con la HbA1c >6,5% o la glucosa plasmática en ayunas >126mg/dl13. La enfermedad coronaria previa incluía los antecedentes de IM agudo o intervención coronaria percutánea o cirugía de revascularización coronaria. Se determinó enfermedad renal con una tasa de filtrado glomerular reducida (< 90ml/min/1,73 m2) según la fórmula CKD-EPI14. Los trastornos psiquiátricos fueron síndrome depresivo, ansiedad y trastornos de la personalidad. Se revisó el consumo previo de ácido acetilsalicílico y otros tratamientos con antiagregantes plaquetarios, anticoagulantes, bloqueadores beta, inhibidores de la enzima de conversión de la angiotensina o antagonistas del receptor de la angiotensina II.
Obtención y análisis de los datos de la resonancia magnética cardiacaLas imágenes de RMC se obtuvieron con un escáner de resonancia magnética de 1,5 T (Achieva, Philips; Países Bajos). El momento de realización de la RMC se definió como el número de días transcurridos desde el ingreso con MINOCA hasta la realización del estudio de RMC. El protocolo de obtención de datos de la RMC incluyó cinerradiografía funcional con secuencias de precesión libre en estado estacionario y en situación de contención de la respiración en las 3 proyecciones del eje largo y en la orientación del eje corto que incluían ambos ventrículos desde la base hasta el vértice del ventrículo izquierdo (grosor del corte, 8 mm; espacio del corte, 2 mm). Se utilizaron imágenes de secuencia STIR ponderadas en T2 (STIR-T2) para detectar edema miocárdico y se obtuvieron en las mismas proyecciones de eje largo y eje corto que las secuencias de cinerradiografía. Al cabo de 2 o 3 min de la administración intravenosa de la sustancia de contraste a base de gadolinio, gadobutrol (0,15 mmol/kg; Gadovist, Bayer-Schering Pharma; Alemania), se obtuvieron las imágenes de realce temprano de gadolinio en las 3 proyecciones del eje largo que permitieron evaluar la presencia de hiperemia, obstrucción microvascular o trombo intraventricular. Para evaluar la necrosis/fibrosis miocárdica, se utilizaron imágenes de realce tardío de gadolinio (RTG) obtenidas entre 8 y 10 min después de administrar el contraste con secuencias segmentadas de eco de gradiente con prepulso de inversión-recuperación en las mismas proyecciones de eje largo y eje corto que las secuencias de cinerradiografía. El tiempo de inversión se ajustó al miocardio sano nulo a lo largo del tiempo. El mismo protocolo estandarizado se mantuvo a lo largo del periodo de inclusión, sin cambios notables en las secuencias realizadas (material adicional).
Se cuantificaron los volúmenes ventriculares y la fracción de eyección de ambos ventrículos y la masa del ventrículo izquierdo (VI) utilizando la combinación de imágenes de cinerradiografía en el eje corto, tal como se ha descrito anteriormente, con el software Portal IntelliSpace (Philips Healthcare, Países Bajos)15. Los volúmenes ventriculares y la masa del VI se indexaron utilizando la superficie corporal calculada con la fórmula de Dubois16.
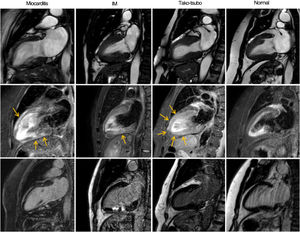
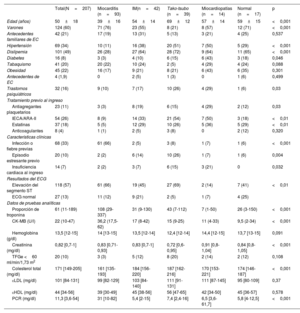
Para evaluar la presencia y la distribución de alteraciones regionales y generales en el movimiento de la pared del VI, se utilizó el modelo de 17 segmentos de la American Heart Association17. Además, se analizó la distribución del edema miocárdico identificado como las áreas de intensidad de señal elevada en las imágenes STIR-T2. Por último, se evaluaron el patrón y la extensión del RTG miocárdico (subendocárdico, de la pared media o subepicárdico), lo que permitió clasificar a los pacientes en 5 grupos diagnósticos basados en la RMC: miocarditis aguda, IM agudo, miocardiopatía de tako-tsubo, miocardiopatía o RMC normal. La miocarditis aguda se definió como la presencia de edema subepicárdico o transparietal con RTG de la pared media irregular o subepicárdico con o sin alteraciones asociadas de la movilidad de la pared, según los criterios de Lake Louise18. Se determinó IM agudo por la presencia de alteraciones en la movilidad parietal regional del VI con edema y patrón de RTG de subendocárdico a transparietal en la zona irrigada por una arteria coronaria. Se diagnosticó miocardiopatía de tako-tsubo por la presencia de alteración de la movilidad de la pared apical o medioventricular en las secuencias de cinerradiografía además de una distribución vascular epicárdica con edema miocárdico transparietal en los mismos segmentos y sin RTG considerable19. En el grupo de miocardiopatía se incluyeron diagnósticos de miocardiopatía dilatada, miocardiopatía hipertrófica, sarcoidosis o miocardiopatía arritmogénica del ventrículo derecho según los criterios de la RMC20-22. La RMC se consideró normal si no había alteraciones en la movilidad de la pared, edema miocárdico o patrones de RTG específicos ni otras alteraciones estructurales o funcionales (figura 1).
La primera fila muestra imágenes de cinerradiografía de la secuencia SSFP telesistólica en proyección de 2 cámaras para cada diagnóstico. La segunda fila muestra imágenes ponderadas en T2 para detectar edema (flechas) y la tercera fila, imágenes ponderadas en T1 tras la administración de gadolinio para estudiar el RTG. En el caso de la miocarditis, se observa un edema subepicárdico lineal y RTG irregular en la pared anterior y en la pared mediobasal inferior dentro del miocardio. El infarto agudo de miocardio muestra edema transparietal en la pared medioanterior con RTG de subendocárdico a transparietal en el mismo segmento. En la miocardiopatía de tako-tsubo, se observa acinesia y edema transparietal en los segmentos medioapicales sin RTG. En el paciente normal no se observan alteraciones. IM: infarto de miocardio; RMC: resonancia magnética cardiaca; RTG: realce tardío de gadolinio.
Se evaluó la distribución normal de las variables continuas con la prueba de Shapiro-Wilk. Las variables continuas con una distribución normal expresan como media ± desviación estándar, mientras que las variables con distribución no normal se expresan en mediana [intervalo intercuartílico]. Las variables cualitativas expresan frecuencias y porcentajes absolutos. Para comparar variables continuas se utilizaron la prueba de la t de Student o el análisis de la varianza. Para comparar variables dicotómicas y variables cualitativas entre los grupos, se utilizaron las pruebas de Fisher o de la χ2 de Pearson. Para el análisis estadístico se utilizó el software Stata (versión 15.1, StataCorp, Estados Unidos).
RESULTADOSSe identificó a 207 pacientes con un diagnóstico inicial de MINOCA y se obtuvieron imágenes de RMC consecutivas. Según los resultados de la RMC, se estableció diagnóstico en el 91% de los pacientes (188 pacientes): miocarditis aguda en 93 (45%), IM en 42 (20%), miocardiopatía de tako-tsubo en 39 (19%) y otras miocardiopatías en 14 (7%), además de 7 pacientes con miocardiopatía dilatada, 5 con miocardiopatía hipertrófica, 1 paciente con miocardiopatía arritmogénica del ventrículo derecho y 1 paciente con sarcoidosis cardiaca. En 17 pacientes (8%), la RMC demostró la existencia de un corazón estructuralmente normal (figura 2). En 2 pacientes la RMC no fue concluyente: en uno el diagnóstico definitivo fue pericarditis y en el otro no se estableció ningún diagnóstico definitivo en el momento del alta. Se excluyó del siguiente análisis a estos 2 pacientes. El tiempo medio transcurrido desde el ingreso en el hospital hasta la realización de la RMC fue de 7 [5-9] días, sin diferencias significativas en la demora de la RMC entre los grupos diagnósticos del conjunto de la cohorte.
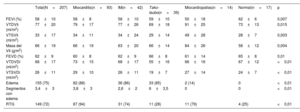
Características basales y resultados de la RMCEn la tabla 1 se muestran las características clínicas del conjunto de la cohorte y de cada grupo diagnóstico. La media de edad de la población fue 50±18 años y se constató predominio de varones (60%). En casi el 90% de los pacientes el electrocardiograma presentó alteraciones con elevación del segmento ST como observación más habitual (118 pacientes [57%]). En 14 pacientes (7%) se observaron síntomas concomitantes de insuficiencia cardiaca, mientras que no hubo ningún paciente con edema pulmonar o shock cardiogénico. El sexo masculino fue más frecuente en el grupo con diagnóstico de miocarditis (76%) y en el de RMC normal (71%), mientras que las mujeres lo fueron en el grupo con miocardiopatía de tako-tsubo (79%). La edad fue menor en el grupo con miocarditis seguido del grupo con IM, y fue mayor en el grupo con miocardiopatía de tako-tsubo.
Características basales de la población del estudio
| Total(N=207) | Miocarditis (n=93) | IM(n=42) | Tako-tsubo (n=39) | Miocardiopatías (n=14) | Normal (n=17) | p | |
|---|---|---|---|---|---|---|---|
| Edad (años) | 50±18 | 39±16 | 54±14 | 69±12 | 57±14 | 59±15 | <0,001 |
| Varones | 124 (60) | 71 (76) | 23 (55) | 8 (21) | 8 (57) | 12 (71) | <0,001 |
| Antecedentes familiares de EC | 42 (21) | 17 (19) | 13 (31) | 5 (13) | 3 (21) | 4 (25) | 0,537 |
| Hipertensión | 69 (34) | 10 (11) | 16 (38) | 20 (51) | 7 (50) | 5 (29) | <0,001 |
| Dislipemia | 101 (49) | 26 (28) | 27 (64) | 28 (72) | 9 (64) | 11 (65) | <0,001 |
| Diabetes | 16 (8) | 3 (3) | 4 (10) | 6 (15) | 6 (43) | 3 (18) | 0,046 |
| Tabaquismo | 41 (20) | 20 (22) | 10 (24) | 2 (5) | 4 (29) | 4 (24) | 0,088 |
| Obesidad | 45 (22) | 16 (17) | 9 (21) | 8 (21) | 6 (43) | 6 (35) | 0,301 |
| Antecedentes de EC | 4 (1,9) | 0 | 2 (5) | 1 (3) | 0 | 1 (6) | 0,499 |
| Trastornos psiquiátricos | 32 (16) | 9 (10) | 7 (17) | 10 (26) | 4 (29) | 1 (6) | 0,03 |
| Tratamiento previo al ingreso | |||||||
| Antiagregantes plaquetarios | 23 (11) | 3 (3) | 8 (19) | 6 (15) | 4 (29) | 2 (12) | 0,03 |
| IECA/ARA-II | 54 (26) | 8 (9) | 14 (33) | 21 (54) | 7 (50) | 3 (18) | <0,01 |
| Estatinas | 37 (18) | 5 (5) | 12 (29) | 10 (26) | 5 (36) | 5 (29) | <0,01 |
| Anticoagulantes | 8 (4) | 1 (1) | 2 (5) | 3 (8) | 0 | 2 (12) | 0,320 |
| Características clínicas | |||||||
| Infección o fiebre previas | 68 (33) | 61 (66) | 2 (5) | 3 (8) | 1 (7) | 1 (6) | <0,001 |
| Episodio estresante previo | 20 (10) | 2 (2) | 6 (14) | 10 (26) | 1 (7) | 1 (6) | 0,004 |
| Insuficiencia cardiaca al ingreso | 14 (7) | 2 (2) | 3 (7) | 6 (15) | 3 (21) | 0 | 0,032 |
| Resultados del ECG | |||||||
| Elevación del segmento ST | 118 (57) | 61 (66) | 19 (45) | 27 (69) | 2 (14) | 7 (41) | <0,01 |
| ECG normal | 27 (13) | 11 (12) | 9 (21) | 2 (5) | 1 (7) | 4 (25) | |
| Datos de pruebas analíticas | |||||||
| Proporción de troponina | 61 (11-189) | 108 (29-337) | 31 (9-130) | 43 (7-112) | 7 (1-50) | 26 (3-150) | <0,001 |
| CK-MB (U/l) | 22 (10-47) | 36,2 (17,5-62) | 17 (8-42) | 15 (9-25) | 11 (4-33) | 9,5 (2-34) | <0,001 |
| Hemoglobina (g/dl) | 13,5 [12-15] | 14 [13-15] | 13,5 [12-14] | 12,4 [12-14] | 14,4 [12-15] | 13,7 [13-15] | 0,091 |
| Creatinina (mg/dl) | 0,82 [0,7-1] | 0,83 [0,71-0,93] | 0,83 [0,7-1] | 0,72 [0,6-0,95] | 0,91 [0,8-1,04] | 0,84 [0,8-1,05] | <0,001 |
| TFGe <60 ml/min/1,73 m2 | 20 (10) | 3 (3) | 5 (12) | 8 (20) | 2 (14) | 2 (12) | 0,108 |
| Colesterol total (mg/dl) | 171 [149-205] | 161 [135-193] | 184 [156-220] | 187 [162-216] | 170 [153-221] | 174 [146-187] | <0,001 |
| cLDL (mg/dl) | 101 [84-131] | 99 [82-129] | 103 [84-140] | 111 [91-131] | 111 [87-145] | 95 [80-109] | 0,37 |
| cHDL (mg/dl) | 44 [34-56] | 39 [30-49] | 45 [38-56] | 56 [47-65] | 42 [34-50] | 45 [36-57] | 0,578 |
| PCR (mg/dl) | 11,3 [3,6-54] | 31 [10-82] | 5,4 [2-15] | 7,4 [2,4-16] | 6,5 [3,6-61,7] | 5,8 [4-12,5] | <0,001 |
ARA-II: antagonistas del receptor de la angiotensina II; cHDL: colesterol unido a lipoproteínas de alta densidad; CK-MB: creatinincinasa miocárdica; cLDL: colesterol unido a lipoproteínas de baja densidad; EC: enfermedad coronaria; ECG: electrocardiograma; IECA: inhibidores de la enzima de conversión de la angiotensina; IM: infarto de miocardio; PCR: proteína C reactiva; TFGe: tasa de filtrado glomerular estimada.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
En la tabla 2 se muestran los datos de la RMC según los grupos diagnósticos. La fracción de eyección del VI media, así como los volúmenes del VI, se hallaban dentro de los valores normales de la población general. No obstante, al comparar los grupos diagnóstico entre sí, la fracción de eyección del VI fue mucho menor y el volumen telediastólico del VI indexado, sensiblemente mayor en el grupo con miocardiopatía comparado con los otros grupos. En conjunto, se observaron alteraciones regionales en la movilidad de la pared del VI en 126 pacientes (62%). El predominio de edema miocárdico en el conjunto de la cohorte fue del 75% según las imágenes STIR-T2, con ausencia de edema miocárdico focal en los pacientes con una RMC normal (según definición). En los pacientes con miocardiopatía de tako-tsubo fue mayor el número de segmentos del VI con edema. Se observó RTG en 149 pacientes (72%) y en el grupo con miocarditis se constató la frecuencia más alta de RTG (94%), seguida por los pacientes del grupo con miocardiopatía (77%) y el grupo con IM (74%).
Características de la resonancia magnética cardiaca en la población general y según los grupos diagnósticos
| Total(N=207) | Miocarditis(n=93) | IM(n=42) | Tako-tsubo(n=39) | Miocardiopatías(n=14) | Normal(n=17) | p | |
|---|---|---|---|---|---|---|---|
| FEVI (%) | 58±10 | 58±8 | 58±10 | 59±10 | 50±18 | 62±6 | 0,007 |
| VTDVIi (ml/m2) | 77±20 | 79±17 | 77±26 | 69±18 | 91±25 | 73±13 | 0,015 |
| VTSVIi (ml/m2) | 33±17 | 34±11 | 34±24 | 29±14 | 49±28 | 28±7 | 0,003 |
| Masa del VIi (g/m2) | 66±19 | 66±19 | 63±20 | 66±14 | 84±26 | 58±12 | 0,004 |
| FEVD (%) | 62±9 | 60±8 | 62±9 | 66±8 | 61±14 | 65±8 | 0,01 |
| VTDVDi (ml/m2) | 68±17 | 73±15 | 68±17 | 55±16 | 66±16 | 67±12 | <0,01 |
| VTSVDi (ml/m2) | 26±11 | 29±10 | 26±11 | 19±7 | 27±14 | 24±7 | <0,01 |
| Edema | 155 (75) | 82 (88) | 36 (86) | 33 (85) | 2 (14) | 0 | <0,01 |
| Segmentos con edema | 3,4±3 | 3,8±3 | 2,6±2 | 6±3,5 | 0 | 0 | <0,01 |
| RTG | 149 (72) | 87 (94) | 31 (74) | 11 (28) | 11 (79) | 4 (25) | <0,01 |
FEVD: fracción de eyección del ventrículo derecho; FEVI: fracción de eyección del ventrículo izquierdo; IM: infarto de miocardio; RTG: realce tardío de gadolinio; VIi: ventrículo izquierdo indexado; VTDVDi: volumen telediastólico del ventrículo derecho indexado; VTDVIi: volumen telediastólico del ventrículo izquierdo indexado; VTSVDi: volumen telesistólico del ventrículo derecho indexado; VTSVIi: volumen telesistólico del ventrículo izquierdo indexado.
Los valores expresan n (%) o media±desviación estándar.
Según un tiempo medio de 7 días transcurrido desde el diagnóstico hasta la RMC, se dividió la cohorte en 2 grupos: RMC temprana (≤ 7 días, 117 pacientes) y RMC tardía (>7 días, 88 pacientes) (figura 3).
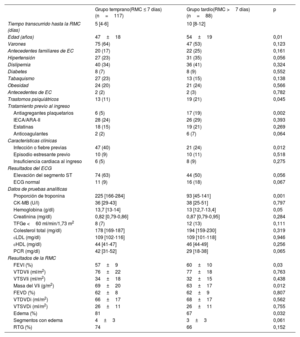
La edad fue la única característica basal que permitió observar diferencias notables entre los grupos a los que se hizo una RMC temprana o tardía (47±18 frente a 54±19 años; p=0,01). Cuando se compararon los resultados de la RMC entre los 2 grupos, la presencia de edema en las imágenes STIR-T2 fue más frecuente en los pacientes con RMC temprana que en aquellos con RMC tardía (el 81 frente al 67%; p=0,03). En cambio, no hubo diferencias en cuanto a alteraciones regionales de la movilidad de la pared del VI y presencia de RTG entre la RMC temprana y la tardía. La fracción de eyección del VI fue ligeramente inferior en el grupo de pacientes con RMC temprana que en el de RMC tardía (el 57 frente al 60%; p=0,03) (tabla 3).
Características clínicas y resultados de la RMC según el tiempo transcurrido hasta la RMC
| Grupo temprano(RMC ≤ 7 días) (n=117) | Grupo tardío(RMC >7 días) (n=88) | p | |
|---|---|---|---|
| Tiempo transcurrido hasta la RMC (días) | 5 [4-6] | 10 [8-12] | |
| Edad (años) | 47±18 | 54±19 | 0,01 |
| Varones | 75 (64) | 47 (53) | 0,123 |
| Antecedentes familiares de EC | 20 (17) | 22 (25) | 0,161 |
| Hipertensión | 27 (23) | 31 (35) | 0,056 |
| Dislipemia | 40 (34) | 36 (41) | 0,324 |
| Diabetes | 8 (7) | 8 (9) | 0,552 |
| Tabaquismo | 27 (23) | 13 (15) | 0,138 |
| Obesidad | 24 (20) | 21 (24) | 0,566 |
| Antecedentes de EC | 2 (2) | 2 (3) | 0,782 |
| Trastornos psiquiátricos | 13 (11) | 19 (21) | 0,045 |
| Tratamiento previo al ingreso | |||
| Antiagregantes plaquetarios | 6 (5) | 17 (19) | 0,002 |
| IECA/ARA-II | 28 (24) | 26 (29) | 0,393 |
| Estatinas | 18 (15) | 19 (21) | 0,269 |
| Anticoagulantes | 2 (2) | 6 (7) | 0,064 |
| Características clínicas | |||
| Infección o fiebre previas | 47 (40) | 21 (24) | 0,012 |
| Episodio estresante previo | 10 (9) | 10 (11) | 0,518 |
| Insuficiencia cardiaca al ingreso | 6 (5) | 8 (9) | 0,275 |
| Resultados del ECG | |||
| Elevación del segmento ST | 74 (63) | 44 (50) | 0,056 |
| ECG normal | 11 (9) | 16 (18) | 0,067 |
| Datos de pruebas analíticas | |||
| Proporción de troponina | 225 [166-284] | 93 [45-141] | 0,001 |
| CK-MB (U/l) | 36 [29-43] | 38 [25-51] | 0,797 |
| Hemoglobina (g/dl) | 13,7 [13-14] | 13 [12,7-13,4] | 0,05 |
| Creatinina (mg/dl) | 0,82 [0,79-0,86] | 0,87 [0,79-0,95] | 0,284 |
| TFGe <60 ml/min/1,73 m2 | 8 (7) | 12 (13) | 0,111 |
| Colesterol total (mg/dl) | 178 [169-187] | 194 [159-230] | 0,319 |
| cLDL (mg/dl) | 109 [102-116] | 109 [101-118] | 0,946 |
| cHDL (mg/dl) | 44 [41-47] | 46 [44-49] | 0,256 |
| PCR (mg/dl) | 42 [31-52] | 29 [18-38] | 0,065 |
| Resultados de la RMC | |||
| FEVI (%) | 57±9 | 60±10 | 0,03 |
| VTDVIi (ml/m2) | 76±22 | 77±18 | 0,763 |
| VTSVIi (ml/m2) | 34±18 | 32±15 | 0,438 |
| Masa del VIi (g/m2) | 69±20 | 63±17 | 0,012 |
| FEVD (%) | 62±8 | 62±9 | 0,807 |
| VTDVDi (ml/m2) | 66±17 | 68±17 | 0,562 |
| VTSVDi (ml/m2) | 26±11 | 26±11 | 0,755 |
| Edema (%) | 81 | 67 | 0,032 |
| Segmentos con edema | 4±3 | 3±3 | 0,061 |
| RTG (%) | 74 | 66 | 0,152 |
ARA-II: antagonistas del receptor de la angiotensina II; cHDL: colesterol unido a lipoproteínas de alta densidad; CK-MB: creatinincinasa miocárdica; cLDL: colesterol unido a lipoproteínas de baja densidad; EC: enfermedad coronaria; ECG: electrocardiograma; FEVD: fracción de eyección del ventrículo derecho; FEVI: fracción de eyección del ventrículo izquierdo; IECA: inhibidores de la enzima de conversión de la angiotensina; PCR: proteína C reactiva; RMC: resonancia magnética cardiovascular; RTG: realce tardío de gadolinio; TFGe: tasa de filtrado glomerular estimada; VIi: ventrículo izquierdo indexado; VTDVDi: volumen telediastólico del ventrículo derecho indexado; VTDVIi: volumen telediastólico del ventrículo izquierdo indexado; VTSVDi: volumen telesistólico del ventrículo derecho indexado; VTSVIi: volumen telesistólico del ventrículo izquierdo indexado.
Salvo otra indicación, los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
El rendimiento diagnóstico de la RMC fue mayor cuando la RMC se hizo dentro de la primera semana (resonancia temprana) (el 96 frente al 86%; p=0,02). A pesar de que la miocarditis fue el diagnóstico más habitual en ambos grupos de RMC, este diagnóstico se estableció con mayor frecuencia en el grupo de RMC temprana (el 53 frente al 35%; p=0,01). No se observaron diferencias entre el grupo con IM y el de miocardiopatía de tako-tsubo. Por otro lado, fue más frecuente observar una RMC normal en el grupo de RMC tardía (el 14 frente al 4%; p=0,02) (figura 4).
DISCUSIÓNLos principales resultados del presente estudio son: a) alto rendimiento diagnóstico de la RMC en general, que permite confirmar el diagnóstico en el 91% de los pacientes con un diagnóstico inicial de MINOCA, y b) aumento posterior del rendimiento diagnóstico hasta el 96% cuando la RMC realizada en la primera semana tras el cuadro clínico inicial.
En pacientes con un diagnóstico provisional inicial de MINOCA, es importante establecer un diagnóstico etiológico para personalizar el tratamiento y facilitar una estratificación precisa del riesgo. En las últimas guías internacionales sobre práctica clínica, se recomienda la RMC para los pacientes con un diagnóstico inicial de MINOCA para establecer el diagnóstico etiológico1. Esta recomendación se basa en pruebas sólidas que demuestran que la RMC confirma el diagnóstico etiológico en una proporción que oscila entre el 64 y el 89% de los pacientes con MINOCA3-9,23,24. En el presente estudio, el uso de la RMC confirmó el diagnóstico etiológico en 9 de 10 pacientes con un diagnóstico inicial de MINOCA. Las diferencias en el rendimiento diagnóstico de la RMC observadas entre el presente estudio y la literatura médica anterior pueden explicarse por muchos factores, como el tiempo transcurrido desde el inicio de los síntomas hasta la realización de la RMC. Los estudios previos con un menor rendimiento diagnóstico de la RMC fueron aquellos con mayor demora entre el inicio de los síntomas y la RMC. En 388 pacientes con un diagnóstico de MINOCA a los que se hizo una RMC en una media de 37 días (el 10% de los estudios de RMC realizados dentro de los 14 días desde el inicio de los síntomas), Dastidar et al.5 mostraron un rendimiento diagnóstico de la RMC del 75%. En otro estudio de 719 pacientes a los que se hizo una RMC dentro de los 30 días desde el inicio de los síntomas, Williams et al.8 notificaron que en el 74% pudo establecerse un diagnóstico definitivo. En el presente estudio, la RMC se hizo en una media de 7 días, lo que podría explicar el mayor rendimiento diagnóstico comparado con estudios anteriores5,8.
Tras una lesión cardiaca aguda, se producen cambios dinámicos en el miocardio25. Entre estos cambios destaca la existencia de un patrón de edema bimodal durante la primera semana tras el IM y que el edema observado en la RMC empieza a desaparecer después de la primera semana26. Así pues, si la RMC se realiza más tarde, hay un número considerable de etiologías, como una ligera miocarditis o la miocardiopatía de tako-tsubo, que pueden pasar desapercibidas. Sörensson et al.7 compararon 2 grupos de pacientes incluidos en estudios coronarios normales de IM realizados en Estocolmo (Stockholm Myocardial Infarction with Normal Coronaries [SMINC]). Aunque los pacientes incluidos en el estudio inicial SMINC tenían características clínicas comparables a los del SMINC-2, en el estudio inicial SMINC la RMC se realizó tras una demora media de 12 días y solo el 20% de los pacientes presentaron edema, mientras que en el estudio SMINC-2 la RMC se realizó tras una media de demora de 3 días y se detectó edema miocárdico en más del 75% de los pacientes. Estos resultados también se asociaron con una mejora en el rendimiento diagnóstico de la RMC en el estudio SMINC-2 (77%) comparado con el SMINC (47%). Como observaron los autores, la mayor proporción de pacientes con edema a pesar de una menor concentración media de troponina del estudio SMINC-2 comparados con los pacientes del estudio SMINC inicial podría estar relacionada con el mayor rendimiento diagnóstico de la RMC7. En el presente estudio, se constató un porcentaje considerablemente mayor de edema en el grupo de la RMC temprana (el 81 frente al 67%), lo que podría explicar el mayor rendimiento diagnóstico de la RMC en este grupo. Los cuadros clínicos específicos pueden dar lugar a la sospecha de un diagnóstico que puede llevar a los médicos responsables del tratamiento a remitir a los pacientes a una RMC más temprana. En el caso de la población del presente estudio, merece la pena destacar que el 40% de los pacientes a los que se hizo una RMC temprana acudieron con fiebre, lo que indica el diagnóstico de miocarditis.
La distribución final del diagnóstico etiológico tras la RMC puede explicarse en parte por el momento de realización de la RMC, tal como ya se ha descrito, pero también por las características basales de la población. Comparada con la del estudio SMINC-27, la población del presente estudio era más joven (50 frente a 58 años) y la proporción de varones era mayor (el 60 frente al 29%). Estas diferencias podrían relacionarse con la mayor proporción de miocarditis (el 45 frente al 17%) y la menor proporción de miocardiopatía de tako-tsubo (el 19 frente al 35%) descrita en el presente estudio frente a las notificadas en el estudio SMINC-27. En un estudio reciente con 170 mujeres con un diagnóstico inicial de MINOCA, solo se estableció un diagnóstico definitivo de miocarditis en el 14,7% de las pacientes, lo que apunta a un menor predominio de miocarditis en las mujeres27.
En estudios anteriores ya se ha descrito regularmente el predominio del IM como diagnóstico definitivo, que oscila entre el 22 y el 26%5-8. Más recientemente, un metanálisis realizado por Mileva et al.28 que incluía 26 estudios y 3.624 pacientes mostró predominio del IM en el 22%. Esta proporción es similar a la observada en el presente estudio, en el que la frecuencia fue del 20%.
Limitaciones del estudioEn el presente estudio hay que reconocer varias limitaciones. Se trata de un estudio unicéntrico con un número de pacientes relativamente reducido en cada grupo diagnóstico, lo que puede menoscabar las conclusiones. La inclusión prospectiva pero con análisis retrospectivo de los pacientes puede introducir un sesgo de remisión debido a la decisión del médico y las consideraciones logísticas para la remisión a una RMC. En 57 pacientes (27%), la RMC se hizo antes de la angiografía coronaria, lo que llevó a un diagnóstico de miocarditis aguda en 54 pacientes. En consecuencia, no se hizo ninguna angiografía coronaria. Los 3 pacientes restantes (1 paciente con IM, 1 con miocardiopatía de tako-tsubo y 1 con miocardiopatía) presentaron lesiones no obstructivas en la angiografía coronaria realizada después de la RMC. Dada la duración del periodo de inclusión, las técnicas de RMC más recientes que pueden aumentar el rendimiento diagnóstico, tales como la cartografía en T1 y T218, no estuvieron disponibles para todos los pacientes.
CONCLUSIONESEn una cohorte grande de pacientes consecutivos, la RMC estableció el diagnóstico preexistente en el 91% de los pacientes con un diagnóstico provisional inicial de MINOCA. La realización de la RMC en la primera semana del cuadro clínico inicial aumentó el rendimiento diagnóstico hasta el 96%. La miocarditis siguió siendo el diagnóstico más frecuente con independencia del momento de realizarse la RMC, aunque fue más frecuente en los estudios iniciales.
La RMC desempeña un papel importante en la evaluación de pacientes con IM y enfermedad coronaria no obstructiva (MINOCA). No obstante, el momento de realización de la RMC puede influir en su rendimiento diagnóstico. La última guía de la ESC recomienda realizar la RMC en las 2 semanas siguientes al inicio de los síntomas.
¿QUÉ APORTA DE NUEVO?La realización de la RMC en los 7 días siguientes al inicio de los síntomas permite un mayor rendimiento diagnóstico en pacientes con un diagnóstico provisional inicial de MINOCA. Los resultados de este estudio respaldan la defensa de un análisis temprano con RMC en pacientes con MINOCA.
Ninguna organización financió las investigaciones para este estudio.
CONSIDERACIONES ÉTICASEl estudio se realizó de acuerdo con la Declaración de Helsinki y fue revisado y aprobado por el Comité Institucional de Revisión o Junta de Revisión Institucional (código de ética: PI-22-048 y PI-19-257). Debido al análisis retrospectivo de los datos adquiridos clínicamente, el comité de ética local prescindió de la necesidad de consentimiento informado por escrito. Dada la extensión del periodo de inclusión y la naturaleza retrospectiva de los datos clínicos utilizados, no se han tenido en cuenta los posibles sesgos de sexo y género.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALNo se utilizaron herramientas de inteligencia artificial para la preparación de este artículo.
CONTRIBUCIÓN DE LOS AUTORESTodos los autores han contribuido de manera considerable a la concepción o diseño del artículo, la obtención, análisis o interpretación de los datos para el artículo, escribieron la versión preliminar o corrigieron de forma crucial el contenido intelectual. Todos los autores han dado la aprobación final de la versión que se publicará, han aceptado ser responsables de todos los aspectos del artículo y han asegurado que las cuestiones relacionadas con la precisión o integridad de cualquier parte del artículo se han investigado y resuelto de modo apropiado.
CONFLICTO DE INTERESESV. Delgado recibió honorarios de conferenciante de Edwards Lifesciences, GE Healthcare, Medtronic, Philips y Novartis honorarios de asesoramiento de Edwards Lifesciences y Novo Nordisk. A. Bayés-Genís ha participado en trabajos de asesoramiento y conferencias para Abbott, AstraZeneca, Bayer, Boehringer Ingelheim, Novartis, Roche Diagnostics y Vifor. Los demás autores no tienen nada que revelar.