La mortalidad en shock cardiogénico (SC), sobre todo en casos refractarios donde se emplean dispositivos de soporte circulatorio mecánico (SCM), es muy elevada. El objetivo es analizar los resultados de un programa de atención a pacientes en SC tras la implementación de un equipo multidisciplinario en nuestro centro y la organización en red con los hospitales del área.
MétodosEstudio observacional retrospectivo de los pacientes atendidos desde septiembre de 2014 a enero de 2019. Se incluyó a los pacientes en SC refractario que precisaron SCM y aquellos que por edad y ausencia de comorbilidades pueden ser candidatos a tratamientos avanzados. El objetivo principal es evaluar la supervivencia hospitalaria.
ResultadosEn total se incluyó a 130 pacientes (69 locales y 61 trasladados). La media de edad era 52±15 años (el 72% varones). Las etiologías predominantes de SC fueron la insuficiencia cardiaca aguda descompensada (29%), el infarto agudo de miocardio (26%) y el shock tras cardiotomía (25%). En 105 pacientes (81%) se empleó SCM, mayoritariamente oxigenador extracorpóreo de membrana (58%). La supervivencia al alta hospitalaria fue del 57% (74 de 130 pacientes). Los principales destinos fueron la recuperación miocárdica y el trasplante cardiaco. La puntuación SAPS II, el lactato, el infarto como etiología del SC y la puntuación de inotrópicos y vasoactivos resultaron predictores independientes de mortalidad hospitalaria.
ConclusionesLa creación de equipos multidisciplinarios para la atención de pacientes en SC mayoritariamente refractario y la coordinación en red con los hospitales del área son factibles y consiguen una supervivencia hospitalaria de más de la mitad de los pacientes atendidos.
Palabras clave
El shock cardiogénico (SC) continúa siendo una entidad de elevada mortalidad1. Hasta el momento, el único tratamiento con eficacia clínica clara es la revascularización temprana en el SC tras un infarto agudo de miocardio (IAM)2. En los últimos años, se ha asistido al aumento exponencial en el uso de dispositivos de soporte circulatorio mecánico (SCM) para los casos más graves y refractarios al tratamiento médico, cuya mortalidad se acerca al 100%3,4. Estos dispositivos tienen básicamente 2 finalidades: a) facilitar el funcionamiento y la recuperación de los ventrículos afectos, y b) asegurar una adecuada perfusión y oxigenación de órganos vitales que evite el fracaso multiorgánico y la muerte del paciente.
El uso de estas y otras terapias complejas en pacientes en SC refractario hace recomendable la creación de equipos multidisciplinarios especializados en su tratamiento. Estos equipos, formados principalmente por cardiólogos de insuficiencia cardiaca (IC) avanzada, intervencionistas, cirujanos cardiacos y especialistas en cuidados críticos, se integran en centros hospitalarios con especial dedicación y recursos para la atención de pacientes en SC5,6. Además de coordinarse internamente, se propone que sean el núcleo de referencia de una red jerarquizada de hospitales con distintos niveles de atención, análogas a las que se utilizan en el IAM o en el ictus, que permita dar una mejor cobertura a la población de referencia del área7. Experiencias similares en otros países y contextos han conseguido resultados satisfactorios4,8,9.
El objetivo es analizar los resultados iniciales de un programa de atención a pacientes en SC, mayoritariamente refractario, tras la creación de un equipo multidisciplinario en nuestro centro y la coordinación en red con los hospitales de nuestra área de referencia.
MÉTODOSContextoEn los últimos años, uno de los objetivos de nuestro centro ha sido la mejora de la atención a los pacientes en SC mediante la creación de una unidad de SC a finales de 2014. Esta unidad, formada por un equipo multidisciplinario, está disponible las 24 h los 7 días de la semana y se asienta en 4 especialidades fundamentales: IC avanzada, cirugía cardiaca, cardiología intervencionista y cuidados críticos. Los principios fundamentales de esta unidad son 4: una rápida identificación y caracterización del SC, revascularización precoz en casos de SC tras IAM, empleo de SCM en casos refractarios, y la implementación de una estrategia de salida del proceso.
Proceso clínico y toma de decisionesDesde la implementación de esta organización, se considera para ser atendidos por esta vía a todos los pacientes con criterios de SC que tengan datos de refractariedad y precisen SCM de corta duración o que, por edad y situación vital, sean candidatos a tratamientos avanzados de IC, como una asistencia ventricular mecánica de larga duración (AVMLD) o un trasplante cardiaco (TxC).
Se define el SC como una presión arterial sistólica <90mmHg durante más de 30min o el uso de catecolaminas para mantener al menos una presión de 90mmHg, signos clínicos de congestión pulmonar y signos de mala perfusión de órganos con al menos una de las siguientes: alteración del estado mental, piel fría y sudorosa, oliguria con una diuresis <30 ml/h o un lactato arterial> 2,0 mmol/l10. Se considera que un paciente tiene SC refractario cuando mantiene datos de SC pese al tratamiento inicial con vasopresores, inotrópicos y balón de contrapulsación intraaórtico (BCIA) en algunos casos. Los pacientes con SC refractario son candidatos a SCM una vez descartadas contraindicaciones absolutas (negativa del paciente o la familia, más de 30min de parada cardiaca no recuperada, shock séptico o expectativa de vida corta por edad o comorbilidades). También son candidatos a SCM de corta duración como puente al TxC los pacientes en SC dependientes de inotrópicos (INTERMACS 3) que no son buenos candidatos a una AVMLD (p. ej., insuficiencia grave del ventrículo derecho, miocardiopatía hipertrófica/restrictiva o comunicación interventricular tras IAM irreparable).
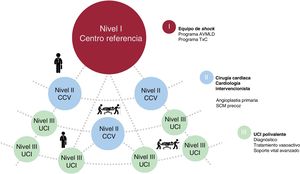
Los pacientes pueden acceder al proceso por 2 vías: pacientes atendidos directamente en nuestro centro (locales) o pacientes remitidos desde otros hospitales (trasladados). Dentro de nuestra área, se divide a los hospitales en 3 niveles de cuidados en función de los medios de que disponen (figura 1):
Nivel III: generalmente provistos de una unidad de cuidados intensivos polivalente. Son capaces de diagnosticar al paciente en SC, de aplicar medidas de soporte vital avanzado e instaurar el tratamiento inicial con fármacos y en algunos casos el implante de un BCIA.
Nivel II: además de lo anterior, disponen de un programa de angioplastia primaria 24 h los 7 días de la semana y en muchos casos son capaces de instaurar un SCM por sus cardiólogos intervencionistas o cirujanos cardiacos.
Nivel I: centro terciario con posibilidad de angioplastia primaria y SCM las 24 h todos los días. Cuenta con un equipo multidisciplinario para la atención del SC. Además, dispone de un programa de AVMLD y TxC.
Cuando un paciente puede ser candidato a ser atendido por esta vía, el médico responsable del paciente se pone en contacto con algún miembro del equipo de SC (activación del «código shock», generalmente un cardiólogo de guardia de IC avanzada, presencial o telefónicamente). Este miembro, tras recoger la información básica, comunica los datos al resto del equipo para decidir el tratamiento del paciente (por lo general, cirujano cardiaco, intensivista/cardiólogo de cuidados críticos e IC avanzada). En algunos casos de pacientes referidos, un miembro del equipo de SC del hospital de nivel I se desplaza hasta el hospital donde se encuentra el paciente para valorarlo in situ. Los pacientes que cumplen los criterios anteriormente señalados son trasladados al hospital de referencia. También existen traslados intermedios entre hospitales de los niveles II y III. Los pacientes que se encuentran en hospitales de nivel II con SC refractario, idealmente deben ser estabilizados mediante SCM para trasladarlos después con mayor seguridad. En algún caso, un equipo del hospital de nivel I formado por cirujano cardiaco, perfusionista e intensivista se puede desplazar hasta el centro donde se encuentra el paciente para el implante de un dispositivo de SCM y posteriormente trasladar al paciente al hospital de referencia. Todos los días a las 12:30 los médicos de la unidad de SC realizan una sesión clínica dirigida a consensuar el tratamiento del paciente (figura 1).
Una vez decidido el empleo de un dispositivo de SCM en los casos de SC refractario, el implante se realiza precozmente como «puente a la decisión». Los dispositivos de SCM empleados son: asistencias ventriculares mecánicas de corta duración (AVMCD; Impella CP [Abiomed, Alemania] o Levitronix CentriMag [Abbott, Estados Unidos] univentricular o biventricular) u oxigenador extracorpóreo de membrana venoarterial (ECMO-VA) (CardioHelp [Maquet, Alemania] o Levitronix CentriMag con oxigenador de membrana). En general, se prefiere el ECMO-VA cuando el paciente presenta alguna de las siguientes condiciones: a) estado neurológico dudoso o parada cardiorrespiratoria prolongada; b) inestabilidad hemodinámica profunda con afección biventricular y compromiso respiratorio, y c) coagulopatía grave secundaria al SC o también haber recibido doble antiagregación o inhibidores de la glucoproteína IIb/IIIa (para dispositivos quirúrgicos).
Respecto a los dispositivos de AVMCD, el Impella CP es de elección en casos de SC tras IAM con afección del ventrículo izquierdo (VI) en el contexto de la angioplastia primaria, siempre que no presenten alguna de las condiciones expuestas anteriormente. También se emplea como «puente a la decisión» en algunos casos de IC aguda descompensada que progresan a SC con afección predominante del VI y para la descarga del VI en pacientes en ECMO-VA periférica. En el resto de los supuestos se emplea el Levitronix CentriMag en cualquiera de sus modalidades (univentricular o biventricular, con o sin oxigenador de membrana, canulación quirúrgica o mínimamente invasiva)11.
Diseño del estudio y objetivosEs un estudio observacional retrospectivo de todos los pacientes consecutivos atendidos en la unidad de SC desde septiembre 2014 hasta enero 2019. Desde la implementación de este programa, se recogen y almacenan los datos de los pacientes prospectivamente en un registro local. Las variables hemodinámicas y bioquímicas se recogen al diagnóstico del SC en los pacientes locales y en el momento del traslado a nuestro centro en los pacientes referidos. También se recogen variables demográficas y de tratamiento del paciente. En aras de mejorar la caracterización de los pacientes, se ha calculado la puntuación de inotrópicos y vasoactivos (PIV) a las 24 y a las 48 h de ingreso. También se han calculado las puntuaciones Sepsis-related Organ Failure Assesment (SOFA), Simplified Acute Physiology Score (SAPS) II y Acute Physiology And Chronic Health Evaluation II (APACHE II) en las primeras 24 h de ingreso. Para asignar la causa de muerte en los casos con varias contribuyentes, se consideró aquella que tuvo una mayor influencia en el evento final.
El objetivo principal del estudio es evaluar la supervivencia al alta hospitalaria. Otros objetivos: a) conocer el destino de los pacientes en SC; b) identificar predictores independientes y precoces de mortalidad hospitalaria, y c) conocer el pronóstico a medio-largo plazo de los supervivientes.
Análisis estadísticoLas variables continuas se expresan como media±desviación estándar o mediana [intervalo intercuartílico] si no siguen la distribución normal. Las variables categóricas se presentan como frecuencia y porcentaje. En los contrastes de hipótesis se empleó el test de Wilcoxon para variables continuas y la prueba de la χ2 con corrección de Yates (en caso de valores <5 en alguna de las celdas) para las categóricas. También se utilizó el test exacto de Fisher.
Se realizaron análisis univariante y multivariante mediante regresión logística entre supervivientes y no supervivientes al alta hospitalaria. Las variables asociadas con mortalidad con p <0,1 en el análisis univariante se incluyeron en el multivariante. La inclusión de variables en el modelo pronóstico se ha hecho con base en el método stepwise-backward y se han considerado las variables valorables en las primeras 24 h de ingreso del paciente en el hospital de nivel I. Para el análisis de supervivencia se emplearon curvas de Kaplan-Meier. Se consideró significación estadística un valor de p <0,05. Se empleó para el análisis el programa informático STATA IC/15. Este estudio fue aprobado por el Comité de Ética de Investigación de la Universidad Autónoma de Madrid y del Hospital Universitario Puerta de Hierro Majadahonda.
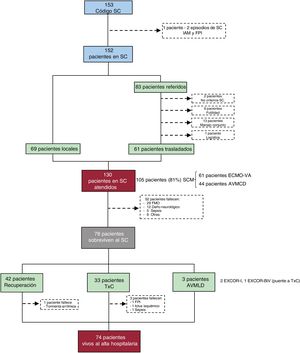
RESULTADOSEn total, se activó el «código shock» en 152 pacientes (153 episodios; 1 paciente tuvo 2 procesos de SC, solo se considera el primero). De ellos, 69 fueron pacientes locales y 83 consultas telefónicas de otros centros. Finalmente, de los 83 pacientes consultados, se trasladó a nuestro centro a 61. Las principales causas para no ser trasladado fueron la posibilidad de realizar un tratamiento adecuado y consensuado en el hospital donde se encontraba el paciente (n=13) y la futilidad (n=6). En total, 130 pacientes (69 locales y 61 trasladados) fueron atendidos e incluidos en el presente análisis (figura 2).
Diagrama de flujo de los pacientes incluidos en el programa. AVMCD: asistencia ventricular mecánica de corta duración; ECMO-VA: oxigenador extracorpóreo de membrana venoarterial; FMO: fallo multiorgánico; FPI: fallo primario del injerto; IAM: infarto agudo de miocardio; SC: shock cardiogénico; SCM: soporte circulatorio mecánico; TxC: trasplante cardiaco.
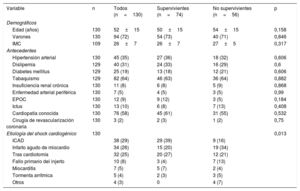
Las características demográficas de los pacientes se recogen en la tabla 1. La media de edad de los pacientes fue 52±15 años (el 72% varones). Las etiologías predominantes de SC fueron la IC aguda descompensada (29%), el IAM (26%) y el SC tras cardiotomía (25%). La etiología fue diferente entre los pacientes locales y los trasladados: en los pacientes locales, más de la mitad de los casos fueron SC posquirúrgicos (tras cardiotomía y fallo primario del injerto), mientras que en los pacientes trasladados predominaron el IAM y la IC aguda descompensada.
Características basales y demográficas de la población
| Variable | n | Todos (n=130) | Supervivientes (n=74) | No supervivientes (n=56) | p |
|---|---|---|---|---|---|
| Demográficos | |||||
| Edad (años) | 130 | 52±15 | 50±15 | 54±15 | 0,158 |
| Varones | 130 | 94 (72) | 54 (73) | 40 (71) | 0,846 |
| IMC | 109 | 26±7 | 26±7 | 27±5 | 0,317 |
| Antecedentes | |||||
| Hipertensión arterial | 130 | 45 (35) | 27 (36) | 18 (32) | 0,606 |
| Dislipemia | 129 | 40 (31) | 24 (33) | 16 (29) | 0,6 |
| Diabetes mellitus | 129 | 25 (19) | 13 (18) | 12 (21) | 0,606 |
| Tabaquismo | 129 | 82 (64) | 46 (63) | 36 (64) | 0,882 |
| Insuficiencia renal crónica | 130 | 11 (8) | 6 (8) | 5 (9) | 0,868 |
| Enfermedad arterial periférica | 130 | 7 (5) | 4 (5) | 3 (5) | 0,99 |
| EPOC | 130 | 12 (9) | 9 (12) | 3 (5) | 0,184 |
| Ictus | 130 | 13 (10) | 6 (8) | 7 (13) | 0,408 |
| Cardiopatía conocida | 130 | 76 (58) | 45 (61) | 31 (55) | 0,532 |
| Cirugía de revascularización coronaria | 130 | 3 (2) | 2 (3) | 1 (2) | 0,75 |
| Etiología del shock cardiogénico | 130 | 0,013 | |||
| ICAD | 38 (29) | 29 (39) | 9 (16) | ||
| Infarto agudo de miocardio | 34 (26) | 15 (20) | 19 (34) | ||
| Tras cardiotomía | 32 (25) | 20 (27) | 12 (21) | ||
| Fallo primario del injerto | 10 (8) | 3 (4) | 7 (13) | ||
| Miocarditis | 7 (5) | 5 (7) | 2 (4) | ||
| Tormenta arrítmica | 5 (4) | 2 (3) | 3 (5) | ||
| Otros | 4 (3) | 0 | 4 (7) | ||
EPOC: enfermedad pulmonar obstructiva crónica; ICAD: insuficiencia cardiaca aguda descompensada; IMC: índice de masa corporal.
Las variables categóricas se expresan como n (%) y las continuas, como media desviación±estándar.
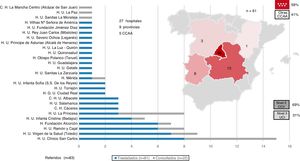
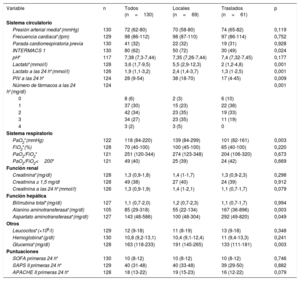
Los pacientes trasladados provenían mayoritariamente de hospitales de nivel II (69%) y de la propia comunidad autónoma (59%). La mediana de tiempo desde el diagnóstico del SC hasta el traslado fue de 2 [1-4] días. Se trasladó a 18 pacientes con BCIA, 14 con ECMO-VA (10 de los 11 con canulación periférica, portaban además un BCIA) y 6 con AVMCD (todos Levitronix CentriMag). No hubo ninguna complicación destacable durante el traslado (figura 3).
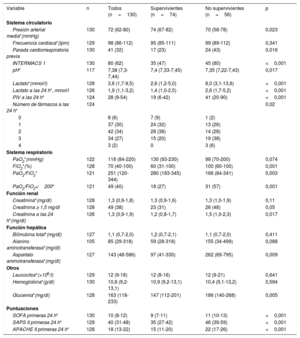
La situación clínica de los pacientes al ingreso y en las primeras 24h en nuestra unidad de cuidados intensivos se describe en la tabla 2 y la tabla 3; 41 pacientes (32%) tuvieron una parada cardiorrespiratoria previa y 80 (62%) se diagnosticaron en situación INTERMACS 1. Los valores de lactato, creatinina, aspartato aminotransferasa, alanino aminotransferasa y las puntuaciones SOFA, SAPS II y APACHE II reflejan la situación de fallo multiorgánico en la que se encontraban los pacientes en las primeras horas de ingreso en nuestro centro. A las 24 h, el 63% de los pacientes necesitaba 2 o más fármacos vasoactivos para mantener estabilidad hemodinámica. Los pacientes trasladados tuvieron valores de lactato al ingreso más bajos (5,5 [2,9-12,3] frente a 2,0 [1,2-4,8] mmol/l; p=0,001), pero transaminasas más elevadas (aspartato aminotransferasa, 100 [48-304] frente a 292 [49-820] mg/dl; p=0,049; alanino aminotransferasa, 55 [22-134] frente a 167 [36-896] mg/dl; p=0,003) (tabla 3).
Variables de fallo de órganos al primer contacto y durante las primeras 24h en función de la supervivencia al alta hospitalaria
| Variable | n | Todos (n=130) | Supervivientes (n=74) | No supervivientes (n=56) | p |
|---|---|---|---|---|---|
| Sistema circulatorio | |||||
| Presión arterial media*(mmHg) | 130 | 72 (62-80) | 74 (67-82) | 70 (58-78) | 0,023 |
| Frecuencia cardiaca*(lpm) | 129 | 98 (86-112) | 95 (85-111) | 99 (89-112) | 0,341 |
| Parada cardiorrespiratoria previa | 130 | 41 (32) | 17 (23) | 24 (43) | 0,016 |
| INTERMACS 1 | 130 | 80 (62) | 35 (47) | 45 (80) | <0,001 |
| pH* | 117 | 7,38 (7,3-7,44) | 7,4 (7,33-7,45) | 7,35 (7,22-7,43) | 0,017 |
| Lactato*(mmol/l) | 128 | 3,6 (1,7-9,5) | 2,6 (1,2-5,0) | 8,0 (3,1-13,9) | <0,001 |
| Lactato a las 24 h*, mmol/l | 126 | 1,9 (1,1-3,2) | 1,4 (1,0-2,5) | 2,6 (1,7-5,2) | <0,001 |
| PIV a las 24 h* | 124 | 28 (9-54) | 19 (6-42) | 41 (20-90) | <0,001 |
| Número de fármacos a las 24 h* | 124 | 0,02 | |||
| 0 | 8 (6) | 7 (9) | 1 (2) | ||
| 1 | 37 (30) | 24 (32) | 13 (26) | ||
| 2 | 42 (34) | 28 (38) | 14 (28) | ||
| 3 | 34 (27) | 15 (20) | 19 (38) | ||
| 4 | 3 (2) | 0 | 3 (6) | ||
| Sistema respiratorio | |||||
| PaO2*(mmHg) | 122 | 118 (84-220) | 130 (93-230) | 98 (70-200) | 0,074 |
| FiO2*(%) | 128 | 70 (40-100) | 60 (31-100) | 100 (60-100) | 0,001 |
| PaO2/FiO2* | 121 | 251 (120-344) | 280 (183-345) | 166 (84-341) | 0,003 |
| PaO2/FiO2<200* | 121 | 49 (40) | 18 (27) | 31 (57) | 0,001 |
| Función renal | |||||
| Creatinina*(mg/dl) | 128 | 1,3 (0,9-1,8) | 1,3 (0,9-1,6) | 1,3 (1,0-1,9) | 0,11 |
| Creatinina ≥ 1,5 mg/dl | 128 | 49 (38) | 23 (31) | 26 (48) | 0,05 |
| Creatinina a las 24 h*(mg/dl) | 126 | 1,3 (0,9-1,9) | 1,2 (0,8-1,7) | 1,5 (1,0-2,3) | 0,017 |
| Función hepática | |||||
| Bilirrubina total*(mg/dl) | 127 | 1,1 (0,7-2,0) | 1,2 (0,7-2,1) | 1,1 (0,7-2,0) | 0,411 |
| Alanino aminotransferasa*(mg/dl) | 105 | 85 (29-318) | 59 (28-318) | 155 (34-499) | 0,088 |
| Aspartato aminotransferasa*(mg/dl) | 127 | 143 (48-586) | 97 (41-330) | 262 (69-795) | 0,009 |
| Otros | |||||
| Leucocitos*(×109/l) | 129 | 12 (9-18) | 12 (8-16) | 12 (9-21) | 0,641 |
| Hemoglobina*(g/dl) | 130 | 10,8 (9,2-13,1) | 10,9 (9,2-13,1) | 10,4 (9,1-13,2) | 0,594 |
| Glucemia*(mg/dl) | 128 | 163 (118-233) | 147 (112-201) | 186 (140-268) | 0,005 |
| Puntuaciones | |||||
| SOFA primeras 24 h* | 130 | 10 (8-12) | 9 (7-11) | 11 (10-13) | <0,001 |
| SAPS II primeras 24 h* | 129 | 40 (31-48) | 35 (27-42) | 46 (39-59) | <0,001 |
| APACHE II primeras 24 h* | 128 | 18 (13-22) | 15 (11-20) | 22 (17-26) | <0,001 |
APACHE II: Acute Physiology And Chronic Health Evaluation II; FiO2: fracción inspirada de oxígeno; INTERMACS: escala de clasificación de pacientes en insuficiencia cardiaca avanzada (The Interagency Registry for Mechanically Assisted Circulatory Support); PaO2: presión arterial de oxígeno; PIV: puntuación de inotrópicos y vasoactivos; SAPS II: Simplified Acute Physiology Score; SOFA: Sepsis-related Organ Failure Assesment.
Las variables categóricas se expresan como n (%) y las continuas, como media (intervalo).
Variables de fallo de órganos al primer contacto y durante las primeras 24h en función del origen del paciente
| Variable | n | Todos (n=130) | Locales (n=69) | Traslados (n=61) | p |
|---|---|---|---|---|---|
| Sistema circulatorio | |||||
| Presión arterial media*(mmHg) | 130 | 72 (62-80) | 70 (58-80) | 74 (65-82) | 0,119 |
| Frecuencia cardiaca*(lpm) | 129 | 98 (86-112) | 98 (87-110) | 97 (86-114) | 0,752 |
| Parada cardiorrespiratoria previa | 130 | 41 (32) | 22 (32) | 19 (31) | 0,928 |
| INTERMACS 1 | 130 | 80 (62) | 50 (72) | 30 (49) | 0,024 |
| pH* | 117 | 7,38 (7,3-7,44) | 7,35 (7,26-7,44) | 7,4 (7,32-7,45) | 0,177 |
| Lactato*(mmol/l) | 128 | 3,6 (1,7-9,5) | 5,5 (2,9-12,3) | 2 (1,2-4,8) | 0,001 |
| Lactato a las 24 h*(mmol/l) | 126 | 1,9 (1,1-3,2) | 2,4 (1,4-3,7) | 1,3 (1-2,5) | 0,001 |
| PIV a las 24 h* | 124 | 28 (9-54) | 38 (18-70) | 17 (4-45) | 0,009 |
| Número de fármacos a las 24 h*(mg/dl) | 124 | 0,001 | |||
| 0 | 8 (6) | 2 (3) | 6 (10) | ||
| 1 | 37 (30) | 15 (23) | 22 (38) | ||
| 2 | 42 (34) | 23 (35) | 19 (33) | ||
| 3 | 34 (27) | 23 (35) | 11 (19) | ||
| 4 | 3 (2) | 3 (5) | 0 | ||
| Sistema respiratorio | |||||
| PaO2*(mmHg) | 122 | 118 (84-220) | 139 (84-299) | 101 (82-161) | 0,003 |
| FiO2*(%) | 128 | 70 (40-100) | 100 (45-100) | 65 (40-100) | 0,220 |
| PaO2/FiO2* | 121 | 251 (120-344) | 274 (123-348) | 204 (106-320) | 0,673 |
| PaO2/FiO2<200* | 121 | 49 (40) | 25 (39) | 24 (42) | 0,669 |
| Función renal | |||||
| Creatinina*(mg/dl) | 128 | 1,3 (0,9-1,8) | 1,4 (1-1,7) | 1,3 (0,9-2,3) | 0,298 |
| Creatinina ≥ 1,5 mg/dl | 128 | 49 (38) | 27 (40) | 24 (39) | 0,912 |
| Creatinina a las 24 h*(mmol/l) | 126 | 1,3 (0,9-1,9) | 1,4 (1-2,1) | 1,1 (0,7-1,7) | 0,079 |
| Función hepática | |||||
| Bilirrubina total*(mg/dl) | 127 | 1,1 (0,7-2,0) | 1,2 (0,7-2,3) | 1,1 (0,7-1,7) | 0,994 |
| Alanino aminotransferasa*(mg/dl) | 105 | 85 (29-318) | 55 (22-134) | 167 (36-896) | 0,003 |
| Aspartato aminotransferasa*(mg/dl) | 127 | 143 (48-586) | 100 (48-304) | 292 (49-820) | 0,049 |
| Otros | |||||
| Leucocitos*(×109/l) | 129 | 12 (9-18) | 11 (8-19) | 13 (9-18) | 0,348 |
| Hemoglobina*(g/dl) | 130 | 10,8 (9,2-13,1) | 10,4 (9,1-12,4) | 11 (9,4-13,3) | 0,241 |
| Glucemia*(mg/dl) | 128 | 163 (118-233) | 191 (145-265) | 133 (111-181) | 0,003 |
| Puntuaciones | |||||
| SOFA primeras 24 h* | 130 | 10 (8-12) | 10 (8-12) | 10 (8-12) | 0,746 |
| SAPS II primeras 24 h* | 129 | 40 (31-48) | 40 (33-48) | 39 (29-50) | 0,882 |
| APACHE II primeras 24 h* | 128 | 18 (13-22) | 19 (15-23) | 16 (12-22) | 0,079 |
APACHE II: Acute Physiology And Chronic Health Evaluation II; FiO2: fracción inspirada de oxígeno; INTERMACS: escala de clasificación de pacientes en insuficiencia cardiaca avanzada (The Interagency Registry for Mechanically Assisted Circulatory Support); PaO2: presión arterial de oxígeno; PIV: puntuación de inotrópicos y vasoactivos; SAPS II: Simplified Acute Physiology Score; SOFA: Sepsis-related Organ Failure Assesment.
Las variables categóricas se expresan como n (%) y las continuas, como media (intervalo).
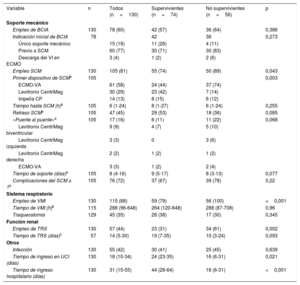
En 105 de los 130 pacientes (81%) se empleó un dispositivo de SCM. En el 57% de estos se realizó una escalada de soporte desde el BCIA. Solo 10 pacientes (el 8% de la serie) no tuvieron BCIA ni dispositivo de SCM. El ECMO-VA fue el primer dispositivo empleado en más de la mitad de los casos (61 de 105; 58%). En 30 pacientes el dispositivo inicial fue el Levitronix CentriMag (8 izquierdos, 2 derechos y 20 biventriculares) y en 14 el Impella CP. En 17 casos se empleó un segundo dispositivo de SCM para estabilizar al paciente, fundamentalmente por problemas respiratorios y hemodinámicos en pacientes en ECMO-VA periférico con puente a AVMCD tipo Levitronix CentriMag (tabla 4).
Tratamiento y evolución de los pacientes durante el shock
| Variable | n | Todos (n=130) | Supervivientes (n=74) | No supervivientes (n=56) | p |
|---|---|---|---|---|---|
| Soporte mecánico | |||||
| Empleo de BCIA | 130 | 78 (60) | 42 (57) | 36 (64) | 0,386 |
| Indicación inicial de BCIA | 78 | 42 | 36 | 0,273 | |
| Único soporte mecánico | 15 (19) | 11 (26) | 4 (11) | ||
| Previo a SCM | 60 (77) | 30 (71) | 30 (83) | ||
| Descarga del VI en ECMO | 3 (4) | 1 (2) | 2 (6) | ||
| Empleo SCM | 130 | 105 (81) | 55 (74) | 50 (89) | 0,043 |
| Primer dispositivo de SCMa | 105 | 0,003 | |||
| ECMO-VA | 61 (58) | 24 (44) | 37 (74) | ||
| Levitronix CentriMag | 30 (29) | 23 (42) | 7 (14) | ||
| Impella CP | 14 (13) | 8 (15) | 6 (12) | ||
| Tiempo hasta SCM (h)a | 105 | 6 (1-24) | 8 (1-27) | 6 (1-24) | 0,255 |
| Retraso SCMa | 105 | 47 (45) | 29 (53) | 18 (36) | 0,085 |
| «Puente al puente»a | 105 | 17 (16) | 6 (11) | 11 (22) | 0,068 |
| Levitronix CentriMag biventricular | 9 (9) | 4 (7) | 5 (10) | ||
| Levitronix CentriMag izquierda | 3 (3) | 0 | 3 (6) | ||
| Levitronix CentriMag derecha | 2 (2) | 1 (2) | 1 (2) | ||
| ECMO-VA | 3 (3) | 1 (2) | 2 (4) | ||
| Tiempo de soporte (días)a | 105 | 8 (4-16) | 9 (5-17) | 8 (3-13) | 0,077 |
| Complicaciones del SCM ≥ 1a | 105 | 76 (72) | 37 (67) | 39 (78) | 0,22 |
| Sistema respiratorio | |||||
| Empleo de VMI | 130 | 115 (88) | 59 (79) | 56 (100) | <0,001 |
| Tiempo de VMI (h)b | 115 | 288 (96-648) | 264 (120-648) | 288 (87-708) | 0,96 |
| Traqueostomía | 129 | 45 (35) | 28 (38) | 17 (30) | 0,345 |
| Función renal | |||||
| Empleo de TRS | 130 | 57 (44) | 23 (31) | 34 (61) | 0,002 |
| Tiempo de TRS (días)c | 57 | 14 (5-30) | 19 (7-35) | 10 (3-24) | 0,093 |
| Otros | |||||
| Infección | 130 | 55 (42) | 30 (41) | 25 (45) | 0,639 |
| Tiempo de ingreso en UCI (días) | 130 | 18 (10-34) | 24 (23-35) | 16 (6-31) | 0,021 |
| Tiempo de ingreso hospitalario (días) | 130 | 31 (15-55) | 44 (28-64) | 16 (6-31) | <0,001 |
BCIA: balón de contrapulsación intraaórtico; ECMO: oxigenador extracorpóreo de membrana; ECMO-VA: ECMO venoarterial; SCM: soporte circulatorio mecánico; TRS: terapia renal sustitutiva; UCI: unidad de cuidados intensivos; VI: ventrículo izquierdo; VMI: ventilación mecánica no invasiva.
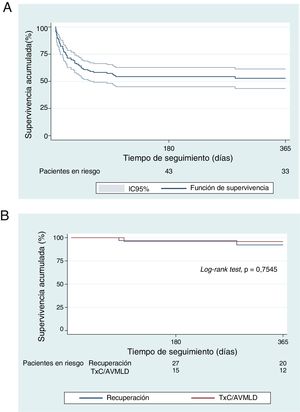
Sobrevivieron a la fase aguda del SC 78 pacientes (60%): 42 lograron la recuperación miocárdica, se trasplantó a 33 en código urgente y en 3 se implantó una AVMLD tipo EXCOR como «puente a trasplante». La supervivencia total al alta hospitalaria fue del 57% (74 de 130 pacientes; el 51% de los pacientes locales y el 64% de los trasladados). Entre los pacientes que sobrevivieron a la fase aguda del SC, la supervivencia al alta hospitalaria fue del 95% (74 de 78 pacientes). Tan solo fallecieron 1 paciente por tormenta arrítmica tras la recuperación y 3 pacientes tras el TxC (fallo primario del injerto, ictus isquémico y sepsis). La supervivencia al alta hospitalaria del TxC en código urgente en esta serie fue del 91% (30 de 33 pacientes). Los 3 pacientes con AVMLD tipo EXCOR llegaron al TxC tras 85, 90 y 140 días desde el implante. En el análisis de Kaplan-Meier la supervivencia a 1 año de toda la cohorte fue del 53%. En los supervivientes, tras una mediana de seguimiento de 221 [44-699] días tras el alta, solo hubo 5 muertes, con una supervivencia actuarial a 1 año del 94%, sin diferencias en función del destino del paciente (figura 4).
A: curva de supervivencia actuarial de Kaplan-Meier del total de la serie. B: curvas de supervivencia actuarial de Kaplan-Meier de los pacientes que sobreviven al alta hospitalaria en función del destino. AVMLD: asistencia ventricular mecánica de larga duración; IC95%: intervalo de confianza del 95%; TxC: trasplante cardiaco.
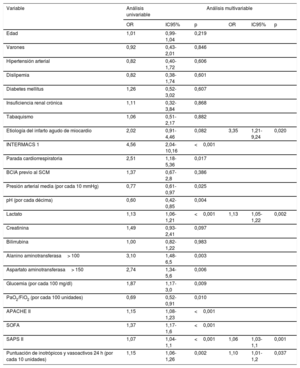
Los resultados de los análisis univariable y multivariable de mortalidad hospitalaria se recogen en la tabla 5. Resultaron predictores independientes de mortalidad hospitalaria el SCA como etiología de SC (odds ratio [OR]=3,35; intervalo de confianza del 95% [IC95%], 1,21-9,24; p=0,02), el lactato inicial (OR=1,13; IC95%, 1,05-1,22; p=0,002), la puntuación SAPS II en las primeras 24 h (OR=1,06; IC95%, 1,03-1,1; p=0,001) y la PIV a las 24 h del ingreso (OR=1,1; IC95%, 1,01-1,2; p=0,037). El estadístico C de este modelo multivariable que incluyó parámetros clínicos de las primeras horas de ingreso fue de 0,82 (IC95%, 0,75-0,90).
Análisis univariable y multivariable de mortalidad hospitalaria
| Variable | Análisis univariable | Análisis multivariable | ||||
|---|---|---|---|---|---|---|
| OR | IC95% | p | OR | IC95% | p | |
| Edad | 1,01 | 0,99-1,04 | 0,219 | |||
| Varones | 0,92 | 0,43-2,01 | 0,846 | |||
| Hipertensión arterial | 0,82 | 0,40-1,72 | 0,606 | |||
| Dislipemia | 0,82 | 0,38-1,74 | 0,601 | |||
| Diabetes mellitus | 1,26 | 0,52-3,02 | 0,607 | |||
| Insuficiencia renal crónica | 1,11 | 0,32-3,84 | 0,868 | |||
| Tabaquismo | 1,06 | 0,51-2,17 | 0,882 | |||
| Etiología del infarto agudo de miocardio | 2,02 | 0,91-4,46 | 0,082 | 3,35 | 1,21-9,24 | 0,020 |
| INTERMACS 1 | 4,56 | 2,04-10,16 | <0,001 | |||
| Parada cardiorrespiratoria | 2,51 | 1,18-5,36 | 0,017 | |||
| BCIA previo al SCM | 1,37 | 0,67-2,8 | 0,386 | |||
| Presión arterial media (por cada 10 mmHg) | 0,77 | 0,61-0,97 | 0,025 | |||
| pH (por cada décima) | 0,60 | 0,42-0,85 | 0,004 | |||
| Lactato | 1,13 | 1,06-1,21 | <0,001 | 1,13 | 1,05-1,22 | 0,002 |
| Creatinina | 1,49 | 0,93-2,41 | 0,097 | |||
| Bilirrubina | 1,00 | 0,82-1,22 | 0,983 | |||
| Alanino aminotransferasa> 100 | 3,10 | 1,48-6,5 | 0,003 | |||
| Aspartato aminotransferasa> 150 | 2,74 | 1,34-5,6 | 0,006 | |||
| Glucemia (por cada 100 mg/dl) | 1,87 | 1,17-3,0 | 0,009 | |||
| PaO2/FiO2 (por cada 100 unidades) | 0,69 | 0,52-0,91 | 0,010 | |||
| APACHE II | 1,15 | 1,08-1,23 | <0,001 | |||
| SOFA | 1,37 | 1,17-1,6 | <0,001 | |||
| SAPS II | 1,07 | 1,04-1,1 | <0,001 | 1,06 | 1,03-1,1 | 0,001 |
| Puntuación de inotrópicos y vasoactivos 24 h (por cada 10 unidades) | 1,15 | 1,06-1,26 | 0,002 | 1,10 | 1,01-1,2 | 0,037 |
APACHE II: Acute Physiology And Chronic Health Evaluation II; BCIA, balón de contrapulsación intraórtico; FiO2: fracción inspirada de oxígeno; IC95%: intervalo de confianza del 95%; INTERMACS, escala de clasificación de pacientes en insuficiencia cardiaca avanzada (The Interagency Registry for Mechanically Assisted Circulatory Support); OR: odds ratio; PaO2: presión arterial de oxígeno; SAPS II: Simplified Acute Physiology Score; SCM, soporte circulatorio mecánico; SOFA: Sepsis-related Organ Failure Assesment.
Las principales causas de muerte durante la fase aguda del SC fueron el fallo multiorgánico en 29 de 52 (56%) pacientes fallecidos, el daño neurológico en 12 (23%): 8 encefalopatías anóxicas, 2 ictus isquémicos y 2 ictus hemorrágicos, y la sepsis en 5 casos (10%). De los 105 pacientes con SCM, 76 (72%) tuvieron al menos 1 complicación relacionada. Las principales complicaciones fueron las hemorragias con necesidad de transfusión o reintervención en 47 pacientes (45%), los ictus en 13 (12%): 9 isquémicos y 4 hemorrágicos, y la isquemia arterial periférica en relación con la canulación del dispositivo de SCM en 9 pacientes (9%). Tan solo 2 de los 13 pacientes con ictus y 3 de los 9 con isquemia arterial periférica sobrevivieron al alta hospitalaria.
DISCUSIÓNEste trabajo muestra los resultados de un programa de atención a pacientes en SC mayoritariamente refractario, tras la creación de una unidad multidisciplinaria de SC y la organización en red con los hospitales del área territorial. Los principales hallazgos son: a) una supervivencia al alta hospitalaria del 57%; b) la gran mayoría de los pacientes que sobreviven es por recuperación miocárdica o TxC urgente; c) la etiología del SC, la concentración de lactato, la puntuación SAPS II y la PIV resultaron predictores independientes de mortalidad hospitalaria, y d) la supervivencia a medio plazo de los pacientes que sobreviven al ingreso hospitalario es excelente (el 94% a 1 año).
En los últimos años, ha crecido significativamente el interés por mejorar la atención de los pacientes en SC. Además del aumento en el uso de dispositivos de SCM3, gran parte de los esfuerzos se centran en aspectos organizativos, con la creación de equipos multidisciplinarios experimentados y redes hospitalarias con derivación de pacientes a centros de referencia5–7. Estas redes permitirían: a) dar la mejor y más homogénea atención a todos los pacientes de un determinado territorio; b) centralizar la actividad, aumentar la experiencia de los equipos y, con ello, mejorar los resultados en esta entidad, y c) ser la base asistencial que permita generar evidencia científica de la que se carece hoy día en este campo. Esta serie es, en nuestro conocimiento, la primera reportada en nuestro país con este modelo de organización, y posee características que la hacen única respecto a otras publicadas.
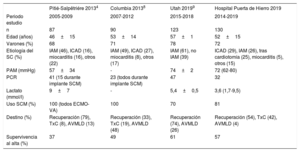
En primer lugar, se muestran los resultados de una estrategia basada en criterios de selección definidos a priori, a diferencia de otras series que se han construido desde el empleo de dispositivos de SCM o el perfil de gravedad del paciente. Aunque esto puede condicionar una mayor heterogeneidad de la población estudiada, consideramos que tiene la virtud de mostrar la actividad y las posibilidades en la «vida real» de un programa de estas características. Los datos de actividad y resultados pueden ser útiles para la planificación de otros equipos y áreas. Durante el periodo estudiado se atendió una media de 2-3 casos al mes y los resultados se han mantenido estables, posiblemente fruto del proceso de aprendizaje y entrenamiento del equipo en los años previos a la puesta en marcha del programa. Pese a la dificultad para comparar las distintas series de SC publicadas, la supervivencia al alta hospitalaria comunicada en nuestro trabajo concuerda con las de otros grupos con programas similares4,8,9 (tabla 6). Aunque pudiera parecer que no se ha avanzado en la mejora del pronóstico de estos pacientes en las últimas décadas, pues sigue teniendo mortalidades alrededor del 50%, creemos que las características de los pacientes atendidos en este y otros centros reflejan una población cada vez más enferma que en el pasado pudiera no haber tenido siquiera opciones de tratamiento.
Comparación de las características y resultados de nuestro programa de atención a pacientes en SC respecto a otros publicados
| Pitié-Salpêtriére 20134 | Columbia 20138 | Utah 20199 | Hospital Puerta de Hierro 2019 | |
|---|---|---|---|---|
| Periodo estudio | 2005-2009 | 2007-2012 | 2015-2018 | 2014-2019 |
| n | 87 | 90 | 123 | 130 |
| Edad (años) | 46±15 | 53±14 | 57±1 | 52±15 |
| Varones (%) | 68 | 71 | 78 | 72 |
| Etiología del SC (%) | IAM (46), ICAD (16), miocarditis (16), otros (22) | IAM (49), ICAD (27), miocarditis (8), otros (17) | IAM (61), no IAM (39) | ICAD (29), IAM (26), tras cardiotomía (25), miocarditis (5), otros (15) |
| PAM (mmHg) | 57±34 | - | 74±2 | 72 (62-80) |
| PCR | 41 (15 durante implante SCM) | 23 (todos durante implante SCM) | 47 | 32 |
| Lactato (mmol/l) | 9±7 | - | 5,4±0,5 | 3,6 (1,7-9,5) |
| Uso SCM (%) | 100 (todos ECMO-VA) | 100 | 70 | 81 |
| Destino (%) | Recuperación (79), TxC (8), AVMLD (13) | Recuperación (33), TxC (19), AVMLD (48) | Recuperación (74), AVMLD (26) | Recuperación (54), TxC (42), AVMLD (4) |
| Supervivencia al alta (%) | 37 | 49 | 61 | 57 |
AVMLD: asistencia ventricular mecánica de larga duración; ECMO-VA: oxigenador extracorpóreo de membrana venoarterial; ICAD: insuficiencia cardiaca aguda descompensada; IAM: infarto agudo de miocardio; PAM: presión arterial media; PCR: parada cardiorrespiratoria; SC: shock cardiogénico; SCM: soporte circulatorio mecánico; TxC: trasplante cardiaco.
En segundo lugar y relacionado con lo anterior, en este programa se han incluido todas las etiologías de SC sin exclusión. A pesar de que la fisiopatología y el contexto clínico de los pacientes son distintos, sobre todo en los posquirúrgicos, en muchas ocasiones el tratamiento y el destino del paciente son comunes. En nuestra serie, el 74% de los pacientes incluidos tuvieron un SC no secundario a un IAM. Estos datos de actividad, con un porcentaje de SC tras IAM menor que un tercio del total de pacientes, concuerdan con otros publicados recientemente, donde se destaca el cambio de perfil del paciente en SC que se atiende hoy en las unidades de cuidados intensivos12.
Y, en tercer lugar, en esta serie el TxC en código urgente fue el destino del 42% de los pacientes que sobrevivieron a la fase aguda del SC por no presentar signos de recuperación miocárdica. Este elevado empleo del TxC en pacientes en SC solo es posible en países con una alta tasa de donación y con tiempos de espera relativamente cortos como en el nuestro13. Aunque los resultados del TxC en este tipo de pacientes pueden ser inferiores a los obtenidos en el TxC electivo y esto ha sido objeto de estudio y controversia14,15, en centros con experiencia y con una adecuada selección de los receptores tras la resolución del fallo multiorgánico, se pueden obtener resultados de supervivencia> 90% al alta hospitalaria, como fue en nuestro caso (30/33 pacientes, el 91%).
Respecto al estudio de predictores de mortalidad, la puntuación SAPS II, el IAM como etiología del SC, el lactato al ingreso y la PIV resultaron ser potentes predictores independientes de mortalidad hospitalaria en nuestra serie. Estos hallazgos concuerdan con la evidencia publicada. La puntuación SAPS II, que incluye entre otros parámetros la edad del paciente, la presión arterial, la frecuencia cardiaca, la escala Glasgow y otros valores bioquímicos y respiratorios, ya había mostrado su capacidad predictiva de mortalidad en pacientes en SC4,16. Asimismo el IAM como etiología del SC o la concentración de lactato habían mostrado correlación con mal pronóstico en estos pacientes4,17. Por último, recientemente, Na et al. han demostrado que una elevada PIV en las primeras 48h del diagnóstico del SC se asocia con una mayor mortalidad hospitalaria, como hemos observado en este estudio18.
LimitacionesEl presente estudio tiene las limitaciones inherentes a cualquier estudio retrospectivo. Además, no representa al total de pacientes en SC, dados los criterios de selección empleados. A esto hay que sumar un probable sesgo de selección, ya que se traslada y se trata principalmente a los pacientes más estables y con mejor pronóstico a priori. La aplicabilidad de esta serie, por tanto, ha de ser considerada en el contexto clínico descrito, teniendo en cuenta aspectos como el acceso al TxC y el perfil de los pacientes incluidos. Esto hace que la comparación entre series continúe siendo dificultosa. La ausencia de un control histórico, que podría ayudar a esclarecer las ventajas de este modelo de organización en la era del SCM, es otra limitación.
CONCLUSIONESLa creación de equipos multidisciplinarios para la atención de pacientes en SC, fundamentalmente refractario, y la coordinación en red con los hospitales de un determinado territorio son factibles y consiguen una supervivencia hospitalaria de más de la mitad de los pacientes atendidos. Es nuestro medio, la mayor parte de los pacientes sobreviven por recuperación miocárdica o tras recibir un TxC en código urgente. Estos resultados, junto con otras experiencias publicadas, respaldan la generalización de este modelo de organización interna y territorial en cada área geográfica. Se necesitarán estudios multicéntricos y de mayor volumen para conocer mejor los beneficios de esta estrategia y mejorar los resultados.
FINANCIACIÓNEl presente trabajo ha sido financiado parcialmente por una beca concedida por la Sociedad Española de Cardiología para «Proyectos de investigación SEC-ROVI para promoción de la investigación en insuficiencia cardiaca de la Sección de Insuficiencia Cardiaca 2017».
CONFLICTO DE INTERESESNinguno.
- –
El shock cardiogénico continúa siendo una entidad de elevada mortalidad y con un tratamiento cada vez más complejo debido al creciente uso de dispositivos de soporte circulatorio mecánico en casos refractarios. Experiencias iniciales y la analogía con otras enfermedades «dependientes del tiempo», como el infarto o el ictus, hacen recomendables la creación de equipos especializados en centros de referencia y la coordinación en red con los centros del área para optimizar los resultados.
- –
Se presenta la primera experiencia en nuestro país tras implementar este modelo de organización en nuestra área. Con él, se consigue la supervivencia al alta hospitalaria de más de la mitad de pacientes. En nuestro medio y a diferencia de otros contextos, el trasplante cardiaco urgente es uno de los principales destinos de los supervivientes. Los pacientes que sobreviven a la fase aguda del shock tienen un pronóstico a medio plazo excelente.