Los avances en los tratamientos del cáncer, como los inhibidores del punto de control inmunitario (immune checkpoint inhibitors [ICI]), han mejorado los resultados, pero también se han relacionado con complicaciones cardiovasculares. Se ha propuesto una variedad de mecanismos para el daño cardiovascular, entre los cuales pueden citarse síndromes coronarios agudos, desenmascaramiento de enfermedades cardiovasculares subyacentes ocultas, arritmias, miocarditis y pericarditis como parte de un síndrome inmunitario sistémico como consecuencia del tratamiento con ICI. Además, a medida que aumenta rápidamente la aplicación clínica del tratamiento con ICI, crece la preocupación por las secuelas a largo plazo en los supervivientes.
La resonancia magnética cardiaca (RMC) es útil para establecer el diagnóstico de los pacientes en que se sospecha daño miocárdico. Hasta la fecha, todos los estudios sobre cardiotoxicidad por ICI han explorado la capacidad de la RMC para detectar exclusivamente miocarditis1. El objetivo de este estudio es describir la existencia, el tipo y el grado de daño miocárdico en una cohorte bien definida de pacientes oncológicos tratados con ICI.
En este estudio de cohortes, observacional y transversal, se seleccionó consecutivamente a pacientes programados para tratamiento con ICI entre abril de 2019 y octubre de 2020 en el Hospital Universitario de Salamanca. El protocolo del estudio fue aprobado por el comité de ética del Hospital Universitario de Salamanca y los participantes dieron su consentimiento informado por escrito. Se practicó a los pacientes una RMC de 1,5 T (Philips Healthcare, Países Bajos) que incorporaba una evaluación de la morfología y la función cardiacas, secuencia de recuperación con triple inversión de tau corta ponderada en T2 (T2W-STIR), realce tardío de gadolinio (RTG), recuperación de look-locker modificada en T1 (con un esquema de adquisición 5(3)3 para T1-MOLLI) antes y 15 min después del gadolinio, y mapeo en T2 (secuencia de gradiente multieco en eco de espín) según las recomendaciones vigentes2. El posprocesado del mapeo se realizó con el software Medis 2.1, estableciendo la región de interés en el segmento medioseptal del ventrículo izquierdo en el eje corto. El diagnóstico por RMC de miocarditis aguda se estableció según los criterios Lake Louise3; los criterios principales en este documento son un marcador positivo basado en T2 (imágenes ponderadas en T2 o mapeo en T2) y marcadores positivos de caracterización de tejido basados en T1 (tiempo de relajación en T1 o volumen extracelular o RTG anómalo)3. Puesto que la miocarditis se diagnosticó con base en los hallazgos de la de RMC, se emplearon como controles las imágenes de RMC de 50 individuos sin cardiopatía y de iguales sexo y edad de una muestra de nuestra población local (NCT03429452)4.
Las variables cualitativas se describen como porcentajes y las variables continuas, como mediana [intervalo intercuartílico]. Se utilizó la prueba exacta de Fisher para comparar proporciones entre grupos. Se utilizaron pruebas no paramétricas a nivel ordinal para muestras independientes (prueba de la U de Mann-Whitney). Los análisis se realizaron con SPSS Statistics, versión 22 (IBM, Estados Unidos).
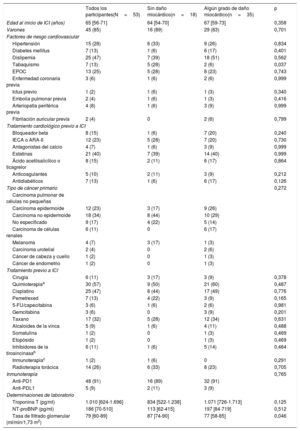
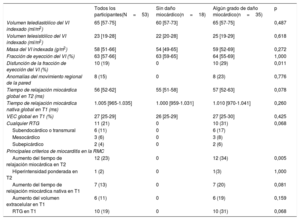
Se incluyó a 53 pacientes consecutivos. La mediana de edad fue de 65 [56-71] años, el 85% de los pacientes eran varones, el 72% presentaba factores de riesgo cardiovascular, el 17% tenía antecedentes de enfermedad cardiovascular y el 60% tomaba medicamentos con efectos cardiovasculares concomitantes. Antes del tratamiento con ICI, al 11% de los pacientes se les realizó cirugía, el 57% recibió quimioterapia y el 26%, radiación torácica (tabla 1). La mediana de tiempo desde el inicio de los ICI fue de 222 [19-1.033] días, con una mediana del número de ciclos recibidos de 13 [6,5-23,5]. La RMC identificó algún grado de daño miocárdico en 35 pacientes (66%) (tabla 2). Se produjo reducción de la fracción de eyección del ventrículo izquierdo (FEVI) en 10 pacientes (19%; 8 con FEVI del 35-55% y 2 con FEVI <35%): 3 por infarto de miocardio, 2 por insuficiencia de válvula aórtica y 5 sin RTG. En total, mostraron RTG 11 pacientes (21%), con localización subendocárdica o transmural en 6 (11%), RTG subepicárdico en 2 (4%) y RTG mesocárdico en 3 (6%). Se observó miocarditis aguda que cumplía los criterios de Lake Louise en 7 pacientes (13%). En los pacientes con miocarditis, en comparación con aquellos que no la presentaban, los valores de mapeo en T2 (65 [63-77] frente a 55 [51-59] ms); p=0,005) fueron considerablemente superiores, sin diferencias entre ambos grupos en el mapeo en T1 nativo (1.086 [1.012-1.125] frente a 998 [959-1.032] ms; p=0,081) o en volumen extracelular (el 34 [29-37] frente al 26% [25-28]; p=0,159). Se identificó RTG en 3 de 7 pacientes (43%) con criterios de miocarditis y en 8 de 46 (17%) sin estos (p=0,075). Además, no hubo diferencias en la existencia de anomalías de la contractilidad regional de la pared (el 14 frente al 15%; p=0,937) entre los pacientes con y sin criterios similares a la miocarditis. Por último, se observó un leve derrame pericárdico en 4 pacientes (7%), todos sin miocarditis. No se detectó ninguna otra complicación.
Características clínicas
| Todos los participantes(N=53) | Sin daño miocárdico(n=18) | Algún grado de daño miocárdico(n=35) | p | |
|---|---|---|---|---|
| Edad al inicio de ICI (años) | 65 [56-71] | 64 [54-70] | 67 [59-73] | 0,358 |
| Varones | 45 (85) | 16 (89) | 29 (83) | 0,701 |
| Factores de riesgo cardiovascular | ||||
| Hipertensión | 15 (28) | 6 (33) | 9 (26) | 0,834 |
| Diabetes mellitus | 7 (13) | 1 (6) | 6 (17) | 0,401 |
| Dislipemia | 25 (47) | 7 (39) | 18 (51) | 0,562 |
| Tabaquismo | 7 (13) | 5 (28) | 2 (6) | 0,037 |
| EPOC | 13 (25) | 5 (28) | 8 (23) | 0,743 |
| Enfermedad coronaria previa | 3 (6) | 1 (6) | 2 (6) | 0,999 |
| Ictus previo | 1 (2) | 1 (6) | 1 (3) | 0,340 |
| Embolia pulmonar previa | 2 (4) | 1 (6) | 1 (3) | 0,416 |
| Arteriopatía periférica previa | 4 (8) | 1 (6) | 3 (9) | 0,999 |
| Fibrilación auricular previa | 2 (4) | 0 | 2 (6) | 0,799 |
| Tratamiento cardiológico previo a ICI | ||||
| Bloqueador beta | 8 (15) | 1 (6) | 7 (20) | 0,240 |
| IECA o ARA-II | 12 (23) | 5 (28) | 7 (20) | 0,730 |
| Antagonistas del calcio | 4 (7) | 1 (6) | 3 (9) | 0,999 |
| Estatinas | 21 (40) | 7 (39) | 14 (40) | 0,999 |
| Ácido acetilsalicílico o ticagrelor | 8 (15) | 2 (11) | 6 (17) | 0,864 |
| Anticoagulantes | 5 (10) | 2 (11) | 3 (9) | 0,212 |
| Antidiabéticos | 7 (13) | 1 (6) | 6 (17) | 0,126 |
| Tipo de cáncer primario | 0,272 | |||
| Carcinoma pulmonar de células no pequeñas | ||||
| Carcinoma epidermoide | 12 (23) | 3 (17) | 9 (26) | |
| Carcinoma no epidermoide | 18 (34) | 8 (44) | 10 (29) | |
| No especificado | 9 (17) | 4 (22) | 5 (14) | |
| Carcinoma de células renales | 6 (11) | 0 | 6 (17) | |
| Melanoma | 4 (7) | 3 (17) | 1 (3) | |
| Carcinoma urotelial | 2 (4) | 0 | 2 (6) | |
| Cáncer de cabeza y cuello | 1 (2) | 0 | 1 (3) | |
| Cáncer de endometrio | 1 (2) | 0 | 1 (3) | |
| Tratamiento previo a ICI | ||||
| Cirugía | 6 (11) | 3 (17) | 3 (9) | 0,378 |
| Quimioterapiaa | 30 (57) | 9 (50) | 21 (60) | 0,487 |
| Cisplatino | 25 (47) | 8 (44) | 17 (49) | 0,776 |
| Pemetrexed | 7 (13) | 4 (22) | 3 (9) | 0,165 |
| 5-FU/capecitabina | 3 (6) | 1 (6) | 2 (6) | 0,981 |
| Gemcitabina | 3 (6) | 0 | 3 (9) | 0,201 |
| Taxano | 17 (32) | 5 (28) | 12 (34) | 0,631 |
| Alcaloides de la vinca | 5 (9) | 1 (6) | 4 (11) | 0,488 |
| Somatulina | 1 (2) | 0 | 1 (3) | 0,469 |
| Etopósido | 1 (2) | 0 | 1 (3) | 0,469 |
| Inhibidores de la tirosincinasab | 6 (11) | 1 (6) | 5 (14) | 0,464 |
| Inmunoterapiac | 1 (2) | 1 (6) | 0 | 0,291 |
| Radioterapia torácica | 14 (26) | 6 (33) | 8 (23) | 0,705 |
| Inmunoterapia | 0,765 | |||
| Anti-PD1 | 48 (91) | 16 (89) | 32 (91) | |
| Anti-PDL1 | 5 (9) | 2 (11) | 3 (9) | |
| Determinaciones de laboratorio | ||||
| Troponina T (pg/ml) | 1.010 [624-1.696] | 834 [522-1.238] | 1.071 [726-1.713] | 0,125 |
| NT-proBNP (pg/ml) | 186 [70-510] | 113 [62-415] | 197 [84-719] | 0,512 |
| Tasa de filtrado glomerular (ml/min/1,73 m2) | 79 [60-89] | 87 [74-90] | 77 [58-85] | 0,046 |
5-FU: 5-fluorouracilo; ARA-II: antagonistas del receptor de la angiotensina II; EPOC: enfermedad pulmonar obstructiva crónica; ICI: inhibidor de puntos de control inmunitario; IECA: inhibidores de la enzima de conversión de la angiotensina; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
Los fármacos quimioterapéuticos fueron, por orden descendente: carboplatino, pemetrexed, etopósido, cisplatino, capecitabina, 5-FU, gemcitabina, somatulina y alcaloides de la vinca.
Características de la RMC
| Todos los participantes(N=53) | Sin daño miocárdico(n=18) | Algún grado de daño miocárdico(n=35) | p | |
|---|---|---|---|---|
| Volumen telediastólico del VI indexado (ml/m2) | 65 [57-75] | 60 [57-73] | 65 [57-75] | 0,487 |
| Volumen telesistólico del VI indexado (ml/m2) | 23 [19-28] | 22 [20-28] | 25 [19-29] | 0,618 |
| Masa del VI indexada (g/m2) | 58 [51-66] | 54 [49-65] | 59 [52-69] | 0,272 |
| Fracción de eyección del VI (%) | 63 [57-66] | 63 [59-65] | 64 [55-69] | 1,000 |
| Disfunción de la fracción de eyección del VI (%) | 10 (19) | 0 | 10 (29) | 0,011 |
| Anomalías del movimiento regional de la pared | 8 (15) | 0 | 8 (23) | 0,776 |
| Tiempo de relajación miocárdica global en T2 (ms) | 56 [52-62] | 55 [51-58] | 57 [52-63] | 0,078 |
| Tiempo de relajación miocárdica nativa global en T1 (ms) | 1.005 [965-1.035] | 1.000 [959-1.031] | 1.010 [970-1.041] | 0,260 |
| VEC global en T1 (%) | 27 [25-29] | 26 [25-29] | 27 [25-30] | 0,425 |
| Cualquier RTG | 11 (21) | 0 | 10 (31) | 0,068 |
| Subendocárdico o transmural | 6 (11) | 0 | 6 (17) | |
| Mesocárdico | 3 (6) | 0 | 3 (8) | |
| Subepicárdico | 2 (4) | 0 | 2 (6) | |
| Principales criterios de miocarditis en la RMC | ||||
| Aumento del tiempo de relajación miocárdica en T2 | 12 (23) | 0 | 12 (34) | 0,005 |
| Hiperintensidad ponderada en T2 | 1 (2) | 0 | 1(3) | 1,000 |
| Aumento del tiempo de relajación miocárdica nativa en T1 | 7 (13) | 0 | 7 (20) | 0,081 |
| Aumento del volumen extracelular en T1 | 6 (11) | 0 | 6 (19) | 0,159 |
| RTG en T1 | 10 (19) | 0 | 10 (31) | 0,068 |
RMC: resonancia magnética cardiaca; RTG: realce tardío de gadolinio; VEC: volumen extracelular; VI: ventrículo izquierdo.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
El daño miocárdico es frecuente en los pacientes tratados con ICI y no se debe exclusivamente a la aparición de miocarditis activa. La RMC a menudo puede revelar una arteriopatía coronaria oculta, una afección similar a la miocarditis u otro daño miocárdico por valvulopatía (como en nuestra cohorte)5. En este estudio unicéntrico, se observó daño miocárdico en relación con una afección similar a la miocarditis en el 13% de los estudios de RMC y el 11% adicional de pacientes con hallazgos de RMC compatibles con etiología isquémica. La manifestación de una valvulopatía desconocida como la insuficiencia aórtica podría deberse a la radioterapia previa6 o podría ser un hallazgo casual preexistente al inicio de los ICI. Dado que la RMC es la modalidad no invasiva más adecuada para identificar la existencia, el tipo y el grado de daño miocárdico, debe emplearse para el seguimiento de los pacientes tratados con ICI para detectar enfermedades que se presentan antes de la aparición de anomalías de la contractilidad regional de la pared o disfunción del VI. Un diseño longitudinal, en lugar del diseño transversal actual, sería preferible en estudios futuros, en los que la información de la RMC antes de iniciar la inmunoterapia establecerá mejor las secuencias del daño cardiaco.
FINANCIACIÓNEste estudio fue avalado por el Centro de Investigación Biomédica en Red Enfermedades Cardiovasculares (CIBERCV), por un proyecto de excelencia (PIE14/00066) y por un proyecto de investigación (PI17/00145); todos los recursos nacionales, públicos y competitivos del Instituto de Salud Carlos III (Ministerio de Ciencia e Innovación, España) son mantenidos por el Fondo Europeo de Desarrollo Regional de la UE.
CONTRIBUCIÓN DE LOS AUTORESB. Barrio-Collado, A. Martin-Garcia, P.L. Sánchez y Juan Jesús Cruz concibieron y diseñaron el estudio; R. Eiros y A. Martin-García contribuyeron a la búsqueda de bibliografía; B. Barrio-Collado, A. Martin-Garcia, R. Eiros y C. Sanchez-Pablo contribuyeron con la evaluación clínica de los participantes; B. Barrio-Collado y R. Eiros llevaron a cabo la recogida de datos clínicos; R. Eiros y P.L. Sanchez contribuyeron al análisis e interpretación de los datos, y R. Eiros y P.L. Sanchez contribuyeron a la redacción del artículo.
CONFLICTO DE INTERESESLos autores no tienen conflictos de intereses relacionados con este artículo.