En los últimos años, las intervenciones coronarias percutáneas asistidas por robótica (ICPR) se han utilizado como una alternativa eficaz, segura y viable a la ICP manual1. Los resultados iniciales han sido favorables1, y en la última década, aunque la complejidad de las intervenciones robóticas ha ido en aumento2, estos buenos resultados se han mantenido3, con la ventaja adicional de que se minimiza la exposición a la radiación y disminuyen los problemas ortopédicos derivados del uso de delantales plomados4,5.
Dado que esta tecnología aún está en proceso de implementación en los laboratorios de intervencionismo, la evidencia disponible respecto a la ICP-R en la práctica clínica diaria es escasa. Se presentan los datos de un registro retrospectivo de los primeros 58 casos consecutivos de ICP-R (64 estenosis coronarias) realizadas en un centro terciario entre junio de 2021 y enero de 2022. Todos los pacientes tenían enfermedad coronaria (EC) significativa con indicación de revascularización por síntomas, isquemia inducible o diagnóstico previo de EC grave en un territorio de alto riesgo (bien por tomografía computarizada coronaria o en una coronariografía previa). Todas las intervenciones se llevaron a cabo con el Robotic CorPath 200 System (Corindus Vascular Robotics, Estados Unidos), en el que un casete estéril acoplado a la mesa de intervencionismo permite operar a distancia el catéter guía, la guía de angioplastia y los dispositivos desde la consola de mandos. Todos los pacientes firmaron los consentimientos informados pertinentes tanto para las pruebas como para la publicación, y el trabajo fue aprobado por el comité de ética de investigación de nuestro centro.
Todas las intervenciones se realizaron con sedación consciente. Se hizo seguimiento de los pacientes tras el procedimiento, y se registraron los eventos de muerte, infarto de miocardio (IM), angina, hemorragia, ictus, descompensación de la insuficiencia cardiaca o deterioro de la función renal.
Los pacientes tenían una mediana de edad de 64 [intervalo intercuartílico, 54-77] años, y 43 (74,1%) eran varones, con una elevada prevalencia de factores de riesgo cardiovascular: el 67,2% tenía hipertensión; el 29,3%, diabetes mellitus, y el 69%, dislipemia; una mediana de índice de masa corporal de 27,81 [24,83-31,49]; 43 pacientes (74,1%) tenían antecedentes de EC, con una mediana de la fracción de eyección del 55% [45-60%].
Un total de 20 pacientes (34,5%) estaban asintomáticos con isquemia inducida en una prueba de imagen de estrés previa. En 38 casos (65,5%) se trataba de segundos tiempos programados a lesiones no culpables en pacientes que ya habían sufrido un IM. A excepción de 3 casos, todas las intervenciones se llevaron a cabo por abordaje radial (94,8%), y se trataron un total de 64 lesiones significativas situadas en la arteria descendente anterior izquierda (31,2%), la arteria circunfleja (23,4%), la arteria coronaria derecha (31,2%) y ramas coronarias secundarias (14,2%). Al medir simultáneamente las dosis de radiación (μGy/s) en la posición habitual del primer operador y en la consola de mandos, se documentó una reducción de la exposición a la radiación de un 98,2%.
La revascularización asistida exclusivamente por robótica tuvo éxito en el 95,3% de las lesiones. Sin embargo, en 6 pacientes fue necesaria la conversión a una intervención manual. En 1 paciente no se pudo cruzar la lesión debido a calcificación muy extensa que requirió aterectomía rotacional; en otro paciente, la lesión era una oclusión crónica con fracaso de la intervención manual, y en un tercer paciente no se pudo avanzar la guía debido a la extrema tortuosidad del vaso. Tras el implante del stent, fue necesaria la conversión a manual en 1 paciente que se complicó con una perforación coronaria que se trató con microesferas. Dos pacientes presentaron trombosis de la punta del catéter y embolización con IM intraprocedimiento, que se trató con tirofibán e inflado de balón.
La mediana de tiempo desde el procedimiento al alta fue de 5,5 [4,5-8] h, sin ninguna complicación inmediata. Tras un mínimo de 30 días de seguimiento, no hubo ningún evento mayor relacionado con la ICP-R. Un paciente sufrió una trombosis de la arteria axilar 5 días después de la intervención, presumiblemente relacionada con la manipulación manual del catéter, y otro paciente sufrió un IM en otro territorio coronario.
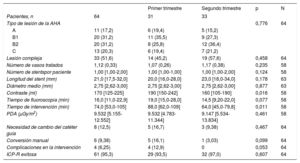
Al evaluar los principales datos medidos durante los procedimientos, teniendo en consideración la curva de aprendizaje inicial, se pudo constatar (tabla 1) que incluso con una tendencia temporal a tratar lesiones más complejas (figura 1), en la segunda mitad de nuestra experiencia con la ICP-R (meses 5-8 de experiencia), el uso de contraste y el tiempo de intervención se redujeron significativamente, con una disminución del tiempo de fluoroscopia y de la radiación total gracias a un mejor conocimiento del sistema, con un alto porcentaje de éxitos, menor necesidad de conversiones manuales y ausencia de complicaciones intraprocedimiento.
Características de las intervenciónes asistidas por robótica en la cohorte total y divididas en la primera y la segunda mitad de experiencia
| Primer trimestre | Segundo trimestre | p | N | ||
|---|---|---|---|---|---|
| Pacientes, n | 64 | 31 | 33 | ||
| Tipo de lesión de la AHA | 0,776 | 64 | |||
| A | 11 (17,2) | 6 (19,4) | 5 (15,2) | ||
| B1 | 20 (31,2) | 11 (35,5) | 9 (27,3) | ||
| B2 | 20 (31,2) | 8 (25,8) | 12 (36,4) | ||
| C | 13 (20,3) | 6 (19,4) | 7 (21,2) | ||
| Lesión compleja | 33 (51,6) | 14 (45,2) | 19 (57,6) | 0,458 | 64 |
| Número de vasos tratados | 1,12 (0,33) | 1,07 (0,26) | 1,17 (0,38) | 0,235 | 58 |
| Número de stentspor paciente | 1,00 [1,00-2,00] | 1,00 [1,00-1,00] | 1,00 [1,00-2,00] | 0,124 | 58 |
| Longitud del stent (mm) | 21,0 [17,5-32,0] | 20,0 [16,0-28,0] | 23,0 [18,0-34,0] | 0,178 | 63 |
| Diámetro medio (mm) | 2,75 [2,62-3,00] | 2,75 [2,62-3,00] | 2,75 [2,62-3,00] | 0,877 | 63 |
| Contraste (ml) | 170 [125-225] | 190 [150-242] | 160 [105-190] | 0,016 | 58 |
| Tiempo de fluoroscopia (min) | 16,0 [11,0-22,9] | 19,0 [15,0-28,0] | 14,5 [9,20-22,0] | 0,077 | 58 |
| Tiempo de intervención (min) | 74,0 [53,0-105] | 88,0 [62,0-109] | 64,0 [45,0-79,8] | 0,011 | 58 |
| PDA (μGy/m2) | 9.532 [5.155-12.552] | 9.532 [4.783-11.344] | 9.147 [5.534-13.834] | 0,461 | 58 |
| Necesidad de cambio del catéter guía | 8 (12,5) | 5 (16,7) | 3 (9,38) | 0,467 | 64 |
| Conversión manual | 6 (9,38) | 5 (16,1) | 1 (3,03) | 0,099 | 64 |
| Complicaciones en la intervención | 4 (6,25) | 4 (12,9) | 0 | 0,053 | 64 |
| ICP-R exitosa | 61 (95,3) | 29 (93,5) | 32 (97,0) | 0,607 | 64 |
AHA: American Heart Association; ICP-R: intervención coronaria percutánea asistida por robótica; PDA: producto de dosis por área.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
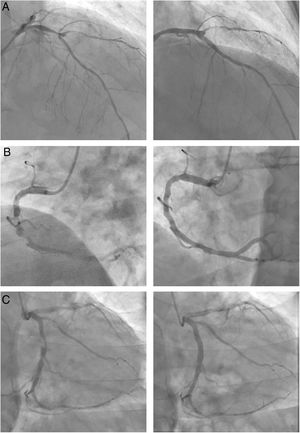
Las imágenes de la derecha muestran los resultados finales de las 3 revascularizaciones. A: lesión bifurcada en la parte media de la arteria descendente anterior, que afecta al origen de la diagonal, con un aneurisma entre ambas ramas. B: suboclusión crónica en el segmento medio de la arteria coronaria derecha, intensamente calcificada, excéntrica y difusa. C: lesión tubular muy excéntrica en la parte proximal de la arteria circunfleja.
Como novatos en el uso de esta técnica, identificamos los siguientes puntos clave que nos ayudaron en nuestra práctica diaria con esta modalidad robótica:
- •
El apoyo durante la intervención es fundamental. En nuestra cohorte, fue necesario un cambio del catéter guía en 8 pacientes (12,5%), 4 de ellos en los primeros 30 días de experiencia. En caso de que se precise apoyo adicional, puede lograrse con un extensor de catéter guía (Guideliner, Vascular Solutions, Estados Unidos), que puede manejarse con precisión como «dispositivo» mediante la consola.
- •
En la preparación para el paso de la guía, enhebrar en ese mismo momento el balón o el stent que se vaya a emplear puede reducir el tiempo consumido en el intercambio de material; esto tiene especial importancia, sobre todo al inicio, ya que es una competencia nueva para el equipo de enfermería.
- •
En caso de desplazamiento del catéter guía de los ostium coronarios durante la ICP, mantener el balón hinchado y «traccionar el dispositivo» tiene el mismo efecto que si en ese momento se avanza el catéter guía durante la ICP manual y permite resolver la mayor parte de los sondajes subselectivos.
- •
Tras el implante del stent, empujar hacia delante el dispositivo (stent o balón) para asegurar su liberación completa antes de retirarlo permite evitar la intubación profunda del catéter, potencialmente peligrosa.
- •
• Emplear dosis altas de heparina. Las 2 trombosis de la punta del catéter acontecieron en el primer trimestre de experiencia, con dosis de heparina ajustadas según el peso (100 UI/kg). Desde que administramos sistemáticamente 10.000 UI, no se ha vuelto a documentar ningún trombo intracoronario y tampoco ha ocurrido ninguna complicación hemorrágica en el seguimiento.
En conclusión, la evidencia actual indica que la ICP-R es segura y eficaz1,2 y abre nuevos horizontes en el campo de la revascularización coronaria. Hay evidencia que demuestra la posibilidad de realizar ICP complejas (incluidas lesiones C de la AHA, oclusiones crónicas y enfermedad del tronco coronario izquierdo), manteniendo unos muy buenos resultados clínicos y de la intervención3,5, y actualmente se están recabando datos sobre la aplicación de esta modalidad robótica a las ICP en la práctica clínica diaria. Nuestra experiencia inicial es favorable, aunque limitada por sesgos de selección, ya que se trata de una cohorte unicéntrica y no se dispuso de una cohorte de control para comparar los resultados. Los modelos disponibles hasta ahora tienen ciertas limitaciones, ya que solo permiten la manipulación de 1 guía o dispositivo coronario en cada momento, son incompatibles con las técnicas de imagen intracoronarias y tienen unos costes elevados. Estas y otras limitaciones técnicas podrán abordarse mediante la iteración y la innovación6. Si bien la experiencia inicial requiere una selección adecuada de los casos, con la experiencia acumulada se reducen los tiempos de intervención y se adquiere una mayor pericia que permite abordar niveles de complejidad cada vez mayores (figura 1).
FINANCIACIÓNM. Tamargo cuenta con el apoyo de un contrato Río Hortega, CM20/00054 del Instituto de Salud Carlos III, España.
CONTRIBUCIÓN DE LOS AUTORESTodos los autores cumplieron todas y cada una de las características definidas por el Comité Internacional de Editores de Revistas Médicas para los criterios de autoría de artículos científicos.
CONFLICTO DE INTERESESNada que declarar.