La duración adecuada de la doble terapia antiagregante (DAPT) después de un infarto de miocardio con elevación del segmento ST (IAMCEST) está todavía en discusión.
MétodosAnalizamos el efecto de la DAPT extendida a 5 años sobre la mortalidad global, mortalidad cardiovascular y reingreso o mortalidad cardiovascular, en una cohorte multicéntrica de pacientes con IAMCEST supervivientes al año.
ResultadosSe incluyeron 3.107 pacientes hospitalizados por IAMCEST de los que el 93% recibió DAPT al alta. A los 5 años se mantenía en 275 pacientes con un perfil alto de gravedad. La mortalidad cardiovascular de los pacientes con antiagregación simple (SAPT) frente a DAPT a 5 años fue de 1,4 y 3,6% (p <0,01), respectivamente. La mortalidad no-cardiovascular fue del 3,3 frente a 5,8% (p=0,049) a 5 años, respectivamente. La incidencia del evento combinado a un año fue del 14,6% en SAPT frente a 11,8% en DAPT (p=0,496), y del 11,4 frente a 46,5% (p <0,001) a 5 años, respectivamente. El mantenimiento de la DAPT hasta los 5 años se asoció de forma independiente a mayor mortalidad: por cualquier causa (HR=2,16; IC95%, 1,40-3,33), cardiovascular (HR=2,83; IC95%, 1,37-5,84) y rehospitalización cardiovascular y mortalidad (HR=5,20; IC95%, 3,96-6,82). Un análisis emparejado por puntuación de propensión, y uno con ponderación de probabilidad inversa, confirman estos resultados.
ConclusionesNuestros resultados sugieren la hipótesis de que, en supervivientes a un año de IAMCEST, alargar la DAPT hasta 5 años en pacientes de alto riesgo no mejora su pronóstico a largo plazo.
Palabras clave
La inhibición plaquetaria es fundamental en la prevención secundaria de eventos aterotrombóticos1. El número de fármacos y la duración del tratamiento que ofrecen suficiente protección contra los eventos trombóticos y generan un reducido número de complicaciones (principalmente hemorragia) siguen siendo objeto de estudio. El síndrome coronario agudo suele ser el resultado de la rotura de la placa y la obstrucción coronaria aguda de un vaso coronario epicárdico a causa de la exposición de material trombogénico dentro de la placa, lo que genera la activación y la adhesión de las plaquetas y, finalmente, la formación de trombos2. La inhibición plaquetaria es más importante todavía en los casos de colocación de un stent en la arteria coronaria, que restablece el flujo arterial cuando se dilata la arteria y se implanta un dispositivo metálico, generalmente con un polímero farmacoactivo, en la pared del vaso coronario. Las intervenciones coronarias percutáneas (ICP) generalmente inducen la denudación de la íntima, lo que expone el material trombogénico y desencadena una cascada inflamatoria que finalmente también promueve la trombosis3.
Los primeros estudios realizados con la primera generación de stents farmacoactivos mostraron beneficios de prevención isquémica del tratamiento antiagregante plaquetario doble (TAPD) que se ampliaba más de 12 meses, principalmente a causa de eventos de trombosis del stent tardíos y muy tardíos relacionados con la tecnología temprana del stent farmacoactivo. Después de más de 37 ensayos clínicos con varios inhibidores de los receptores plaquetarios P2Y12, las recomendaciones actuales de tratamiento con antiagregantes plaquetarios para pacientes que sobreviven al infarto agudo de miocardio con elevación del segmento ST (IAMCEST) incluyen 12 meses de ácido acetilsalicílico combinado con un inhibidor del receptor P2Y125.
La reciente guía de práctica clínica de la Sociedad Europea de Cardiología (ESC) sobre el infarto de miocardio sin elevación del segmento ST (2020) recomienda individualizar la estrategia del tratamiento antiagregante plaquetario y su duración para equilibrar los riesgos isquémico y hemorrágico durante el seguimiento6. En cambio, la guía de práctica clínica del IAMCEST se actualizó por última vez en 20175. Desde entonces, varios estudios y metanálisis han observado un pronóstico cardiovascular similar con una menor duración del TAPD después de la ICP7 y con un beneficio neto en pacientes con mayor riesgo de hemorragia8. La administración del TAPD durante periodos más cortos seguida de un tratamiento con un solo inhibidor del P2Y12 se demostró no inferior a los tratamientos habituales9,10. Sin embargo, los estudios citados fusionaron a pacientes con síndromes coronarios crónicos y agudos, con diferentes pronósticos respecto a la presentación y las características clínicas asociadas11,12. A pesar de los beneficios potenciales de una menor duración del TAPD, el TAPD ampliado también ha prometido beneficios potenciales en lo tocante al pronóstico cardiovascular y la prevención de eventos trombóticos recurrentes4,13. Las consecuencias del TAPD ampliado aún se están debatiendo porque el equilibrio entre el riesgo de hemorragia y el beneficio de la prevención de eventos cardiovasculares varía con la edad y otros factores14. Algunos estudios indican ausencia de beneficio15, mientras que otros comunican algunas mejoras en el pronóstico a largo plazo4,16. Faltan evaluaciones aceptables y contemporáneas sobre la duración óptima en el IAMCEST.
El objetivo del presente estudio es analizar el efecto de la intensidad del tratamiento antiagregante plaquetario (doble frente a simple) en la incidencia a 5 años de eventos graves en pacientes con IAMCEST supervivientes 1 año de la cohorte ATención HOspitalaria del Síndrome coronario (ATHOS).
MÉTODOSSe seleccionó a los participantes con IAMCEST de la cohorte ATHOS de pacientes consecutivos con síndrome coronario agudo. El objetivo inicial del estudio ATHOS fue establecer la variabilidad interhospitalaria en el tratamiento del síndrome coronario agudo17. Se realizó un seguimiento basado en esta cohorte retrospectiva.
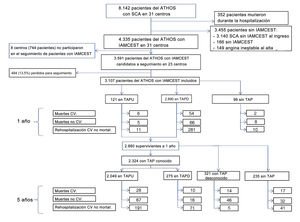
De los 31 hospitales que aportaron datos sobre 250-300 pacientes con síndrome coronario agudo entre 2014 y 2016, 23 participaron en el seguimiento a largo plazo de sus 3.591 pacientes dados de alta vivos con el diagnóstico de IAMCEST. Estaban disponibles los datos sobre el tratamiento antiagregante plaquetario del 86,5% de los 3.107 supervivientes al alta y posteriormente se realizó un seguimiento a 5 años de 2.880 supervivientes al año (figura 1). El IAMCEST se definió de acuerdo con la guía de práctica clínica vigente5. La fibrinolisis solo se tuvo en cuenta si los retrasos esperados en el tratamiento primario con ICP no eran aceptables y no había contraindicaciones. La ICP después de la fibrinolisis se realizó en fase aguda cuando no se podía intervenir en los tiempos óptimos y la ICP fue programada durante el ingreso.
Diagrama de los pacientes seleccionados de la cohorte ATHOS para el seguimiento a 1 y a 5 años y los eventos observados. ATHOS: Atención hospitalaria del síndrome coronario; CV: cardiovascular; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IM: infarto de miocardio; SCA: síndrome coronario agudo; TAP: tratamiento antiagregante plaquetario; TAPD: tratamiento antiagregante plaquetario doble; TAPU: tratamiento antiagregante plaquetario único.
Se registraron variables sociodemográficas de referencia y variables de riesgo cardiovascular, tratamiento (como el tratamiento antiagregante plaquetario), gravedad (muerte hospitalaria, reinfarto, edema pulmonar agudo y shock cardiogénico) y hemorragia grave durante el ingreso. Se incluyeron los accidentes cerebrovasculares tanto isquémicos como hemorrágicos.
La situación vital, las rehospitalizaciones por causas cardiovasculares y de otro tipo, y el tratamiento antiagregante plaquetario se obtuvieron de visitas personales, historias clínicas electrónicas o entrevistas telefónicas con pacientes dados de alta al año y nuevamente a los 5 años con los supervivientes al año.
Se excluyó del análisis a 321 pacientes de quienes no se pudo averiguar el tratamiento antiagregante plaquetario en el seguimiento de entre 1 y 5 años y a 235 pacientes que no pudieron recibir tratamiento antiagregante plaquetario por contraindicaciones u otros motivos. En el caso de los pacientes que recibieron TAPD en el momento de un evento de interés o al final del seguimiento de 5 años, se supuso que nunca se suspendió el TAPD después del primer año.
Criterios de valoraciónLos principales criterios de valoración, evaluados a los 5 años de seguimiento, fueron la mortalidad cardiovascular, la mortalidad por causas no cardiovasculares y la rehospitalización o la mortalidad cardiovascular.
Métodos estadísticosLas variables cualitativas se presentan como número y porcentaje y las variables continuas, como media ± desviación estándar o mediana [intervalo intercuartílico], dependiendo de su distribución. En las comparaciones de variables cualitativas entre el TAPD y el tratamiento antiagregante plaquetario único (TAPU), se utilizó la prueba de la χ2 o la prueba exacta de Fisher. En el caso de las variables continuas, la prueba de la t de Student o la prueba de la U de Mann-Whitney. El análisis de supervivencia se realizó mediante el método de Kaplan-Meier y la comparación entre grupos, con la prueba de rangos logarítmicos.
La hazard ratio (HR) de los criterios de valoración definidos en ATHOS para el TAPD se estimó mediante modelos de riesgos proporcionales de Cox ajustados por factores de confusión. Las características basales se consideraron potenciales factores de confusión si el análisis univariante mostraba asociación en p <0,10 con el TAPD y la variable de interés en el seguimiento (mortalidad general y cardiovascular y rehospitalización o mortalidad cardiovascular). Los modelos también se ajustaron por variables clínicamente relevantes, como la edad y el sexo. Los requisitos de proporcionalidad se analizaron mediante visualización gráfica y el método de Grambsch y Therneau18.
Además, se realizaron análisis de emparejamiento por puntuación de propensión y análisis ponderados por propensión inversa. Las puntuaciones de propensión se calcularon como la probabilidad estimada de recibir TAPD de una regresión logística que incluye edad, sexo, tabaquismo, hipertensión, diabetes, infarto de miocardio previo, accidente cerebrovascular previo, arteriopatía periférica previa, enfermedad pulmonar obstructiva crónica, nefropatía, edema pulmonar agudo o shock cardiogénico o clase de Killip III-IV durante el ingreso. Esta última se eligió sobre la fracción de eyección del ventrículo izquierdo (FEVI) debido a la buena correlación entre las 2 variables y el mayor número de valores ausentes en la FEVI (23,4%). En caso de buena correlación, se optó por la variable con menos datos ausentes (p. ej., entre diabetes y glucemia, la diabetes).
Respecto al emparejamiento por puntuación de propensión, cada paciente con TAPU se emparejó con 3 pacientes que recibieron TAPD mediante un algoritmo de igualación más próxima «avaro» (greedy) sin reemplazo, con un límite de 0,2 en la desviación estándar del logit de la puntuación de propensión. Se aplicó un modelo de Cox de riesgo proporcional con estimación robusta de la varianza y se ajustó además por la edad y el sexo en la muestra emparejada en una primera aproximación y en toda la muestra ponderando para la inversa de la puntuación de propensión en la segunda.
Aprobación éticaEste proyecto fue aprobado por el comité de ética de la investigación del IMIM-Hospital del Mar (referencia 2014/5491/1) y declarado NO-EPA por la Agencia Española del Medicamento y Productos Sanitarios (# 2258/RG 4274). Las intervenciones y la recopilación de datos cumplieron la Declaración de Helsinki y las leyes españolas de protección de datos. Los pacientes no fueron informados de la presente investigación porque los datos se obtuvieron anonimizados y en retrospectiva de las historias clínicas por sus propios médicos. Se seleccionó a algunos pacientes (menos del 20%) de manera prospectiva para obtener muestras de sangre: todos ellos firmaron el consentimiento informado.
Participación pública y del pacienteEste proyecto se inició para poner de relieve las diferencias actuales en el tratamiento del síndrome coronario agudo en España. Ninguno de los pacientes participó en la elaboración de la pregunta de investigación, pero los resultados del estudio se presentarán a la asociación de pacientes GICOR para difundir las conclusiones de este estudio.
Declaración de transparenciaEste artículo es una descripción franca, precisa y transparente del estudio que se publica. No se han omitido aspectos importantes del estudio. Se han explicado todas las diferencias respecto al estudio previsto inicialmente.
RESULTADOSFinalizaron el seguimiento a 1 año 3.107 (86,5%) de los 3.591 pacientes con IAMCEST dados de alta vivos de los 23 hospitales que participaron en el seguimiento a largo plazo de la cohorte ATHOS, y se realizó un seguimiento a 5 años de 2.880 supervivientes al año (figura 1).
Las características basales de los supervivientes al año que luego continuaron con TAPD (275) o TAPU (2.049) difirieron en los antecedentes de enfermedades e intervenciones cardiovasculares, que fueron más frecuentes en los pacientes con TAPD. La velocidad de filtrado glomerular y la frecuencia de diabetes mellitus en el momento del ingreso también fueron considerablemente más altas en los pacientes con TAPD (tabla 1).
Características basales (ingreso) de los pacientes con características de infarto agudo de miocardio con elevación del segmento ST en TAPU o TAPD entre 1 y 5 años después del alta
| TAPU | TAPD | p | |
|---|---|---|---|
| n=2.049 | n=275 | ||
| Tipo de SCA | 0,99 | ||
| SCA con elevación del segmento ST | 98,2 | 98,2 | |
| No clasificable | 1,76 | 1,82 | |
| Edad (años) | 62,1±13,2 | 62,9±12,7 | 0,309 |
| Mujeres | 20,2 | 17,5 | 0,321 |
| Tabaquismo | 69,0 | 72,4 | 0,287 |
| Hipertensión | 51,1 | 54,5 | 0,313 |
| Diabetes mellitus | 23,2 | 30,9 | 0,007 |
| Infarto de miocardio previo | 9,81 | 24,7 | <0,001 |
| Angina previa | 8,64 | 26,2 | <0,001 |
| Accidente cerebrovascular previo | 3,12 | 6,55 | 0,007 |
| Arteriopatía periférica | 4,15 | 6,18 | 0,165 |
| ICP previa | 8,20 | 26,2 | <0,001 |
| Cirugía de revascularización coronaria previa | 1,07 | 6,55 | <0,001 |
| Enfermedad respiratoria crónica | 7,96 | 9,45 | 0,461 |
| Enfermedad renal crónica | 4,49 | 5,45 | 0,573 |
| Tasa de filtrado glomerular (ml/min/1,73 m2) | 88,1±38,8 | 84,1±26,3 | 0,030 |
| Glucemia (mg/dl) | 149±64,6 | 160±82,2 | 0,040 |
| EPA/SC o Killip III-IV | 6,83 | 9,82 | 0,094 |
| Fracción de eyección del ventrículo izquierdo <30% | 20,1 | 22,7 | 0,416 |
| Hemorragia grave | 1,12 | 1,45 | 0,756 |
| Accidente cerebrovascular durante el ingreso | 0,44 | 0,73 | 0,648 |
EPA: edema pulmonar agudo; ICP: intervención coronaria percutánea; IM: infarto de miocardio; SC: shock cardiogénico; SCA: síndrome coronario agudo; TAPD: tratamiento antiagregante plaquetario doble; TAPU: tratamiento antiagregante plaquetario único.
Los valores expresan porcentajes o media ± desviación estándar.
Además de las diferencias en los tratamientos antiagregantes plaquetarios esperadas en estos pacientes, se observó un ligero pero estadísticamente significativo aumento de la prescripción de estatinas, diuréticos, inhibidores de la enzima de conversión de la angiotensina o antagonistas del receptor de la angiotensina II y bloqueadores beta en los pacientes que continuaban con el TAPD después de 1 año de seguimiento (tabla 2).
Características de los pacientes con infarto agudo de miocardio con elevación del segmento ST en TAPU o TAPD a los 5 años después del alta
| TAPU | TAPD | p | |
|---|---|---|---|
| n=2.049 | n=275 | ||
| Fibrilación auricular | 3,65 | 3,30 | 0,903 |
| Tratamientos | |||
| Desfibrilador automático implantable | 0,34 | 0,73 | 0,289 |
| Marcapasos | 0,39 | 0,00 | 0,607 |
| Estatinas | 91,3 | 96,7 | 0,003 |
| IECA o ARA-II | 70,5 | 80,6 | 0,001 |
| Diuréticos | 23,6 | 28,3 | 0,100 |
| Bloqueadores beta | 77,3 | 84,7 | 0,007 |
| Ácido acetilsalicílico | 95,7 | 100 | 0,001 |
| Clopidogrel | 3,90 | 67,6 | <0,001 |
| Ticlopidina | 0,00 | 0,73 | 0,014 |
| Prasugrel | 0,15 | 14,2 | <0,001 |
| Ticagrelor | 0,29 | 18,5 | <0,001 |
| Cualquier inhibidor del P2Y12 | 4,32 | 100 | <0,001 |
ARA-II: antagonistas del receptor de la angiotensina II; IECA: inhibidores de la enzima de conversión de la angiotensina; TAPD: tratamiento antiagregante plaquetario doble; TAPU: tratamiento antiagregante plaquetario único.
Los valores expresan porcentajes.
La figura 1 detalla los tipos de eventos que ocurrieron en pacientes con TAPU y TAPD a los 5 años.
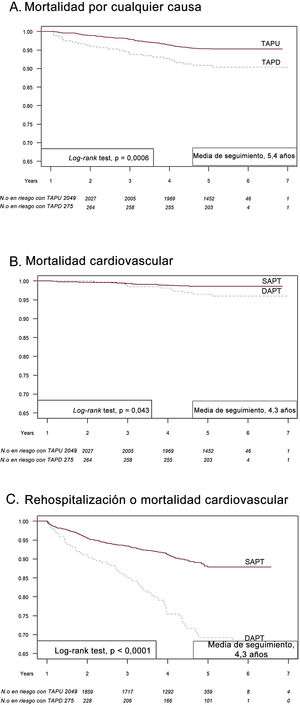
La figura 2 presenta la supervivencia sin eventos de Kaplan-Meier a los 5 años para la mortalidad por cualquier causa (figura 2A), mortalidad cardiovascular (figura 2B) y rehospitalización o mortalidad cardiovascular (figura 2C) de los pacientes con TAPU y TAPD ampliada. Los pacientes con TAPD tuvieron un pronóstico a los 5 años considerablemente peor que los pacientes con TAPU en todos los criterios de valoración.
Ilustración central. Curva de Kaplan-Meier de supervivencia sin eventos a 1 y 5 años. Mortalidad por cualquier causa (A), mortalidad cardiovascular (B) y rehospitalización o mortalidad cardiovascular (C) de los pacientes con TAPU y TAPD ampliado. TAPD: tratamiento antiagregante plaquetario doble; TAPU: tratamiento antiagregante plaquetario único.
Luego se ajustó el efecto del TAPD por posibles factores de confusión: variables asociadas significativamente con eventos a 5 años (tablas 1-3 del material adicional) y con el tipo de tratamiento antiagregante plaquetario (tabla 1 y tabla 2). Ampliar el TAPD más allá de 1 año se asoció con mayor mortalidad general, mortalidad cardiovascular y el criterio de valoración combinado de rehospitalización o mortalidad cardiovascular, incluso tras ajustar por los factores de confusión (tabla 3). El emparejamiento 1:3 por puntuación de propensión y los modelos de riesgos proporcionales ponderados por probabilidad inversa (tablas 4 y 5 del material adicional) confirmaron este pronóstico.
Hazard ratio de mortalidad general, mortalidad cardiovascular y rehospitalización o mortalidad cardiovascular del tratamiento antiagregante plaquetario doble comparado con el tratamiento antiagregante plaquetario único a los 5 años después del ingreso por infarto agudo de miocardio con elevación del segmento ST
| No ajustado | Modelo 1 | Modelo 2 | Modelo 3 | |
|---|---|---|---|---|
| HR (IC95%) | HR (IC95%) | HR (IC95%) | HR (IC95%) | |
| Seguimiento de 1 a 5 años | ||||
| Mortalidad general | 2,10 (1,36-3,24) | 2,16 (1,40-3,33) | 1,79 (1,14-2,87) | 1,64 (1,04-2,58) |
| Mortalidad CV | 2,74 (1,33-5,65) | 2,83 (1,37-5,84) | 2,32 (1,11-4,87) | 2,12 (1,00-4,49) |
| Mortalidad CV o rehospitalización* | 2,82 (2,15-3,69) | 2,78 (2,12-3,64) | 2,5 (1,9-3,29) | 2,46 (1,87-3,24) |
CV: cardiovascular; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
Modelo 1: edad+sexo femenino.
Modelo 2: modelo 1+tabaquismo+hipertensión+diabetes+infarto de miocardio previo+accidente cerebrovascular previo+arteriopatía periférica previa+enfermedad pulmonar obstructiva crónica+nefropatía.
Modelo 3: modelo 2+edema pulmonar agudo o shock cardiogénico o Killip III-IV al ingreso.
En esta cohorte retrospectiva de la vida real de pacientes con IAMCEST supervivientes al año que continuaron con TAPD, la mortalidad general, la mortalidad cardiovascular y la rehospitalización cardiovascular aumentaron a los 5 años en comparación con los pacientes en TAPU.
El TAPD tras un IAMCEST está recomendado en la guía de práctica clínica vigente5 hasta los 12 meses, sobre todo con la esperanza de reducir la trombosis del stent y la progresión a futuros eventos isquémicos no relacionados con la lesión coronaria inicial. Los estudios TRITON-TIMI 3819 y PLATO20 aleatorizaron a pacientes entre 2004 y 2008, con el 26 y el 38% de IAMCEST respectivamente. Más recientemente, un subestudio del ensayo PEGASUS-TIMI 5416, en el cual aproximadamente el 55% de los pacientes fueron ingresados por IAMCEST, mostró que reiniciar el TAPD más de 12 meses después del IAMCEST no confería ningún beneficio respecto al placebo en la muerte cardiovascular a 3 años, accidente cerebrovascular o infarto de miocardio; sin embargo, aumentaron las hemorragias graves. De manera semejante, en la cohorte ATHOS, los pacientes con TAPD presentaron mejor supervivencia sin eventos cardiovasculares ni eventos por cualquier causa, aunque ambos se limitaron al primer año. A partir de entonces y hasta los 5 años, mantener el TAPD se asoció con un peor pronóstico en todos los criterios de valoración.
El TAPD a largo plazo después del IAMCEST ha recibido escasa atención en ensayos clínicos aleatorizados. El ensayo DAPT4 incluyó a 9.961 pacientes tratados con stents farmacoactivos de primera y segunda generación, y solo el 10% tenían IAMCEST. Las complicaciones causadas por la trombosis del stent, el infarto de miocardio y la muerte no cardiovascular favorecieron el TAPD a los 30 meses a pesar de las tasas más altas de hemorragia grave a los 33 meses de seguimiento. Después de esta recomendación, la proporción de pacientes con IAMCEST que recibieron TAPD ampliado más de 12 meses aumentó del 51% en 2010 al 77% en 2015 en Cataluña21. En el estudio EPICOR de 20 países, el 49% de los pacientes con IAMCEST recibieron TAPD a los 2 años de seguimiento22. Aquellos con una duración más larga del TAPD eran mayores, tenían más diabetes mellitus y, por lo general, recibían tratamiento médico.
El subestudio DAPT publicado en 201623 mostró una puntuación de predicción de eventos isquémicos con discreta capacidad para percibir la necesidad de TAPD durante 12 meses frente al TAPD durante 18 meses. Esta puntuación contenía la existencia de diabetes mellitus, stent < 3mm, tabaquismo, stents farmacoactivos de primera generación, insuficiencia cardiaca, FEVI baja, injerto de vena safena y presentación como infarto de miocardio, infarto de miocardio previo o ICP. Los pacientes con IAMCEST en TAPD a largo plazo de la cohorte ATHOS, principalmente con ácido acetilsalicílico y clopidogrel, tenían con mayor frecuencia un evento cardiovascular previo o diabetes mellitus. Sin embargo, el TAPD ampliado no se asoció con un mejor pronóstico general ni siquiera tras ajustar las características clínicas de alto riesgo isquémico residual.
Es posible que el supuesto beneficio del TAPD ampliado en el ATHOS no sea mayor que una peor característica basal de mal pronóstico. Se cree que el riesgo residual isquémico después de un infarto de miocardio es atribuible por igual a lesiones culpables y no culpables24. Sin embargo, una vez que la tasa de trombosis del stent disminuye por debajo del 1% por año24,25, el riesgo isquémico residual prevalente se asocia con lesiones no culpables, que pueden evaluarse y tratarse mejor con estrategias agresivas de reducción de lípidos.
En el ensayo Optidual26, con solo el 12% de los pacientes con IAMCEST, ampliar el TAPD hasta los 22 meses no logró la superioridad estadística en ningún criterio de valoración. En el ensayo Smart-Date27, ampliar el TAPD a una mediana de 17 meses no disminuyó el criterio de valoración principal, sino que disminuyó el número de infartos de miocardio, junto con tendencia al aumento de las hemorragias. En la cohorte ATHOS, las causas de rehospitalización a 1 año no fueron diferentes en los grupos de TAPU y de TAPD. A los 5 años, los pacientes con TAPD fueron ingresados con mayor frecuencia por infarto de miocardio y otras enfermedades cardiovasculares (tabla 3 del material adicional).
El único estudio aleatorizado en pacientes con IAMCEST, el DAPT-STEMI28, mostró que 6 meses de TAPD no fueron inferiores, por lo que respecta a las complicaciones, que el régimen convencional de 12 meses. La novedad de ese estudio fue que 2 tercios de los pacientes fueron tratados con ticagrelor o prasugrel, lo que puede conferir protección isquémica aguda durante los primeros meses después del primer ingreso, pero también puede tender a aumentar las tasas de hemorragia durante los meses siguientes. Solo un tercio de los pacientes de la cohorte ATHOS recibieron TAPD con prasugrel o ticagrelor al alta y durante el seguimiento.
LimitacionesEste es un seguimiento a largo plazo de pacientes consecutivos con IAMCEST, la mayoría de ellos tratados con ICP. Se pudo dar seguimiento al 71% de los pacientes iniciales con IAMCEST del ATHOS, ya que 23 de los 31 centros participantes se implicaron en el seguimiento completo a 5 años. Las características basales de los participantes y no participantes fueron bastante parecidas (tabla 6 del material adicional), lo que indica que en nuestros resultados hay poco sesgo, si lo hubiere.
En el momento en que se inició el estudio, no se había publicado ninguna puntuación validada del TAPD que pronosticara eventos trombóticos o hemorrágicos. Aún hay pocas pruebas que permitan realizar ajustes precisos del tratamiento antitrombótico a largo plazo de los pacientes con IAMCEST.
Las limitaciones del estudio comprenden la pérdida del 13,6% de los pacientes candidatos; sin embargo, las diferencias de las características basales de los participantes y de los que se perdieron para el seguimiento no fueron significativas o fueron clínicamente irrelevantes (tabla 7 del material adicional). El número de pacientes en TAPD después de 1 año fue de 275, mientras que en TAPU fue de más de 2.000: se asume que todos ellos continuaron recibiendo el TAPD hasta el final del estudio o el final del seguimiento. Sin embargo, dado que no hay ningún ensayo clínico que haya aleatorizado el TAPD a tan largo plazo, consideramos que nuestro mensaje es especialmente importante.
No había datos disponibles sobre la necesidad de tratamiento anticoagulante en esta cohorte al alta después del primer ingreso; sin embargo, la tasa de fibrilación auricular, una de las principales indicaciones de anticoagulación, fue similar entre los grupos de TAPU y de TAPD. La hemorragia durante el seguimiento es un problema importante29 y no pudo determinarse. Presumiblemente, la hemorragia grave podría haber causado rehospitalización o muerte que podría haberse incluido en nuestro criterio de valoración combinado de mortalidad o rehospitalización cardiovascular; sin embargo, esta falta de datos es una limitación. El TAPD o el TAPU se evaluaron al final del estudio o del seguimiento, y se supuso que los pacientes habían continuado con ellos sin cambios desde el comienzo del seguimiento 1 año después del IAMCEST inicial. Por último, los resultados de nuestro diseño de cohortes retrospectivo pueden reflejar diferencias en el pronóstico de pacientes con varios riesgos inherentes no medidos; esto también muestra la dificultad de evaluar y tratar correctamente el riesgo cardiovascular a largo plazo después de un evento isquémico de la arteria coronaria.
CONCLUSIONESNuestros resultados apuntan a la hipótesis de que, para los supervivientes de IAMCEST a 1 año, ampliar el TAPD hasta 5 años para los pacientes con alto riesgo no mejora su pronóstico a largo plazo.
FINANCIACIÓNEste estudio ha recibido la siguiente financiación: CIBERCV para la investigación en enfermedades cardiovasculares; Fondos Europeos de Desarrollo Regional (FEDER); FISP12/03287; FIS-CP12/03287, FIS-14/00449, FIS-PI081327, FIS-INTRASALUDPI18/00030; Agència de Gestió d’Ajuts Universitaris de Recerca (AGAUR) de Catalunya, 2017SGR222.
CONTRIBUCIÓN DE LOS AUTORESConcepto del estudio: J. Marrugat, I. Subirana, F. Fernández-Avilés, P.L. Sánchez, M. Roqué, D. Fernández-Bergés, J. Sanchis y R. Elosua. Obtención de datos del estudio: todos los autores. Análisis de datos: A. Toloba, H. Tizón-Marcos e I. Subirana. Interpretación de los resultados y preparación del original: H. Tizón-Marcos, R. Elosua y J. Marrugat. Todos los autores son responsables de la revisión crítica del artículo y de la aprobación de la versión final. Declaración de la Junta de Revisión Institucional: el estudio se realizó de acuerdo con la Declaración de Helsinki.
CONFLICTO DE INTERESESJ. Sanchis es editor jefe de Revista Española de Cardiología; se ha seguido el procedimiento editorial establecido en la Revista para garantizar la gestión imparcial del manuscrito.
Los demás autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a todos los investigadores y colaboradores del estudio ATHOS que aparecen en la lista que se incluye en el material adicional por la obtención de los datos.