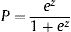La endocarditis infecciosa (EI) es una enfermedad compleja con elevada mortalidad. La evaluación pronóstica es esencial en el tratamiento de la enfermedad; sin embargo, las guías internacionales no aportan una evaluación objetiva del riesgo individual. Se desarrolló un modelo predictivo de mortalidad hospitalaria en EI izquierda combinando las variables pronósticas propuestas por la guía europea.
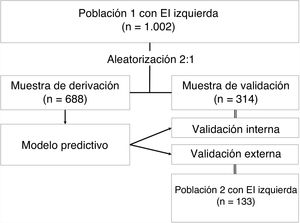
MétodosSe utilizaron 2 cohortes prospectivas de pacientes con EI izquierda. La cohorte 1 (n=1.002) se aleatorizó 2:1 para obtener 2 muestras: muestra de derivación (n=688) y muestra de validación interna (n=314). La cohorte 2 (n=133) se utilizó para la validación externa.
ResultadosEl modelo incluyó edad, endocarditis protésica, comorbilidades, insuficiencia cardiaca, insuficiencia renal, shock séptico, Estafilococo aureus, hongos, complicaciones perianulares, disfunción ventricular y vegetaciones como predictores independientes de mortalidad hospitalaria. El modelo mostró buena capacidad discriminativa (área bajo la curva ROC=0,855; IC95%, 0,825-0,885) y calibración (p valor test Hosmer-Lemeshow=0,409) que se ratificaron en la validación interna (área bajo curva ROC=0,823; IC95%, 0,774-0,873) y externa (área bajo curva ROC=0,753; IC95%, 0,659-0,847). Para la muestra de validación interna (mortalidad 29,9%) el modelo predijo una mortalidad de 30,7% (IC95%, 27,7-33,7) y para la muestra de validación externa (mortalidad 27,1%) 26,4% (IC95%, 22,2-30,5).
ConclusionesSe presenta un modelo predictivo de mortalidad hospitalaria en EII basado en las variables pronósticas propuestas por la guía europea de EI y con alta capacidad discriminativa.
Palabras clave
La endocarditis infecciosa (EI) izquierda (EII) es una enfermedad rara con una mortalidad elevada que oscila entre el 15 y el 40%1-4. El pronóstico puede mejorar gracias a avances recientes, tales como las nuevas indicaciones para la aplicación de técnicas de diagnóstico por la imagen, los nuevos y potentes antibióticos y la cirugía precoz. Sin embargo, aunque es posible que la mortalidad ajustada haya disminuido, la mortalidad absoluta se mantiene estable5-7.
Con un pronóstico tan desolador, la identificación temprana de los pacientes con un mal resultado a corto plazo es crucial y podría influir en la evolución natural de la enfermedad. Aunque la guía de práctica clínica europea sobre la EI insiste en la evaluación pronóstica, solo proporciona una lista de 19 variables independientes asociadas con mal resultado, y para algunas de estas variables las pruebas son escasas. Las guías norteamericanas no proporcionan ninguna recomendación al respecto8,9.
Los factores pronósticos proporcionados por la guía europea se dividen en 4 grupos: 4 variables se relacionan con las características del paciente (edad avanzada, EI de la válvula protésica, diabetes mellitus y comorbilidad); 5, con complicaciones clínicas (insuficiencia cardiaca, insuficiencia renal, área de ictus isquémico moderada, hemorragia cerebral y shock séptico); 3, con un microorganismo causal (Staphylococcus aureus, hongos y bacilos gramnegativos), y 7, con hallazgos ecocardiográficos (complicaciones perianulares, regurgitación grave de la válvula izquierda, fracción de eyección del ventrículo izquierdo reducida, hipertensión pulmonar, vegetación grande, disfunción grave de la válvula protésica y cierre prematuro de la válvula mitral, y otros signos de presión diastólica elevada). Para algunas de estas variables, prácticamente no hay pruebas que ratifiquen su valor pronóstico. Además, no se ha sopesado el impacto pronóstico de cada una de las variables, y algunas conllevan indudablemente un peor pronóstico que otras.
El objetivo del estudio es obtener y validar un modelo para predecir el resultado a corto plazo de los pacientes con EII en función de estas variables y utilizando una población grande de pacientes con esta enfermedad.
MÉTODOSPoblación en estudioEn este estudio se utilizaron 2 cohortes prospectivas de pacientes consecutivos con EII procedentes de 4 hospitales universitarios terciarios. La cohorte 1 incluyó a todos los pacientes consecutivos con diagnóstico confirmado de EII entre 2000 y 2017, procedentes de 3 hospitales, y se utilizó para obtener y dar validez interna al modelo predictivo. La cohorte 2, utilizada para la validación externa, incluyó a todos los pacientes con un diagnóstico final de EII establecido entre 2012 y 2017 e ingresados en otro hospital. Todos los centros son hospitales universitarios terciarios, con instalaciones de cirugía cardiaca urgente, y son centros de referencia en el tratamiento y la investigación de la EI.
Los centros participantes cuentan con bases de datos locales, prospectivas y en curso, que incluyen a todos los pacientes consecutivos con EI ingresados en sus instituciones. En cada centro se registró un informe de caso estandarizado de cada paciente. Los protocolos se ajustaron a las directrices éticas de la Declaración de Helsinki de 1975 y sus revisiones posteriores y fueron aprobados por los comités de ética locales. La proporción de datos ausentes fue < 10% en todas las variables analizadas.
Solo se incluyó a pacientes con EII confirmada según los criterios de Duke hasta 2002 y según los criterios de Duke modificados a partir de entonces10,11.
Diseño del estudioSe obtuvo el modelo predictivo y se validó a nivel interno utilizando datos de la cohorte 1 (n = 1.002). Esta población se aleatorizó en una proporción 2:1 para las muestras de derivación y de validación interna. Se utilizaron aproximadamente 2 tercios de la población para obtener el modelo (muestra de derivación, n=688) y el otro tercio para validarlo (muestra de validación interna, n=314). El modelo predictivo se diseñó a partir de los resultados de un análisis multivariable de la mortalidad hospitalaria que incluía todas las variables pronósticas propuestas por la guía europea. El modelo se validó externamente en la cohorte 2 (n=133). El diseño del estudio se presenta en la figura 1.
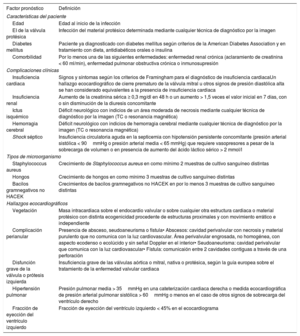
Definición de las variablesDel total de 19 variables pronósticas propuestas en la guía sobre EI de la Sociedad Europea de Cardiología (ESC), se incluyeron 17 en el análisis del presente estudio. Las variables se registraron durante el ingreso hospitalario, pero solo antes de la intervención en caso de cirugía cardiaca. No se incluyeron el cierre precoz de válvula mitral ni los signos ecocardiográficos de presión diastólica alta, por considerarlos factores sustitutos de insuficiencia cardiaca. Además, la definición de algunas variables se adaptó para ganar simplicidad y reproducibilidad al utilizar el modelo predictivo. La insuficiencia grave de la válvula izquierda y la disfunción grave de la válvula protésica se agruparon, y la vegetación valvular se consideró independientemente de su longitud, ya que no hay pruebas de un valor discriminatorio claro para considerar una vegetación tan grande. Los predictores preespecificados y sus definiciones se resumen en la tabla 1.
Definición de cada factor pronóstico utilizado en la construcción del modelo predictivo
| Factor pronóstico | Definición |
|---|---|
| Características del paciente | |
| Edad | Edad al inicio de la infección |
| EI de la válvula protésica | Infección del material protésico determinada mediante cualquier técnica de diagnóstico por la imagen |
| Diabetes mellitus | Paciente ya diagnosticado con diabetes mellitus según criterios de la American Diabetes Association y en tratamiento con dieta, antidiabéticos orales o insulina |
| Comorbilidad | Por lo menos una de las siguientes enfermedades: enfermedad renal crónica (aclaramiento de creatinina < 60 ml/min), enfermedad pulmonar obstructiva crónica o inmunosupresión |
| Complicaciones clínicas | |
| Insuficiencia cardiaca | Signos y síntomas según los criterios de Framingham para el diagnóstico de insuficiencia cardiacaUn hallazgo ecocardiográfico de cierre prematuro de la válvula mitral u otros signos de presión diastólica alta se han considerado equivalentes a la presencia de insuficiencia cardiaca |
| Insuficiencia renal | Aumento de la creatinina sérica ≥ 0,3 mg/dl en 48 h o un aumento > 1,5 veces el valor inicial en 7 días, con o sin disminución de la diuresis concomitante |
| Ictus isquémico | Déficit neurológico con indicios de un área moderada de necrosis mediante cualquier técnica de diagnóstico por la imagen (TC o resonancia magnética) |
| Hemorragia cerebral | Déficit neurológico con indicios de hemorragia cerebral mediante cualquier técnica de diagnóstico por la imagen (TC o resonancia magnética) |
| Shock séptico | Insuficiencia circulatoria aguda en la septicemia con hipotensión persistente concomitante (presión arterial sistólica < 90mmHg o presión arterial media < 65 mmHg) que requiere vasopresores a pesar de la sobrecarga de volumen o en presencia de aumento del ácido láctico sérico > 2 mmol/l |
| Tipos de microorganismo | |
| Staphylococcus aureus | Crecimiento de Staphylococcus aureus en como mínimo 2 muestras de cultivo sanguíneo distintas |
| Hongos | Crecimiento de hongos en como mínimo 3 muestras de cultivo sanguíneo distintas |
| Bacilos gramnegativos no HACEK | Crecimientos de bacilos gramnegativos no HACEK en por lo menos 3 muestras de cultivo sanguíneo distintas |
| Hallazgos ecocardiográficos | |
| Vegetación | Masa intracardiaca sobre el endocardio valvular o sobre cualquier otra estructura cardiaca o material protésico con distinta ecogenicidad procedente de estructuras proximales y con movimiento errático e independiente |
| Complicación perianular | Presencia de absceso, seudoaneurisma o fístula• Abscesos: cavidad perivalvular con necrosis y material purulento que no comunica con la luz cardiovascular. Área perivalvular engrosada, no homogénea, con aspecto ecodenso o ecolúcido y sin señal Doppler en el interior• Seudoaneurisma: cavidad perivalvular que comunica con la luz cardiovascular• Fístula: comunicaión entre 2 cavidades contiguas a través de una perforación |
| Disfunción grave de la válvula o prótesis izquierda | Insuficiencia grave de las válvulas aórtica o mitral, nativa o protésica, según la guía europea sobre el tratamiento de la enfermedad valvular cardiaca |
| Hipertensión pulmonar | Presión pulmonar media > 35mmHg en una cateterización cardiaca derecha o medida ecocardiográfica de presión arterial pulmonar sistólica > 60mmHg o menos en el caso de otros signos de sobrecarga del ventrículo derecho |
| Fracción de eyección del ventrículo izquierdo | Fracción de eyección del ventrículo izquierdo < 45% en el ecocardiograma |
EI: endocarditis infecciosa; HACEK: Haemophilus spp., Aggregatibacter spp., Cardiobacterium spp., Eikenella spp. y Kingella spp.; TC: tomografía computarizada.
La mortalidad hospitalaria se utilizó como el evento principal e incluía la mortalidad por cualquier causa durante el ingreso hospitalario. El tratamiento antibiótico y las indicaciones de cirugía seguían las recomendaciones de la guía europea y las decisiones se tomaron por grupos multidisciplinarios expertos en EI. Se consideró que la cirugía urgente era la realizada durante la fase activa de la enfermedad, antes de finalizar el tratamiento antibiótico12.
Análisis estadísticoLas variables categóricas informan de la frecuencia (N) y los porcentajes de la media ± desviación estándar o la mediana [intervalo intercuartílico] en los casos de distribución no normal. La distribución normal de las variables cuantitativas se verificó con la prueba de Kolmogorov-Smirnov y visualmente a través de gráficos Q-Q (cuantil-cuantil). Las variables cualitativas se compararon con la prueba de la χ2 y la prueba exacta de Fisher. Las variables continuas se compararon con la prueba de la t de Student o su equivalente para pruebas no paramétricas, la prueba de la U de Mann-Whitney, para variables que se distribuían de manera no normal.
La aleatorización de la cohorte 1 se llevó a cabo por asignación simple individual de cada evento con una probabilidad de 0,67 para la muestra de derivación y una probabilidad de 0,33 para la muestra de validación. Se utilizó el programa de diseño C4 Study Design Pack V 1.1 de Glaxo Wellcome S.A.
El análisis univariable se llevó a cabo en la muestra de derivación (cohorte 1) para comprobar la relación lineal de cada variable con el resultado, la mortalidad hospitalaria. Para obtener el modelo predictivo, se ajustó un modelo de regresión logística con el método de probabilidad máxima recurriendo a la selección gradual retrógrada, que incluía los factores pronósticos que aparecen en la tabla 1. Se controló el cociente variable/evento para evitar el sobreajuste. Para el modelo final, se calcularon las odds ratio (OR) ajustadas para cada una de las variables incluidas, junto con sus intervalos de confianza del 95% (IC95%). Este modelo se validó internamente en la muestra de validación (cohorte 1) y externamente en la cohorte 2.
Se verificó la no colinealidad entre las variables incluidas en el modelo. El área bajo la curva característica operativa del receptor (ROC) sirvió para medir lo bien que discriminaba el modelo entre los pacientes con un riesgo alto o bajo de mortalidad hospitalaria. Un valor de 0,5 indica ausencia de discriminación y un valor igual a 1 indica discriminación perfecta. La calibración se evaluó con la prueba de Hosmer-Lemeshow y con gráficos que comparaban la mortalidad predicha con la observada para los distintos niveles de riesgo.
Los valores de p son bilaterales y se consideraron estadísticamente significativos cuando p < 0,05. Los análisis se realizaron con el software SPSS, versión 24.0 (IBM), y el software R, versión 3.4.3 (Fundación R para el análisis estadístico).
RESULTADOSCaracterísticas iniciales de los pacientes con endocarditis infecciosa izquierdaLa descripción de las principales características de la cohorte 1 y la comparación entre las muestras de derivación y de validación interna resultantes de su aleatorización se muestran en la tabla 1 del material adicional. No se observaron diferencias relevantes y la distribución de las variables pronósticas fue homogénea.
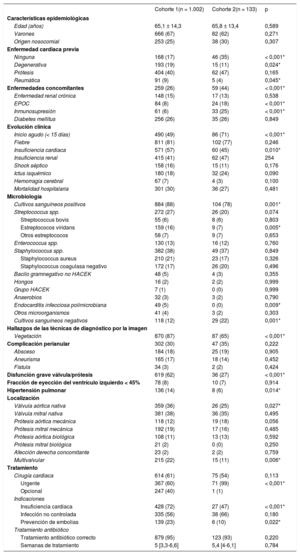
Por otro lado, se compararon las características principales de las cohortes 1 y 2 (tabla 2).
Comparación de poblaciones en las cohortes 1 y 2
| Cohorte 1(n = 1.002) | Cohorte 2(n = 133) | p | |
|---|---|---|---|
| Características epidemiológicas | |||
| Edad (años) | 65,1 ± 14,3 | 65,8 ± 13,4 | 0,589 |
| Varones | 666 (67) | 82 (62) | 0,271 |
| Origen nosocomial | 253 (25) | 38 (30) | 0,307 |
| Enfermedad cardiaca previa | |||
| Ninguna | 168 (17) | 46 (35) | < 0,001* |
| Degenerativa | 193 (19) | 15 (11) | 0,024* |
| Prótesis | 404 (40) | 62 (47) | 0,165 |
| Reumática | 91 (9) | 5 (4) | 0,045* |
| Enfermedades concomitantes | 259 (26) | 59 (44) | < 0,001* |
| Enfermedad renal crónica | 148 (15) | 17 (13) | 0,538 |
| EPOC | 84 (8) | 24 (18) | < 0,001* |
| Inmunosupresión | 61 (6) | 33 (25) | < 0,001* |
| Diabetes mellitus | 256 (26) | 35 (26) | 0,849 |
| Evolución clínica | |||
| Inicio agudo (< 15 días) | 490 (49) | 86 (71) | < 0,001* |
| Fiebre | 811 (81) | 102 (77) | 0,246 |
| Insuficiencia cardiaca | 571 (57) | 60 (45) | 0,010* |
| Insuficiencia renal | 415 (41) | 62 (47) | 254 |
| Shock séptico | 158 (16) | 15 (11) | 0,176 |
| Ictus isquémico | 180 (18) | 32 (24) | 0,090 |
| Hemorragia cerebral | 67 (7) | 4 (3) | 0,100 |
| Mortalidad hospitalaria | 301 (30) | 36 (27) | 0,481 |
| Microbiología | |||
| Cultivos sanguíneos positivos | 884 (88) | 104 (78) | 0,001* |
| Streptococcus spp. | 272 (27) | 26 (20) | 0,074 |
| Streptococcus bovis | 55 (6) | 8 (6) | 0,803 |
| Estreptococos viridans | 159 (16) | 9 (7) | 0,005* |
| Otros estreptococos | 58 (7) | 9 (7) | 0,653 |
| Enterococcus spp. | 130 (13) | 16 (12) | 0,760 |
| Staphylococcus spp. | 382 (38) | 49 (37) | 0,849 |
| Staphylococcus aureus | 210 (21) | 23 (17) | 0,326 |
| Staphylococcus coagulasa negativo | 172 (17) | 26 (20) | 0,496 |
| Bacilo gramnegativo no HACEK | 48 (5) | 4 (3) | 0,355 |
| Hongos | 16 (2) | 2 (2) | 0,999 |
| Grupo HACEK | 7 (1) | 0 (0) | 0,999 |
| Anaerobios | 32 (3) | 3 (2) | 0,790 |
| Endocarditis infecciosa polimicrobiana | 49 (5) | 0 (0) | 0,009* |
| Otros microorganismos | 41 (4) | 3 (2) | 0,303 |
| Cultivos sanguíneos negativos | 118 (12) | 29 (22) | 0,001* |
| Hallazgos de las técnicas de diagnóstico por la imagen | |||
| Vegetación | 870 (87) | 87 (65) | < 0,001* |
| Complicación perianular | 302 (30) | 47 (35) | 0,222 |
| Absceso | 184 (18) | 25 (19) | 0,905 |
| Aneurisma | 165 (17) | 18 (14) | 0,452 |
| Fístula | 34 (3) | 2 (2) | 0,424 |
| Disfunción grave válvula/prótesis | 619 (62) | 36 (27) | < 0,001* |
| Fracción de eyección del ventrículo izquierdo < 45% | 78 (8) | 10 (7) | 0,914 |
| Hipertensión pulmonar | 136 (14) | 8 (6) | 0,014* |
| Localización | |||
| Válvula aórtica nativa | 359 (36) | 26 (25) | 0,027* |
| Válvula mitral nativa | 381 (38) | 36 (35) | 0,495 |
| Prótesis aórtica mecánica | 118 (12) | 19 (18) | 0,056 |
| Prótesis mitral mecánica | 192 (19) | 17 (16) | 0,485 |
| Prótesis aórtica biológica | 108 (11) | 13 (13) | 0,592 |
| Prótesis mitral biológica | 21 (2) | 0 (0) | 0,250 |
| Afección derecha concomitante | 23 (2) | 2 (2) | 0,759 |
| Multivalvular | 215 (22) | 15 (11) | 0,006* |
| Tratamiento | |||
| Cirugía cardiaca | 614 (61) | 75 (54) | 0,113 |
| Urgente | 367 (60) | 71 (99) | < 0,001* |
| Opcional | 247 (40) | 1 (1) | |
| Indicaciones | |||
| Insuficiencia cardiaca | 428 (72) | 27 (47) | < 0,001* |
| Infección no controlada | 335 (56) | 38 (66) | 0,180 |
| Prevención de embolias | 139 (23) | 6 (10) | 0,022* |
| Tratamiento antibiótico | |||
| Tratamiento antibiótico correcto | 879 (95) | 123 (93) | 0,220 |
| Semanas de tratamiento | 5 [3,3-6,6] | 5,4 [4-6,1] | 0,784 |
EPOC: enfermedad pulmonar obstructiva crónica; HACEK: Haemophilus spp., Aggregatibacter spp., Cardiobacterium spp., Eikenella spp. y Kingella spp.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
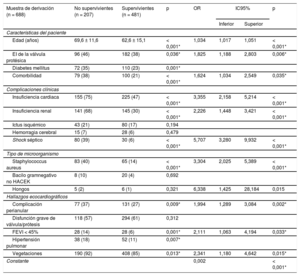
La tabla 3 muestra la relación entre las variables propuestas por la guía europea y la mortalidad hospitalaria en la muestra de derivación (n=688). Todas las variables, excepto el ictus isquémico, la hemorragia cerebral, los hongos, los bacilos gramnegativos no HACEK (Haemophilus spp., Aggregatibacter spp., Cardiobacterium spp., Eikenella spp., Kingella spp.) y la disfunción grave de la válvula/prótesis se relacionaron estadísticamente con la mortalidad hospitalaria en el análisis univariable.
Asociación entre la mortalidad hospitalaria y las variables propuestas por la guía europea sobre EI en la cohorte 1 (muestra de derivación)
| Muestra de derivación (n = 688) | No supervivientes (n = 207) | Supervivientes (n = 481) | p | OR | IC95% | p | |
|---|---|---|---|---|---|---|---|
| Inferior | Superior | ||||||
| Características del paciente | |||||||
| Edad (años) | 69,6 ± 11,6 | 62,6 ± 15,1 | < 0,001* | 1,034 | 1,017 | 1,051 | < 0,001* |
| EI de la válvula protésica | 96 (46) | 182 (38) | 0,036* | 1,825 | 1,188 | 2,803 | 0,006* |
| Diabetes mellitus | 72 (35) | 110 (23) | 0,001* | ||||
| Comorbilidad | 79 (38) | 100 (21) | < 0,001* | 1,624 | 1,034 | 2,549 | 0,035* |
| Complicaciones clínicas | |||||||
| Insuficiencia cardiaca | 155 (75) | 225 (47) | < 0,001* | 3,355 | 2,158 | 5,214 | < 0,001* |
| Insuficiencia renal | 141 (68) | 145 (30) | < 0,001* | 2,226 | 1,448 | 3,421 | < 0,001* |
| Ictus isquémico | 43 (21) | 80 (17) | 0,194 | ||||
| Hemorragia cerebral | 15 (7) | 28 (6) | 0,479 | ||||
| Shock séptico | 80 (39) | 30 (6) | < 0,001* | 5,707 | 3,280 | 9,932 | < 0,001* |
| Tipo de microorganismo | |||||||
| Staphylococcus aureus | 83 (40) | 65 (14) | < 0,001* | 3,304 | 2,025 | 5,389 | < 0,001* |
| Bacilo gramnegativo no HACEK | 8 (10) | 20 (4) | 0,692 | ||||
| Hongos | 5 (2) | 6 (1) | 0,321 | 6,338 | 1,425 | 28,184 | 0,015 |
| Hallazgos ecocardiográficos | |||||||
| Complicación perianular | 77 (37) | 131 (27) | 0,009* | 1,994 | 1,289 | 3,084 | 0,002* |
| Disfunción grave de válvula/prótesis | 118 (57) | 294 (61) | 0,312 | ||||
| FEVI < 45% | 28 (14) | 28 (6) | 0,001* | 2,111 | 1,063 | 4,194 | 0,033* |
| Hipertensión pulmonar | 38 (18) | 52 (11) | 0,007* | ||||
| Vegetaciones | 190 (92) | 408 (85) | 0,013* | 2,341 | 1,180 | 4,642 | 0,015* |
| Constante | 0,002 | < 0,001* | |||||
EI: endocarditis infecciosa; FEVI: fracción de eyección del ventrículo izquierdo; HACEK: Haemophilus spp., Aggregatibacter spp., Cardiobacterium spp., Eikenella spp. y Kingella spp.; IC95%: intervalo de confianza del 95%; OR: odds ratio.
Los valores expresan n (%) o media ± desviación estándar.
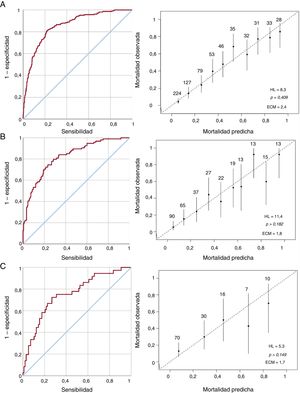
A continuación se realizó un análisis multivariante (tabla 3). Los predictores independientes de la mortalidad hospitalaria fueron la edad, la EI de válvula protésica, la comorbilidad, la insuficiencia cardiaca, la insuficiencia renal, el shock séptico, Staphylococcus aureus, los hongos, las complicaciones perianulares, la disfunción ventricular y las vegetaciones. El modelo mostró una buena capacidad discriminatoria con un área bajo la curva ROC de 0,855 (IC95%, 0,825-0,885) y una buena calibración (figura 2A).
Capacidad discriminatoria y calibración del modelo. A: curva ROC y gráfico que compara la mortalidad hospitalaria observada y la predicha en la muestra de derivación. B: curva ROC y gráfico que compara la mortalidad hospitalaria observada y la predicha en la muestra de validación interna. C: curva ROC y gráfico que compara la mortalidad hospitalaria observada y la predicha en la muestra de validación externa. ECM: error cuadrático medio; HL: Hosmer-Lemeshow; ROC: característica operativa del receptor.
La fórmula para predecir la mortalidad hospitalaria se creó utilizando los logaritmos de la OR ajustada a partir del modelo predictivo:
donde z=–6,288+0,033 × la edad+0,602 × EI de válvula protésica+0,485 × comorbilidad+1,210 × insuficiencia cardiaca+0,800 × insuficiencia renal+1,742 × shock séptico+1,195 × Staphylococcus aureus+1,847 × hongos+0,690 × complicación perianular+0,747 × fracción de eyección del ventrículo izquierdo baja+0,850 × vegetación.Validación del modeloEl modelo se validó interna y externamente con la muestra de validación interna de la cohorte 1 (n=314) y de la cohorte 2 (n=133) respectivamente. La validación interna mostró un área bajo la curva ROC de 0,823 (IC95%, 0,774-0,873). El modelo predijo una mortalidad hospitalaria del 30,7% (IC95%, 27,7-33,7) y una mortalidad observada del 29,9% (figura 2B).
La validación interna mostró un área bajo la curva ROC de 0,753 (IC95%, 0,659-0,847). El modelo predijo una mortalidad hospitalaria del 26,4% (IC95%, 22,2-30,5) y una mortalidad observada del 29,9% (figura 2C).
Presentación del modeloPuede accederse al modelo como aplicación informática vía internet en la página web de ENDOVAL score13 y a través de Google Play Store (ENDOVAL score).
DISCUSIÓNSe presenta el primer modelo predictivo de mortalidad hospitalaria en la EII obtenido por medio de los factores pronósticos propuestos por la guía europea para el tratamiento de la EI. Los resultados muestran que el modelo tiene gran capacidad discriminatoria.
Evaluación pronóstica en la endocarditis infecciosa izquierdaEl diagnóstico y el tratamiento de la EI es un reto clínico. La identificación temprana de los pacientes con EII con riesgo elevado es crucial para cambiar el curso natural de la enfermedad8. Algunas investigaciones previas importantes se han centrado en el pronóstico de la EI1,4,5,7,14-16. Aunque algunos de estos estudios clásicos sobre la EI presentan una muy buena visión general de la enfermedad, tienen limitaciones metodológicas importantes. En primer lugar, estos estudios no diferencian entre los eventos de EI izquierda y derecha, a pesar de que las características y el pronóstico son muy distintos1,4,14. Además, la mayor parte de los estudios dirigieron la atención a la evaluación de un único factor pronóstico o unos pocos3,11,12,17-31. La guía europea sintetiza los factores pronósticos más importantes en un esfuerzo por reflejar los conocimientos actuales y ayudar a los médicos en la práctica diaria; no obstante, la información no es lo suficientemente precisa y su utilidad práctica es escasa. Se comprobó la potencia pronóstica de estas variables preespecificadas, ya que se consideraba que todas ellas tienen importancia clínica y cuentan con el apoyo científico de los autores y revisores de la guía.
Implicaciones prácticasSe publicó una estratificación pronóstica muy simple de los pacientes con EII establecida en el ingreso y en función de la presencia de insuficiencia cardiaca, Staphylococcus aureus y complicaciones perianulares15. Este nuevo modelo predictivo es una herramienta simple que permite obtener una estimación rápida y precisa del pronóstico del paciente. Este no debería considerarse definitivo, sino una fuente complementaria de información pronóstica que, junto con otras variables, ayudará a los médicos a decidir si la cirugía está indicada y cuándo. De los resultados puede inferirse que el riesgo de mortalidad hospitalaria puede evaluarse para el mismo paciente en distintos momentos de la enfermedad, aunque esta hipótesis debería confirmarse en estudios prospectivos. Además, el modelo también puede ayudar a los pacientes y las familias a obtener información precisa y comprender mejor la enfermedad y sus complicaciones.
Características diferenciales de este estudioEste estudio tiene algunos puntos fuertes. Solo incluye a pacientes con EII confirmada. El número de eventos es alto, tratándose de una enfermedad con poca incidencia, y se ha incluido información de los 4 hospitales terciarios. La información es homogénea y de gran calidad. Por último, el estudio centró la atención en los factores pronósticos propuestos por la guía europea y demuestra su potencia pronóstica por primera vez. Esta metodología evita el sesgo que pudiera existir en la población en estudio con respecto a la selección de variables para construir el modelo predictivo y favorece la generalización de resultados.
LimitacionesEste estudio también tiene algunas limitaciones. Todos los centros son terciarios, con instalaciones de cirugía cardiaca, y son centros de referencia en el tratamiento de la EI, lo cual limita la aplicabilidad del modelo a hospitales de características similares. La cohorte 1 incluyó a pacientes diagnosticados entre 2000 y 2017, un periodo largo durante el cual se han probado distintas formas de tratamiento, lo que podría haber limitado la precisión del modelo. La cohorte de validación externa es más reciente, lo que podría explicar algunas de las diferencias entre cohortes y podría considerarse una limitación metodológica. Aunque el buen desempeño del modelo en la cohorte de validación refuerza la utilidad clínica del presente estudio, las validaciones externas futuras, en particular con muestras más grandes y distintas poblaciones de mezcla de casos, mejorarían la aplicabilidad del modelo predictivo. La definición de variables en la guía europea a veces es sencilla y otras incluye ligeras adaptaciones que podrían haber limitado el impacto pronóstico de esas variables.
Por último, la inclusión de otras variables pronósticas puede mejorar el rendimiento predictivo del modelo; no obstante, en aras de la simplicidad y la aplicabilidad general, solo se probaron las variables propuestas por la guía europea. Se necesitan investigaciones futuras para validar los resultados y explorar el efecto de incluir nuevas variables.
CONCLUSIONESEl modelo predictivo de la mortalidad hospitalaria en la EI izquierda según las variables pronósticas propuestas por la guía de la ESC sobre EI tiene una gran capacidad discriminatoria.
- -
La mortalidad por EII es alta y continúa estable a pesar de avances médicos importantes. Existen varios factores pronósticos conocidos que la guía europea sobre EI sintetiza en un esfuerzo por reflejar los conocimientos actuales y ayudar a los médicos en la práctica clínica diaria; no obstante, la información no es lo bastante precisa y su utilidad práctica es escasa.
- -
Este estudio añade un modelo predictivo de mortalidad hospitalaria en la EII con una capacidad discriminatoria alta según las variables pronósticas propuestas por la guía de la ESC sobre EI. Este modelo emerge como una herramienta de ayuda en el proceso de toma de decisiones del equipo de endocarditis, proporcionando una estimación rápida y precisa del pronóstico del paciente. Además, el modelo también puede ayudar a los pacientes y a sus familias a obtener información precisa y comprender mejor la enfermedad y sus complicaciones.
Este estudio fue financiado por la Gerencia Regional de Salud de la Junta de Castilla y León (GRS 1523/A/17).
CONFLICTO DE INTERESESNinguno.