Las enfermedades cardiovasculares tienen en la actualidad un gran impacto social y económico y constituyen una de las principales causas de mortalidad y morbilidad. Los modelos computacionales personalizados del corazón están demostrando ser útiles tanto para ayudar a comprender los mecanismos subyacentes a las patologías cardiacas como para optimizar su tratamiento prediciendo la respuesta del paciente. En este contexto, se ha puesto en marcha la Red Española de Investigación en Modelización Computacional Cardiaca (V-Heart SN). El objetivo general de V-Heart SN es el desarrollo de un modelo computacional multifísico y multiescala integrado del corazón. Este objetivo general se aborda a través de los siguientes objetivos específicos: a) integrar los diferentes modelos numéricos teniendo en cuenta la especificidad de los pacientes; b) ayudar a avanzar en el conocimiento de los mecanismos asociados a las diferentes patologías cardiacas y vasculares; y c) apoyar la aplicación de terapias personalizadas. Este artículo presenta el estado actual de la modelización computacional cardiaca y los diferentes trabajos científicos desarrollados por los miembros de la red para favorecer una mayor comprensión de las características y utilidad de los modelos.
Palabras clave
Las enfermedades cardiovasculares tienen un gran impacto social y económico en España y en el resto del mundo, en morbilidad, mortalidad y coste para el sistema de asistencia sanitaria. La evaluación diagnóstica y terapéutica de los pacientes depende todavía de los estudios empíricos, en los que se comparan estadísticamente los resultados de distintos grupos de pacientes con similares enfermedades. La elección del tratamiento óptimo resulta difícil y la eficacia del tratamiento es escasa, ya que cada paciente tiene su propio perfil específico de la enfermedad. Están surgiendo modelos computacionales del corazón (también denominados corazón virtual, corazón in silico o gemelo digital) como una herramienta útil que proporciona un marco de referencia en el que integrar datos diversos de pacientes individuales, que pueden usarse para mejorar el diagnóstico y optimizar y planificar tratamientos personalizados1.
Los modelos matemáticos multiescala del corazón, basados en principios biofísicos, proporcionan un puente entre los modelos celulares a menor escala y la función del órgano a mayor escala. Por ejemplo, en la electrofisiología cardiaca, los datos experimentales y clínicos se integran mediante modelos computacionales del potencial de acción humano2 y su propagación en estructuras cardiacas bidimensionales (2D) y tridimensionales (3D). Estos modelos se están utilizando para generar y probar hipótesis que son difíciles de abordar en experimentos. Se han elaborado modelos cardiacos no patológicos de las aurículas3,4 y los ventrículos5 humanos con un alto grado de detalle electroanatómico. Actualmente se dispone también de modelos del torso humano6 que permiten la reconstrucción de los potenciales eléctricos que generan el electrocardiograma de superficie.
Para simular de un modo realista el complejo comportamiento multifísico del corazón, los modelos computacionales tienen que simular la electrofisiología, la contracción muscular y la mecánica del flujo sanguíneo7. Los avances realizados en la modelización matemática en la última década y los recursos computacionales permiten actualmente la resolución de modelos acoplados multifísicos sumamente complejos que pueden tener en cuenta mecanismos de retroalimentación a nivel biofísico para llevar a cabo estudios in silico fiables, que son útiles para la estratificación del riesgo de los pacientes, la planificación del tratamiento o la realización de ensayos clínicos in silico, entre otras aplicaciones8,9.
Las crecientes disponibilidad de imágenes cardiacas in vivo y tendencia hacia la medicina personalizada han hecho posible la creación de modelos específicos de cada paciente. Se puede extraer la anatomía cardiaca de una persona concreta a partir de las imágenes médicas obtenidas in vivo (p. ej., tomografía computarizada o resonancia magnética [RM]). También pueden incorporarse a los modelos parámetros estimados a partir de estadísticas de ámbito poblacional o a partir de experimentos ex vivo (orientación de las fibras, anisotropía o heterogeneidad electrofisiológica, entre otros) cuando no se dispone de datos específicos del paciente, y ello asegura que estos parámetros se mantengan dentro de la banda fisiológica. Luego, se obtiene el modelo específico del paciente mediante el ajuste de los parámetros, de tal forma que los resultados de la simulación del modelo sean coherentes con lo obtenido en los registros clínicos.
Sin embargo, el camino que va desde la elaboración de un modelo cardiaco específico del paciente a su aplicación clínica es complejo y requiere la participación de un equipo multidisciplinario. Los clínicos proporcionan datos anatómico-fisiológicos y un conocimiento previo para la construcción de los modelos, su personalización y su validación. Otros profesionales, con diferentes tipos de formación en matemáticas, ingeniería y física, formulan entonces las ecuaciones, elaboran los programas informáticos necesarios para resolverlas y realizan simulaciones que imiten fenómenos multifísicos cardiacos en situaciones de salud y de enfermedad. Recientemente se ha creado la Red Española de Investigación en Modelización Computacional Cardiaca (VHeart-SN), de la que forman parte 9 universidades y centros de investigación españoles que tienen una amplia experiencia en diferentes aspectos de los modelos computacionales del corazón. El objetivo principal de la red es elaborar un modelo computacional multifísico y multiescala integrado del corazón y aumentar las colaboraciones con los equipos clínicos y las empresas médicas para contribuir en última instancia a la traslación de los modelos virtuales del corazón a las aplicaciones clínicas. En este artículo se resume el estado actual de la modelización computacional cardiaca y diferentes trabajos científicos desarrollados por los miembros de la red.
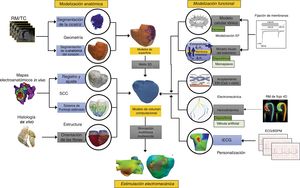
MÉTODOSModelización anatómicaHay un gran número de técnicas disponibles para obtener un modelo 3D del corazón de un paciente a partir de imágenes obtenidas in vivo mediante RM o tomografía computarizada10 (figura 1, geometría). De entre ellas, vale la pena mencionar las que se basan en el conocimiento previo de la anatomía del corazón, como las basadas en atlas estadísticos11 o las más recientes basadas en técnicas de aprendizaje profundo (deep learning).
Representación esquemática de los productos en desarrollo para la creación de un modelo computacional tridimensional (3D) del corazón. En este diagrama de flujo se muestran las principales fases del proceso de elaboración de un modelo cardiaco 3D destinado a la simulación biofísica: generación de la geometría cardiaca 3D y generación de la malla (meshing) (a partir de la resonancia magnética [RM] o la tomografía computarizada [TC]), generación del sistema de conducción cardiaco (SCC), generación de la estructura miocárdica, modelización biofísica (electrofisiología [EF] cardiaca y electromecánica) y finalmente simulación multifísica y multiescala. Los modelos pueden personalizarse mediante el electrocardiograma (ECG) o los mapas de potenciales de superficie corporal (BSPM) del paciente. Las flechas indican el avance desde los datos clínicos/biológicos (ex vivo e in vivo) hacia el modelo computacional final y la simulación electromecánica. Los recuadros azules indican métodos que permiten obtener una personalización de las propiedades específicas del modelo para un paciente concreto, mientras que los recuadros grises corresponden a descripciones de base poblacional o genéricas de otras propiedades. iECG: técnicas de imagen electrocardiográficas.
Además de la geometría 3D, cada modelo computacional del corazón tiene que incluir otras propiedades como, por ejemplo, la orientación de las fibras cardiacas o las enfermedades que afectan a la estructura del miocardio (figura 1, sistema de conducción y estructura del corazón). Es necesario utilizar modelos matemáticos para definir la dirección preferente en la que se propagará la activación eléctrica6,12 o la deformación mecánica. El último componente anatómico crucial necesario en los modelos cardiacos es el sistema de conducción del corazón. Algunos de los modelos cardiacos existentes han incluido el sistema de conducción cardiaco a un nivel funcional (propagación endocárdica rápida) o se han basado en datos obtenidos ex vivo13. Los métodos avanzados más recientes incluyen la red de Purkinje de un determinado paciente mediante estimación inversa basada en los datos de mapeo electroanatómico14.
Además de estos componentes anatómicos, es posible definir regiones en las que se observa un remodelado estructural y funcional, como las cicatrizaciones o el tejido fibroso. Estas lesiones fibrosas pueden segmentarse a partir de las imágenes de RM con realce tardío in vivo5, que proporcionan una información precisa acerca de la ubicación de las lesiones isquémicas (cicatriz de infarto y zona limítrofe).
Modelos electrofisiológicos y mecánicosLa aplicación de diferentes modelos experimentales, como el de patch-clamp, ha permitido la cuantificación de las propiedades biofísicas de los cardiomiocitos, a escala tanto celular como tisular. Este conocimiento hizo posible elaborar modelos computacionales de miocitos individuales (figura 1, modelos electrofisiológicos). En general, se basan en el formalismo matemático de Hodgkin-Huxley15, en el que el potencial de acción celular se describe mediante un sistema de ecuaciones que modeliza la cinética de los canales iónicos individuales, las bombas y los intercambiadores, así como sus interacciones eléctricas. Se han elaborado varios modelos computacionales de la actividad eléctrica cardiaca celular, de los miocitos ventriculares2 y auriculares16 y de las fibras de Purkinje17. Los modelos de propagación tisular utilizados habitualmente son el del bidominio y el del monodominio18, que se acoplan a modelos celulares para formar un modelo multiescala. Estos modelos tisulares (unidimensional [1D], 2D o 3D) pueden incluir una estructura heterogénea del tejido cardiaco y una expresión celular heterogénea (apical-basal, endocárdico-epicárdico y ventrículos izquierdo-derecho), lo cual les proporciona un alto grado de realismo19.
Los modelos cardiacos 3D destinados a simulaciones computacionales electromecánicas deben incluir el acoplamiento electromecánico, también denominado acoplamiento de excitación-contracción. En él, la activación eléctrica induce una contracción del tejido cardiaco, que influye a su vez en el potencial de acción a través de las corrientes activadas por la actividad mecánica20. La contracción se inicia por un aumento del calcio intracelular, cuya dinámica debe tenerse en cuenta también en la aparición de diferentes arritmias21.
Modelos hemodinámicosGracias a la dinámica de fluidos computacional (DFC), es posible obtener matemáticamente el comportamiento de la sangre en el interior del corazón. Los modelos del corazón tienen en cuenta el movimiento y la deformación a gran escala, la interacción entre fluido y estructura de las válvulas, la dinámica de flujo complejo inducida en el interior de las cámaras y la transición del impulso eléctrico a través del tejido, entre otros factores. Se puede resolver mediante computación todos estos fenómenos acoplados con códigos computacionales multifísicos y multiescala8,22. Por lo que respecta a la personalización del modelo, las técnicas diagnósticas avanzadas, como la RM de contraste de fase tetradimensional (4D) o la ecocardiografía ultrarrápida 3D/4D, han permitido obtener el flujo sanguíneo complejo del interior de los vasos sanguíneos y del corazón del paciente. La combinación de estas técnicas de imagen con la DFC permite personalizar la simulación numérica y obtener modelos computacionales específicos para un determinado paciente23.
Los modelos computacionales más sencillos, denominados modelos 0D/modelos de parámetros concentrados (lumped), son también herramientas computacionales de interés para el estudio de la hemodinámica en el conjunto del sistema cardiovascular, que no pueden obtenerse con modelos de más dimensiones como la DFC y la interacción entre fluido y estructura. Por ejemplo, se elaboró un modelo de la circulación fetal, personalizado con los datos de ecografía Doppler disponibles, para cuantificar la redistribución de la sangre en casos de restricción del crecimiento intrauterino24. Los modelos de parámetros concentrados se han utilizado también recientemente para un estudio holístico de las interacciones entre corazón y cerebro, para la personalización de modelos cardiovasculares con datos procedentes de miles de casos de la base de datos UK Biobank y para identificar nuevas relaciones entre factores neurológicos como las lesiones de hiperintensidad de sustancia blanca y anomalías cardiacas como la fibrilación auricular (FA)25. En este sentido, también es posible crear un modelo simple basado en el acoplamiento de modelos 1D o 0D con modelos 3D para estudiar de manera eficiente problemas de hemodinámica26. Los modelos 1D permiten investigar los mecanismos físicos que subyacen a los cambios de la presión y de la forma de onda del pulso de flujo a que da lugar en una enfermedad cardiovascular27.
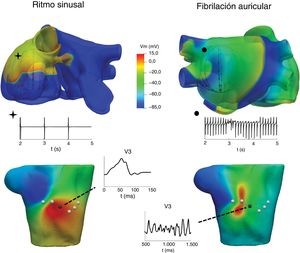
APLICACIONES CLÍNICASArritmias auricularesEs bien sabido que las arritmias auriculares pueden ser causadas por diversos mecanismos, como una reentrada de circuito único, una reentrada de circuitos múltiples, una actividad ectópica local rápida o rotores. La identificación de los mecanismos que subyacen a las arritmias auriculares puede tener una repercusión importante en la personalización del tratamiento para determinados tipos de pacientes o para un paciente específico. Una de las aplicaciones de los modelos computacionales es facilitar el conocimiento de la relación existente entre los patrones de activación auricular y las características de los electrogramas registrados mediante catéteres8,28,29 y proponer mejores biomarcadores del electrograma que puedan aportar información acerca de la dinámica de la FA y de la zona del tejido que mantiene la FA. En la figura 2 se muestra la relación entre 2 activaciones auriculares, en ritmo sinusal (izquierda) y en FA (derecha), los electrogramas registrados mediante un catéter intracavitario, los mapas de superficie y la onda P en la derivación precordial V3.
Arriba: propagación auricular producida por un ritmo sinusal (izquierda) y por una estimulación ectópica procedente del seno coronario (derecha) y sus señales de electrograma registradas en 1 electrodo intracavitario. Abajo: mapas de potenciales de la superficie corporal en un instante de las simulaciones de arriba y onda P registrada en la derivación precordial V3.
Los modelos computacionales son también una plataforma adecuada para el estudio de la influencia de las caracteristicas electrofisiológicas y del remodelado específico del paciente (es decir, el remodelado eléctrico y la distribución de la fibrosis), en la aparición y el mantenimiento de la FA, lo cual puede ser útil para orientar el tratamiento. Empleando modelos tisulares 2D y de modelos 3D de las aurículas izquierda y derecha específicos para el paciente, se ha observado que la fibrosis y el gradiente de grosor de la pared auricular pueden afectar a la estabilización de los factores desencadenantes de la FA30.
Además, para profundizar en el conocimiento de los mecanismos de inicio y perpetuación de la FA, las simulaciones de ordenador podrían desempeñar un papel en la planificación y la predicción del efecto de un tratamiento en un futuro próximo. Actualmente la ablación de la FA es el tratamiento de primera línea para el control del ritmo en la FA de algunos pacientes seleccionados, sobre todo los que tienen una FA paroxística y prefieren un tratamiento de intervención31. Sin embargo, es bien sabido que los resultados de la ablación de la FA dependen de muchos factores importantes, como el tipo de FA (paroxística, persistente o permanente), la edad, las comorbilidades, el tamaño de la aurícula, la toma de fármacos antiarrítmicos y el número y el momento de aplicación de las repetidas intervenciones de ablación. El principal obstáculo al que se enfrentan las intervenciones de ablación de la FA es la selección correcta de los pacientes y la identificación del tamaño adecuado de las lesiones generadas, con objeto de evitar un daño innecesario en la aurícula. La eficacia de la ablación de la FA puede mejorarse con una estrategia de ablación optimizada, específica para cada paciente, predicha con un modelo computacional antes de realizar la intervención de ablación. Por ejemplo, un estudio in silico ha mostrado recientemente el impacto térmico de una oclusión con balón del seno coronario durante la ablación por radiofrecuencia del istmo mitral32.
Como prueba de concepto de que los modelos computacionales pueden guiar las intervenciones de ablación, Boyle et al.1 llevaron a cabo un estudio prospectivo en 10 pacientes con FA persistente y fibrosis auricular a los que se realizó una ablación óptima dirigida. Los autores utilizaron modelos computacionales personalizados de las aurículas reconstruidas a partir de las exploraciones de imagen de RM con realce tardío de gadolinio del paciente, con objeto de identificar los lugares que estaban manteniendo la FA o serían posibles orígenes de FA en el futuro. Sus resultados indicaron que el uso de esta metodología aumenta la eficacia de la intervención.
La ubicación de los focos ectópicos durante una taquicardia auricular focal es difícil de determinar con técnicas no invasivas. Los métodos basados en electrocardiogramas de 12 derivaciones estándares o en mapas de potenciales de superficie corporal no han aportado luz suficiente sobre la forma de correlacionar con exactitud las ubicaciones del foco ectópico con la distribución de las características del potencial o de la onda P en la superficie del torso. Esta limitación implica intervenciones de mapeo invasivas intraoperatorias más prolongadas, que podrían resultar en una ablación deficiente de los focos de la arritmia. Recientemente se ha utilizado un modelo de aurícula-torso multiescala muy detallado para elaborar una metodología de aprendizaje automático (machine learning) para clasificar los mapas de potenciales de superficie corporal en función de la ubicación de los focos ectópicos auriculares6,33.
La modelización computacional ha contribuido también a la caracterización de los efectos en el sistema autónomo de la actividad eléctrica auricular y el establecimiento de acciones que llevan a interrumpir o perpetuar la arritmia auricular, y hay un interés reciente por la modelización del sistema nervioso autónomo intrínseco cardiaco para evaluar la ablación de plexos ganglionados en combinación con el aislamiento de las venas pulmonares34.
Taquicardias ventriculares y planificación de la intervención de terapia de resincronización cardiacaLos modelos ventriculares electrofisiológicos han sido útiles para esclarecer los mecanismos que subyacen a los fenómenos de repolarización ventricular35,36 y mejorar la definición de los marcadores del riesgo de arritmia cuantificados a partir de los signos del electrograma y el electrocardiograma. A modo de ejemplo, las oscilaciones de baja frecuencia de la repolarización ventricular, propuestas recientemente para guiar el implante de un desfibrilador automático implantable profiláctico37, se han investigado mediante modelización computacional y simulación para identificar sus bases celulares, establecer una relación con el riesgo de arritmia y relacionarlo con otros fenómenos arritmogénicos38,39. Otro reciente modelo electrofisiológico específico del paciente, denominado mapeo in silico de ritmo, predijo el origen en el tracto de salida derecho en las arritmias ventriculares idiopáticas de 10/11 casos40. También se ha utilizado un modelo específico del paciente para investigar el mecanismo de microrreentrada que conduce a la generación de extrasístoles cerca de las áreas de infarto41,42. Los resultados de la simulación explican cómo surgen las extrasístoles a partir de microrreentradas que se mantienen por la estructura heterogénea de las regiones de infarto.
Las terapias de resincronización cardiaca, también denominadas de estimulación biventricular, son el tratamiento más ampliamente utilizado para este tipo de disfunción cardiaca. Un modelo integrado fluido-electro-mecánico del corazón, que incluye la dinámica de la sangre en el interior de las cavidades cardiacas, ha pasado a ser una herramienta de simulación predictiva de inestimable valor para analizar la terapia de resincronización cardiaca en diferentes etapas, para las empresas de tecnología médica en la mejora del diseño de dichos dispositivos y para médicos en la mejora de un tratamiento adaptado al paciente concreto.
El modelo computacional cardiaco aplicado dentro del código Alya7–9 comprende los principales mecanismos de la función del músculo cardiaco, incluida la electrofisiología, la mecánica del músculo cardiaco y del flujo de sangre, el acoplamiento de excitación-contracción y la retroalimentación mecanicoeléctrica para el estudio del músculo cardiaco de una forma holística. Gracias a este modelo, es posible simular la terapia de resincronización cardiaca aplicada con un marcapasos tradicional (figura 3, arriba) y un marcapasos intraventricular percutáneo (figura 3, abajo). Concretamente, en el segundo caso, se analiza la mecánica de fluidos en el interior de los ventrículos mediante los vórtices generados por el marcapasos.
Estimulación intraventricular percutánea. Arriba: evolución de las tensiones en la pared cardiaca durante la estimulación del ritmo cardiaco; el color del tejido se basa en la tensión de VonMises. Abajo: evolución de la mecánica de la sangre en el interior de los ventrículos; el color del tejido se basa en la propagación de la actividad eléctrica. La mecánica de fluidos se analiza mediante los vórtices producidos.
Otra aplicación en la que los modelos numéricos han sido muy útiles para mejorar la tecnología es el diseño de marcapasos y desfibriladores43. Los estudios numéricos más recientes han mostrado que la orientación de las fibras y la cinética de la membrana (electroporación) son cruciales para determinar los resultados de la desfibrilación44. No se ha alcanzado aún el objetivo último de un dispositivo eléctrico personal optimizado que preste apoyo al corazón cuando este falla. A pesar de las mejoras que se han realizado en este sentido, todavía hay que impulsar más los modelos computacionales para alcanzar este objetivo. Las principales perspectivas que han revelado los modelos computacionales son que la geometría realista del corazón y el remodelado de la enfermedad son importantes43.
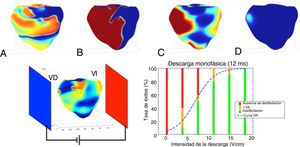
Se realizaron y analizaron simulaciones numéricas 3D realistas del problema de la desfibrilación en una geometría ventricular. Con el aumento de la intensidad de la descarga, la tasa de éxitos de la desfibrilación aumenta y sigue una curva logística clásica (curva de dosis-respuesta), tal como se muestra en la figura 4. Los datos de simulación concuerdan bien con los datos clínicos. En estudios posteriores se utilizaron simulaciones numéricas para facilitar el diseño de la forma de onda ideal45 y de la colocación de los electrodos46. Continúa siendo necesaria mucha más investigación para identificar la estrategia óptima para la desfibrilación.
Arriba: 4 instantáneas consecutivas obtenidas durante una descarga de desfibrilación de 12ms con resultado satisfactorio. A: actividad eléctrica antes de la descarga. B: actividad polarizada intensa durante la descarga. C: actividad 50ms después del final de la descarga. D: ausencia de actividad 100ms después del final de la descarga. Abajo: disposición y gráfico que muestra el porcentaje de éxitos de la desfibrilación en función de la intensidad de la descarga eléctrica según lo obtenido mediante 50 simulaciones numéricas. La curva logística (curva dosis-respuesta [DR]) corresponde al mejor ajuste de los datos. VD: ventrículo derecho; VI: ventrículo izquierdo.
La hemodinámica cardiaca puede contribuir también a un mejor conocimiento de los patrones del flujo de sangre en cámaras cardiacas complejas, como la aurícula izquierda, y a optimizar dispositivos médicos como los de cierre de la orejuela izquierda. En los pacientes con contraindicaciones para los anticoagulantes orales, se implantan dispositivos de cierre de la orejuela para impedir la entrada de flujo de sangre en la orejuela de la aurícula izquierda, que es donde se forma el 99% de los trombos asociados con FA. Un implante deficiente del dispositivo de cierre de la orejuela puede generar trombos fuera del dispositivo. Se creó una plataforma virtual 3D interactiva del implante a través de internet47, denominada VIDAA, para la elección de las configuraciones de cierre de la orejuela más apropiadas para cada morfología de la orejuela de la aurícula izquierda de cada paciente, que predijo la región de formación del trombo peridispositivo en algunos casos48. En relación con la hemodinámica cardiovascular, la Food and Drug Administration de Estados Unidos ha autorizado una nueva herramienta, denominada HeartFlow FFRCT Analysis, para evaluar la reserva fraccional de flujo. El programa informático HeartFlow's FFRCT fue uno de los primeros códigos de DFC que se utilizó en la práctica clínica ordinaria, y abrió el camino a los códigos computacionales avanzados, como el CaaS 3D-QCA vFFR (Pie Medical Imaging, Países Bajos). El proceso de trabajo del 3D-QCA vFFR crea una reconstrucción 3D de la arteria coronaria mediante la combinación de proyecciones angiográficas ortogonales y evalúa la disminución de la presión, que proporciona un valor de reserva fraccional de flujo virtual utilizando un código de DFC27.
DISCUSIÓNLos progresos tecnológicos de los últimos años, como las infraestructuras computacionales avanzadas, los programas informáticos de código abierto y las bases de datos médicas de libre acceso, han llevado a elaborar modelos biofísicos más próximos a la traslación al ámbito clínico. Actualmente se están utilizando en el contexto académico y en la industria para un mejor conocimiento de la fisiología y para la optimización de los dispositivos y tratamientos médicos. Sin embargo, las herramientas basadas en la modelización rara vez se emplean en otras decisiones clínicas, como el diagnóstico y las recomendaciones de tratamiento.
Varios motivos explican que no haya un uso más establecido de los modelos biofísicos en la práctica clínica ordinaria. El amplio proceso de validación clínica necesario exige una robustez y unos tiempos que no son fáciles de cumplir. Aunque varios estudios de investigación clínica basados en modelos biofísicos han mostrado ya su potencial, continúa siendo necesario demostrar su valor añadido en ensayos clínicos aleatorizados. Aunque resulte difícil, la formación de equipos multidisciplinarios que definan conjuntamente proyectos desde el principio es esencial para acercar los modelos biofísicos a la práctica clínica ordinaria. Los modelos biofísicos requieren de los clínicos un conocimiento previo para obtener simulaciones realistas que imiten el comportamiento complejo del corazón. Además, las herramientas computacionales suelen requerir muchos datos, pero no todos los tipos de datos clínicos resultan útiles: deben ser datos apropiados para la pregunta que se pretende responder con el diseño del modelo y, de ser posible, obtenidos de manera prospectiva. Por otra parte, los datos deben haber sido depurados y anotados de forma completa, lo cual es a menudo un proceso tedioso y laborioso. Es necesario que los ingenieros biomédicos estén incluidos en las unidades clínicas con una infraestructura de tecnologías de la información moderna, para proporcionar las capacidades y herramientas tecnológicas necesarias para llevar a cabo tareas relativas a los datos, como la armonización, la anonimización y la estandarización. Además, las bases de datos amplias, con un equilibrio apropiado entre controles y casos patológicos con eventos, requieren estudios multicéntricos, con centros clínicos que adopten la filosofía de puesta en común de los datos y cumplan siempre las leyes de protección de datos. Por último, es necesario un esfuerzo de aplicación para pasar del desarrollo de las herramientas en un entorno académico a un uso regular en el proceso de trabajo clínico, con la creación de interfaces de visualización de fácil acceso para los clínicos y específicos de la aplicación, para la búsqueda, integración y exploración de datos multimodales específicos de los pacientes, estadísticas de base poblacional, resultados de simulaciones y conocimientos clínicos. Están en desarrollo entornos de programas informáticos, como el ecosistema Rocket49, para abordar estos retos.
Las herramientas computacionales tienen un futuro brillante en cardiología; estamos al comienzo de un cambio de paradigma en la medicina, en el que los modelos biofísicos avanzados desempeñarán un papel importante en la cardiología. En los próximos años, los modelos biofísicos mejorarán significativamente gracias a la fuerte implicación de los clínicos en su diseño y desarrollo, definiendo las preguntas de mayor interés por responder e incorporando datos de gran calidad, específicos del paciente, para validar el valor añadido de las simulaciones. Los clínicos no deben tener miedo de las herramientas computacionales, sino que deben adoptarlas; los modelos biofísicos y los algoritmos de inteligencia artificial no reemplazarán a los clínicos, sino que los apoyarán y les permitirán centrarse en tareas de mayor interés humano, como el razonamiento y la comunicación médico-paciente.
En España, hay equipos de investigación excelentes con expertos mundiales en sus respectivos campos médicos y de ingeniería. La iniciativa VHeart-SN ha facilitado la integración de los grupos de investigación nacionales que trabajan en la modelización cardiaca, con un espíritu de puesta en común de los conocimientos y los recursos. El siguiente paso debe ser integrar plenamente a los equipos médicos en la iniciativa y formar unidades multidisciplinarias para facilitar la traslación clínica de las herramientas computacionales con objeto de mejorar la toma de decisiones clínicas para nuestros pacientes y fomentar la innovación a través de la conexión con las grandes empresas de asistencia sanitaria y la creación de nuevas empresas innovadoras.
FINANCIACIÓNEste trabajo fue financiado en parte por: Acciones de Dinamización Redes de Excelencia 2016, Plan Estatal de Investigación Científica y Técnica y de Innovación, Ministerio de Economía y Competitividad (DPI2016-81873-REDT) y CompBioMed2, acuerdo de subvención ID: 823712. Los autores agradecen también el apoyo del Consejo de Investigación Europeo (ERC-StG 638284) y del Gobierno de España a través de los siguientes programas: Retos I+D (TIN2014-59932-JIN, RTI2018-093416-B-I00, SAF2017-88019-C3-3R, RTI2018-101193-B-I00, DPI2016-75799-R y PID2019-105674RB-I00); María de Maeztu (MDM-2015-0502), y Severo Ochoa (SEV-2017-0718 y CEX2018-000797-S).
CONFLICTO DE INTERESESLos autores no tienen nada que declarar.


![Representación esquemática de los productos en desarrollo para la creación de un modelo computacional tridimensional (3D) del corazón. En este diagrama de flujo se muestran las principales fases del proceso de elaboración de un modelo cardiaco 3D destinado a la simulación biofísica: generación de la geometría cardiaca 3D y generación de la malla (meshing) (a partir de la resonancia magnética [RM] o la tomografía computarizada [TC]), generación del sistema de conducción cardiaco (SCC), generación de la estructura miocárdica, modelización biofísica (electrofisiología [EF] cardiaca y electromecánica) y finalmente simulación multifísica y multiescala. Los modelos pueden personalizarse mediante el electrocardiograma (ECG) o los mapas de potenciales de superficie corporal (BSPM) del paciente. Las flechas indican el avance desde los datos clínicos/biológicos (ex vivo e in vivo) hacia el modelo computacional final y la simulación electromecánica. Los recuadros azules indican métodos que permiten obtener una personalización de las propiedades específicas del modelo para un paciente concreto, mientras que los recuadros grises corresponden a descripciones de base poblacional o genéricas de otras propiedades. iECG: técnicas de imagen electrocardiográficas. Representación esquemática de los productos en desarrollo para la creación de un modelo computacional tridimensional (3D) del corazón. En este diagrama de flujo se muestran las principales fases del proceso de elaboración de un modelo cardiaco 3D destinado a la simulación biofísica: generación de la geometría cardiaca 3D y generación de la malla (meshing) (a partir de la resonancia magnética [RM] o la tomografía computarizada [TC]), generación del sistema de conducción cardiaco (SCC), generación de la estructura miocárdica, modelización biofísica (electrofisiología [EF] cardiaca y electromecánica) y finalmente simulación multifísica y multiescala. Los modelos pueden personalizarse mediante el electrocardiograma (ECG) o los mapas de potenciales de superficie corporal (BSPM) del paciente. Las flechas indican el avance desde los datos clínicos/biológicos (ex vivo e in vivo) hacia el modelo computacional final y la simulación electromecánica. Los recuadros azules indican métodos que permiten obtener una personalización de las propiedades específicas del modelo para un paciente concreto, mientras que los recuadros grises corresponden a descripciones de base poblacional o genéricas de otras propiedades. iECG: técnicas de imagen electrocardiográficas.](https://static.elsevier.es/multimedia/03008932/0000007400000001/v1_202012210608/S0300893220303535/v1_202012210608/es/main.assets/thumbnail/gr1.jpeg?xkr=eyJpdiI6ImZuSzM5REY1dXZEUXcydWJkZWdQRGc9PSIsInZhbHVlIjoiZEp5QSs1MkJwQnpmSnkrc05pYzFja2U3TXR2MEEyaWZ5akFQbUlITUxsVT0iLCJtYWMiOiJkNDc0NjZjOWQyM2Q5MzAwZTMxZWE2ODY1ZmM4YzdmMGUwYzA4YzFlNDA4ZTk5ZDIwZTJlNmFiMDczOWJjN2Q2IiwidGFnIjoiIn0=)


![Arriba: 4 instantáneas consecutivas obtenidas durante una descarga de desfibrilación de 12ms con resultado satisfactorio. A: actividad eléctrica antes de la descarga. B: actividad polarizada intensa durante la descarga. C: actividad 50ms después del final de la descarga. D: ausencia de actividad 100ms después del final de la descarga. Abajo: disposición y gráfico que muestra el porcentaje de éxitos de la desfibrilación en función de la intensidad de la descarga eléctrica según lo obtenido mediante 50 simulaciones numéricas. La curva logística (curva dosis-respuesta [DR]) corresponde al mejor ajuste de los datos. VD: ventrículo derecho; VI: ventrículo izquierdo. Arriba: 4 instantáneas consecutivas obtenidas durante una descarga de desfibrilación de 12ms con resultado satisfactorio. A: actividad eléctrica antes de la descarga. B: actividad polarizada intensa durante la descarga. C: actividad 50ms después del final de la descarga. D: ausencia de actividad 100ms después del final de la descarga. Abajo: disposición y gráfico que muestra el porcentaje de éxitos de la desfibrilación en función de la intensidad de la descarga eléctrica según lo obtenido mediante 50 simulaciones numéricas. La curva logística (curva dosis-respuesta [DR]) corresponde al mejor ajuste de los datos. VD: ventrículo derecho; VI: ventrículo izquierdo.](https://static.elsevier.es/multimedia/03008932/0000007400000001/v1_202012210608/S0300893220303535/v1_202012210608/es/main.assets/thumbnail/gr4.jpeg?xkr=eyJpdiI6ImFkTXhBQUt0ZkcxbXNkTUYyekltWUE9PSIsInZhbHVlIjoiN3Q0dlUwcUNOY0xJdC92bXhWM1cxVW5sNU5kdEVCZWtKRVZsREtaUXo4bz0iLCJtYWMiOiIyNDUzMjZjZGEzMjY5OWJhOTA0NjFkYjdjOWQ2Nzg1YzNiMjZhMTUwMGQ2N2ZhODMyNmM3MThmOTFiZTUxNWViIiwidGFnIjoiIn0=)