El miocardio no compactado es una entidad mal definida y en controversia, con una amplia expresividad fenotípica: desde un simple rasgo anatómico hasta una enfermedad con grave afección cardiaca. Los criterios diagnósticos actuales se basan únicamente en hallazgos morfológicos de hipertrabeculación y tienen una baja especificidad para identificar casos de miocardiopatía. El tratamiento del miocardio no compactado también es heterogéneo y no existen guías de práctica clínica específicas. La insuficiencia cardiaca, las arritmias ventriculares y las embolias sistémicas son las complicaciones cardiovasculares más frecuentes. En esta revisión, se tratan las limitaciones diagnósticas de los diferentes criterios disponibles y se propone una aproximación holística alternativa (que incluye variables funcionales por imagen, de caracterización tisular genética y estudio familiar) que puede ayudar en el diagnóstico diferencial de casos con hipertrabeculación. Se describe la genética de esta entidad y el solapamiento con otras miocardiopatías. Por último, se centra en aspectos debatidos del tratamiento clínico y se propone utilizar las mismas variables ya comentadas para la estratificación pronóstica e individualizar el seguimiento de los pacientes.
Palabras clave
El miocardio no compactado (MCNC) es una entidad heterogénea que se caracteriza por hipertrabeculación, nichos intertrabeculares profundos y una fina capa de miocardio compactado1. Aunque se describió por primera vez hace más de 30 años2, el MCNC sigue siendo un trastorno poco definido y mal entendido, considerado una miocardiopatía hereditaria sin clasificar por la Sociedad Europea de Cardiología3, y una miocardiopatía genética por la American Heart Association4.
Se han propuesto varios parámetros de diagnóstico por la imagen, pero no existen criterios estandarizados. Los distintos criterios son contradictorios y solo se fijan en rasgos morfológicos, lo que ha dado como resultado un sobrediagnóstico del MCNC5. Además, esta heterogeneidad ha llevado a resultados de MCNC muy variables observados en la literatura médica. En definitiva, no hay ninguna guía clínica o plan asistencial para una entidad tan controvertida, lo que hace del tratamiento clínico un reto enorme.
En esta revisión, se centra la atención en los diversos criterios diagnósticos disponibles y en la complejidad de llegar a un diagnóstico correcto. Además, se analizan las dificultades y controversias del tratamiento clínico específico.
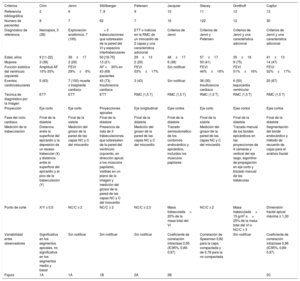
CRITERIOS DIAGNÓSTICOS Y DIAGNÓSTICO DIFERENCIALDefinición de la entidadEl diagnóstico de MCNC actualmente se basa en técnicas de diagnóstico por la imagen cardiaca, tanto con ecocardiografía transtorácica (ETT) como con resonancia magnética cardiovascular (RMC). Se han propuesto distintos criterios diagnósticos, que dan prioridad a los rasgos morfológicos para comparar las capas de miocardio compactado y no compactado, sin tener en cuenta parámetros funcionales. Estos criterios son contradictorios, no estandarizados y se basan en series reducidas de pacientes, lo que hace muy heterogéneo el diagnóstico de MCNC (tabla 1).
Resumen de los distintos criterios diagnósticos del miocardio no compactado
| Criterios | Chin | Jenni | Stöllberger | Petersen | Jacquier | Stacey | Grotthoff | Captur |
|---|---|---|---|---|---|---|---|---|
| Referencia bibliográfica | 2 | 6 | 7, 8 | 9 | 10 | 11 | 12 | 13 |
| Número de pacientes | 8 | 7 | 62 | 7 | 16 | 122 | 12 | 30 |
| Diagnóstico de referencia | Necropsia, 3 (38) | Exploración anatómica, 7 (100) | > 3 trabeculaciones que sobresalen de la pared del VI y espacios intertrabeculares | ETT o indicios en la RMC de un miocardio de 2 capas y una característica adicional | Criterios de Jenni | Criterios de Jenni y Petersen | Criterios de Jenni y una característica adicional | Criterios de Jenni y una característica adicional |
| Edad, años | 9 [11-22] | 39±17 | 50 [18-75] | 29±13 | 48±17 | 57±17 | 35±18 | 41±13 |
| Mujeres | 3 (38) | 2 (29) | 13 (21) | 2 (29) | 6 (38) | 50 (41) | 9 (75) | 14 (47) |
| Función sistólica del ventrículo izquierdo | Amplitud AF 10%-33% | FEVI 29%±6% | AF <30% en 43 (69) pacientes | FEVI 53%±17% | Sin notificar | FEVI 44%±16% | FEVI 51%±16% | FEVI 52%±17% |
| Eventos cardiovasculares | 5 (63) | 7 (100) muerte o trasplante cardiaco | 45 (73) Insuficiencia cardiaca | 3 (43) | Sin notificar | 36 (30) Insuficiencia cardiaca | 6 (50) taquicardia ventricular | 20 (67) |
| Técnica de diagnóstico por la imagen | ETT | ETT | ETT | RMC (1,5 T) | RMC (1,5 T) | RMC (1,5 T) | RMC (1,5 T) | RMC (1,5 T) |
| Proyección | Eje corto | Eje corto | Proyecciones apicales | Eje longitudinal | Ejes cortos | Eje corto | Ejes cortos | Ejes cortos |
| Fase del ciclo cardiaco | Final de la diástole | Final de la sístole | Final de la diástole | Final de la diástole | Final de la diástole | Final de la sístole | Final de la diástole | Final de la diástole |
| Medición de la trabeculación | Distancia entre la superficie del epicardio y la depresión de un receso trabecular (X) y distancia entre la superficie del epicardio y el pico de la trabeculación (Y) | Medición del grosor de la pared de las capas NC y C del miocardio | Presencia de más de 3 trabeculaciones que sobresalen de la pared del ventrículo izquierdo, en dirección apical a los músculos papilares, visibles en un plano de la imagen y medición del grosor de la pared de las capas NC y C del miocardio | Medición del grosor de la pared de las capas NC y C del miocardio | Trazado semiautomático de los contornos endocárdico y epicárdico, incluidos los músculos papilares | Medición del grosor de la pared de las capas NC y C del miocardio | Trazado manual de los bordes epicárdicos en las proyecciones de 4 cámaras y vertical del eje largo, algoritmo de propagación en eje corto y trazado manual de las trabéculas | Segmentación del borde endocárdico y método de recuento de cajas para el análisis fractal |
| Punto de corte | X/Y ≤ 0,5 | NC/C ≥ 2 | NC/C ≥ 2 | NC/C ≥ 2,3 | Masa trabeculada> 20% de la masa total del VI | NC/C ≥ 2 | Masa trabeculada> 15 g/m2 o> 25% de la masa total del VI o NC/C ≥ 3 | Dimensión fractal apical máxima ≥ 1,30 |
| Variabilidad entre observadores | Significativa en los segmentos apicales, no significativa en los segmentos medio y basal | Sin notificar | Sin notificar | Sin notificar | Coeficiente de correlación intraclase 0,95 (IC95%, 0,89-0,97) | Correlación de Spearman 0,82 para la capa compactada y de 0,78 para la no compactada | Sin notificar | Coeficiente de correlación intraclase 0,96 (IC95%, 0,89-0,97) |
| Figura | 1A | 1A | 1B | 2A | 2B | 2C |
IC95%: intervalo de confianza del 95%; AF: acortamiento fraccional; C: compactada; ETT: ecocardiografía transtorácica; FEVI: fracción de eyección del ventrículo izquierdo; NC: no compactada; RMC: resonancia magnética cardiovascular.
A no ser que se indique lo contrario, los datos expresan n (%), media±desviación estándar o n; mediana [intervalo intercuartílico].
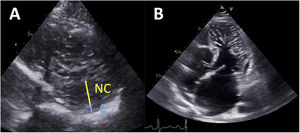
Chin et al.2 comunicaron por primera vez los criterios diagnósticos de la ETT en el MCNC a partir de una serie de 8 pacientes. Estos autores propusieron medir la distancia desde la superficie del epicardio hasta el seno de las trabéculas (X), y la distancia desde la superficie del epicardio hasta la cumbre de las trabéculas (Y) en proyecciones del eje corto. Los autores establecieron que un cociente X/Y ≤ 0,5 al final de la diástole era indicativo de MCNC (figura 1A). Posteriormente, Jenni et al.2 publicaron una serie de 34 pacientes y sugirieron medir la capa de epicardio compactado (C) y la capa de epicardio no compactado (NC). Se consideró que un cociente NC/C ≥ 2 medido en proyecciones del eje corto al final de la sístole era indicativo de MCNC6 (figura 1A). Stöllberger et al.2 comunicaron el tercer criterio apropiado en una serie de 62 pacientes. Según sus observaciones, la presencia en un plano apical de más de 3 trabéculas sobresaliendo de la pared del VI (en posición apical desde la inserción de los músculos papilares) se consideró indicativa de MCNC7 (figura 1B). Más tarde se actualizó este criterio para que también incluyera un cociente de NC/C ≥ 2 determinado en proyecciones del eje corto al final de la diástole8. De todos los criterios propuestos, el de Jenni se ha convertido en el más utilizado en la práctica clínica con ETT.
Criterios diagnósticos del miocardio no compactado con ecocardiografía transtorácica. A: medición del grosor de la pared de las capas de miocardio compactado (C) y no compactado (NC) en una proyección del eje corto, al final de la diástole (criterios de Chin) o de la sístole (criterios de Jenni). B: proyección apical de 4 cámaras en la que se observan trabéculas numerosas y prominentes que sobresalen apicalmente del ventrículo izquierdo desde los músculos papilares (criterios de Stöllberger).
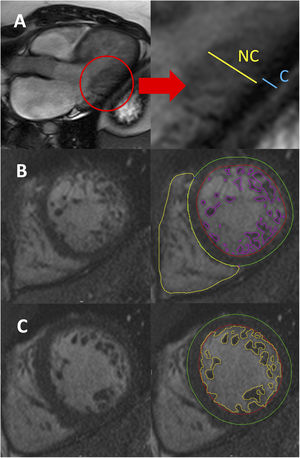
En el caso de la RMC, se han descrito como mínimo 5 criterios diagnósticos distintos, aunque habitualmente solo se utilizan 2 (Petersen y Jacquier) en la práctica clínica. Petersen et al.9 comunicaron por primera vez criterios diagnósticos derivados de la RMC a partir de una serie de 7 pacientes con hipertrabeculación en la ETT o la RMC. Los autores comunicaron que un cociente entre las capas NC/C> 2,3 medido en proyecciones del eje largo al final de la diástole era indicativo de MCNC (figura 2A). Más tarde, Jacquier et al. publicaron otros criterios basados en una serie de 16 pacientes que cumplían los criterios de la ETT de Jenni. Según sus observaciones, una masa trabeculada> 20% de la masa total del VI demostraba una excelente precisión diagnóstica para el MCNC10 (figura 2B). Los criterios de Jacquier et al. parecen más sólidos que los de Petersen si se tiene en cuenta que se determina la hipertrabeculación total del miocardio y no solo el cociente de hipertrabeculación en una región específica. Aunque los criterios de Jacquier tienen una reproducibilidad excelente entre observadores, su evaluación requiere mucho tiempo. Así pues, los criterios de Petersen se han convertido en los más utilizados en la práctica clínica habitual. De hecho, por su mayor resolución espacial y mejor caracterización tisular, comparado con la ETT, para confirmar el diagnóstico de MCNC se recomienda siempre una RMC.
Criterios diagnósticos del miocardio no compactado con resonancia magnética cardiovascular. A: medición del grosor de la pared de las capas de miocardio compactado (C) y no compactado (NC) en una proyección del eje longitudinal al final de la diástole (criterios de Petersen). B: borde endocárdico (rojo) y epicárdico (verde), incluido el contorno semiautomático de las trabéculas (morado) para cuantificar la masa trabeculada, en una proyección del eje corto (criterios de Jacquier). C: contorno endocárdico (rojo) y epicárdico (verde), incluido el contorno semiautomático de las trabéculas (amarillo) para el análisis fractal, en una proyección del eje corto (criterios de Captur).
Se han descrito algunos otros enfoques diagnósticos de la RMC. Stacey et al.11 propusieron medir el cociente NC/C en secuencias de cine de RMC del eje corto al final de la sístole. A partir de una serie de 122 pacientes, especificaron que un cociente ≥ 2 era indicativo de MCNC. Grothoff et al.12 publicaron una serie reducida de 12 pacientes con MCNC y concluyeron que un valor discriminatorio de 15 gramos de masa trabeculada/m2 demostraba una excelente precisión diagnóstica del MCNC. Por último, Captur et al.13 publicaron una serie de 30 pacientes y explicaron un nuevo método diagnóstico basado en el análisis fractal, una herramienta semiautomática que cuantifica el grado de hipertrabeculación. La dimensión fractal, un marcador de la complejidad geométrica, se obtiene después de delimitar el endocardio del VI al final de la diástole, y una dimensión fractal apical máxima ≥ 1,30 es diagnóstica de MCNC (figura 2C). El análisis fractal tiene una reproducibilidad excelente entre observadores y en un mismo observador, aunque su uso no está muy extendido por la disponibilidad limitada del software necesario para su evaluación.
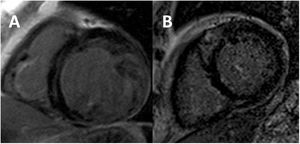
Limitaciones de la definición actualComo se ha comentado anteriormente, ninguno de estos criterios incluye parámetros funcionales del VI tales como el tamaño, la función sistólica (fracción de eyección del ventrículo izquierdo [FEVI]), o la presencia de realce tardío de gadolinio (RTG) (figura 3). El resultado de ello ha sido probablemente un sobrediagnóstico de los casos de MCNC5, incluso en pacientes asintomáticos con enfermedad cardiovascular no establecida. En un estudio poblacional, el 15% cumplía por lo menos un criterio de MCNC14. También convendría destacar que la sola presencia de hipertrabeculación que cumple los criterios de MCNC no se ha relacionado con la remodelación del VI15 ni con los eventos16,17. En un subestudio del registro MESA se analizó a 2.742 pacientes con una RMC inicial y un seguimiento a 9,5 años. Se dividió a los pacientes en quintiles de hipertrabeculación siguiendo la evaluación de Petersen9 y no se observaron diferencias entre los grupos en cuanto a cambios en el volumen del VI o la FEVI15. Cuando se tuvieron en cuenta los criterios de valoración clínicos, según un estudio de 700 pacientes remitidos a RMC, el cumplimiento de cualquiera de los 4 criterios de la RMC mencionados antes no se relacionó con complicaciones cardiacas graves (MACE) a los 7 años de seguimiento16. Se observaron resultados parecidos en un metanálisis a gran escala de 574 pacientes con MCNC: los criterios diagnósticos de por sí no tuvieron valor pronóstico más allá de la FEVI o la presencia de RTG17. Además, la hipertrabeculación en la miocardiopatía dilatada (MCD) no isquémica no se ha relacionado con un peor resultado18.
Imágenes de resonancia magnética cardiovascular potenciadas en T1 en las que se observan distintos patrones de realce tardío de gadolinio en el miocardio no compactado. A: captación lineal intramiocárdica del tabique basal. B: captación focal intramiocárdica del tabique anteroseptal.
Por otro lado, se han notificado casos de hipertrabeculación adquirida y reversible. En particular, se ha observado un predominio alto en atletas: entre el 8% y el 10% de los atletas con un nivel de entrenamiento alto cumplen criterios de MCNC19,20. De hecho, en un estudio poblacional a gran escala se demostró que la actividad física enérgica se relacionaba de manera progresiva con hipertrabeculación: en los sujetos que hacían más actividad era mayor la proporción de criterios de MCNC, independientemente del volumen del VI21. Además, en otro estudio se observó que el embarazo se relacionaba a menudo con hipertrabeculación: el 8% de las mujeres presentó MCNC durante el embarazo, que en su mayoría desapareció tras el parto22. Asimismo, se observó que una gran proporción de pacientes con anemia drepanocítica presentaban hipertrabeculación, y por lo menos el 8% cumplía criterios de MCNC23. Estas observaciones indican que algunos cambios en las condiciones de carga podrían llevar a remodelación fisiológica con marcada hipertrabeculación del VI sin implicaciones pronósticas.
Al contrario, en otros estudios se han observado resultados discordantes y se ha indicado que la hipertrabeculación podría no considerarse un hallazgo benigno, lo que refuerza el hecho de que el MCNC es una entidad muy heterogénea. En un estudio poblacional a gran escala de 10.097 pacientes a los que se hizo una tomografía computarizada cardiaca, los pacientes con hipertrabeculación corrían un mayor riesgo de MACE a los 4,0 años de seguimiento, y el grado de hipertrabeculación (medido como la masa trabeculada del VI indexada) se relacionó de forma independiente con los eventos24. Asimismo, en otro estudio de 339 pacientes con MCNC a los que se hizo un seguimiento de hasta 6,3 años se observó que la hipertrabeculación del VI (definida por los criterios de Petersen) que se extendía desde la punta del corazón hasta los segmentos mediobasales se relacionaba de manera independiente con la mortalidad por cualquier causa25. Además, en una serie de 328 pacientes con MCNC a los que se hizo un seguimiento de hasta 3,1 años, los autores observaron que la presencia de adelgazamiento miocárdico (definido como un adelgazamiento abrupto del miocardio compactado superior al 50% o más respecto a un segmento miocárdico contiguo) se relacionaba de forma independiente con un mayor riesgo de MACE26.
Se sabe poco de la afectación del ventrículo derecho (VD) en el MCNC. El VD es una cavidad cardiaca que de manera natural presenta mayor hipertrabeculación que el VI y, por tanto, la aplicación de los mismos criterios del VI podría llevar a un solapamiento considerable con la población sana. No se han publicado ni validado valores umbral específicos, y cuantificar con ETT las trabéculas del VD es técnicamente complicado. Se han propuesto varias mediciones en la RMC de la hipertrabeculación del VD, incluida el área trabeculada y el volumen del VD al final de la diástole, así como los cocientes NC/C del VD en las proyecciones del eje corto y de las 4 cavidades cardiacas27. No obstante, se ha observado un notable solapamiento con los controles y, sin implicaciones pronósticas, se recomienda prudencia a la hora de analizar estas variables.
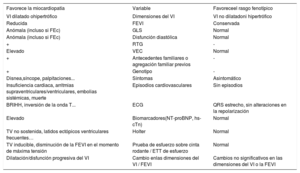
Un paso más: el enfoque holísticoTodos estos datos contradictorios han incitado a algunos autores a preguntarse si el MCNC es una miocardiopatía real o un simple rasgo morfológico28,29. En consecuencia, se han propuesto algunos algoritmos que combinan la FEVI, la presencia de RTG, los datos electrocardiográficos, los antecedentes familiares, o las pruebas genéticas para diferenciar la hipertrabeculación fisiológica (un rasgo fenotípico) de las formas patológicas30–32 (tabla 2). Según un estudio multicéntrico reciente y a gran escala, en el que se propuso un algoritmo progresivo para identificar a los pacientes con MCNC de bajo riesgo: los casos sin alteraciones en el electrocardiograma, con FEVI conservada, sin RTG y sin antecedentes familiares no presentaron MACE tras 5 años de seguimiento. Esto indica que aquellos casos podrían corresponder a una hipertrabeculación fisiológica o “benigna” y no a una miocardiopatía. No obstante, en los pacientes con cualquiera de las alteraciones antes mencionadas se observaba un riesgo aumentado de sufrir episodios cardiovasculares, lo que confirma la naturaleza patológica de dicha hipertrabeculación33.
Diagnóstico diferencial de pacientes con características morfológicas de hipertrabeculación
| Favorece la miocardiopatía | Variable | Favoreceel rasgo fenotípico |
|---|---|---|
| VI dilatado ohipertrófico | Dimensiones del VI | VI no dilatadoni hipertrófico |
| Reducida | FEVI | Conservada |
| Anómala (incluso si FEc) | GLS | Normal |
| Anómala (incluso si FEc) | Disfunción diastólica | Normal |
| + | RTG | - |
| Elevado | VEC | Normal |
| + | Antecedentes familiares o agregación familiar previos | - |
| + | Genotipo | - |
| Disnea,síncope, palpitaciones... | Síntomas | Asintomático |
| Insuficiencia cardiaca, arritmias supraventriculares/ventriculares, embolias sistémicas, muerte | Episodios cardiovasculares | Sin episodios |
| BRIHH, inversión de la onda T... | ECG | QRS estrecho, sin alteraciones en la repolarización |
| Elevado | Biomarcadores(NT-proBNP, hs-cTn) | Normal |
| TV no sostenida, latidos ectópicos ventriculares frecuentes… | Holter | Normal |
| TV inducible, disminución de la FEVI en el momento de máxima tensión | Prueba de esfuerzo sobre cinta rodante / ETT de esfuerzo | Normal |
| Dilatación/disfunción progresiva del VI | Cambio enlas dimensiones del VI / FEVI | Cambios no significativos en las dimensiones del VI o la FEVI |
BRIHH: bloqueo de la rama izquierda del haz de His; ECG: electrocardiograma; ETT: ecocardiografía transtorácica; FEc: fracción de eyección conservada; FEVI: fracción de eyección del ventrículo izquierdo; GLS: Deformación (strain) longitudinal global; hs-cTn: troponina cardiaca de alta sensibilidad; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral (tipo B); RTG: realce tardío de gadolinio; TV: taquicardia ventricular; VEC: volumen extracelular; VI: ventrículo izquierdo.
Además, se han propuesto otros parámetros de diagnóstico por la imagen, tales como las variables de deformación y mapeo, aunque solo se han probado en series reducidas de casos y no se recomiendan en la práctica clínica habitual. La deformación miocárdica (strain), la rotación y la torsión del VI en la ETT están alteradas en el MCNC, incluso con una FEVI conservada, y son considerablemente inferiores comparado con los controles34. Se han descrito resultados parecidos con la RMC con una buena correlación con el grado de hipertrabeculación y con un valor diagnóstico creciente35,36. Además, los T1 nativos y el volumen extracelular son mayores en los pacientes con MCNC comparado con los controles, incluso en ausencia de RTG37.
Las pruebas genéticas son también muy útiles en el diagnóstico de las formas patológicas del MCNC. Aunque se ha informado de 189 genes relacionados con el MCNC, según una revisión reciente solo se constata relación considerable de 32 (tabla 3) con la entidad38. Las variantes genéticas suelen involucrar genes sarcoméricos (entre una tercera parte y la mitad de los casos, más a menudo MYH7, MYBPC3, ACTC1 y TTN), pero también pueden afectar a reguladores de los genes transcripcionales/traslacionales, mitocondriales y del citoesqueleto38,39, a canales iónicos40 y a las variaciones en el número de copias41. La mayor parte de las causas genéticas son mutaciones sin sentido (55%) y el patrón hereditario más frecuente es el autosómico dominante (83%), y los patrones que predominan menos son los ligados al cromosoma X y mitocondriales 39. Así pues, si hay sospecha clínica de MCNC, es razonable hacer pruebas genéticas para confirmar el diagnóstico, tal como se recomienda en un acuerdo de expertos con una recomendación de clase IIB42. La presencia de una variante genética patógena o probablemente patógena confirmará el diagnóstico, y evitará exámenes innecesarios en los familiares con genotipo negativo. No obstante, solo se describen variantes patógenas en aproximadamente el 30% o 40% de los casos33,43,44. Y lo que es más importante, algunos genotipos se han asociado al fenotipo y al pronóstico: en concreto, las variantes del MYBPC3 y el TTN, así como otros genes, se correlacionan con un mayor riesgo de MACE, mientras que las variantes del MYH7 y el ACTC1 tienen resultados más favorables39.
Lista de genes asociados al miocardio no compactado. En la tabla solo se muestran los genes con una relación definitiva o moderada con el miocardio no compactado según una revisión reciente38
| Función génica | Gen | Nombre del gen |
|---|---|---|
| Sarcómero | ACTC1 | Actina alfa 1 del músculo cardiaco |
| DES | Desmina | |
| LDB3 | Dominio de unión LIM 3 | |
| MYBPC3 | Proteína de unión a miosina C3 | |
| MYH7 | Gen de la cadena pesada de la betamiosina 7 | |
| PLN | Fosfolambán | |
| OBSCN | Obscurina | |
| RYR2 | Receptor de rianodina | |
| TNNT2 | Troponina T2, de tipo cardiaco | |
| TPM1 | Tropomiosina 1 | |
| TTN | Titina | |
| Citoesqueleto | DMD | Distrofina |
| DTNA | Alfa-distrobrevina | |
| LMNA | Lámina A/C | |
| Desmosoma | PKP2 | Placofilina 2 |
| Tráfico intracelular | LAMP2 | Proteína 2 de la membrana asociada a lisosomas |
| PLE-KHM2 | Dominios homólogos de Pleckstrina RUN que contiene M2 | |
| Canal iónico | HCN4 | Canal 4 glicado de nucleótidos cíclicos activado por hiperpolarización de potasio/sodio |
| SCN5A | Subunidad alfa 5 del canal de sodio dependiente de voltaje | |
| Mitocondria | NNT | NAD transhidrogenasa |
| TAZ | Tafazzina | |
| TMEM70 | Proteína transmembrana 70 | |
| Degradación de proteínas | MIB1 | E3 ubiquitina-proteína ligasa MIB1 |
| Transducción de señales | ALPK3 | Alfa cinasa 3 |
| DMPK | DM1 proteína cinasa | |
| Regulador transcripcional/traslacional | NKX2.5 | Proteína homebox NK2 5 |
| NONO | Proteína que une octámero que no contiene un dominio POU | |
| PRDM16 | Dominio PR que contiene 16 | |
| RBM20 | Proteína ligadora de ARN 20 | |
| TBX20 | Factor de transcripción TBX20 | |
| TBX5 | Factor de transcripción TBX5 |
ARN: ácido ribonucleico; DM1: distrofia miotónica 1; LIM: acrónimo de LIN-11, Isl-1 y MEC-3.
De todos modos, el MCNC comparte generalidades genéticas con otras miocardiopatías tales como la miocardiopatía dilatada (MCD) y la miocardiopatía hipertrófica (MCH), en las que también suelen intervenir genes sarcoméricos28,38,39. Esta observación explica el gran solapamiento entre todas estas miocardiopatías: algunos pacientes con MCD o MCH también cumplen los criterios diagnósticos del MCNC, mientras que los pacientes con MCNC confirmado también pueden manifestar características de la MCD o la MCH1, incluso con distintos fenotipos entre los familiares45. Algunos autores han propuesto la existencia de un continuo de expresión fenotípica entre el MCNC, la MCD y la MCH, y que ambos factores genéticos y desencadenantes no genéticos interactúan con el fenotipo final38,46. Sin embargo, no se han propuesto características claras para diferenciar estos fenotipos en la práctica clínica, por lo que a menudo se complica el diagnóstico basado solo en técnicas de imagen cardiaca. El MCNC también puede aparecer junto con enfermedades cardiacas congénitas o con trastornos neuromusculares28. Además, se han descrito casos aislados de MCNC sin características fenotípicas de otras miocardiopatías en mutaciones infantiles del gen TAZ (p. ej., síndrome de Barth)47 o en mutaciones del gen MIB1 que regula la vía NOTCH48. De hecho, las vías genéticas que se relacionan de manera exclusiva con el MCNC y no con la MCD o la MCH intervienen a menudo en el desarrollo y diferenciación de los cardiomiocitos, como en la vía NOTCH38. Esta observación respalda la hipótesis de que el MCNC puede ser consecuencia de una embriogénesis anómala.
En algunos estudios con técnicas de imagen cardiaca se han intentado definir marcadores que permitan diferenciar entre las distintas miocardiopatías. Un patrón de deformación característico en la ETT, con valores más altos en la base del VI comparado con el ápex (donde la hipertrabeculación es más pronunciada) podría diferenciar el MCNC de la MCD, cuyos valores de deformación son uniformemente reducidos49. La combinación de análisis fractal y deformación longitudinal global en la RMC permitió diferenciar de forma precisa entre los pacientes con MCNC y aquellos con MCD50. Recientemente, en un estudio basado en la radiómica (una técnica emergente de análisis de imágenes para un fenotipado más profundo en la RMC) se demostró que la inteligencia artificial permitía una excelente diferenciación de la MCD, la MCH y el MCNC de un modo automático y muy eficaz51.
Por último, se ha descrito agregación familiar en aproximadamente un 40% o 50% de los casos de MCNC33,43,45 y por lo tanto se recomienda el cribado familiar en todos los pacientes para confirmar el diagnóstico inicial e identificar a los familiares asintomáticos52. Según el acuerdo de expertos42, si se describe una variante genética causante de enfermedad en un paciente, debería hacerse una evaluación clínica y genética a los familiares de primer grado con una recomendación de clase I.
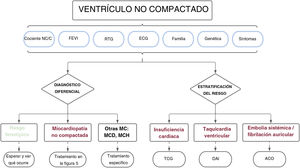
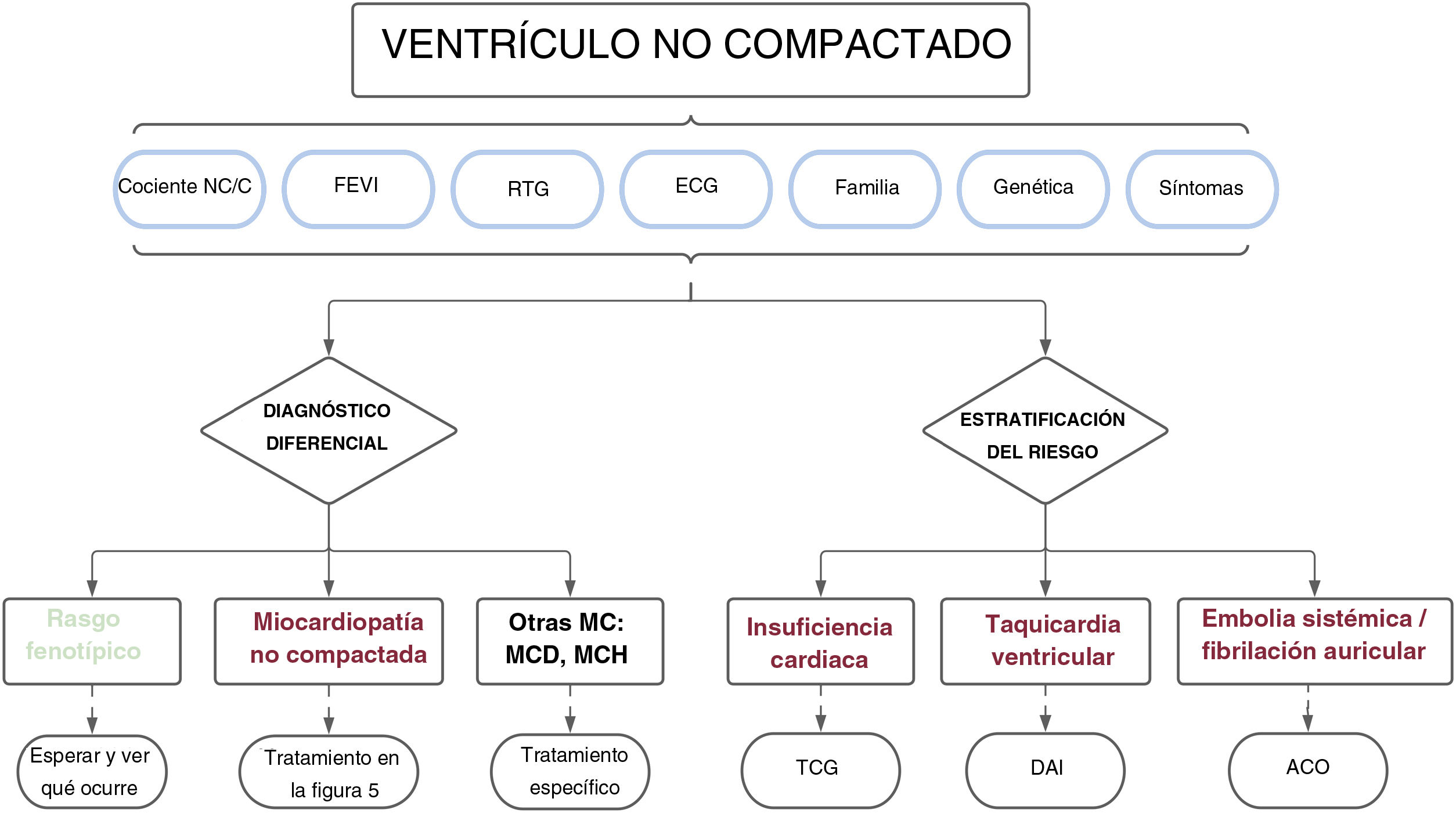
Por lo tanto, según las distintas series publicadas recogidas en esta revisión, la presencia de notable hipertrabeculación miocárdica no debería considerarse, a priori, un rasgo morfológico normal, sino que debería estudiarse de manera integral. Y aún más importante, el diagnóstico no debería basarse únicamente en criterios morfológicos de las imágenes, sino que también habría que considerar la situación clínica, el electrocardiograma, los antecedentes familiares, las pruebas genéticas, las variables funcionales de las imágenes y la presencia de fibrosis miocárdica, entre otros parámetros. Un enfoque holístico así permitirá diferenciar entre los casos de hipertrabeculación fisiológica y los de una miocardiopatía (tabla 2). Solo aquellos pacientes con criterios morfológicos que no muestren otros signos de alarma pueden considerarse una variante normal, mientras que a aquellos con características patológicas claras (alteraciones en el electrocardiograma, FEVI reducida, RTG o agregación familiar) se les debería diagnosticar de miocardiopatía no compactada. Este diagnóstico diferencial es clínicamente apropiado porque los sujetos con un simple rasgo fenotípico tienen resultados favorables y podrían no requerir un seguimiento periódico, lo que evitaría costos innecesarios y la carga psicológica de un diagnóstico incorrecto. Al contrario, los pacientes con una miocardiopatía corren un mayor riesgo de sufrir episodios cardiovasculares y por tanto se les debería monitorizar y tratar de manera apropiada (véase apartado siguiente) (figura 4).
Figura central. Enfoque clínico en sujetos con características morfológicas del miocardio no compactado. Se recomienda una evaluación diagnóstica exhaustiva para excluir a los pacientes con un rasgo fenotípico simple y aquellos con otras miocardiopatías. Pueden aplicarse las mismas variables utilizadas en el diagnóstico diferencial para estratificar el riesgo e individualizar el tratamiento y el seguimiento de los pacientes. ACO: anticoagulación oral; C: compactado; DAI: desfibrilador automático implantable; ECG: electrocardiograma; FEVI: fracción de eyección del ventrículo izquierdo; MC: miocardiopatía; MCD: miocardiopatía dilatada; MCH: miocardiopatía hipertrófica; MCNC: miocardio no compactado; NC: no compactado; RTG: realce tardío de gadolinio; TCG: tratamiento clínico guiado.
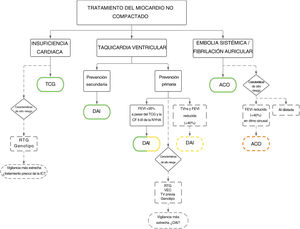
Dada la falta de criterios diagnósticos universales, las consecuencias del MCNC son inciertas. Algunas series dan al MCNC un mal pronóstico2,44,53, mientras que otras sugieren un perfil más benigno15,16,54. Además, no existe ninguna guía o plan asistencial específico que contribuya al tratamiento integral de estos pacientes. Sin embargo, existen algunas recomendaciones consensuadas por expertos42, con cambios sutiles en el tratamiento clínico comparado con otras miocardiopatías (figura 5), que refuerzan la importancia de un diagnóstico correcto.
Tratamiento clínico de los pacientes con miocardio no compactado. El verde significa que se trata de una recomendación de clase I, el amarillo una recomendación de clase IIa y el naranja una recomendación de clase IIb. ACO: anticoagulación oral; AI: aurícula izquierda; CF NYHA: clase funcional de la New York Heart Association; DAI: desfibrilador automático implantable; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; ns: no sostenida; RTG: realce tardío de gadolinio; TCG: tratamiento clínico guiado; TV: taquicardia ventricular; VEC: volumen extracelular.
Las principales complicaciones asociadas al MCNC son la insuficiencia cardiaca (IC), las arritmias ventriculares, las embolias sistémicas y la muerte. Puede que algunos pacientes sean asintomáticos, que se les diagnostique de manera casual o durante el cribado familiar. La manifestación clínica más habitual de esta enfermedad es la IC, que aparece entre el 14% y el 21% de los pacientes adultos26,33,43. La incidencia es mayor a la observada en la población con MCD (4,05 episodios cada 100 personas año)33,55. La FEVI es el mejor factor de predicción de IC, y los pacientes con FEVI reducida corren un mayor riesgo, en especial aquellos con una FEVI ≤ 35%33. Así pues, los pacientes con FEVI reducida deberían recibir de inmediato un tratamiento clínico guiado para reducir la mortalidad y la hospitalización por IC, y mejorar el estado clínico y funcional con una recomendación de clase I según directrices internacionales56,57 (figura 5). Además, la presencia de RTG (un marcador de la fibrosis miocárdica en la RMC), se ha relacionado con riesgo de IC, incluso en ausencia de disfunción sistólica grave33. Otras variables que se relacionan con la IC son un mayor grado de hipertrabeculación24 y determinados genotipos, en concreto las variantes del TTN33,39 y el MYBPC339. Así pues, parece razonable someter a estos pacientes a una vigilancia clínica más estrecha (que incluya péptidos natriuréticos y ecocardiografía) para detectar los primeros signos y síntomas de la IC. Aunque los estudios prospectivos deberían aclarar si el inicio inmediato del tratamiento de la IC podría mejorar el pronóstico (figura 5). Hasta el momento, el tratamiento recomendado es comparable al de los pacientes con IC y FEVI reducida56,57.
Las arritmias ventriculares son otra complicación frecuente y temida, que aparece entre el 19% y el 21% de los pacientes26,33, con muerte súbita de origen cardiaco (MSC) en el 5% o 6%58,59. En un estudio retrospectivo multicéntrico se estimó la incidencia de los episodios de arritmia en unos 2,79 episodios cada 100 personas año33, lo que es estadísticamente similar a las cifras observadas para la MCD55. La FEVI sigue siendo el mejor factor de predicción de la presencia de arritmias ventriculares33 y las indicaciones para la prevención primaria de la MSC y el implante de un desfibrilador automático implantable (DAI) son comparables a las de la población general: los pacientes con una FEVI ≤ 35% a pesar del óptimo tratamiento médico durante ≥ 3 meses, clase funcional II y III de la New York Heart Association y expectativas de supervivencia superiores a 1 año, con una recomendación de clase IIa en las últimas guías europeas, y con una recomendación de clase I en las guías estadounidenses56,57,60,61. La recomendación europea más débil en pacientes no isquémicos se cambió tras los resultados del ensayo DANISH62. Además, un acuerdo de expertos recomienda el DAI preventivo en los casos de FEVI reducida y taquicardias ventriculares no sostenidas, incluso en ausencia de RTG, con una recomendación de clase IIa42 (figura 5). Las indicaciones para una prevención secundaria son más homogéneas en las distintas guías: los pacientes que sobreviven a una MSC, y aquellos con fibrilación ventricular documentada o con taquicardias ventriculares sostenidas o no toleradas hemodinámicamente deberían recibir un DAI con una recomendación de clase I si la supervivencia prevista es superior a 1 año, según las guías internacionales (figura 5)56,57,60,61. Cabe mencionar que se han notificado tasas altas de descargas apropiadas del DAI en pacientes con MCNC, tanto después de la prevención primaria como de la secundaria44,63,64, y por eso parece ser un tratamiento eficaz en esta miocardiopatía. Por tanto, se sugiere un umbral bajo para el implante de un DAI, incluso aunque la evidencia de sus beneficios en la etiología no isquémica no esté aún clara.
El RTG es otro factor importante de predicción de arritmias ventriculares en el MCNC17,33,65 y la fibrosis miocárdica parece ser un sustrato arrítmico. Conforme a otras miocardiopatías55,66,67, el RTG se ha relacionado con malos resultados y riesgo de MSC en el MCNC, incluso sin disfunción sistólica grave33. No obstante, el RTG no se ha incorporado todavía en el plan asistencial, basado únicamente en la FEVI56,57,60,61. En un estudio reducido, el volumen extracelular en la RMC también se asoció al riesgo de arritmias ventriculares sin RTG37. Además, la presencia de arritmias previas, incluidas las taquicardias ventriculares, se ha relacionado con un mayor riesgo de MSC en la población pediátrica con MCNC59. Por último, algunos genotipos también se han relacionado con arritmias ventriculares: ACTC133, MYBPC3, genes arritmógenos (ABCC9, ANK2, CACNA2D1, CASQ2, HCN4, KCNE3, KCNH2, KCNQ1, RYR2 y SCN5A), y genes no sarcoméricos no arritmógenos (DMPK, DSP, DTNA, FKTN, HFE, JUP, LMNA, PKP2, PLEC, PLN, PRDM16, RBM20 y SGCD)39.
Todos estos factores de riesgo sirven para identificar a pacientes con mayor riesgo de sufrir episodios arrítmicos. Así pues, se recomienda una vigilancia clínica más estrecha y la detección proactiva de arritmias asintomáticas, incluida la monitorización electrocardiográfica y las pruebas de esfuerzo sobre cinta rodante. En el momento actual, no pueden hacerse recomendaciones sobre el implante inmediato de DAI en estos subgrupos de pacientes, y los futuros estudios prospectivos deberían investigar si un enfoque más agresivo mejoraría los resultados clínicos (figura 5). Podría contemplarse un enfoque combinado con FEVI y RTG, similar al propuesto en los pacientes con MCD, para identificar a los pacientes de alto riesgo68.
Las embolias sistémicas son otra manifestación clásica habitualmente asociada al MCNC, con una prevalencia estimada de un 15%69. Sin embargo, con las series recientes se ha notificado un menor riesgo, de entre el 3,1% y el 4,6%26,33, que podría explicarse por un tratamiento anticoagulante más intensivo. Más allá de los factores de embolia tradicionales, como la fibrilación auricular (FA) y la disfunción sistólica, el MCNC tiene un riesgo de embolia intrínseco. Esto se ha considerado secundario a la estasis sanguínea en los recesos intertrabeculares, aunque un mayor grado de hipertrabeculación no se ha relacionado con un mayor riesgo de ictus24. La presencia de embolias sistémicas previas en el MCNC es una indicación de tratamiento de anticoagulación oral (ACO) con una recomendación de clase I según un acuerdo de expertos (figura 5).42
La FA es también habitual en el MCNC, con una prevalencia de hasta el 29% de los pacientes70, y se relaciona con un mayor riesgo de embolia sistémica69. En pacientes con MCNC, la FA es una indicación de ACO, independientemente del riesgo tromboembólico de escalas tradicionales (CHA2DS2-VASc), con una recomendación de clase I según las guías europeas y el acuerdo de expertos (figura 5)42,71. La dilatación de la aurícula izquierda también se ha relacionado con riesgo de embolias sistémicas en el MCNC33, lo que podría constituir un marcador inmediato de la FA. Aunque no pueden hacerse recomendaciones para el uso de ACO preventivos basándose en las dimensiones de la aurícula izquierda, en los pacientes con dilatación de la aurícula izquierda podría contemplarse una búsqueda más proactiva de FA asintomática, tal como se ha indicado en la MCH72. Una FEVI reducida es otro factor de riesgo indicativo de embolia sistémica33,69 y podría contemplarse a los pacientes con una FEVI ≤ 40% para ACO preventivos, incluso en ritmo sinusal, con una recomendación de clase IIB según acuerdo de expertos (figura 5)42. Teniendo en cuenta el riesgo aumentado de embolia, se recomienda el cribado proactivo de trombos intraventriculares con ecocardiografía de contraste si la FEVI es reducida. En caso de detección de un trombo, el tratamiento de primera elección suelen ser los antagonistas de la vitamina K por el menor riesgo de embolia comparado con los anticoagulantes orales directos73. De lo contrario, se prefieren los anticoagulantes orales directos a los antagonistas de la vitamina K, por la mejor tolerabilidad, a pesar de que la evidencia en el MCNC se limita a la notificación de casos74. Recientemente, se ha propuesto un algoritmo para los ACO preventivos en el MCNC, que incluye todas las variables anteriormente mencionadas75.
En la tabla 4 se describen las series de MCNC más importantes discutidas en esta revisión.
Resumen de los principales estudios sobre miocardio no compactado mencionados en la revisión
| Primer autor | Número de pacientes | Mujeres, n (%) | Edad, años | Criterios diagnósticos | FEVI, % (DE o IQR) | Genotipo positivo | Agregación familiar | Seguimiento, años | Insuficiencia cardiaca | Arritmias ventriculares | Embolias sistémicas | Fallecidos | MACE, n (%) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Stacey, 201311 | 122 | 50 (41) | 57±17 | Stacey | 44±16 | Sin notificar | Sin notificar | Sin notificar | 36 (30) | 6 (5) | 10 (8) | 6 (5) | Sin notificar |
| Vaidya, 202125 | 339 | 157 (46) | 47 [34-61] | Jenni, Chin y Petersen | 45 [30-58] | Sin notificar | Sin notificar | 6,3 [3,1-10,8] | Sin notificar | Sin notificar | Sin notificar | 59 (17) | Sin notificar |
| Ramchand, 202126 | 328 | 136 (42) | 43±17 | Petersen | 45±14 | Sin notificar | Sin notificar | 3,1 | 41 (13) | 70 (21) | 15 (5) | 15 (5) | 102 (31) |
| Casas, 202133 | 585 | 251 (43) | 45±20 | Jenni y Petersen | 48±17 | 99 (42) | 106 (42) | 5,1 [2,3-8,1] | 110 (19) | 87 (15) | 18 (3) | 34 (6) | 223 (38) |
| van Waning, 201843 | 327 (275 adultos) | 152 (46) | 45 [33-56] | Jenni y Petersen | 174 (53) con disfunción sistólica del VI | 104 (32) | 120 (37) | 2,1 [0,3-4,8] en adultos | 72 (22) | 19 (6) | 38 (12) | 24 (7) | 72 (22) |
| Sedaghat-Hamedani, 201744 | 95 | 20 (19% de los probandos) | 41±14 | Stöllberger, Jenni y Petersen | 38±15 | 36 (38) | 22 (23) | 5,1 | Sin notificar | 24 (35) | 7 (10) | 9 (13) | Sin notificar |
| Brescia, 201359 | 242 niños | 97 (40) | 9 [0-14] | Jenni | 150 (62) con disfunción sistólica del VI | Sin notificar | 56 (23) | 4,0 [1,8-15,9] | Sin notificar | 42 (17) | Sin notificar | 31 (13) | Sin notificar |
| Andreini, 201665 | 113 | 43 (38) | 44±17 | Jenni y Petersen | 45±15 | Sin notificar | 17 (15) | 3,8 [2,2-5,7] | 16 (14) | 10 (9) | 5 (4) | 5 (4) | 36 (32) |
| Stöllberger, 201169 | 144 | 43 (30) | 54±16 | Stöllberger | 88 (61) con AF del VI <25% | Sin notificar | Sin notificar | Sin notificar | Sin notificar | Sin notificar | 22 (15) | Sin notificar | Sin notificar |
AF: acortamiento fraccional; DE: desviación estándar; FEVI: fracción de eyección del ventrículo izquierdo; IQR: intervalo intercuartílico; MACE: eventos adversos cardiovasculares mayores; VI: ventrículo izquierdo.
Los datos expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
En definitiva, parece claro que la incidencia de MACE en los pacientes con MCNC confirmado (determinado no solo por rasgos morfológicos) no es despreciable. En un intento de establecer escalas de riesgo en esta población, se llevó a cabo un estudio retrospectivo y multicéntrico a gran escala con 585 pacientes, de los cuales 223 (38%) experimentaron MACE durante un periodo de seguimiento medio de 5,1 años. En el análisis multivariante, las variables relacionadas de forma independiente con MACE fueron la edad, la FEVI y la presencia de alteraciones en el electrocardiograma. Estas variables se incorporaron, junto con el sexo, la agregación familiar y los factores de riesgo cardiovascular, para idear un modelo de predicción del riesgo que también estuviera validado en una población externa. El rendimiento de esta escala fue muy alto (índice C=0,72; intervalo de confianza del 95%, 0,67-0,75) y permitió estimar el riesgo correcto de hasta 5 años diferenciando entre pacientes de poco riesgo y de alto riesgo33. En un estudio de Ramchand et al.26 se observó una serie retrospectiva y unicéntrica de 328 pacientes, con 102 (31%) MACE durante un periodo de seguimiento medio de 3,1 años. Tras ajustar en función de los antecedentes clínicos, las variables relacionadas de forma independiente con los resultados fueron el adelgazamiento del miocardio compactado, la concentración elevada de NT-proBNP y aumento del volumen telesistólico del VI. La combinación de las 3 variables confirió una mayor precisión para estratificar el riesgo. Aunque estos 2 enfoques no implican alteraciones concretas en el tratamiento clínico, pueden identificar pacientes de alto riesgo que podrían beneficiarse de una vigilancia más estrecha o pacientes con poco riesgo que podrían no requerir un seguimiento estricto. Y lo más importante, se basan en variables ya disponibles que no requieren una evaluación compleja y que por lo tanto pueden aplicarse fácilmente a la práctica clínica. En futuros estudios se debería esclarecer si la aplicación prospectiva de dichas escalas de riesgo mejoran el pronóstico de esta enfermedad.
CONCLUSIONESComentarios finalesEl MCNC es una entidad mal definida, heterogénea y controvertida. Actualmente el diagnóstico se basa en variables morfológicas de las imágenes, que tienen poca especificidad para identificar los casos verdaderos de miocardiopatía. Las pruebas indican que, con un enfoque diagnóstico, holístico y exhaustivo con información clínica, las variables funcionales de las imágenes, el cribado familiar y la genética podrá diferenciarse con mayor precisión entre la hipertrabeculación fisiológica y una miocardiopatía no compactada. El tratamiento clínico es también complicado por el pronóstico incierto y la falta de directrices concretas. Se recomienda estratificar el riesgo, usando la FEVI y el RTG entre otros parámetros, para identificar a los pacientes con poco riesgo y a los de alto riesgo y adaptar el seguimiento.
Direcciones futurasEstamos ante un cambio de paradigma en las miocardiopatías debido a los conocimientos cada vez mayores de la genética cardiovascular y a una comprensión más profunda de la relación entre el genotipo y el fenotipo. Así pues, en última instancia se hará referencia a la expresión fenotípica de una variante genética concreta, en lugar de utilizar la terminología de las enfermedades cardiacas tradicionales. Además, el incesante desarrollo de técnicas de diagnóstico por la imagen cardiaca y la aplicación de algoritmos de inteligencia artificial permitirá una mejor identificación de los casos de hipertrabeculación patológica, que dará lugar a una optimización de los recursos del sistema sanitario.
FINANCIACIÓNNinguna.
CONTRIBUCIÓN DE LOS AUTORESJ.F. Rodríguez-Palomares y I. Ferreira-González concibieron la revisión, G. Casas y J.F. Rodríguez-Palomares escribieron el artículo, I. Ferreira-González lo revisó de manera crítica.
CONFLICTO DE INTERESESI. Ferreira-González ha recibido honorarios de conferenciante de Bayer, Daichii-Sankyo, Boehringer y Sanofi, ha recibido financiación por asistir a reuniones de Bayer, Boehringer y Sanofi, y ha participado en consejos asesores de Sanofi y Philips.
Los autores agradecen a Hannah Cowdrey su exhaustiva revisión del artículo para su precisión en inglés.