El medioambiente es un gran determinante de la salud cardiovascular. La cardiología ambiental estudia la contribución de las exposiciones ambientales con el objetivo de minimizar las influencias nocivas de la contaminación y promover la salud cardiovascular mediante estrategias preventivas o terapéuticas específicas. La presente revisión se centra en el material particulado y los metales, contaminantes con la evidencia científica más sólida, e incluye las posibles intervenciones. La legislación, la mitigación y el control de los contaminantes en el aire, el agua y los alimentos y las políticas ambientales de espacios cardiosaludables son medidas clave para la salud cardiovascular. Entre las estrategias individuales, cabe reseñar la quelación de metales divalentes como el plomo y el cadmio, que solamente pueden eliminarse del cuerpo vía quelación. El ensayo clínico TACT (NCT00044213) demostró el beneficio cardiovascular en pacientes con un infarto de miocardio previo, especialmente en los diabéticos. Actualmente, el ensayo TACT2 (NCT02733185) está reproduciendo los resultados del TACT en personas con diabetes. Datos de Estados Unidos y Argentina también han mostrado la posible utilidad de la quelación en la enfermedad arterial periférica grave. Más investigación y acción en cardiología ambiental podría contribuir sustancialmente a mejorar la prevención y el tratamiento de las enfermedades cardiovasculares.
Palabras clave
Las enfermedades cardiovasculares (ECV), primera causa de hospitalización y muerte en la mayor parte del mundo, se desarrollan como resultado de complejas interacciones entre los genes y el entorno. La brecha manifiesta entre la incidencia de ECV y la identificación de los factores de riesgo ha dirigido el interés de la comunidad científica hacia el estudio de factores de riesgo adicionales, sobre todo los modificables como los relacionados con el ambiente1–13.
En el siglo xx se observaron efectos a corto y largo plazo de la contaminación atmosférica en relación con notables aumentos de la morbimortalidad cardiovascular14–17. El análisis sistemático del aumento de la morbimortalidad cardiovascular coincidiendo con aumentos de la contaminación atmosférica en numerosas ciudades en Estados Unidos18,19, junto con la evidencia de la relación entre metales como el mercurio y el riesgo de infarto de miocardio (IM)20 y el plomo y la mortalidad cardiovascular21, constituyó el punto de partida para que a inicios de los años dos mil apareciera el concepto de «cardiología ambiental» en un artículo publicado en Environmental Health Perspectives, una revista influyente en el campo de las ciencias de la salud ambiental4.
Se ha demostrado en estudios epidemiológicos un aumento consistente del riesgo de ECV en relación con la exposición a corto y largo plazo de las concentraciones de partículas contaminantes en el ambiente, y el sistema cardiovascular es el más afectado2,4,8,22. Se han descrito varias vías fisiopatológicas plausibles, como el aumento de la coagulación, la trombosis, la propensión a las arritmias, la vasoconstricción arterial aguda, las respuestas inflamatorias sistémicas y el fomento crónico de la ateroesclerosis1,10,11,23–42. Estos efectos se han relacionado con la cardiopatía isquémica, la insuficiencia cardiaca congestiva, el IM, las arritmias ventriculares malignas, la vulnerabilidad de la placa, la trombosis aguda, el ictus, la diabetes mellitus y la hipertensión arterial5,8,9,43–45. En este marco, el estudio más amplio sobre la influencia de la carga de enfermedad en el mundo ha señalado que la contaminación atmosférica es el cuarto factor de riesgo después de la hipertensión arterial, el tabaquismo y los riesgos dietéticos, por delante incluso de la hipercolesterolemia3. El 50% de los 6,7 millones de muertes atribuibles a la contaminación atmosférica en 2019 se deben a ECV3. A escala individual, en el mundo las personas perderían de media 1,7 años de vida por la exposición a contaminación atmosférica antropogénica, y si se incluyen fuentes que no son fácilmente prevenibles, como el polvo del desierto o los fuegos naturales, la pérdida aumentaría a 2,9 años46.
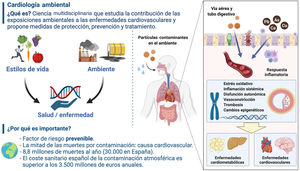
¿Qué es la cardiología ambiental?La exposición a la contaminación ambiental, que incluye sustancias químicas como el material particulado de diámetro aerodinámico ≤ 2,5 μm (MP2,5), los metales y algunos compuestos orgánicos y la contaminación acústica, contribuye al riesgo de ECV. A falta de una definición universal, proponemos definir la cardiología ambiental como la ciencia interdisciplinaria que estudia la contribución de las exposiciones ambientales en las ECV con el objetivo de desarrollar estrategias preventivas o terapéuticas específicas para minimizar las influencias nocivas de la contaminación del medioambiente y promover la salud cardiovascular. Esta revisión se centra en MP y metales, los contaminantes de los que se dispone de la evidencia científica más sólida.
EVIDENCIA CLÍNICAContaminación atmosférica¿Cuáles son los efectos de la contaminación en nuestra salud? Los eventos clínicos asociados con la contaminación atmosférica están ampliamente descritos2,7,8. Parece que no existe un umbral de contaminación mínimo de seguridad e incluso la relación podría ser supralineal, es decir, mayor efecto adverso con cambios de contaminación en grados de exposición más bajos que cuando los mismos cambios ocurren con mayor exposición47,48.
La contaminación atmosférica, además de asociarse con incrementos de hospitalizaciones por cardiopatía isquémica, fibrilación auricular e insuficiencia cardiaca2, se ha relacionado con ingresos por disecciones de aorta43 y con participar en la génesis de las cardiopatías congénitas49. También hay datos que relacionan la contaminación atmosférica y la enfermedad arterial periférica, como resumió un informe reciente de la American Heart Association50. El estado proinflamatorio generado por la contaminación atmosférica contribuye a un peor pronóstico en pacientes con ECV45,51.
La exposición a mayor contaminación atmosférica aumenta la mortalidad8,17,18,21,45,47. Aunque clásicamente se ha atribuido mayor mortalidad cardiovascular independientemente de la composición de los contaminantes23, datos recientes muestran que las partículas ricas en metales y ácidos son más tóxicas52. El aumento de la mortalidad diaria por ECV con un aumento de 10 μg/m3 en el promedio de 2 días de la concentración de MP2,5 fue del 0,55%53. Incluso la exposición a MP de polvo del desierto se ha relacionado con el aumento de la mortalidad cardiovascular el día antes y el mismo día de la exposición54.
El MP es una mezcla de sustancias con distintas toxicidades que incluye hollín, hidrocarburos, compuestos de azufre y nitrógeno, polvo y un cóctel de metales como el arsénico, el cadmio y el níquel. Muchos contaminantes forman partículas suspendidas en el aire que pueden inhalarse. Estas partículas pueden proceder de fuentes naturales (incendios forestales, aerosoles marinos, erupciones volcánicas, polvo del desierto) o fuentes humanas (actividades industriales, transporte, sistemas de calefacción y combustión de productos fósiles en general) y se clasifican por su tamaño, que es un importante factor de sus efectos adversos.
Las partículas gruesas comprenden las de diámetro entre >2,5 y ≤ 10 μm y se depositan en las partes altas de las vías respiratorias. Las partículas finas (MP2,5) se depositan en las partes más profundas de los pulmones, pasan al torrente sanguíneo y suelen proceder de actividades humanas como la quema de madera, la industria, la construcción, los automóviles y el sector del transporte en general (figura 1). Los incendios forestales también son una fuente, así como el polvo de los hogares y el humo de los cigarrillos y la cocina. Las partículas ultrafinas (diámetro ≤ 0,1μm [MP0,1]) las emiten también los automóviles, especialmente los motores diésel, y también pueden acceder fácilmente a la circulación sistémica. La quema de combustibles fósiles para calentar y cocinar también genera partículas ultrafinas.
Metales pesadosUn número creciente de estudios epidemiológicos, sustentados por evidencia experimental y estudios toxicológicos, indican que la exposición a metales aumenta el riesgo de ECV. En un estudio reciente en Estados Unidos con más de 9.000 individuos, los participantes con gran exposición a metales pesados (plomo y cadmio) tuvieron una mortalidad por ECV 1,63 veces mayor que los participantes con poca exposición55. Una cohorte de 3.600 participantes del Strong Heart Study, en poblaciones de aborígenes norteamericanos con exposición a arsénico en el agua de bebida, registró mayor mortalidad cardiovascular y por todas las causas (hazard ratio=1,28 por cada aumento del intervalo intercuartílico de arsénico en orina)56. En el Strong Heart Study, la mayor exposición al cadmio también se asoció con mayor riesgo de morbimortalidad cardiovascular por cardiopatía isquémica, insuficiencia cardiaca y enfermedad cerebrovascular57.
Los metales ambientales son ubicuos y las poblaciones están crónicamente expuestas a través de los alimentos, el aire, el humo del tabaco y el agua de bebida en algunas zonas; por lo tanto, el impacto potencial de esta exposición en la salud pública es considerable. En Estados Unidos, el 32% de la disminución de las tasas de mortalidad cardiovascular observada entre 1988 y 2004 se pudo explicar por la disminución de la exposición al plomo y el cadmio, ajustando por los factores de riesgo tradicionales58.
Varios estudios en poblaciones españolas han mostrado la relación entre biomarcadores de metales y diferentes resultados relacionados con el riesgo cardiovascular9,44,59,60. En el Estudio Hortega, una muestra de la población general de Valladolid, las concentraciones de cobre, zinc, antimonio, cadmio, cromo y vanadio se asociaron con ECV incidente durante 13 años de seguimiento9,12. En el estudio de los trabajadores de Aragón (cohorte AWHS, Aragon Workers’ Health Study)61, con unas concentraciones de metales en orina similares a las del Estudio Hortega, las altas concentraciones en orina de arsénico inorgánico, cadmio, titanio y, quizá, antimonio se asociaron con diferentes grados de ateroesclerosis subclínica41.
El estudio en la cohorte AWHS tiene especial interés, ya que los estudios previos generalmente se habían limitado a las arterias carótidas, pero no estudiaban territorios vasculares como el femoral y el coronario. La exposición a arsénico se ha asociado con un aumento del grosor intimomedial carotídeo en un estudio de Bangladesh62 y en el Strong Heart Study63. También se ha hallado asociación directa entre las concentraciones sanguíneas de cadmio y el grosor intimomedial carotídeo en mujeres austriacas11, y con la prevalencia de placa ateroesclerótica en un estudio en Suecia10,42. En el estudio AWHS, el arsénico y el cadmio se asociaron con la presencia de placa en carótidas, pero además el cadmio y el titanio con placa en femorales y el titanio y posiblemente el cadmio y el antimonio con el calcio coronario. Las asociaciones se mantuvieron tras el ajuste por otros metales y factores de riesgo clásicos61.
Los metales podrían ayudar a la identificación temprana de individuos en riesgo por su exposición, la que haría posible implementar medidas individualizadas antes de los eventos clínicos. Un ensayo clínico aleatorizado en el que se evaluó la administración de un quelante de metales pesados, conocido como etilendiaminotetraacetato (EDTA) disódico, frente a placebo en pacientes con IM previo supuso una mejora del evento combinado primario (tiempo hasta muerte por cualquier causa, IM recurrente, revascularización coronaria, hospitalización por angina o ictus) en el grupo de intervención (hazard ratio=0,82)64. El subgrupo de pacientes diabéticos tuvo mayor beneficio aún, con una reducción del riesgo del 41%65.
EVIDENCIA DE ESTUDIOS MECANÍSTICOSLa contaminación atmosférica accede al organismo a través de los alveolos y promueve el desarrollo de ECV mediante la activación de distintos mecanismos, como inflamación, disfunción endotelial, estrés oxidativo, disfunción autonómica y trombogenicidad8. Otros contaminantes pueden llegar por vía digestiva a través del agua o la bebida.
El incremento de la inflamación se asocia con eventos isquémicos, arritmias, insuficiencia cardiaca y descontrol de los factores de riesgo cardiovascular. La contaminación atmosférica promueve la producción de interleucina 6 (IL-6) y proteína C reactiva, marcadores inflamatorios asociados con mayor riesgo de ECV24. La exposición a mayor contaminación ambiental en las 24 h previas al ingreso modula el perfil inflamatorio en pacientes con IM. La mayor exposición aguda a dióxido de azufre, un gas vinculado con la combustión de combustibles fósiles y la actividad industrial, se ha asociado con IM de mayor tamaño con mayor actividad leucocitaria25.
La exposición crónica a gran contaminación atmosférica se ha asociado con la génesis y la vulnerabilidad de las placas coronarias con valores muy por debajo de los límites establecidos por la Unión Europea (MP2,5 anual<25 μg/m3). La tomografía de coherencia óptica mostró una mayor prevalencia de fibroateromas de capa fina e infiltrados macrofágicos en los pacientes con síndrome coronario agudo expuestos a mayores concentraciones anuales de MP2,526. Incluso dentro de los grados de exposición recomendados por la Organización Mundial de la Salud (OMS) antes de 2021 (MP2,5 anual <10 μg/m3, actualmente MP2,5 anual <5 μg/m3), los valores más altos se asocian con mayor actividad leucocitaria arterial y de la leucopoyesis medidas mediante captación de 18F-FDG, que a su vez se asocian con eventos cardiovasculares en el seguimiento de los pacientes27.
El estrés oxidativo también tiene un papel prominente en los efectos patogénicos de la contaminación ambiental, tanto vasculares como miocárdicos28. Estudios epidemiológicos y de exposición controlada han demostrado asociaciones positivas entre concentraciones de MP2,5 y los de diversos biomarcadores de estrés oxidativo plasmáticos o urinarios29, incluidos aumentos de las sustancias reactivas al ácido tiobarbitúrico (TBARS), un marcador de peroxidación lipídica30. El papel del estrés oxidativo en el daño endotelial está respaldado por datos de modelos animales. La exposición controlada y de corta duración al humo de diésel en concentraciones similares a las detectadas en el ámbito urbano produce una disfunción transitoria de la microcirculación32. La inhalación de partículas del diésel causa disfunción endotelial en ratas, efecto que se revierte mediante tratamiento con quelantes de radicales libres de oxígeno33. El estrés oxidativo, además, tiene un papel importante en el miocardio. Cardiomiocitos aislados de rata expuestos a partículas de diésel presentaron una reducción en la contractilidad que se atenuó mediante antioxidantes34. En otro experimento en roedores, la exposición a partículas de diésel aumentó la susceptibilidad al daño miocárdico inducido por isquemia-reperfusión, efecto asociado con generación local de radicales libres de oxígeno y citocinas proinflamatorias35. En ratas, la exposición prolongada a MP2,5 causa daño en las células miocárdicas, con alteraciones ultraestructurales y de infiltrado inflamatorio36, y alteraciones mitocondriales37 que conducen a remodelado e hipertrofia38.
Varios contaminantes ambientales (p. ej., el plomo) pueden causar disfunción autonómica y desencadenar arcos reflejos que alteran la frecuencia cardiaca y favorecen las arritmias39. En la mayoría de los estudios epidemiológicos se han descrito asociaciones negativas entre diferentes índices de variabilidad del ritmo cardiaco y las concentraciones de MP2,5 y otros contaminantes40, que podrían relacionarse con la mayor incidencia de arritmias descritas en pacientes con IM45. Además, se ha propuesto la participación de la proteina cinasa II dependiente de calcio y calmodulina (CaMKII) en estos efectos proarrítmicos66. Estos mecanismos se han involucrado también en la toxicidad vascular de los metales como el cadmio y el plomo67. El plomo, por ejemplo, puede sustituir al calcio en la calmodulina. Este mecanismo se ha relacionado con la regulación de la sintasa del óxido nítrico, lo cual afecta a la producción del óxido nítrico, que es clave en la función endotelial y la inhibición de la agregación plaquetaria68.
El MP y los constituyentes gaseosos de la contaminación atmosférica también favorecen la aparición de trombos69. La evidencia disponible indica que la exposición aguda a MP2,5 induce un desplazamiento en el balance hemostático hacia un estado protrombótico. Este se ha asociado con elevaciones en biomarcadores de estrés oxidativo e inflamación y con activación plaquetaria, así como con reducciones en la fibrinolisis69. Por otro lado, la exposición a partículas ultrafinas aumenta la formación de factor XIIa in vitro, mientras que la formación de trombina tras dicha exposición se inhibe en animales deficientes en este factor, lo que indica una modulación directa de la vía intrínseca de la coagulación70.
Múltiples estudios han relacionado la exposición a metales con biomarcadores de estrés oxidativo67,71 y patrones metabólicos72 y epigenéticos73,74. Asimismo, un área de interés creciente es el de las interacciones gen-ambiente, ya que, además de ayudar a la identificación temprana de individuos que podrían beneficiarse de estrategias de prevención intensificadas, pueden apuntar a mecanismos biológicos que ayuden a entender mejor el papel del medioambiente en la ECV y ampliar el panel de estrategias para la prevención y el control de estas enfermedades.
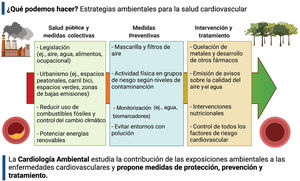
ESTRATEGIAS DE PREVENCIÓN Y TRATAMIENTOAnte todo esto, ¿qué se puede hacer? Las medidas de salud pública, mediante legislación y medidas de mitigación y control de los contaminantes ambientales, son estrategias fundamentales para minimizar la contaminación del aire, el agua y los alimentos con compuestos tóxicos y proteger a las poblaciones de los efectos nocivos de estas sustancias en la salud cardiovascular (figura 2). Con el fin de motivar estas medidas, la OMS impulsó en septiembre de 2021 una nueva guía de calidad del aire que recomienda a los países que establezcan un límite anual de MP2,5 de 5 μg/m3 y un límite diario de 15 μg/m3. Estas recomendaciones están muy por debajo de los límites establecidos legalmente en la Unión Europea, Estados Unidos y la gran mayoría de los países. En España y muchos países de Latinoamérica, la gran mayoría de las ciudades tienen niveles de contaminación atmosférica muy por encima de las recomendaciones de la OMS e incluso de los límites establecidos por los propios países. Como estrategia colectiva, por lo tanto, es necesario realizar un esfuerzo legislador y de implementación de la legislación para cumplir con las recomendaciones de la OMS. Las políticas ambientales que tienen efectos globales en la disminución de las concentraciones de contaminantes son, por ejemplo, el diseño óptimo de carriles bici y espacios peatonales, la promoción del transporte público, medidas para reducir las emisiones de combustible y otros gases tóxicos y una nueva legislación para la construcción de edificios de viviendas y oficinas sostenibles, la prohibición y la eliminación de sistemas antiguos de calefacción altamente contaminantes y potenciar los espacios verdes.
Por otra parte, las estrategias de prevención individual (figura 2) pueden incluir barreras respiratorias, que podrían ser una opción en ambientes exteriores. Aun así, los protectores respiratorios como las mascarillas de gasa, algodón, quirúrgicas y de tela aún no están validados para reducir la exposición a MP2,5, por lo que no se recomiendan en este sentido. Sin embargo, otros tipos de equipo de protección personal, como las máscaras faciales con respirador (p. ej., máscara N95), están validadas y diseñadas específicamente para filtrar el 95% de las partículas, incluido el MP2,5. Aun así, no se ha demostrado que ninguna intervención personalizada para reducir la exposición a la contaminación reduzca los eventos cardiovasculares22. Son necesarios más estudios para evaluar la efectividad de este tipo barreras individuales.
En ambientes de interior, las concentraciones de MP2,5 se pueden reducir con sistemas de purificación de aire de alta eficiencia en el aire acondicionado de los hogares. Aunque se ha señalado el impacto de estos sistemas en la reducción de biomarcadores inflamatorios y trombogénicos circulantes y de la presión arterial75, la evidencia es insuficiente, lo que desalienta las afirmaciones sobre los beneficios cardiovasculares de los purificadores de aire76. Por otra parte, proporcionar información en tiempo real de los niveles de contaminación atmosférica puede ser una forma de proteger la salud pública en determinadas circunstancias77. Sin embargo, falta evidencia para ver el impacto clínico de esta intervención y a quién puede beneficiar.
La dieta también puede tener un impacto en el efecto de la contaminación ambiental en nuestra salud. En este sentido, los suplementos dietéticos con ácidos grasos omega 3 se han asociado con beneficios cardiovasculares subclínicos a corto plazo ante la exposición a MP2,578, y los suplementos con vitamina B (ácido fólico, B6, B12) han mostrado un posible beneficio para mitigar los efectos de MP2,5 en inflamación y disfunción cardiaca autonómica en estudios piloto79. Los suplementos con ácido fólico también han mostrado capacidad para eliminar el arsénico más rápidamente del cuerpo y disminuir su toxicidad80.
En relación con el ejercicio físico en zonas con alta contaminación atmosférica, la interacción depende de múltiples mecanismos. Los estudios de modelos de salud pública han estimado que, en la mayoría de las situaciones, los beneficios de la actividad física superan a los riesgos de la contaminación81, aunque la evidencia es insuficiente para personas afectas de factores de riesgo o ECV estabecidas82.
En lo referente al tratamiento, la investigación se ha dirigido a la eliminación de metales en el organismo. El cadmio y el plomo, cationes divalentes, disponen de quelantes con alta afinidad como el EDTA y sus sales EDTA disódico y EDTA cálcico disódico. Hasta la fecha, varios estudios han demostrado que la administración intravenosa de EDTA disódico aumenta la excreción urinaria de metales tóxicos, incluidos el cadmio y el plomo83–85. Arenas et al. publicaron los resultados obtenidos con la administración de una infusión de EDTA disódico en pacientes con antecedentes de IM, lo cual resultó en un aumento del 71% en el total de excreción urinaria de metales en comparación con el valor inicial, con un efecto sustancial en el plomo (el 3.835% de aumento) y el cadmio (el 633% de aumento)83. La alta excreción de estos metales tras la administración de EDTA refleja la exposición acumulada a lo largo de los años a estos metales a través de diversas fuentes (contaminación atmosférica, agua, tabaco, contaminación del suelo y de los alimentos, y otras) y la dificultad de eliminar estos metales que son tóxicos pero con gran parecido a metales esenciales como el calcio y el zinc, a los que reemplazan en numerosas proteínas y enzimas.
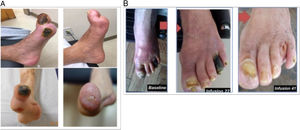
El Trial to Assess Chelation Therapy (TACT) fue un ensayo clínico a doble ciego, controlado con placebo y factorial 2 × 2 que evaluó los riesgos y beneficios de 40 infusiones de EDTA disódico en comparación con un placebo en 1.708 participantes con antecedentes de IM. Se siguió a los pacientes durante 5 años. Este ensayo demostró una reducción significativa del 18% (p=0,035) del objetivo primario combinado de muerte, IM, accidente cerebrovascular, revascularización coronaria y hospitalización por angina64. El beneficio fue más evidente en los pacientes con antecedentes de diabetes, con una reducción del 41% del riesgo relativo del objetivo cardiovascular combinado (p <0,001) y una reducción del 43% en la mortalidad por todas las causas (p=0,011)65. Actualmente, el ensayo clínico TACT2 (NCT02733185) está reproduciendo los resultados del TACT en personas con diabetes. Los resultados del TACT2 estarán disponibles alrededor de finales de 2023. En un metanálisis reciente, el beneficio más claro del tratamiento con EDTA parece ser para los pacientes con diabetes y enfermedad arterial periférica86. En efecto, hay varios casos publicados de beneficio espectacular en pacientes con enfermedad arterial periférica grave en Estados Unidos87 y Argentina88 (figura 3). En el futuro se podría desarrollar quelantes de metales por vía oral o más fáciles de administrar. Por ejemplo, ahora hay un quelante oral, conocido como succimer o ácido dimercaptosuccínico (DMSA) que se ha usado fundamentalmente para tratar el saturnismo (intoxicación por plomo), pero que no se ha probado con respecto a posibles beneficios cardiovasculares.
Fotos de pacientes con enfermedad arterial periférica grave al inicio y tras repetidas infusiones del agente quelante EDTA (etilendiaminotetraacetato) disódico de un paciente de Miami, Estados Unidos (A, reproducido con permiso de Arenas et al.87) y Rosario, Argentina (B, reproducido con permiso de Ujueta et al.88).
Una pregunta frecuente es si podría ser útil medir metales en sangre o en orina para identificar a personas en riesgo de padecer ECV y aplicarles intervenciones tempranas, y qué concentraciones se podría considerar tóxicas. Los biomarcadores de metales están bien establecidos y se conocen las vidas medias y el tipo de muestra (sangre, orina y otros) que puede ser la más adecuada para cada metal (tabla 1). Sin embargo, son necesarios más estudios para saber si la determinación sistemática de las concentraciones podría ayudar en la práctica clínica.
Biomarcadores de metales asociados con enfermedad cardiovascular
| Metal | Muestra | Vida media | Método | Información adicional | Posible valor de referencia* |
|---|---|---|---|---|---|
| Arsénico | Orina | 1 a 30 días según la especie | Espectrometría de masas con cromatografía líquida para la separación de especies | Evitar consumo de pescado en días previos a la toma de la muestra | 10μg/l (primera orina de la mañana) |
| Cadmio | SangreOrina | 30 a 100 díasDécadas | Espectrometría de masas (sangre y orina) | Los fumadores tienen valores elevados | 1μg/l1μg/l (primera orina de la mañana) |
| Plomo | SangreHueso | 30 a 100 díasDécadas | Espectrometría de masas (sangre)Fluorescencia por rayos X (hueso) | La sangre es el marcador habitual, en hueso se usa para investigación | 3,5μg/dl (sangre) |
Del arsénico, concentración en orina según la correspondencia con el límite en agua; del cadmio, valores alrededor de 3 veces la media geométrica en sangre y orina en la National Health and Nutrition Examination Survey (NHANES)55, claramente relacionados con su grado de toxicidad; la concentración sanguínea de plomo se basa en la recomendación de los Centers for Diseases Control and Prevention para niños y embarazadas, cifras claramente relacionadas con enfermedad cardiovascular.
El riesgo residual cada vez tiene mayor evidencia y probablemente engloba los factores de riesgo no controlados, pero también los no considerados o aún no conocidos. La contaminación ambiental, aunque está incluida entre los factores de riesgo cardiovascular3,11,12,46, aún no ha conseguido una concienciación sanitaria y social en relación con otros factores de riesgo. En cardiología existe una gran falta de formación en este ámbito, por lo que la influencia del medioambiente debería impartirse en los currículos formativos, por ejemplo, dentro de un currículo en cambio climático y salud ambiental.
La guía europea de prevención de 2021 incluye, por primera vez, un apartado específico de contaminación atmosférica e indica como de clase I poner en marcha medidas para reducir la contaminación del aire, incluida la reducción de las emisiones de MP y contaminantes gaseosos, la reducción del uso de combustibles fósiles y limitar las emisiones de dióxido de carbono como medidas para reducir la mortalidad y la morbilidad por ECV89. Por ello, la Comisión de la Unión Europea acordó un paquete de medidas que implementar antes de 2030 para reducir las emisiones nocivas del tráfico, las centrales de energía y la agricultura, dentro de un contexto para hacer frente al cambio climático.
Se debe instar a los pacientes en riesgo de ECV que eviten la exposición a largo plazo en regiones de alta contaminación atmosférica. Se podrían considerar programas de cribado oportunista del riesgo (con clase de recomendación IIb, nivel de evidencia C)89. Además, y según la misma guía, las organizaciones de pacientes y los profesionales de la salud son esenciales en la formación y las iniciativas políticas. Se debería fomentar la legislación sobre «aire limpio» que promueva la reducción de la emisión de partículas y el uso del transporte público. El aprendizaje sobre el impacto de la contaminación ambiental debería iniciarse en la escuela y en las propias familias. También se puede promover la formación de los pacientes (p. ej., escuelas de pacientes).
Por último, hay que señalar el impacto económico de la contaminación ambiental. Solamente con respecto a la contaminación atmosférica, la mortalidad relacionada cuesta a la economía mundial alrededor de 225.000 millones de dólares en ingresos laborales perdidos y más de 5 billones de dólares en pérdidas de bienestar90. A cada español, los problemas derivados de la contaminación atmosférica le cuestan casi 1.000 euros al año91.
FINANCIACIÓNLos autores declaran las siguientes fuentes de financiación: A. Navas-Acién de los National Institutes of Health (P42ES033719, P30ES009089); J. Bañeras, B. Benito y A. Rodríguez Sinovas del Instituto de Salud Carlos III (ISCIII) (PI20/01649 y CIBERCV), cofinanciado por el Fondo Europeo de Desarrollo Regional (ERDF-FEDER, a way to build Europe); A. Domínguez Rodríguez y N. Báez-Ferrer del Instituto de Salud Carlos III (ISCIII) (PI21/00404), cofinanciado por el Fondo Europeo de Desarrollo Regional (ERDF-FEDER, a way to build Europe). J. Iglesies-Grau, M. Téllez-Plaza, V. Arrarte, R. Campuzano Ruiz, A. Cecconi, Francisco Ujueta, C. Vozzi y G.A. Lama no tienen fuentes de financiación relacionadas con este artículo.
CONTRIBUCIÓN DE LOS AUTORESTodos los autores han contribuido en la redacción y la revisión crítica de este trabajo.
CONFLICTO DE INTERESESNingún autor tiene conflictos de intereses con el presente trabajo.