La publicación del estudio EMPEROR-Preserved y la extensión del beneficio cardiovascular de los inhibidores del cotransportador de sodio-glucosa tipo 2 (iSGLT2) a pacientes con insuficiencia cardiaca IC y fracción de eyección (FE)> 40% supone un importante hito en el tratamiento de la IC con FE conservada (IC-FEc). A raíz de estos resultados, en febrero de 2022 la Food and Drug Administration estadounidense aprobó el uso de la empagliflozina para el tratamiento de pacientes con IC independientemente de la FE. Sin embargo, un análisis más detallado del estudio EMPEROR-Preserved genera ciertas dudas en relación con la banda de FE más alta (> 60%). Este grupo de pacientes presenta una gran heterogeneidad y probablemente no se pueda considerar un único fenotipo para fines terapéuticos y de abordaje clínico. Además, la FE es un parámetro continuo. Por ello, no parece que una diferenciación basada en puntos de corte matemáticos concuerde con la evidencia más reciente, que apunta precisamente a un cambio más gradual en cuanto a mecanismos subyacentes, etiologías y respuesta al tratamiento a lo largo del espectro de la FE. Un mejor conocimiento de los mecanismos fisiopatológicos es fundamental para establecer nuevas dianas terapéuticas, interpretar los resultados de los ensayos clínicos y desarrollar tratamientos dirigidos y eficaces.
Palabras clave
El aumento en la incidencia de los factores de riesgo cardiovascular (CV), junto al envejecimiento de la población y el aumento de la esperanza de vida de los pacientes cardiológicos, ha llevado a que aumente la prevalencia de la insuficiencia cardiaca (IC)1. Su impacto socioeconómico supone un reto para nuestro sistema de salud. En España afecta al 2,7% de la población mayor de 45 años y al 8,8% de los mayores de 74. Además, la IC es la primera causa de hospitalización por encima de los 65 años1. En Estados Unidos se estima una prevalencia de 6 millones de personas (un ≈1,8% de la población)2. Presenta grandes mortalidad (del 50-60% estimada a 5 años) y morbilidad, con una reducción especialmente significativa de la calidad de vida3.
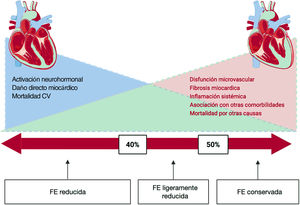
Actualmente el criterio más utilizado para clasificar la IC es la fracción de eyección (FE) del ventrículo izquierdo. Este parámetro ha permitido tradicionalmente diferenciar 2 patrones fenotípicos de la enfermedad con distintas características clínicas: IC con FE conservada (IC-FEc) si la FE es> 50% o IC con FE reducida (IC-FEr) si la FE es <50%. Los pacientes con IC-FEr suelen ser más jóvenes, predominantemente varones y con gran prevalencia de cardiopatía isquémica; por el contrario, el perfil de los pacientes con IC-FEc muestra un predominio del sexo femenino, edad más avanzada y frecuente coexistencia de factores de riesgo CV como hipertensión arterial, diabetes mellitus y fibrilación auricular3. La IC-FEc representa casi la mitad del total de ingresos por IC en el mundo, con un pronóstico tan desfavorable como el de aquellos con FE reducida.
La guía de la Sociedad Europea de Cardiología4 ha establecido recientemente un nuevo fenotipo, IC con FE intermedia, definido en la banda de FE del 40-49%. Este grupo de pacientes comparte características con los de IC-FEc e IC-FEr; sin embargo, en cuanto a fisiopatología y sobre todo en respuesta al tratamiento, parece estar más próximo al de la IC-FEr5. Por este motivo últimamente se prefiere el término FE ligeramente reducida al de FE intermedia6. Por último, existe un grupo de pacientes que mejoran e incluso normalizan la FE gracias al tratamiento, que recibe el nombre de FE recuperada (IC-FErec)6. En estos pacientes, mantener el tratamiento médico óptimo es especialmente importante y su suspensión podría estar relacionada con un nuevo deterioro de la FE7.
A pesar de que la diferencia parece ser matemática (> 50 y <50%), la evidencia más reciente apunta precisamente a un cambio más gradual y un solapamiento considerable de mecanismos subyacentes, fenotipos y respuesta al tratamiento a lo largo del espectro de la FE (figura 1). Hasta el momento, el beneficio clínico de los tratamientos evaluados para la IC ha quedado circunscrito a la IC-FEr. No se ha demostrado que los fármacos pronósticos en IC reduzcan el objetivo combinado de hospitalización por IC o mortalidad CV en la IC-FEc y han conseguido solo discretos resultados, especialmente en la parte baja de la FE conservada (o ligeramente reducida) (figura 2).
Los inhibidores del cotransportador de sodio-glucosa tipo 2 (iSGLT2), fármacos inicialmente desarrollados para el tratamiento de la diabetes por su actividad hipoglucemiante, están revolucionando el abordaje de la enfermedad CV. Los beneficios cardiorrenales observados en los principales ensayos clínicos se traducen en una clara disminución de eventos (tabla 1). Han mostrado claro beneficio en pacientes con enfermedad CV establecida, enfermedad renal crónica o IC-FEr, diabéticos o no6. Estos resultados han llevado a las guías internacionales a recomendar los iSGLT2 con un nivel de clase I A en el tratamiento de pacientes con diabetes mellitus tipo 2 (DM2) y riesgo CV y pacientes con DM2 e IC-FEr6.
Principales ensayos clínicos con iSGLT2
| Estudio | MACE | Muerte CV | Hospitalización por IC | Objetivo renal |
|---|---|---|---|---|
| EMPA-REG OUTCOME, NCT01131676 | 0,86 (0,74-0,99) | 0,62 (0,49-0,77) | 0,65 (0,50-0,85) | 0,54 (0,40-0,75) |
| CANVAS, NCT01032629 | 0,82 (0,72-0,95) | 0,87 (0,72-1,06) | 0,76 (0,52-0,87) | 0,6 (0,47-0,77) |
| DECLARE-TIMI 58, NCT01730534 | 0,9 (0,79-1,02) | 0,98 (0,82-1,17) | 0,73 (0,61-0,88) | 0,53 (0,43-0,66) |
| CREDENCE, NCT02065791 | 0,85 (0,69-1,06) | 0,78 (0,61-1,00) | 0,61 (0,47-0,80) | 0,66 (0,53-0,81) |
| VERTIS CV, NCT01986881 | 0,99 (0,88-1,12) | 0,92 (0,77-1,10) | 0,7 (0,54-0,90) | 0,81 (0,64-0,70) |
| Media general | 0,89 (0,84-0,95) | 0,85 (0,78-0,93) | 0,68 (0,61-0,76) | 0,62 (0,56-0,70) |
CV: cardiovascular; IC: insuficiencia cardiaca; MACE: eventos adversos cardiovasculares mayores.
A la luz de estudios recientes como el EMPEROR-Preserved8, el beneficio clínico de los iSGLT2 parece extenderse también a la IC-FEc (por primera vez en esta enfermedad). El 24 de febrero de 2022, la Food and Drug Administration (FDA) de Estados Unidos aprobó la empagliflozina para reducir el riesgo de muerte CV y hospitalización por IC con cualquier FE. En esta revisión se estudian la evidencia disponible, los distintos mecanismos de acción y el efecto biológico de los iSGLT2 en la IC-FEc.
DEFINICIÓN DE IC-FECLa nueva guía define clínicamente la IC-FEc como: a) signos y síntomas de IC; b) FE ≥ 50% en ausencia de antecedentes de FE reducida; c) descarte de otras afecciones que cursen con FE conservada, y d) evidencia de aumento de las presiones de llenado ventricular por medios invasivos o indirecta mediante E:e’, aumento del volumen auricular o de los péptidos natriuréticos6. Sin embargo, los criterios diagnósticos en IC-FEc pueden presentar ciertas limitaciones:
- •
La IC-FEc es un grupo muy heterogéneo con una fisiopatología diversa, que probablemente no se pueda tratar como un único fenotipo en su abordaje clínico y terapéutico.
- •
El umbral utilizado para clasificar la FE como reducida o conservada se ha ido modificado con el tiempo (desde el 40 hasta el 50%).
- •
La FE es un parámetro muy dependiente de la precarga y la poscarga y además su medición tiene una gran variabilidad dependiendo de la técnica de imagen utilizada. Aunque la cardiorresonancia magnética se considerada el patrón de referencia, la ecocardiografía es la técnica más utilizada por su accesibilidad y bajo coste6.
- •
Distintos estudios basados en técnicas de deformación miocárdica han demostrado de manera convincente que una FE conservada no siempre es sinónimo de una función sistólica del ventrículo izquierdo conservada9.
- •
Por otro lado, la función sistólica cardiaca es un factor dinámico que puede variar con el paso del tiempo. La trayectoria o el cambio en la FE podrían tener mayores implicaciones que una única medición en un momento dado.
- •
Los valores de los péptidos natriuréticos en la IC-FEc tienden a ser más bajos, principalmente debido a un menor estrés diastólico de la pared y la alta tasa de obesidad (se ha señalado que el tejido adiposo metaboliza la molécula de péptido natriurético cerebral [BNP], por lo que puede haber valores de BNP más bajos en pacientes obesos)10.
En la IC-FEr, se cuenta con distintos tratamientos para frenar la sobreactivación del sistema neurohormonal propio de esta enfermedad. Los pilares del tratamiento incluyen iSGLT2, bloqueadores beta, antagonistas del receptor de mineralocorticoides e inhibidores de la neprilisina. Actualmente se prioriza el bloqueo de todas las vías relacionadas con la progresión de la IC frente al intento de alcanzar dosis máximas de alguno de estos fármacos que impida la prescripción del resto6.
En cuanto a los iSGLT2, el beneficio aparece llamativamente pronto. El ensayo clínico DAPA-HF11 (4.744 pacientes, 18 meses de seguimiento) mostró una reducción del combinado de muerte CV o empeoramiento de la IC con dapagliflozina, con una mejoría ya significativa tras 28 días de tratamiento (hazard ratio [HR]=0,51; intervalo de confianza del 95% [IC95%], 0,28-0,94). Asimismo, el EMPEROR-Reduced (3.730 pacientes, 16 meses) mostró una reducción del 58% del riesgo relativo de muerte, hospitalización por IC o visita urgente por IC tras 12 días de tratamiento con empagliflozina.
A diferencia de la IC-FEr, las opciones terapéuticas para la IC-FEc son bastante limitadas. El abordaje de estos pacientes se centra en la prevención y el control de comorbilidades, el alivio de los síntomas de congestión y la rehabilitación cardiaca. Se ha descrito algún beneficio con mineralocorticoides o inhibidores de la neprilisina, pero el efecto ha sido discreto y solo en ciertos subgrupos de pacientes (figura 2).
El tratamiento de la IC-FEc con espironolactona en el estudio TOPCAT12 (3.445 pacientes, 3 años de seguimiento, FE> 45%) no logró una reducción significativa del objetivo primario compuesto (tiempo hasta la muerte CV, parada cardiaca u hospitalización por IC). En un análisis post hoc, sin embargo, se identificó una diferencia de hasta 4 veces en este objetivo entre los pacientes de Rusia y Georgia en comparación con Estados Unidos, Canadá, Brasil y Argentina. Algunos autores apuntan que los pacientes de Rusia y Georgia no cumplían todos los criterios de IC (si no se padece la enfermedad, no hay mejoría con el tratamiento) y cuestionan la adherencia al tratamiento (si no se toma el fármaco, tampoco puede haber mejoría), ya que no se constataron incrementos de potasio, creatinina o canreonato (el metabolito activo de la espironolactona) en estos pacientes13.
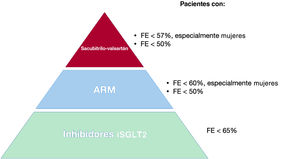
El estudio PARAGON-HF14 (4.822 pacientes, FE> 45%) tampoco demostró una reducción del objetivo primario (muerte CV y hospitalización por IC) con el sacubitrilo-valsartán, aunque sí se observó una mejoría significativa de la clase funcional y un retraso en el deterioro de la función renal. En el análisis de subgrupos, se observó un posible beneficio en mujeres (HR=0,73; IC95%, 0,59-0,90) y en pacientes con FE inferior a la mediana (FE <57%) (HR=0,78; IC95%, 0,64-0,95) (figura 2).
En cualquier caso, hasta el momento no se había demostrado que ningún tratamiento redujera en general el objetivo primario de hospitalización por IC o mortalidad CV en la IC-FEc, y por este motivo la publicación del estudio EMPEROR-Preserved marca un nuevo punto de inflexión (tabla 2).
Principales ensayos clínicos en insuficiencia cardiaca con fracción de eyección conservada
| Estudio | Año | FE (%) | Tratamiento | Control | Objetivo primario | RRR |
|---|---|---|---|---|---|---|
| CHARM-Preserved, NCT00634712 | 2003 | > 40 | Candesartán | Placebo | Muerte CV + hospitalización por IC | −11% |
| PEP-CHF15 | 2006 | > 40 | Peridopril | Placebo | Muerte + hospitalización por IC | −8% |
| I-Preserve, NCT00095238 | 2008 | > 45 | Irbesartán | Placebo | Muerte + hospitalización por IC | −5% |
| TOPCAT, NCT00094302 | 2014 | > 45 | Espironolactona | Placebo | Muerte CV + hospitalización por IC + parada cardiaca | −11% |
| PARAGON-HF, NCT01920711 | 2019 | > 45 | Sacubitrilo-valsartán | Valsartán | Muerte + hospitalización por IC | −13% |
| EMPEROR-Preserved, NCT03057951 | 2021 | > 40 | Empagliflozina | Placebo | Muerte CV + hospitalización por IC | −21% |
| PRESERVE-HF, NCT03030235 | 2021 | > 45 | Dapagliflozina | Placebo | Calidad de vida | 6 puntos KCCQ |
| CHIEF-HF, NCT04252287 | 2021 | > 45 | Canagliflozina | Placebo | Calidad de vida | 4,3 puntos KCCQ |
| DELIVER, NCT03619213 | ¿2022? | > 40 | Dapagliflozina | Placebo | Muerte CV + hospitalización por IC | En marcha |
CV: cardiovascular; FE: fracción de eyección; IC: insuficiencia cardiaca; KCCQ: Kansas City Cardiomyopathy Questionnaire; RRR: reducción del riesgo relativo.
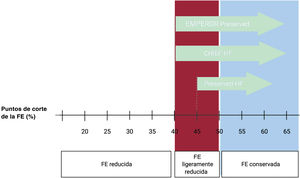
Este estudio investigó el efecto de la empagliflozina en pacientes con IC-FEc (5.988 pacientes, 26,2 meses de seguimiento). El punto de corte para definir IC-FEc fue una FE> 40% medida con cualquier técnica de imagen (figura 3) (incluidas la ventriculografía y la medicina nuclear). Los pacientes debían tener una determinación de FE> 40% en los últimos 6 meses, sin antecedentes de FE <40% durante un periodo estable. Se consideró por ello la posibilidad de incluir a pacientes no solo con FEc, sino también con FE ligeramente reducida y, muy probablemente, con FErec.
El objetivo primario combinado de muerte CV u hospitalización por IC se redujo un 21% frente a placebo (HR=0,79; IC95%, 0,69-0,90; p=0,003), con un número de pacientes que es necesario tratar de 31. Este efecto se relacionó principalmente con una reducción del riesgo de hospitalización por IC del 29% (HR=0.71; IC95%, 0,60-0,83). La magnitud del efecto en el riesgo de hospitalización con empagliflozina en la IC-FEc fue similar al comunicado antes en pacientes con IC-FEr en el EMPEROR-Reduced (el 29 frente al 31%). En el análisis por subgrupos, el efecto fue significativo en pacientes tanto diabéticos como no diabéticos.
Hay dos puntos principales que señalar en este estudio: uno es la atenuación del beneficio clínico con FE> 60% (HR=0,87; IC95%, 0,69-1,10) y otro, el hecho de que casi 1 de cada 3 pacientes presentaba una FE <50%, por lo que no tendrían realmente IC-FEc, sino IC con FE ligeramente reducida según la última definición de la guía (figura 3).
En el grupo con FE 40-49% (1.983 pacientes) había un menor porcentaje de mujeres (33%), mayor porcentaje de diabetes, cardiopatía isquémica y tratamiento con bloqueadores beta, inhibidores de la enzima de conversión de la angiotensina y antagonistas del receptor de mineralocorticoides. En ellos la reducción del objetivo primario fue mayor, del 29% (HR=0,71; IC95%, 0,57-0,88), también derivado de la primera hospitalización por IC. Por otro lado, el total de hospitalizaciones por IC (primera hospitalización y sucesivas) fue significativo (HR=0,57; IC95%, 0,42-0,79; p <0,001).
Si se excluye a los pacientes con IC y FE ligeramente reducida, el grupo con FE-FEc inequívoca (FE> 50%) fue de 4.005 pacientes. Las características clínicas eran ligeramente distintas. El 50% eran mujeres y tenían una edad significativamente más avanzada y con valores de NT-proBNP menores. La reducción del objetivo primario continuó siendo significativa, del 17% (HR=0,83; IC95%, 0,71-0,98; p=0,024), beneficio derivado principalmente de la primera hospitalización por IC (HR=0,78; IC95%, 0,64-0,95; p=0,013). Sin embargo, a diferencia del grupo anterior, el total de hospitalizaciones no fue significativo.
En el grupo de IC-FEc, si se excluye a los pacientes con FE> 60%, en quienes el efecto del fármaco parece atenuarse, la reducción del objetivo primario también es significativa para pacientes con FE entre el 50 y el 60% (HR=0,80; IC95%, 0,64–0,99). Precisamente en un análisis posterior, Milton Packer comparó el estudio EMPEROR-Preserved con el PARAGON-HF en pacientes con FE entre el 52,5 y el 62,5% (intervalo establecido para equiparar ambos estudios)16. Empagliflozina redujo de manera significativa el objetivo combinado de muerte CV y hospitalización por IC, primera hospitalización por IC (HR=0,68; IC95%, 0,51–0,89) y el total de hospitalizaciones (primera y recurrente). No redujo el riesgo de muerte CV de forma aislada. Por el contrario, en el estudio PARAGON-HF, ninguno de los objetivos se redujo significativamente en este intervalo de FE16.
EMPEROR-POOLEDEl EMPEROR-Pooled17 (9.718 pacientes) estudió el efecto de la empagliflozina a lo largo de todo el espectro de la FE. Los autores evaluaron en conjunto los dos mayores ensayos con el mismo fármaco en pacientes con IC: EMPEROR-Reduced (FE <40%) y EMPEROR-Preserved (FE> 40%). Ambos comparten el mismo objetivo primario (combinado de muerte CV y hospitalización por IC) y los 2 objetivos secundarios principales (hospitalización por IC y empeoramiento de la función renal). El diseño estadístico del EMPEROR-Pooled ya estaba planificado antes de empezar a reclutar a los pacientes para cualquiera de estos 2 estudios.
La empagliflozina redujo el objetivo de primera hospitalización por IC y el total de hospitalizaciones por IC (primera y recurrentes) en un grado similar (25-35%) en pacientes con FE <25-<65% (figura 2). El grupo con FE más alta (> 65%) no registró beneficio (HR=1,03; IC95%, 0,67–1,60).
En cuanto al subgrupo de pacientes con FE> 65%, los autores resaltan que eran menos del 10% del total de pacientes y del total de eventos en el estudio. Así, los resultados extraídos no pueden ser igual de precisos y se recuerda una vez más la necesidad de estudios específicos y dirigidos a este tipo de pacientes. En segundo lugar, la mayoría de estos pacientes tenían unas características clínicas concretas: gran prevalencia de fibrilación auricular, cifras de péptidos natriuréticos bajas y una mayor proporción de mujeres, edad avanzada e hipertensión arterial. Los péptidos natriuréticos estaban solo discretamente elevados en relación con los criterios de inclusión del estudio. Los autores apuntan la hipótesis de que los síntomas congestivos como la disnea en este grupo podrían tener menos relación con la IC y más con la fibrilación auricular, la obesidad, las enfermedades pulmonares u otras comorbilidades. Las dudas planteadas en cuanto al diagnóstico podrían explicar la falta de efectividad de un fármaco estudiado precisamente como tratamiento para la IC.
INHIBICIÓN DUAL DE SGLT1 Y SGLT2Los estudios SCORED18 y SOLOIST-WHF19 con sotagliflozina, pese a no que no se diseñaron específicamente para evaluar su efecto en pacientes con IC-FEc, muestran resultados muy prometedores19. La sotagliflozina es un inhibidor dual de los receptores de SGLT2 y SGLT1. Frente a la expresión predominantemente renal de SGLT2, el receptor de SGLT1 se expresa principalmente en el intestino y en menor medida en el segmento S3 del túbulo proximal renal y en el corazón20. La inhibición de ambos receptores aumenta el porcentaje de eliminación renal de glucosa a través del túbulo proximal y además inhibe la absorción intestinal de glucosa gracias al receptor de SGLT1. Otra diferencia con respecto al receptor de SGLT2, es el hecho de que en el miocardio sí se ha demostrado expresión de SGLT1, la cual aumenta de forma significativa durante la isquemia. Su papel a este nivel aún no se conoce en profundidad, pero estudios experimentales apuntan a un potencial efecto cardioprotector en la inhibición miocárdica de SGLT120.
La seguridad y la eficacia de la sotagliflozina ha llevado a su aprobación por la Agencia Europea del Medicamento para el tratamiento de la diabetes mellitus tipo 1. Sin embargo, al igual que otros iSGLT2, parece que su beneficio metabólico no depende exclusivamente de su efecto en el control glucémico. Se ha demostrado que la sotagliflozina reduce el riesgo de hospitalizaciones por IC de pacientes diabéticos con enfermedad renal crónica (SCORED) e IC descompensada (SOLOIST-WHF). Además, el beneficio fue significativo con tan solo unas semanas de tratamiento.
Uno de los puntos novedosos del estudio SOLOIST-WHF (1.222 pacientes, 9 meses de seguimiento) fue la administración de un fármaco de este grupo en el contexto de IC descompensada (a un 48% de los pacientes, la primera dosis se administró incluso antes del alta hospitalaria). Esto lo diferencia del DAPA-HF o el EMPEROR, ambos enfocados en pacientes con IC estable. La sotagliflozina redujo un 33% (HR=0,67; IC95%, 0,52–0,85; p <0,001) el objetivo primario combinado de mortalidad CV, hospitalización por IC o visita a urgencias por IC, con una reducción del 26% en hospitalizaciones por IC (HR=0,64; IC95%, 0,49-0,83; p <0,001). No se observó una reducción significativa de la mortalidad CV ni por otras causas. Aun así, es importante tener en cuenta que el estudio se detuvo antes de lo previsto por problemas de financiación, lo cual redujo significativamente el número de pacientes y obligó a cambiar el objetivo primario establecido en origen (muerte CV u hospitalización por IC).
Otro punto importante que destacar es el bajo porcentaje de pacientes con FE> 50% (≈20%). Sin embargo, en el análisis por subgrupos se demuestra que el efecto de la sotagliflozina es significativo en pacientes tanto con IC-FEr (FE <50%) (HR=0,72; IC95%, 0,56-0,94) como con IC-FEc (FE> 50%) (HR=0,48; IC95%, 0,27-0,86).
BENEFICIOS EN LOS PARÁMETROS DE CALIDAD DE VIDA COMUNICADOS POR LOS PACIENTESLa IC es una de las enfermedades con mayor repercusión en la calidad de vida, con una limitación similar o incluso superior a la observada en pacientes con enfermedad pulmonar obstructiva crónica, hipertensión pulmonar, antecedente de ictus o diálisis21. Por este motivo, además de los objetivos en mortalidad e ingresos hospitalarios, la mejora de la calidad de vida percibida por el propio paciente se está convirtiendo también en una parte fundamental del tratamiento de la IC. En algunas situaciones podría llegar a ser incluso más apreciada que la mejora de la supervivencia, como en el caso de pacientes muy ancianos o con muchas comorbilidades22.
El uso de cuestionarios clínicos para medir el efecto del tratamiento desde la perspectiva del paciente es cada vez más frecuente en los ensayos clínicos, lo que se denomina de forma genérica resultados comunicados por los pacientes (patient reported outcomes). Estos cuestionarios consisten en una serie de preguntas agrupadas en áreas o dominios (limitación física, limitación social, frecuencia de síntomas, etc.). Los cuestionarios más específicos para la IC son el Minnesota Living with Heart Failure Questionnaire (MLHFQ) y el Kansas City Cardiomyopathy Questionnaire (KCCQ). Hace poco, la FDA ha catalogado el KCCQ como objetivo primario (clinical outcome assessment) para ensayos clínicos22.
En la IC-FEc, el estudio PRESERVE-HF23 con dapagliflozina (324 pacientes, 12 semanas de seguimiento) demostró una mejoría de los síntomas, la limitación física y la capacidad funcional. El punto de corte fue una FE> 45% (media del 60%). El grupo tratado presentó una mejoría de 5,8 puntos en la puntuación clínica del KCCQ en comparación con el placebo.
Por su parte, en el estudio CHIEF-HF24 (476 pacientes, 12 semanas de seguimiento) la canagliflozina redujo los síntomas asociados a IC, independientemente de la FE y la presencia de DM. El 59% de los pacientes tenían IC-FEc (definida en este estudio como FE> 40%) (figura 3). La canagliflozina incrementó significativamente la puntuación total del test KCCQ, establecido como objetivo primario, tras solo 2 semanas de seguimiento y los resultados se mantuvieron significativos hasta el final del estudio (p=0,016).
No es sorprendente que los beneficios funcionales y clínicos de los estudios se acompañen de una mejora de los parámetros de calidad de vida. En el estudio EMPA-TROPISM25 (pacientes con IC-FEr; FE media del 36%) los cambios estructurales en el remodelado y la función ventriculares se asociaron con mejoras de la capacidad funcional y la calidad de vida medida en el test KCCQ26. Estos resultados, sumados a los de los estudios DEFINE-HF27, DAPA-HF o EMPEROR-Reduced, refuerzan una vez más el concepto de un efecto de clase con los iSGLT2, esta vez en términos de calidad de vida.
EFECTO BIOLÓGICO DE LOS ISGLT2 EN LA IC-FEcLa IC-FEc es un sindrome complejo, con múltiples etiologías y frecuentemente asociado con otras morbilidades, como DM2, obesidad, envejecimiento o enfermedad renal crónica. Su fisiopatología aún no se conoce en profundidad, precisamente por esta compleja interrelación entre comorbilidades y la relativa escasez de modelos experimentales que puedan reproducir correctamente un modelo de IC-FEc. Los principales procesos biológicos que caracterizan la IC-FEc son la inflamación sistémica, el aumento y la disfunción del tejido adiposo epicárdico, la alteración en la microcirculación coronaria, la fibrosis miocárdica y la rigidez vascular. Todo esto conduce a un deterioro en la distensibilidad vascular y ventricular que (especialmente cuando se acompaña de un deterioro de la función renal) aumenta las presiones de llenado cardiacas y produce disnea a pesar de una FE en el intervalo de FE conservada. El hecho de que se haya demostrado un efecto metabólico de los iSGLT2 en varios de los mecanismos involucrados en la IC-FEc hace plausible que este grupo farmacológico pueda tener un beneficio clínico no solo en la IC-FEr, sino también en la IC-FEc.
A través de su acción glucosúrica, y añadidos a tratamiento antidiabético previo, el efecto hipoglucemiante de los iSGLT2 es discreto (disminuyen un 0,5-1% la glucohemoglobina [HbA1c]). En los últimos años, sin embargo, los iSGLT2 han mostrado beneficio en la enfermedad ateroesclerótica, la IC, la mortalidad total, la mortalidad CV y la progresión de la enfermedad renal crónica. La magnitud de este beneficio y la rápida separación de las curvas de eventos en la mayoría de los ensayos clínicos hacen poco factible que el efecto protector de los iSGLT2 se pueda explicar exclusivamente por una mejora del control glucémico. Múltiples estudios experimentales han demostrado que los iSGLT2 tienen una amplia variedad de efectos metabólicos con capacidad de reducir (o incluso revertir)25 el deterioro fisiopatológico de la IC.
Nuestro grupo de trabajo demostró en un modelo experimental de IC-FEr un aumento del consumo miocárdico de cuerpos cetónicos relacionado con el tratamiento con empagliflozina28. El aumento de cuerpos cetónicos en plasma asociado con los iSGLT2 proporciona al corazón un sustrato energético más eficiente que la glucosa o los ácidos grasos29. La mejora de la eficiencia energética podría ser especialmente útil en situaciones de deterioro energético como la IC o la isquemia miocárdica, donde ayudaría a mitigar la inflamación y la fibrosis30. En pacientes con IC concretamente, se ha demostrado que el incremento de los cuerpos cetónicos mejora la contractilidad ventricular31. En nuestro modelo experimental, esta optimización metabólica ha sido la base para explicar la regresión del remodelado adverso, la reducción de volúmenes y de la hipertrofia y la mejoría de la función tanto sistólica28 como diastólica32. Estos mismos resultados después se trasladaron a la clínica en el estudio EMPA-TROPISM en pacientes no diabéticos con IC-FEr25. Además, la regresión del remodelado adverso medido por cardiorresonancia magnética se asoció con un incremento del consumo pico de oxígeno y mejora de los parámetros de calidad de vida27.
Se han propuesto otros potenciales mecanismos de acción, no excluyentes entre sí, como la reducción del tejido adiposo epicárdico, la fibrosis miocárdica intersticial, la rigidez aórtica30, la mejora de los parámetros inflamatorios o la optimización del metabolismo del hierro.
TEJIDO ADIPOSO EPICÁRDICOLa obesidad es un importante factor de riesgo de IC-FEc33. El aumento de grasa en determinadas localizaciones, como el tejido adiposo epicárdico o el depósito visceral, podría ser especialmente perjudicial, puesto que estos tejidos actúan como órganos metabólicamente activos e influyen directamente en el corazón y la vasculatura. El tejido adiposo epicárdico se encuentra en contacto directo con el miocardio y las aurículas, inmediatamente por debajo de la capa visceral del pericardio. Envuelve las arterias coronarias y comparte con el músculo cardiaco la misma microcirculación, lo que favorece una mayor interacción. Presenta una función dual. En condiciones normales, la grasa epicárdica secreta citocinas con efecto cardioprotector, como la adiponectina. Sin embargo, en determinadas situaciones, su actividad metabólica cambia y se convierte en un foco inflamatorio que refleja los cambios inflamatorios sistémicos y los traslada al miocardio34. El aumento epicárdico de citocinas proinflamatorias favorece la migración de los macrófagos, la disfunción endotelial y la formación de placas de ateroma, empeoran la función diastólica mediante el desacoplamiento de las corrientes de calcio y la desensibilización de los receptores betaadrenérgicos y activa la fibrosis y el remodelado de la matriz extracelular. Existe una relación clara entre el grosor de la grasa epicárdica y el grado de inflamación y fibrosis en el miocardio34.
El volumen de grasa epicárdica es significativamente mayor en los pacientes con IC-FEc, y muchas de las comorbilidades de la IC-FEc, como la obesidad, la diabetes o la enfermedad renal crónica, también cursan con un incremento de grasa epicárdica33. En la IC-FEr la relación es menos clara, pues se han comunicado tanto valores altos como muy bajos de grasa epicárdica en estos pacientes34. El exceso de grasa epicárdica se ha asociado además con un peor pronóstico en la IC-FEc33–35. Se ha observado un incremento significativo de muerte por cualquier causa y hospitalización por IC36 en pacientes con FEc y FE ligeramente reducida, independientemente del índice de masa corporal y otras comorbilidades. Los pacientes obesos con mayor volumen epicárdico presentaban mayor riesgo relativo de eventos que los pacientes con un porcentaje menor. En otro estudio en pacientes con IC-FEc y obesidad, el incremento de grasa epicárdica se asoció con mayores cambios hemodinámicos: mayor aumento de las presiones de llenado, hipertensión pulmonar más grave y peor capacidad funcional35.
En el ensayo clínico EMPA-TROPISM25, se observó una reducción significativa del volumen total de tejido adiposo epicárdico tras 6 meses de tratamiento con empagliflozina30. Esta reducción se acompañó también de una mejora de distintos biomarcadores inflamatorios, de fibrosis miocárdica y de rigidez aórtica30. La dapagliflozina, la ipragliflozina, la luseogliflozina y la canagliflozina, así como algunos agonistas del receptor GLP-134, han mostrado también efectos en la reducción del tejido adiposo epicárdico, similares a lo observado en el estudio EMPA-TROPISM.
No se conoce en detalle el mecanismo de acción por el cual los iSGLT2 actúan a este nivel, pero no parece que dependa completamente de la pérdida de peso30,37. A diferencia del miocardio, en el tejido adiposo epicárdico sí se ha demostrado expresión del receptor de SGLT2, como se ha observado en muestras de pacientes sometidos a cirugía cardiaca38. En estas mismas muestras, la dapagliflozina indujo un aumento de la captación de glucosa, redujo la expresión de citocinas inflamatorias y mejoró la diferenciación de los adipocitos epicárdicos.
FUNCIÓN DIASTÓLICALa disfunción diastólica es uno de los factores más comunes en el desarrollo de la IC-FEc. Precisamente, el término IC diastólica fue la primera definición utilizada en 1998 para hacer referencia al grupo de pacientes con clínica congestiva, FE en el intervalo de normalidad y sin dilatación del ventrículo izquierdo39. A diferencia de la IC-FEr, la mayoría de los pacientes con IC-FEc presentan volúmenes ventriculares normales y elevación de las presiones de llenado en reposo o con el ejercicio.
Hay cada vez más evidencia de que los iSGLT2 tienen un efecto directo en la función diastólica. Se ha demostrado en pacientes diabéticos con FEc que la canagliflozina reduce el marcador de disfunción diastólica E/e’ a los 3 meses de tratamiento40. En otro pequeño estudio con pacientes diabéticos y enfermedad CV establecida41, la empagliflozina redujo la masa ventricular y mejoró significativamente la función diastólica por Doppler tisular, también a los 3 meses.
El beneficio de la empagliflozina en la función diastólica se ha investigado de forma consistente en modelos preclínicos. Nuestro grupo de trabajo utilizó un modelo experimental de IC-FEr con cerdos no diabéticos para estudiar el efecto de la empagliflozina en la función diastólica independientemente del control glucémico. Se aleatorizó a los animales a empagliflozina o placebo y se revaluaron a los 2 meses. La función diastólica se valoró mediante ecocardiografía, resonancia magnética, hemodinámica cardiaca y análisis del miocardio y la sangre con técnicas de histología y biología molecular. Los animales tratados con empagliflozina mostraron al final del seguimiento una función diastólica significativamente mejor que los tratados con placebo. Los hallazgos de las técnicas de imagen se correlacionaron con los de las técnicas de histología y biología molecular, los cuales reflejaron una reducción de la fibrosis miocárdica y el estrés oxidativo32.
METABOLISMO DEL HIERROLa anemia y el déficit de hierro (DH) son dos de las comorbilidades más frecuentes en la IC, y además ambas se asocian de manera independiente con el pronóstico y el estado clínico del paciente42. La prevalencia del DH es de hasta un 59% incluso en ausencia de anemia y conlleva un deterioro tanto de la capacidad funcional como de la calidad de vida y un incremento del riesgo de hospitalización y muerte43.
En la IC-FEr, se ha demostrado que el tratamiento con hierro carboximaltosa intravenoso alivia síntomas, mejora tanto la calidad de vida como la capacidad funcional y reduce las hospitalizaciones. En un subestudio del EMPA-TROPISM, nuestro grupo de trabajo evaluó también el efecto del tratamiento en el contenido miocárdico de hierro medido por cardiorresonancia magnética44. Tras 6 meses de tratamiento con empagliflozina, los valores de T2* se redujeron significativamente (-1,25±2,4 frente a 0,2±2,6 ms; p=0,007) en comparación con placebo, lo que se traduce en una recuperación del contenido de hierro en el miocardio (los valores de T2* y el contenido de hierro tisular son inversamente proporcionales). Los cambios en T2* además estaban correlacionados con reducción de los volúmenes ventriculares y de la hipertrofia y aumento de la FE y el consumo pico de oxígeno. Asimismo, el ensayo Myocardial-Iron también demostró que la administración intravenosa de hierro produce cambios significativos a corto plazo en las secuencias T2* con cardiorresonancia magnética. En ese estudio, los cambios se relacionaron además con mejoría de la FE45.
Hasta el momento, la mayoría de los estudios que muestran déficit de hierro en la IC y evalúan la efectividad de los distintos tratamientos se han centrado en pacientes con FEr. Sin embargo, según algunas series de pacientes, la prevalencia de déficit de hierro podría ser incluso superior en la IC-FEc46. Algunos estudios también extienden el beneficio en calidad de vida y capacidad funcional con la administración intravenosa de hierro a pacientes con FEc47,48. Como se sabe, la deficiencia funcional de hierro se asocia con procesos inflamatorios, y en la fisiopatología de la IC-FEc participan activamente múltiples vías inflamatorias. La interleucina (IL) 6 principalmente, pero también la IL-1β, estimula la expresión de la hepcidina a través de la vía transcripcional JAKSTAT3. La hepcidina inhibe la ferroportina 1 bloqueando, por un lado, la captación de hierro en la mucosa intestinal y, por otro, la movilización de los depósitos celulares. Si bien es cierto que la mejoría del metabolismo del hierro podría ser también un objetivo terapéutico plausible en la IC-FEc, siguen siendo necesarios nuevos estudios enfocados específicamente en este tipo de pacientes.
CONCLUSIONESEl tratamiento de los pacientes con IC ha cambiado mucho en los últimos 5 años. Se ha demostrado que los iSGLT2, fármacos considerados inicialmente como antidiabéticos, reducen las hospitalizaciones y la mortalidad de los pacientes con IC, diabéticos o no. Sin embargo, su beneficio metabólico es independiente del control glucémico y complementario a las demás líneas terapéuticas con beneficio pronóstico.
Las preguntas más importantes que ha generado el uso de los iSGLT2 en el tratamiento de los pacientes con IC son:
- •
¿Se debería tratar a todos los pacientes independientemente de su glucemia? La respuesta es sí. El efecto biológico de los iSGLT2 no depende del control glucémico y se ha demostrado beneficio en pacientes tanto diabéticos como no diabéticos.
- •
¿Cómo y cuándo se debería iniciar el tratamiento con iSGLT2? Los iSGLT2 forman parte de los 4 pilares de tratamiento de la IC, junto con los bloqueadores beta, los antagonistas del receptor de mineralocorticoides y el sacubitrilo-valsartán. Actualmente se prioriza el bloqueo de las 5 vías relacionadas con la progresión de la IC frente al intento de alcanzar dosis máximas de alguno de estos fármacos que impida la prescripción del resto. Además, se ha demostrado que los iSGLT2 producen un beneficio temprano y aditivo al de los demás tratamientos que justificaría su administración precoz y en primera línea para la IC, lo que incluye a los pacientes con nuevo diagnóstico y hospitalizados.
- •
¿Se debería tratar a todos los pacientes en IC independientemente de su FE? Probablemente sí. Puede que los iSGLT2 no sean efectivos en todos los pacientes con IC-FEc, pero el estudio EMPEROR-Preserved representa un nuevo paso para entender los mecanismos de acción y la diversidad de fenotipos de esta enfermedad. Las dudas planteadas sobre los valores más altos en el espectro de la FE, al igual que con otros fármacos, subrayan nuevamente la necesidad de estudios más dirigidos y con un diseño más limpio en IC-FEc. Idealmente, estos nuevos estudios deberían emplear criterios más estrictos en cuanto a la medición de la FE y que esta se hiciese, de ser posible, con cardiorresonancia magnética y mucho más próxima a la fecha de aleatorización que en los estudios previos (EMPEROR, 6 meses; DEFINE, 12 meses). Por otro lado, más allá de una diferenciación matemática basada en la FE, es probable que nuevos criterios de clasificación basados en la etiología o la fisiopatología de la enfermedad ayuden a interpretar mejor los resultados de los ensayos clínicos y establecer dianas terapéuticas más dirigidas. De momento, y a la espera de nuevos estudios que confirmen un posible efecto de clase también en IC-FEc, se hace necesario combinar estos resultados con el control de las comorbilidades, la promoción de un estilo de vida saludable y la prevención y la rehabilitación cardiaca en este tipo de pacientes.
La reciente publicación en abril de 2022 de la guía del American College of Cardiology/American Heart Association49 respalda por primera vez el uso específico de los iSGLT2 para el tratamiento de los pacientes con IC-FEc con un nivel de recomendación 2a. Administrar antagonistas del receptor de mineralocorticoides e inhibidores de la neprilisina también se considera razonable en este grupo, aunque la evidencia al respecto es más débil (nivel de recomendación 2b). En cuanto a la clasificación de la IC, se subraya el carácter dinámico de la FE y las implicaciones pronósticas de su evolución en el tiempo. Se matiza la definición de nuevos grupos y se presentan recomendaciones específicas para los pacientes con FE ligeramente reducida y con FE recuperada como posibles fenotipos de transición.
Las nuevas recomendaciones están en consonancia con nuestro comentario y ponen de manifiesto la necesidad de nuevos estudios y nuevos criterios de clasificación más acordes con la fisiopatología de la enfermedad. Una mejor tipificación de los pacientes es fundamental para identificar tratamientos efectivos para la IC, especialmente en el grupo de FEc.
FINANCIACIÓNJ.A. Requena-Ibáñez ha recibido financiación de la Sociedad Española de Cardiología a través de una beca de movilidad (SEC/PRS-MOV-INT 21/004). C.G. Santos-Gallego y J.J. Badimón declaran no haber recibido financiación.
CONTRIBUCIÓN DE LOS AUTORESTodos los autores han participado en la elaboración del manuscrito y han aprobado la versión final.
CONFLICTO DE INTRESESLos autores informan de que no hay potenciales conflictos de intereses con respecto a este documento.