La intervención coronaria percutánea (ICP) guiada por tomografía de coherencia óptica (OCT) obtiene resultados clínicos comparables a la ICP guiada por ecografía intravascular (IVUS) en pacientes con cardiopatía isquémica estable. Escasean los estudios que comparen los resultados de ICP guiada por OCT con la guiada por IVUS en el infarto agudo de miocardio (IAM). Nuestro objetivo fue comparar los resultados de la ICP guiada por OCT frente a la guiada por IVUS en pacientes con IAM en tiempos de stents liberadores de fármaco (SLF) de segunda generación.
MétodosSe identificó a 5.260 pacientes consecutivos con IAM sometidos a ICP con SLF de segunda generación, guiada por IVUS u OCT, a partir de datos agrupados derivados de una serie de registros coreanos entre 2011-2020. El objetivo primario del estudio fue la tasa de fracaso de la lesión diana al año, definida como la combinación de muerte cardiaca, infarto de miocardio del vaso diana y revascularización de la lesión diana guiada por isquemia.
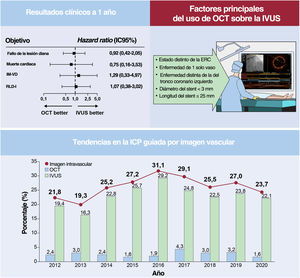
ResultadosSe trató a un total de 535 (10,2%) y 4.725 (89,8%) pacientes con OCT e IVUS, respectivamente. Las tasas de fracaso de la lesión diana al año fueron comparables entre grupos de OCT e IVUS, antes y después del emparejamiento por puntuación de propensión (HR=0,92; IC95%, 0,42-2,05; p=0,84). La OCT no superó el 5% del total de pacientes con implante de SLF de segunda generación. Los principales factores para la selección de la OCT frente a la IVUS fueron la ausencia de enfermedad renal crónica, lesión distinta a tronco coronario izquierdo, enfermedad de un solo vaso, diámetro del stent <3mm y longitud del stent ≤ 25mm.
ConclusionesLa ICP guiada por OCT en pacientes con IAM tratados con SLF de segunda generación proporcionó resultados clínicos comparables del fracaso de la lesión diana a un año respecto a la ICP guiada por IVUS.
Palabras clave
La ecografía intravascular (IVUS) y la tomografía de coherencia óptica (OCT) pueden ilustrar características de la lesión previas a la intervención que no pueden visualizarse mediante angiografía coronaria; la IVUS y la OCT optimizan la colocación del stent y aseguran un área mínima suficiente para el stent y su expansión sin disección de los márgenes o mala aposición del stent1-5. En consecuencia, las guías europea y estadounidense actuales recomiendan tener en cuenta la IVUS y la OCT para optimizar la intervención coronaria percutánea (ICP)6,7. En ensayos aleatorizados recientes se muestran las ventajas de las técnicas de diagnóstico por imagen intravascular, como la ICP guiada por IVUS y por OCT en pacientes con lesiones complejas8.
En varios estudios aleatorizados y basados en registros, se demuestra que existe una clara relación entre la ICP guiada por IVUS y una reducción de los eventos cardiovasculares en pacientes con cardiopatía isquémica9-11. Recientemente, en 2 registros especializados de infarto agudo de miocardio (IAM), se demostró que si la intervención era guiada por IVUS mejoraban los resultados clínicos a largo plazo12,13. Además, la ICP guiada por IVUS produjo mejores resultados clínicos en los pacientes con un riesgo elevado de isquemia o de enfermedad renal crónica (ERC) en el contexto de un IAM14,15. Aunque en pocos estudios se ha comparado directamente la guía por OCT con la angiográfica16, los ensayos aleatorizados han demostrado la no inferioridad de la ICP guiada por OCT comparada con la ICP guiada por IVUS en pacientes con cardiopatía isquémica17-19. Además, en un metanálisis reciente también se observaron resultados comparables entre la ICP guiada mediante OCT y la guiada por IVUS20.
No obstante, hay pocos datos que comparen los resultados clínicos de la ICP guiada por OCT con la guiada por IVUS en el contexto de un IAM. Este estudio pretende investigar el impacto clínico de la ICP guiada por OCT frente a la guiada por IVUS en pacientes con IAM a partir de un registro especializado de IAM a gran escala en tiempos de los stents farmacoactivos (SFA) de segunda generación.
MÉTODOSDiseño del estudio y población de pacientes agrupadaLa población del estudio actual procede del Korean Acute Myocardial Infarction Registry-National Institute of Health (KAMIR-NIH) (KCT-0000863)21 y del Korean Acute Myocardial Infarction Registry-V (KAMIR-V) (KCT-0008355)22, que son bases de datos de pacientes con IAM de la República de Corea a los que no se aplica ningún criterio de exclusión. Se diagnosticó IAM cuando había una mayor concentración de biomarcadores cardiacos específicos, como troponina I/T o fracción MB de la creatincinasa (CK-MB), con al menos 1 valor por encima del límite de referencia superior del percentil 99 y al menos 1 de los siguientes síntomas de isquemia miocárdica: nuevos cambios significativos en la onda T-segmento ST, nuevo bloqueo de la rama izquierda del haz de His u ondas Q patológicas en 2 derivaciones contiguas de un electrocardiograma de 12 derivaciones, y pruebas de diagnóstico por imagen de una nueva pérdida de miocardio viable o una nueva alteración regional del movimiento de la pared23. Estos registros incluyen cohortes prospectivas observacionales, basadas en la web, multicéntricas y de todo el país confirmadas por el Korean Working Group of Acute Myocardial Infarction. Los 20 centros que participaron en el registro KAMIR-NIH y los 43 del registro KAMIR-V estaban equipados para realizar una ICP básica y cirugía cardiaca in situ (tablas 1 y 2 del material adicional). El protocolo del estudio fue aprobado por los comités de ética de cada centro participante. Este estudio cumplió los principios de la Declaración de Helsinki. Todos los pacientes otorgaron su consentimiento informado por escrito para participar en el registro.
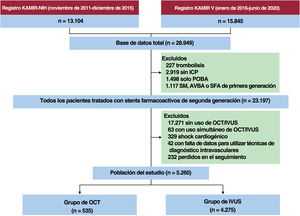
En la figura 1 se presenta detallado el diagrama de flujo del estudio. De entre 28.949 pacientes consecutivos con IAM incluidos entre noviembre de 2011 y junio de 2020 en un estudio, se seleccionó a 23.197, a los que se hizo una ICP con un SFA de segunda generación guiada por IVUS u OCT. Los criterios de exclusión del presente estudio fueron: trombolisis, pacientes no sometidos a ICP, sometidos a ICP sin colocación de stent, pacientes tratados con un stent metálico, un SFA de primera generación o un armazón vascular bioabsorbible sin utilizar OCT ni IVUS; con OCT y IVUS al mismo tiempo, en shock cardiogénico, ausencia de datos y pacientes perdidos durante el seguimiento. A los pacientes dados de alta que nunca volvieron para visita en consultas externas se los designó como pacientes «perdidos en el seguimiento». Por último, para este análisis se seleccionó a 5.260 pacientes. Para el propósito del presente estudio, se dividió a los participantes en un grupo de ICP con OCT (n=535) y un grupo de ICP con IVUS (n=4.725).
Esquema del estudio. AVB: armazón vascular bioabsorbible; IVUS: ecografía intravascular; IAM: infarto agudo de miocardio; ICP: intervención coronaria percutánea; OCT: tomografía de coherencia óptica; POBA: clásica angioplastia con balón simple; SFA: stent farmacoactivo; SM: stent metálico.
Se trató a los pacientes con un diagnóstico de IAM según los principios vigentes24-26. Tras el diagnóstico de IAM, los pacientes recibieron de manera sistemática antiagregantes plaquetarios, como ácido acetilsalicílico (300 mg) y un inhibidor del receptor P2Y12 (clopidogrel 300-600 mg, ticagrelor 180 mg o prasugrel 60 mg), seguido de ácido acetilsalicílico (100 mg diarios) y de inhibidores del receptor P2Y12 (clopidogrel 75 mg 1 vez al día, ticagrelor 90 mg 2 veces al día o prasugrel 10 mg 1 vez al día). La elección del medicamento se dejó en manos de cada uno de los médicos. Todos los procedimientos se hicieron de acuerdo con las técnicas de intervención habituales. La decisión de utilizar la IVUS o la OCT durante la ICP fue del cirujano, que fue también quien determinó la estrategia terapéutica, como el acceso vascular, la elección del stent, el uso de aspiración del trombo y la administración de inhibidores de la glucoproteína IIb/IIIa.
Objetivos y definicionesEl objetivo principal fue el fallo de la lesión diana (FLD), determinada como una combinación de muerte cardiaca, infarto de miocardio (IM) de los vasos diana o revascularización de la lesión diana causada por la isquemia 1 año después del procedimiento inicial. El objetivo secundario incluyó cada uno de los componentes del FLD, trombosis del stent confirmada o probable según la definición del Academic Research Consortium27 y eventos adversos cardiovasculares mayores (MACE), como muerte por cualquier causa, IM y revascularización. El IM del vaso diana se definió como un IM con pruebas de necrosis miocárdica en la zona vascular de un vaso diana tratado anteriormente. La revascularización de la lesión diana se consideró impulsada por la isquemia siempre que cualquier revascularización, como la ICP o la revascularización quirúrgica de la lesión diana, se hiciera con estenosis ≥ 50% del diámetro angiográfico con síntomas de isquemia, resultados positivos en un estudio funcional o estenosis ≥ 70% del diámetro angiográfico, con o sin isquemia documentada. La mortalidad por cualquier causa se consideró muerte cardiaca a no ser que se confirmara una causa no cardiaca. Se determinó ERC con una tasa de filtrado glomerular estimada <60ml/min/1,73 m2, calculada con la ecuación Modification of Diet on Renal Disease. Se definió lesión renal aguda (LRA) como la presencia de cualquiera de los siguientes (sin clasificar): elevación de la concentración sérica de creatinina (≥ 0,3mg/dl) dentro de las primeras 48 h o aumento de la concentración sérica de creatinina (hasta ≥ 1,5 veces la basal), ya fuera conocido o supuesto, en los 7 días previos o volumen de orina <0,5ml/kg/h durante 6h28.
Análisis estadísticoTodos los datos expresan la media ± desviación estándar de las variables continuas y frecuencia (porcentaje) de las variables cualitativas. Se utilizó la prueba de la t de Student para 2 muestras independientes para comparar las diferencias en las variables continuas entre los 2 grupos. Se utilizó la prueba de la χ2 o la prueba exacta de Fisher para comparar diferencias en las variables cualitativas entre los 2 grupos según el número de episodios. La imputación media de los valores ausentes se hizo para minimizar la pérdida de tamaño muestral en el análisis. La tasa de incidencia acumulada de los criterios de valoración clínica se estimó con el método de Kaplan-Meier. Se utilizó la prueba de rangos logarítmicos para determinar si la tasa de incidencia acumulada de los criterios de valoración clínica difería entre los 2 grupos. Se realizaron análisis de regresión de riesgos proporcionales de Cox para calcular la hazard ratio (HR) con su intervalo de confianza del 95% (IC95%) para cada objetivo clínico asociado con el uso de IVUS o OCT. Se recurrió al emparejamiento por puntuación de propensión (PP) para explicar la variable de confusión por indicación. Puesto que el uso de OCT e IVUS no fue aleatorio, se utilizó la PP para ajustar el sesgo de selección o predisposición, que se calculó mediante análisis de regresión logística múltiple con todas las covariables. Los grupos de OCT y IVUS se emparejaron en una proporción de 1:3 sin sustitución con el método de los vecinos más próximos basado en una PP con una amplitud del calibrador de 0,129. La diferencia media estandarizada sirvió para evaluar el equilibrio de la distribución de las covariables entre los 2 grupos. Las covariables con una diferencia media estandarizada <0,1 se consideraron equilibradas. Se hicieron análisis de regresión logística univariante y multivariable para identificar qué determinaba el uso de la OCT. Cualquier variable con un valor de p <0,1 en el análisis univariante se incluyó en los modelos multivariables. La manipulación de los datos y los análisis estadísticos se hicieron con la versión 9.3 de SAS (SAS Institute) y con el software R (versión 4,1.1; R Foundation for Statistical Computing, Austria). La significación estadística se estableció en un valor de p<0,05.
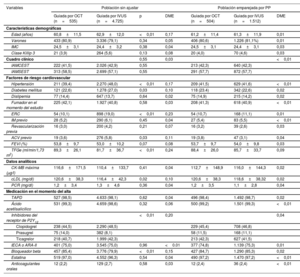
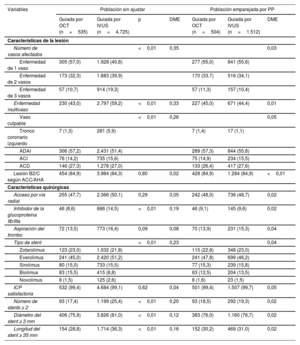
RESULTADOSCaracterísticas basalesEl análisis final incluyó a 5.260 pacientes con IAM; se sometió a 535 (10,2%) a una ICP guiada por OCT y a 4.725 (89,8%) a una ICP guiada por IVUS con implante de SFA de segunda generación. La media de edad de la población total del estudio fue de 62,7±11,9 años, y el 71,7% de los pacientes eran varones. Entre estos, 2.248 pacientes (42,7%) acudieron a la consulta con infarto de miocardio por elevación del segmento ST (IMCEST). En la tabla 1 se resumen las características clínicas basales y en la tabla 2, las características de la lesión y las características quirúrgicas de los 2 grupos. El grupo tratado con ICP guiada por OCT estaba formado por sujetos más jóvenes que los del grupo tratado con ICP guiada por IVUS. Las frecuencias de hipertensión, diabetes mellitus, ERC y antecedentes de accidente cerebrovascular fueron mayores en el grupo tratado con ICP guiada por IVUS que en el de ICP guiada por OCT. La fracción de eyección del ventrículo izquierdo fue similar en ambos grupos. En la tabla 3 del material adicional se proporciona información detallada sobre la administración de medicación en ambos grupos. Las proporciones de enfermedad multivaso, lesión culpable localizada en el tronco coronario izquierdo (TCI) y la administración de inhibidores de la glucoproteína IIb/IIIa fueron mayores en el grupo tratado con ICP guiada por IVUS que en el de ICP guiada por OCT. En el grupo de ICP guiada por IVUS se observó un mayor número de stents implantados (1,29 ± 0,52 frente a 1,19 ± 0,44; p<0,01), un mayor diámetro del stent implantado (3,25 ± 0,48 frente a 3,18 ± 0,47mm; p<0,01) y una mayor longitud del stent implantado (33,7 ± 17,3 frente a 29,3 ± 13,5mm; p<0,01) que en el de ICP guiada por OCT. Tras emparejar por IP, las diferencias estandarizadas entre los grupos fueron < 10,0% en todas las variables, lo que indica un emparejamiento apropiado. No se observaron diferencias significativas en las características basales entre los grupos en la población emparejada por PP (figura 1 del material adicional).
Características basales
| Variables | Población sin ajustar | Población emparejada por PP | |||||
|---|---|---|---|---|---|---|---|
| Guiada por OCT (n=535) | Guiada por IVUS (n=4.725) | p | DME | Guiada por OCT (n=504) | Guiada por IVUS (n=1.512) | DME | |
| Características demográficas | |||||||
| Edad (años) | 60,8±11,5 | 62,9±12,0 | <0,01 | 0,17 | 61,2±11,4 | 61,3±11,9 | 0,01 |
| Varones | 433 (80,9) | 3.336 (79,1) | 0,34 | 0,05 | 406 (80,6) | 1.226 (81,1%) | 0,01 |
| IMC | 24,5±3,1 | 24,4±3,2 | 0,38 | 0,04 | 24,5±3,1 | 24,4±3,1 | 0,03 |
| Clase Killip 3 | 21 (3,9) | 264 (5,6) | 0,13 | 0,08 | 20 (4,0) | 70 (4,6) | 0,03 |
| Cuadro clínico | 0,55 | 0,03 | <0,01 | ||||
| IAMCEST | 222 (41,5) | 2.026 (42,9) | 0,55 | 213 (42,3) | 640 (42,3) | ||
| IAMSEST | 313 (58,5) | 2.699 (57,1) | 0,55 | 291 (57,7) | 872 (57,7) | ||
| Factores de riesgo cardiovascular | |||||||
| Hipertensión | 211 (39,4) | 2.270 (48,0) | <0,01 | 0,17 | 209 (41,5) | 629 (41,6) | <0,01 |
| Diabetes mellitus | 121 (22,6) | 1.278 (27,0) | 0,03 | 0,10 | 118 (23.4) | 342 (22,6) | 0,02 |
| Dislipemia | 77 (14,4) | 647 (13,7) | 0,64 | 0,02 | 75 (14,9) | 215 (14,2) | 0,02 |
| Fumador en el momento del estudio | 225 (42,1) | 1.927 (40,8) | 0,58 | 0,03 | 208 (41,3) | 618 (40,9) | <0,01 |
| ERC | 54 (10,1) | 898 (19,0) | <0,01 | 0,23 | 54 (10,7) | 168 (11,1) | 0,01 |
| IM previo | 28 (5,2) | 290 (6,1) | 0,45 | 0,04 | 27 (5,4) | 83 (5,5) | <0,01 |
| Revascularización previa | 16 (3,0) | 200 (4,2) | 0,21 | 0,07 | 16 (3,2) | 39 (2,6) | 0,03 |
| ACV previo | 19 (3,6) | 276 (5,8) | 0,03 | 0,11 | 19 (3,8) | 47 (3,1) | 0,04 |
| FEVI (%) | 53,8±9,7 | 53,0±10,2 | 0,07 | 0,08 | 53,7±9,7 | 54,0±9,8 | 0,03 |
| TFGe (ml/min/1,73 m2) | 89,3±26,1 | 81,7±36,7 | <0,01 | 0,24 | 88,4±26,0 | 85,7±33,7 | 0,09 |
| Datos analíticos | |||||||
| CK-MB máxima (μg/l) | 116,6±171,5 | 110,4±133,7 | 0,41 | 0,04 | 112,7±148,9 | 116,0±144,3 | 0,02 |
| cLDL (mg/dl) | 120,6±38,3 | 116,4±42,3 | 0,02 | 0,10 | 120,6±38,3 | 118,6±38,32 | 0,02 |
| PCR (mg/dl) | 1,2±3,4 | 1,3±4,6 | 0,36 | 0,04 | 1,2±3,5 | 1,1±2,8 | 0,04 |
| Medicación en el momento del alta | |||||||
| TAPD | 527 (98,5) | 4.633 (98,1) | 0,62 | 0,04 | 496 (98,4) | 1.492 (98,7) | 0,02 |
| Ácido acetilsalicílico | 531 (99,3) | 4.659 (98,6) | 0,32 | 0,06 | 500 (99,2) | 1.501 (99,3) | <0,01 |
| Inhibidores del receptor de P2Y12 | <0,01 | 0,20 | 0,04 | ||||
| Clopidogrel | 238 (44,5) | 2.290 (48,5) | 229 (45,4) | 708 (46,8) | |||
| Prasugrel | 75 (14,0) | 382 (8,1) | 58 (11,5) | 168 (11,1) | |||
| Ticagrelor | 218 (40,7) | 1.999 (42,3) | 213 (42,3) | 627 (41,5) | |||
| IECA o ARA-II | 401 (75,0) | 3.545 (75,0) | 0,96 | <0.01 | 377 (74,8) | 1.139 (75,3) | 0,01 |
| Bloqueador beta | 457 (85,4) | 3.776 (79,9) | <0,01 | 0,15 | 427 (84,7) | 1.290 (85,3) | 0,02 |
| Estatina | 519 (97,0) | 4.552 (96,3) | 0,54 | 0,04 | 490 (97,2) | 1.470 (97,2) | <0,01 |
| Anticoagulantes orales | 12 (2,2) | 129 (2,7) | 0,58 | 0,03 | 12 (2,4) | 36 (2,4) | <0,01 |
ACV: accidente cerebrovascular; ARA-II: antagonistas del receptor de la angiotensina II; CK-MB: creatinincinasa miocárdica; DME: diferencia media estandarizada; cLDL: colesterol unido a lipoproteínas de baja densidad; ERC: enfermedad renal crónica; FEVI: fracción de eyección del ventrículo izquierdo; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; IECA: inhibidores de la enzima de conversión de la angiotensina; IM: infarto de miocardio; IMC: índice de masa corporal; IVUS: ecografía intravascular; OCT: tomografía de coherencia óptica; PCC: proteína C reactiva; PP: puntuación de propensión; TAPD: tratamiento antiagregante plaquetario doble; TFGe: tasa de filtrado glomerular estimada.
Los valores expresan media±desviación estándar o n (%).
Características de la lesión y características quirúrgicas
| Variables | Población sin ajustar | Población emparejada por PP | |||||
|---|---|---|---|---|---|---|---|
| Guiada por OCT (n=535) | Guiada por IVUS (n=4.725) | p | DME | Guiada por OCT (n=504) | Guiada por IVUS (n=1.512) | DME | |
| Características de la lesión | |||||||
| Número de vasos afectados | <0,01 | 0,35 | 0,03 | ||||
| Enfermedad de 1 vaso | 305 (57,0) | 1.928 (40,8) | 277 (55,0) | 841 (55,6) | |||
| Enfermedad de 2 vasos | 173 (32,3) | 1.883 (39,9) | 170 (33,7) | 516 (34,1) | |||
| Enfermedad de 3 vasos | 57 (10,7) | 914 (19,3) | 57 (11,3) | 157 (10,4) | |||
| Enfermedad multivaso | 230 (43,0) | 2.797 (59,2) | <0,01 | 0,33 | 227 (45,0) | 671 (44,4) | 0,01 |
| Vaso culpable | <0,01 | 0,26 | 0,05 | ||||
| Tronco coronario izquierdo | 7 (1,3) | 281 (5,9) | 7 (1,4) | 17 (1,1) | |||
| ADAI | 306 (57,2) | 2.431 (51,4) | 289 (57,3) | 844 (55,8) | |||
| ACI | 76 (14,2) | 735 (15,6) | 75 (14,9) | 234 (15,5) | |||
| ACD | 146 (27,3) | 1.278 (27,0) | 133 (26,4) | 417 (27,6) | |||
| Lesión B2/C según ACC/AHA | 454 (84,9) | 3.984 (84,3) | 0,80 | 0,02 | 428 (84,9) | 1.284 (84,9) | <0,01 |
| Características quirúrgicas | |||||||
| Acceso por vía radial | 255 (47,7) | 2.366 (50,1) | 0,29 | 0,05 | 242 (48,0) | 736 (48,7) | 0,02 |
| Inhibidor de la glucoproteína IIb/IIIa | 46 (8,6) | 686 (14,5) | <0,01 | 0,19 | 46 (9,1) | 145 (9,6) | 0,02 |
| Aspiración del trombo | 72 (13,5) | 773 (16,4) | 0,09 | 0,08 | 70 (13,9) | 231 (15,3) | 0,04 |
| Tipo de stent | <0,01 | 0,23 | 0,04 | ||||
| Zotarolimus | 123 (23,0) | 1.032 (21,8) | 115 (22,8) | 348 (23,0) | |||
| Everolimus | 241 (45,0) | 2.420 (51,2) | 241 (47,8) | 699 (46,2) | |||
| Sirolimus | 80 (15,0) | 733 (15,5) | 77 (15,3) | 239 (15,8) | |||
| Biolimus | 83 (15,5) | 415 (8,8) | 63 (12,5) | 204 (13,5) | |||
| Novolimus | 8 (1,5) | 125 (2,6) | 8 (1,6) | 23 (1,5) | |||
| ICP satisfactoria | 532 (99,4) | 4.684 (99,1) | 0,62 | 0,04 | 501 (99,4) | 1.507 (99,7) | 0,05 |
| Número de stents ≥ 2 | 93 (17,4) | 1.199 (25,4) | <0,01 | 0,20 | 93 (18,5) | 292 (19,3) | 0,02 |
| Diámetro del stent ≥ 3 mm | 406 (75,9) | 3.826 (81,0) | <0,01 | 0,12 | 383 (76,0) | 1.160 (76,7) | 0,02 |
| Longitud del stent ≥ 35 mm | 154 (28,8) | 1.714 (36,3) | <0,01 | 0,16 | 152 (30,2) | 469 (31,0) | 0,02 |
ACC: American College of Cardiology; ACD: arteria coronaria derecha; ACI: arteria circunfleja izquierda; ADAI: arteria coronaria descendente anterior izquierda; AHA: American Heart Association; DFE: diferencia media estandarizada; ICP: intervención coronaria percutánea; IVUS: ecografía intravascular; OCT: tomografía de coherencia óptica; PP: puntuación de propensión.
Los valores expresan media±desviación estándar o n (%).
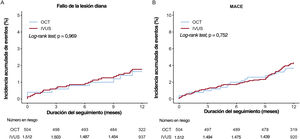
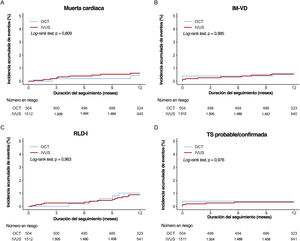
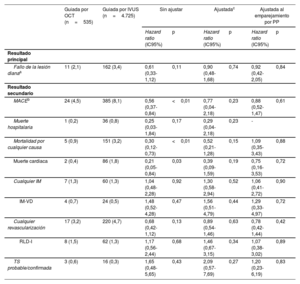
En las figuras 2 y 3 y la tabla 3 se muestra la comparación entre los resultados clínicos de los grupos tratados con ICP guiada por OCT y guiada por IVUS. La duración media del seguimiento fue de 367 [intervalo intercuartílico, 344-387] días. En la población del estudio, durante el primer año de seguimiento tuvieron lugar 173 FLD (3,3%; 86 muertes cardiacas, 24 IM del vaso diana y 70 revascularizaciones de la lesión diana) tras la ICP con un SFA de segunda generación para tratar el IAM. Al cabo de 1 año, 11 pacientes (2,1%) del grupo tratado con ICP guiada por OCT y 162 (3,4%) del grupo de ICP guiada por IVUS sufrieron FLD (HR=0,61; IC95%, 0,33-1,12; p=0,11). Los análisis de sensibilidad múltiple que utilizan la regresión multivariable de Cox y el emparejamiento por PP revelaron que el riesgo de MACE, la mortalidad por cualquier causa y la muerte cardiaca no difirieron mucho entre los 2 grupos, aunque la tasa sin ajustar fue considerablemente inferior en el grupo de ICP guiada por OCT que en el de ICP guiada por IVUS. No se observó ninguna diferencia significativa en el riesgo de sufrir cualquier tipo de IM, IM del vaso diana, cualquier revascularización, revascularización de la lesión diana y trombosis del stent probable/confirmada entre los 2 grupos (figura del material adicional). En el caso de los análisis de subgrupo, se estratificó a todos los pacientes por edad, sexo y enfermedades concomitantes importantes. En la figura 3 del material adicional se muestra un gráfico de bosque en el que el FLD se relaciona con varias características del procedimiento o relacionadas con el paciente en la población general. No se observó ninguna interacción significativa en los análisis de subgrupo.
Curvas de Kaplan-Meier para comparar la tasa de fallo de la lesión diana a los 11 años y los MACE entre la intervención coronaria percutánea guiada por OCT y la guiada por IVUS. Fallo de la lesión diana (A) y MACE (B). IVUS: ecografía intravascular; MACE: eventos adversos cardiovasculares mayores; OCT: tomografía de coherencia óptica.
Curvas de Kaplan-Meier para la muerte cardiaca a 1 año, IM-VD, RLD-I y TS probable/confirmada. Muerte cardiaca (A), IM-VD (B), RLD-I (C) y TS probable/confirmada (D). IM-VD: infarto de miocardio del vaso diana; IVUS: ecografía intravascular; OCT: tomografía de coherencia óptica; RLD-I: revascularización de la lesión diana por isquemia; TS: trombosis del stent.
Resultados de la ICP a los 3 años
| Guiada por OCT (n=535) | Guiada por IVUS (n=4.725) | Sin ajustar | Ajustadac | Ajustada al emparejamiento por PP | ||||
|---|---|---|---|---|---|---|---|---|
| Hazard ratio (IC95%) | p | Hazard ratio (IC95%) | p | Hazard ratio (IC95%) | p | |||
| Resultado principal | ||||||||
| Fallo de la lesión dianaa | 11 (2,1) | 162 (3,4) | 0,61 (0,33-1,12) | 0,11 | 0,90 (0,48-1,68) | 0,74 | 0,92 (0,42-2,05) | 0,84 |
| Resultado secundario | ||||||||
| MACEb | 24 (4,5) | 385 (8,1) | 0,56 (0,37-0,84) | <0,01 | 0,77 (0,04-2,18) | 0,23 | 0,88 (0,52-1,47) | 0,61 |
| Muerte hospitalaria | 1 (0,2) | 36 (0,8) | 0,25 (0,03-1,84) | 0,17 | 0,29 (0,04-2,18) | 0,23 | - | |
| Mortalidad por cualquier causa | 5 (0,9) | 151 (3,2) | 0,30 (0,12-0,73) | <0,01 | 0,52 (0,21-1,28) | 0,15 | 1,09 (0,35-3,43) | 0,88 |
| Muerte cardiaca | 2 (0,4) | 86 (1,8) | 0,21 (0,05-0,84) | 0,03 | 0,39 (0,09-1,59) | 0,19 | 0,75 (0,16-3,53) | 0,72 |
| Cualquier IM | 7 (1,3) | 60 (1,3) | 1,04 (0,48-2,28) | 0,92 | 1,30 (0,58-2,94) | 0,52 | 1,06 (0,41-2,72) | 0,90 |
| IM-VD | 4 (0,7) | 24 (0,5) | 1,48 (0,52-4,28) | 0,47 | 1,56 (0,51-4,79) | 0,44 | 1,29 (0,33-4,97) | 0,72 |
| Cualquier revascularización | 17 (3,2) | 220 (4,7) | 0,68 (0,42-1,12) | 0,13 | 0,89 (0,54-1,46) | 0,63 | 0,78 (0,42-1,44) | 0,42 |
| RLD-I | 8 (1,5) | 62 (1,3) | 1,17 (0,56-2,44) | 0,68 | 1,46 (0,67-3,15) | 0,34 | 1,07 (0,38-3,02) | 0,89 |
| TS probable/confirmada | 3 (0,6) | 16 (0,3) | 1,65 (0,48-5,65) | 0,43 | 2,09 (0,57-7,69) | 0,27 | 1,20 (0,23-6,19) | 0,83 |
IM-VD: infarto de miocardio del vaso diana; IVUS: ecografía intravascular; MACE: eventos adversos cardiovasculares mayores; OCT: tomografía de coherencia óptica; PP: puntuación de propensión; TS: trombosis del stent; RLD-I: revascularización de la lesión diana por isquemia.
Los valores expresan n (%).
Los factores de confusión considerados en la hazard ratio ajustada son edad, sexo, cuadro clínico, hipertensión, diabetes mellitus, enfermedad renal crónica, accidente cerebrovascular previo, tasa de filtrado glomerular estimada, colesterol unido a lipoproteínas de baja densidad, inhibidores del receptor P2Y12, bloqueadores beta, enfermedad multivaso, vaso culpable, lesión B2/C según ACC/AHA, acceso por vía radial, inhibidores de la glucoproteína IIb/IIIa, aspiración del trombo, tipo de stent, número de stents ≥ 2, diámetro del stent ≥ 3mm y longitud del stent ≥ 35mm.
En la tabla 4 del material adicional se muestra la distribución de los pacientes con respecto a la función renal de los grupos de OCT y de IVUS. La proporción de pacientes con ERC fue mayor en el grupo tratado con ICP guiada por IVUS que en el de ICP guiada por OCT (898 [19,0%] frente a 54 [10,2%]; p<0,01). En pacientes con ERC, la incidencia de LRA tras la intervención no fue mayor en el grupo de ICP guiada por OCT que en el de ICP guiada por IVUS.
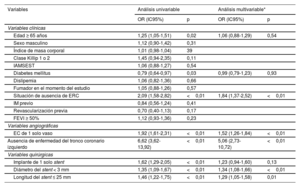
Tendencias en la ICP guiada por imágenes intravasculares y principales factores que influyen en el uso de la OCT frente a la IVUSEl tratamiento del IAM se hizo con ayuda de imágenes diagnósticas en el 25,8% (5.989/23.197) de los 23.197 pacientes sometidos a ICP con implante de SFA de segunda generación entre 2011 y 2020. La ICP guiada por IVUS se llevó a cabo en 5.350 pacientes (23,1%) y se trató a 639 pacientes (2,8%) con ICP guiada por OCT (figura 4). La tasa de uso de la IVUS se mantuvo constante por encima del 20% después de 2014; en cambio, la de la OCT no excedió el 5% durante el periodo de estudio. Se evaluaron los principales factores que influyen en el uso de la OCT en la población en estudio actual mediante análisis de regresión logística univariantes y multivariables (tabla 4). La ausencia de ERC, de enfermedad distinta de la de TCI, enfermedad de 1 solo vaso, un diámetro del stent <3mm y una longitud del stent ≤25mm fueron factores significativos asociados con el uso de la OCT sobre la IVUS.
Ilustración central. ICP guiada por OCT frente a guiada por IVUS en pacientes con infarto agudo de miocardio. ERC: enfermedad renal crónica; ICP: intervención coronaria percutánea; IM-VD: infarto de miocardio del vaso diana; IVUS: ecografía intravascular; OCT: tomografía de coherencia óptica; RLD-I: revascularización de la lesión diana por isquemia; TCI: tronco coronario izquierdo.
Análisis univariable y multivariable de los factores que determinan el uso de la OCT
| Variables | Análisis univariable | Análisis multivariable* | ||
|---|---|---|---|---|
| OR (IC95%) | p | OR (IC95%) | p | |
| Variables clínicas | ||||
| Edad ≥ 65 años | 1,25 (1,05-1,51) | 0,02 | 1,06 (0,88-1,29) | 0,54 |
| Sexo masculino | 1,12 (0,90-1,42) | 0,31 | ||
| Índice de masa corporal | 1,01 (0,98-1,04) | 39 | ||
| Clase Killip 1 o 2 | 1,45 (0,94-2,35) | 0,11 | ||
| IAMSEST | 1,06 (0,88-1,27) | 0,54 | ||
| Diabetes mellitus | 0,79 (0,64-0,97) | 0,03 | 0,99 (0,79-1,23) | 0,93 |
| Dislipemia | 1,06 (0,82-1,36) | 0,66 | ||
| Fumador en el momento del estudio | 1,05 (0,88-1,26) | 0,57 | ||
| Situación de ausencia de ERC | 2,09 (1,58-2,82) | <0,01 | 1,84 (1,37-2,52) | <0,01 |
| IM previo | 0,84 (0,56-1,24) | 0,41 | ||
| Revascularización previa | 0,70 (0,40-1,13) | 0,17 | ||
| FEVI ≥ 50% | 1,12 (0,93-1,36) | 0,23 | ||
| Variables angiográficas | ||||
| EC de 1 solo vaso | 1,92 (1,61-2,31) | <0,01 | 1,52 (1,26-1,84) | <0,01 |
| Ausencia de enfermedad del tronco coronario izquierdo | 6,62 (3,62-13,92) | <0,01 | 5,06 (2,73-10,72) | <0,01 |
| Variables quirúrgicas | ||||
| Implante de 1 solo stent | 1,62 (1,29-2,05) | <0,01 | 1,23 (0,94-1,60) | 0,13 |
| Diámetro del stent < 3 mm | 1,35 (1,09-1,67) | <0,01 | 1,34 (1,08-1,66) | <0,01 |
| Longitud del stent ≤ 25 mm | 1,46 (1,22-1,75) | <0,01 | 1,29 (1,05-1,58) | 0,01 |
EC: enfermedad coronaria; ERC: enfermedad renal crónica; FEVI: fracción de eyección del ventrículo izquierdo; IM: infarto de miocardio; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; IVUS: ecografía intravascular; TCI: tronco coronario izquierdo.
Se compararon los resultados clínicos a 1 año entre la ICP guiada por OCT y la guiada por IVUS de este estudio de cohortes multicéntrico y a gran escala en el que se incluyó a 5.260 pacientes con IAM sometidos a ICP con implante de SFA de segunda generación. Los principales resultados del presente estudio son (figura 4): primero, no se observó ninguna diferencia significativa en los resultados clínicos a 1 año, ni en FLD ni en MACE, entre la ICP guiada por OCT y la guiada por IVUS; segundo, el uso de la OCT no excedió el 5% de todos los pacientes tratados con implante de SFA de segunda generación durante el periodo de estudio, y tercero, los principales factores que influyen en el uso de la OCT sobre la IVUS fueron la ausencia de ERC, de enfermedad distinta de la del TCI y de enfermedad de 1 solo vaso, un diámetro del stent <3mm o una longitud del stent ≤25mm.
Las modalidades de diagnóstico por imagen intravascular, como la IVUS y más recientemente la OCT, tienen una amplia aplicación para orientar la toma de decisiones y optimizar la ICP30. En la última guía se actualizaron las indicaciones sobre el uso de la OCT en la optimización del stent a una recomendación de clase IIa, que se corresponde con la de la IVUS6,7. En el reciente ensayo Optical Coherence Tomography Optimized Bifurcation Event Reduction (OCTOBER), la ICP guiada por OCT fue superior a la ICP en las lesiones en bifurcación complicadas al alcanzarse al cabo de 2 años una tasa de MACE menor que con la ICP guiada por angiografía31. En los ensayos Optical Frequency Domain Imaging vs Intravascular Ultrasound in Percutaneous Coronary Intervention (OPINION), en los que se incluyó a 829 pacientes, se observó que la insuficiencia del vaso diana al cabo de 1 año en el caso de la OCT no fue inferior que con la IVUS (el 5,2 frente al 4,9%; p de no inferioridad =0,04)17. En el ensayoThe Optical Coherence Tomography vs Intravascular Ultrasound-Guided Percutaneous Coronary Intervention (OCTVIUS), en el que participaron 2.008 pacientes, se demostró que la ICP guiada por OCT no era inferior a la ICP guiada por IVUS en el seguimiento de 1 año del FLD19. En un metanálisis reciente también se observó que la ICP guiada por OCT se relacionaba con reducción de la mortalidad por cualquier causa y la mortalidad cardiovascular respecto a la ICP guiada por angiografía, y las ICP guiadas por OCT y por IVUS produjeron resultados comparables20. Aunque no hay estudios aleatorizados y controlados que hayan investigado la ICP guiada por IVUS frente a la guiada por angiografía en el contexto de un IAM, los registros especializados de IAM recientes han demostrado que la guía por IVUS mejoró los resultados clínicos a largo plazo respecto a la angiografía sola12,13. Además, el metanálisis más reciente demostró el efecto favorable de la ICP guiada por IVUS en la mortalidad por cualquier causa (riesgo relativo [RR] = 0,70; IC95%, 0,59-0,82; p<0,01), los MACE (RR = 0,86; IC95%, 0,74-0,99; p=0,04) y la revascularización del vaso diana (RR = 0,83; IC95%, 0,73-0,95; p<0,01) en pacientes con IAM32. En el presente estudio, se observó que los pacientes sometidos a ICP guiada por OCT por un IAM corrían un riesgo de sufrir el principal resultado (FLD a 1 año) similar al de los sometidos a ICP guiada por IVUS. Esto podría atribuirse a que en la población en bruto, el grupo tratado con ICP guiada por OCT mostró una menor tasa de muerte cardiaca que el grupo tratado con ICP guiada por IVUS, lo cual se atribuyó a la menor edad y al menor predominio de enfermedades concomitantes. No obstante, no se observó diferencia alguna entre los 2 grupos tras ajustar por factores de confusión. Sin embargo, dada la amplitud de los intervalos de confianza en la mayor parte de estimaciones del efecto, los resultados del presente estudio no fueron concluyentes y sigue siendo necesario un estudio observacional o un ensayo clínico aleatorizado de mayor tamaño.
Tanto la OCT como la IVUS pueden identificar las características necesarias para el implante óptimo de un stent, es decir, expansión, aposición y complicaciones, que no son evidentes en la angiografía coronaria. La OCT tiene limitaciones para la evaluación de la carga de placa y la detección del tamaño de los vasos en presencia de enfermedad difusa, por la menor penetración tisular, en especial en el caso de la placa rica en lípidos. Al contrario, la resolución de la OCT 10 veces mayor que la de la IVUS facilita una evaluación más detallada de la morfología de la placa, las características histopatológicas y los parámetros de colocación del stent con un posible impacto clínico, como un trombo y la identificación de la placa culpable en los pacientes con IAM, además de la detección de la disección residual de los márgenes y la mala aposición del stent inmediatamente después de su colocación. En el Optical Coherence Tomography-Guided Coronary Stent Implantation Compared to Angiography: a Multicenter Randomised Trial in PCI (ILUMIEN) IV se observó que la intervención guiada por OCT daba como resultado una mayor área mínima del stent que la guiada por angiografía33. Además, en el ensayo ILUMIEN III se demostró que el área mínima del stent tras una ICP guiada por OCT no era inferior a la de la IVUS. La expansión mínima y media del stent con la ICP guiada por OCT también fue comparable a la adquirida con la ICP guiada por IVUS. Las disecciones mayores y la mala aposición grave sin tratar ocurrieron con menor frecuencia en el grupo de ICP guiada por OCT que en el de ICP guiada por IVUS34. Además, en el ensayo OPINION, el diámetro mínimo de la luz del stent evaluado mediante angiografía coronaria cuantitativa y la incidencia de reestenosis binaria a los 8 meses fueron comparables entre los grupos de ICP guiada por OCT y de ICP guiada por IVUS17. No obstante, los ensayos aleatorizados previos en los que se comparó la ICP guiada por OCT con la guiada por IVUS no constaron exclusivamente de pacientes con IAM. En el ensayo OPINION no se incluyó a pacientes con IAM. Además, en el ensayo ILUMIEN III solo se incluyó al 18% de los pacientes con IAM y se excluyeron los IMCEST ocurridos en las 24h posteriores al inicio del cuadro clínico. En el ensayo OCTIVUS también se incluyó a un 10% de pacientes con infarto agudo de miocardio sin elevación del segmento ST (IAMSEST) y se excluyeron los IAMCEST17,19,34. Por consiguiente, es importante saber que el presente estudio se centró en la comparación de los resultados clínicos de la guía por OCT y por IVUS en una población procedente de un registro prospectivo y especializado de IAM sin estudios comparativos aleatorizados.
La verdadera frecuencia mundial de uso de la OCT en el IAM es notablemente inferior a la de la IVUS. La frecuencia de uso de la IVUS en el presente estudio se mantuvo constante por encima del 20% a partir de 2014; no obstante, la frecuencia de la OCT no superó el 5% de los pacientes tratados con SFA de segunda generación durante el periodo del estudio. Asimismo, las frecuencias de uso de la IVUS y la OCT en los pacientes con IAM sometidos a ICP en Estados Unidos en 2019 fueron del 8,7 y el 0,6% respectivamente35. Según encuestas recientes, la razón habitual de la reticencia a utilizar técnicas de diagnóstico por la imagen intravascular son el alto coste, la prolongación de la intervención, las políticas de reembolso, la incertidumbre sobre su ventaja clínica adicional y las preocupaciones sobre su formación apropiada36,37. La poca penetración de la OCT para los pacientes con IAM puede atribuirse a varios factores. En primer lugar, la utilidad de la OCT es escasa cuando hay factores de alto riesgo de LRA como la ERC, pues es necesario eliminar sangre de la luz del vaso para visualizar la pared y se utilizan medios de contraste adicionales38. Sin embargo, no está claro que la ICP guiada por OCT aumente la aparición de ERC. En un estudio reciente se observó que la ICP guiada por OCT no aumentó la incidencia de ERC comparada con la ICP guiada por IVUS, aunque se observó aumento del volumen de contraste en los casos de síndrome coronario agudo39. Según estudios aleatorizados en los que se compara la ICP guiada por OCT y la guiada por angiografía en pacientes con IAMSEST, la OCT no aumentó la incidencia de LRA40. No obstante, en el contexto del IAM, concretamente el IAMCEST, los cirujanos realizan ICP urgentes sin conocer la función renal del paciente, lo cual puede llevar a la preferencia de la IVUS sobre la OCT. En segundo lugar, la ICP guiada por OCT a menudo es complicada por la dificultad de eliminar la sangre del vaso por la lentitud del flujo durante un IAM y por las preocupaciones sobre el riesgo de que ocurra. El entorno de un IAM, que es poco favorable para la OCT por la preocupación sobre el uso de medios de contraste adicionales y el flujo lento, puede ser causa de la poca penetración de la OCT.
En el presente estudio, los principales factores para utilizar la OCT sobre la IVUS fueron la ausencia de insuficiencia renal y de enfermedad distinta de la del tronco coronario izquierdo, la enfermedad de 1 solo vaso, un diámetro del stent <3mm y una longitud del stent ≤ 25mm. La guía vigente ofrece una recomendación de clase IIa para la evaluación con IVUS de las lesiones de la arteria intermedia del tronco coronario izquierdo6,7. Además, la OCT se usa menos en la enfermedad del tronco coronario izquierdo por la necesidad de eliminar la sangre del vaso. En pacientes con insuficiencia renal o enfermedad multivaso, preocupa la posibilidad de una LRA por el uso de medios de contraste adicionales durante la retirada de la sonda de obtención de imagen de la OCT. La OCT se utilizó con mayor frecuencia que la IVUS en lesiones de diámetro relativamente reducido o de poca longitud, donde eliminar la sangre del vaso es relativamente fácil. Puesto que el presente estudio no fue un ensayo aleatorizado, no puede dilucidarse de manera concluyente qué factores llevaron a los cirujanos a elegir la OCT antes que la IVUS. No obstante, este estudio muestra que, entre los pacientes con IAM de la práctica real, los intervencionistas prefieren la OCT en los pacientes con lesiones simples en una sola arteria coronaria y con la función renal relativamente conservada.
LimitacionesLa primera limitación de este estudio es su diseño observacional no aleatorizado, que tiene sesgos de selección e información inherentes. Además, hubo una gran disparidad en el número de pacientes entre los 2 grupos. Aunque se hizo un análisis de sensibilidad con emparejamiento por PP para ajustar por los factores de confusión cuantificados o sin cuantificar, no puede excluirse la posibilidad de que los factores de confusión sin cuantificar influyeran en los resultados. En segundo lugar, a pesar de los análisis agrupados, las diferencias entre las experiencias de los centros y de los intervencionistas en cada modalidad de imagen pueden influir en los resultados del presente estudio. En tercer lugar, la decisión de utilizar la IVUS o la OCT durante la ICP fue del intervencionista. En cuarto lugar, no se dispuso de datos detallados de la intervención, sobre si se hizo posdilatación o sobre la presión máxima del globo, la duración de la intervención, la exposición a radiación o la cantidad total de medios de contraste. Además, faltó información exhaustiva sobre técnicas de diagnóstico por la imagen intravascular que incluyera aspectos tales como el área mínima del stent, la dilatación del stent y las complicaciones agudas. Tampoco se abordó el momento adecuado de las imágenes intravasculares en relación con la ICP. Así pues, el uso de ICP guiada por imágenes intravasculares, como la IVUS y la OCT, no garantiza la optimización de la ICP y, por lo tanto, se requiere prudencia en la interpretación de los resultados.
CONCLUSIONESLa ICP guiada por OCT produjo resultados clínicos comparables en relación con el FLD al cabo de 1 año comparada con la ICP guiada con IVUS. Durante el periodo de estudio, la penetración de la OCT fue relativamente baja (< 5%) comparada con la IVUS en el contexto del IAM. Los factores asociados con el uso de la OCT sobre la IVUS fueron la ausencia de ERC y de enfermedad distinta de la del tronco coronario izquierdo, la enfermedad de 1 solo vaso, un diámetro del stent <3mm y una longitud del stent ≤25mm.
- -
Según datos reales, la ICP guiada por IVUS mejora los resultados clínicos a largo plazo en los pacientes con infarto agudo de miocardio comparada con la ICP guiada por angiografía, aunque en varios estudios se observó que la ICP guiada por OCT produjo resultados comparables a los de la ICP guiada por IVUS en pacientes con cardiopatía isquémica estable.
- -
Los resultados clínicos a 1 año, como el FLD y los MACE, no difirieron de forma notable entre la ICP guiada por OCT y la guiada por IVUS.
- -
La frecuencia de uso de la OCT no superó el 5% del total de pacientes tratados con implante de SFA de segunda generación durante el periodo de estudio.
- -
Los principales factores a la hora de seleccionar la OCT o la IVUS fueron la ausencia de enfermedad renal crónica, de enfermedad distinta de la del tronco coronario izquierdo, de enfermedad de 1 solo vaso, un diámetro del stent <3mm y una longitud del stent ≤25mm.
Este estudio fue financiado por una subvención (2016-ER6304-02) de Research of Korea Centers for Disease Control and Prevention.
CONSIDERACIONES ÉTICASEl protocolo del estudio fue aprobado por los comités de ética de cada centro participante. Este estudio cumplió los principios de la Declaración de Helsinki. Todos los pacientes proporcionaron el consentimiento informado por escrito para participar en el registro.
En la preparación de este artículo se han tenido en cuenta los posibles sesgos de género.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALNo se utilizó inteligencia artificial.
CONTRIBUCIÓN DE LOS AUTORESO.H. Lee y Y. Kim diseñaron el estudio y participaron en los análisis finales y la interpretación de los datos. Este informe fue redactado por O.H. Lee y Y. Kim. Todos los autores aprobaron la versión definitiva del artículo y aseguraron que la precisión o la integridad de cualquier parte de este estudio se había investigado y resuelto de un modo adecuado. Todos los autores accedieron y O.H. Lee, S.J. Heo, Y. Kim y M.H. Jeong verificaron los datos del estudio y tuvieron la responsabilidad final de la decisión de presentar el trabajo para su publicación.
CONFLICTO DE INTERESEST.W. Johnson ha recibido honorarios como asesor y conferenciante de Boston Scientific. Los demás autores no tienem nada que declarar.
Los autores quieren dar las gracias a los investigadores clínicos del Korea Acute Myocardial Infarction Registry. Los autores desean agradecer al Medical Research Support Services of Yonsei University College of Medicine todo el apoyo artístico relacionado con este estudio.